基于TG/DSC/MS技术的煤氧复合全过程及气体产物研究
2022-11-11贾海林焦振营赵万里徐倩倩孙沣楠
贾海林,崔 博,焦振营,赵万里,徐倩倩,孙沣楠
(1. 河南理工大学 煤炭安全生产与清洁高效利用省部共建协同创新中心,河南 焦作 454000;2. 河南理工大学 瓦斯地质与瓦斯治理国家重点实验室培育基地,河南 焦作 454000;3. 中国平煤神马集团 炼焦煤资源开发及综合利用国家重点实验室,河南 平顶山 467099)
煤炭在我国的能源结构中占据重要位置[1-3],然而煤炭开采易受煤自燃灾害的影响[4-5],这对保障煤炭的安全开采与持续供给带来了严峻挑战。为科学防治煤自燃问题,煤氧复合过程中的热特性分析一直是基础研究的焦点,用于理解这些反应的一个重要手段就是热分析技术[6]。
目前利用热分析技术的TG法划分煤自燃阶段的研究较多,ZHAO等[7]通过煤自燃的TG分析,将其划分为4个阶段。ZHU等[8]提出了煤自燃过程的“五阶段”划分法,为潜伏阶段、蓄热阶段、蒸发阶段、活跃阶段和缺氧阶段。张铎等[9]利用同步热分析仪研究了煤样的自燃过程,将其划分为水分蒸发及气体脱附、吸氧增重、热分解失重、燃烧和燃尽阶段。秦汝祥等[10]选取煤自燃TG曲线中的特征温度,将其过程划分为水分蒸发失重、吸氧增重、受热分解、燃烧和燃尽阶段。文虎等[11]通过热重分析,将煤自燃过程划分为4个阶段,初始失重阶段、增重阶段、分解与燃烧阶段和燃尽阶段。关于升温速率对煤自燃TG曲线的影响研究有,JIANG等[12]、WANG等[13]、笔者[14]、刘源等[15]通过热分析发现,TG/DTG曲线随着升温速率的增大逐渐向高温区移动,特征温度逐渐增大。YANG等[16]运用热分析仪表征了不同黄铁矿含量的煤在不同升温速率下的反应过程,指出DTG和DSC曲线的峰值和着火温度随升温速率的增大向更高温度偏移。
关于煤自燃动力学参数的研究有,LI等[17]使用5种不同的动力学分析法计算得到水浸煤的活化能均比原煤低。ZHANG等[18]进行了不同氧体积分数下煤的放热过程研究,发现表观活化能随氧体积分数的降低而逐渐降低。CHEN等[19]研究指出吸氧增重和缓慢化学反应阶段的表观活化能随温度升高而逐渐增加。刘剑等[20]研究发现煤氧化热解服从一级化学反应的动力学机制。宋泽阳等[21]推算出了贫氧环境下煤自燃高温阶段不完全燃烧状态下的耗氧速率公式。邓军等[22]指出煤自燃过程中活化能随煤变质程度的升高而增大。基于DSC曲线法研究煤自燃过程中吸放热效应的文献有:REN等[23]研究发现随氧体积分数的降低,阶段1释放的热量最少,第3阶段释放的热量最多,氧体积分数的降低大幅限制了煤粉的热释放;贾廷贵等[24]研究了煤自燃不同阶段吸放热速率的差异性;解强等[25]发现煤热解反应热随温度的升高呈先增大后降低再增大。
通过文献综述可知,目前利用热分析研究煤自燃进程、煤自燃动力学参数的文献很多,取得一些典型的代表成果,但系统利用DSC分析法对煤氧复合全过程的研究报道并不多。基于此,笔者尝试利用TG/DSC/MS联用测试技术,对煤氧复合全过程的DSC和MS曲线进行分析与解析,以期获得一种基于DSC划分法的煤氧复合全过程的阶段划分方法,探索分析甲烷、乙烯和碳氧化合物的反应历程与生成机理。
1 煤氧复合反应的TG/DSC/MS实验
1.1 TG/DSC/MS实验仪器及工况
实验所用仪器为STA449F3同步热分析仪和QMS403D质谱仪,通过系统联用可实时在线测试煤氧复合反应过程中的质量变化、热量变化和气体产物等。实验煤样质量为10±1 mg,所用气体N2和O2均为高纯气,其纯度均大于99.99%,气体总流量设定为100 mL/min,实验工况设置见表1。

表1 煤氧复合实验的工况
氮气氛围下的实验工况为对照实验,用于对比空气氛围下煤氧复合反应情况。实验步骤如下:首先使用0.15,0.10 mm的标准筛对干燥后的煤样进行筛选,然后将筛分得到的煤样放入Al2O3坩埚,设定升温程序,从室温开始加热,煤氧复合反应产生的气相产物通过气体输送管进入气体池,由质谱仪检测器和分析系统进行在线实时测试。
1.2 实验煤样的制备及工业分析
实验煤样为平煤丁6煤层,煤块试样从井下取出后,使用塑料袋密封装运,到实验室后利用专用工具去除煤样表层,经过破碎和筛分后放入真空干燥箱干燥24 h以上。参照GB/T 212—2008《煤的工业分析方法》用5E-MAG6600全自动工业分析仪对煤样进行工业分析,分析结果见表2。

表2 煤的工业分析
2 基于DSC法的煤氧复合全过程划分与合理性
2.1 基于吸放热变化的煤氧复合阶段划分及特征温度
空气氛围、3种不同升温速率下煤氧复合全过程的DSC曲线如图1所示。观察图1可知,同一氛围不同升温速率下煤氧复合全过程的DSC曲线呈现相似性。总体表现为DSC曲线随温度升高呈先上升后下降,之后进入一小段的平台期(过渡期),然后快速下降至最大放热速率点,最后恢复至平稳的变化趋势。
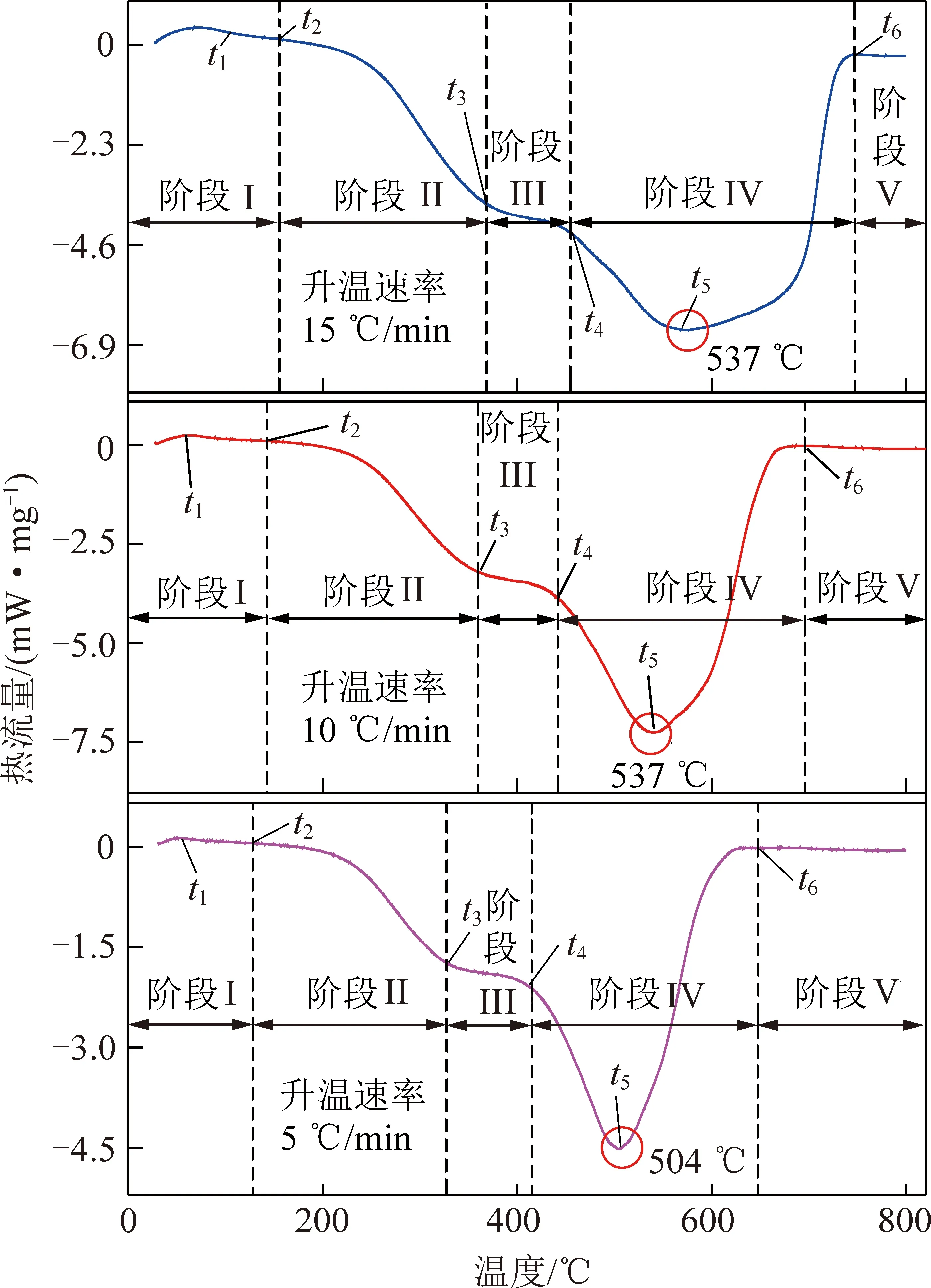
图1 不同升温速率下的DSC曲线Fig.1 DSC curves of coal at different heating rates
基于煤氧复合反应的DSC曲线,选取并定义一些特征温度如下:t1为煤样初始受热时煤中水分蒸发和气体脱附阶段吸热速率达到最大值的温度;t2为煤氧复合过程吸热速率等于放热速率时的温度,之后煤样的放热速率大于吸热速率,总体呈现放热效应;t3为煤样与氧气发生缓慢的初步化学反应向受热分解反应转化的起始点,总体仍呈现放热效应;t4为煤样中挥发分和固定碳开始进入燃烧阶段的温度点;t5为煤样在燃烧阶段释放大量热量,放热速率达到峰值的温度点;t6为煤样基本燃尽后,放热速率变为0的温度。不同升温速率下各阶段特征温度的变化规律如图2所示。

图2 不同升温速率下的特征温度对比Fig.2 Comparison of characteristic temperature at different heating rates
分析图1,2可知,除温度t1和t2因反应早期煤样内部受升温速率影响较小,变化趋势不明显外,温度t3,t4,t5和t6随着升温速率的增加,均呈增大趋势,说明随着升温速率的增加,各阶段的温度区间偏向高温区。此外,通过分析不同升温速率下挥发分和固定碳燃烧放热阶段的峰宽和最大放热速率温度可知,该阶段的放热峰随着升温速率的增大而变宽,峰形由尖锐变钝,煤氧复合反应的放热量也逐渐变大。最大放热速率对应的温度在升温速率为5,10,15 ℃/min下分别为504,537,573 ℃,温度相应延后[26]。
根据DSC曲线选取的6个特征温度,可将煤氧复合反应的吸放热过程划分为5个阶段,分别为水分蒸发及气体脱附吸热阶段、化学吸附和缓慢反应放热阶段、煤热解生成活性基团放热阶段、挥发分和固定碳燃烧放热阶段和燃尽结束阶段。各阶段的定义如下:① 水分蒸发及气体脱附吸热阶段Ⅰ(t0~t2)。在煤氧复合初期,随着煤温的逐渐升高,煤样内部含有的水分受热蒸发,煤结构中的气体发生脱附释放出CH4,CO2等气体,这一过程需要吸收部分热量[27-28]。同时还发生有缓慢的煤氧复合反应,放出微弱的热量,产生少量的碳氧化合物和烃类气态产物,此阶段总体以吸热反应为主,并在t1时达到吸热峰值,吸热速率最大,随着温度的升高,煤样热流率降低,在t2时热流率降为0。② 化学吸附和缓慢反应放热阶段Ⅱ(t2~t3)。随着煤温的进一步升高,煤中活性基团的数量逐渐增加,煤结构的化学吸附作用不断增强,以范德华力的形式与氧分子结合[29],放出少许热量,即吸附热[30],同时随着温度升高,煤样与氧气发生化学反应的速率加快,反应放出的热量逐渐增加,这一阶段总体宏观效应为放热效应。③ 煤热解生成活性基团放热阶段Ⅲ(t3~t4)。此阶段DSC曲线下降趋缓,在整个DSC曲线中呈现一个过渡的平台阶段。主要是煤中活性基团与氧反应生成大量过渡的中间产物,过渡中间产物的稳定性较差。随着温度的进一步升高,过渡中间产物会因受热而发生分解反应,分解产生碳氧化合物和烃类气态产物等,需吸收部分热量,此阶段同时存在桥键断裂生成自由基碎片、脂肪侧链受热裂解生成气态烃、含氧官能团(—COOH、—OH、含氧杂环等)裂解生成部分气体等反应,反应放热速率仍大于分解吸热速率,所以该阶段总体效应仍为放热效应。④ 挥发分和固定碳燃烧放热阶段Ⅳ(t4~t6)。该阶段煤中挥发分、固定碳等开始着火燃烧,煤温大幅升高,煤氧复合反应剧烈,放热速率加快,同时还有煤结构间的缩聚反应,发生交联键(—C—C—和—O—)的断裂等,放热迅速增加,DSC曲线呈急速下降趋势,在t5时放热速率达到峰值。⑤ 燃尽结束阶段Ⅴ(>t6)。该过程中煤中的挥发分基本燃尽,留下灰分物质,不再参与燃烧反应,热量变化逐渐趋于0。
2.2 煤氧复合过程的吸放热分析
煤氧复合反应的DSC曲线与基线之间所围成的面积代表吸热量和放热量,通过对不同升温速率下的DSC曲线求积分,可得到煤氧复合过程中各阶段的吸放热量,如图3所示。

图3 不同升温速率下热焓Fig.3 Enthalpy values at different heating rates
观察图3(a)可知,阶段Ⅰ的吸热量随着升温速率的增大呈明显上升趋势。相较于升温速率5 ℃/min,升温速率10和15 ℃/min的吸热量增加率分别为127.0%和280.3%。观察图3(b)可知,第Ⅱ~Ⅳ阶段的放热量也呈不断增大趋势,放热阶段中阶段Ⅳ的放热量上升趋势较为显著。不同升温速率下的总放热量分别为830.18,1 645.63,2 109.67 J/g,相较于升温速率5 ℃/min,升温速率10和15 ℃/min的总放热量增加率分别为98.2%和154.1%。分析DSC曲线的各个阶段可得出,第Ⅰ阶段由于在升温初期,煤的导热性能比较差,单位时间内无法积聚足够热量,随着升温速率的增大,此阶段温度区间向右偏移,通过吸收较多热量来蒸发水分和脱附气体。第Ⅱ阶段由于煤氧复合反应的持续进行,耗氧量不断增加,煤中吸氧量逐渐减小,在较高升温速率下,由于升温速率过快,煤吸氧进行复合反应释放的热量不能及时向外部环境传递,造成热量积聚,导致煤热焓值逐渐增大。第Ⅲ阶段受温度影响,煤结构中存在大量桥键断裂、脂肪侧链受热裂解、含氧官能团裂解等反应,生成自由基、气态烃、气体的同时产生部分热量。当升温速率增大时,煤结构裂解和断裂反应速率加快,放热量逐渐增加。第Ⅳ阶段由于煤是热的不良导体[31],程序升温变化的高低并不能直接快速影响煤体的内部温度,相同温度时升温速率越低其反应程度越高,当升温速率增大时,由于煤样内部不能及时升温,需要一定时间来传递热量,内部燃烧产生的热量也不能及时向外进行传递,造成放热峰变宽,燃烧温度区间向高温区偏移。
2.3 基于DSC曲线划分煤氧复合阶段的合理性
空气氛围、不同升温速率下的煤氧复合反应的TG曲线如图4所示。根据文献综述中提到的划分方法,在TG-DTG曲线上选取以下特征温度:T1为临界温度,也是DTG曲线上第1个失重峰对应温度;T2为煤氧复合反应前期TG曲线最小值对应温度,即质量变化速率为0时对应温度[32];T3为煤样在吸氧反应中增重率最大点对应温度;T4为煤与氧结合使其质量增加到最大,即将进入较快失重阶段时的温度;T5为煤样的着火点温度,其确定方法如图4所示,作DTG曲线上最大峰值垂线与TG曲线相交点的切线,该切线与TG曲线上热解温度T4水平线的交点所对应温度;T6为煤样在燃烧阶段质量变化速率最大点对应温度;T7为燃尽结束温度。不同升温速率下煤氧复合反应阶段对应的特征温度与质量变化见表3。
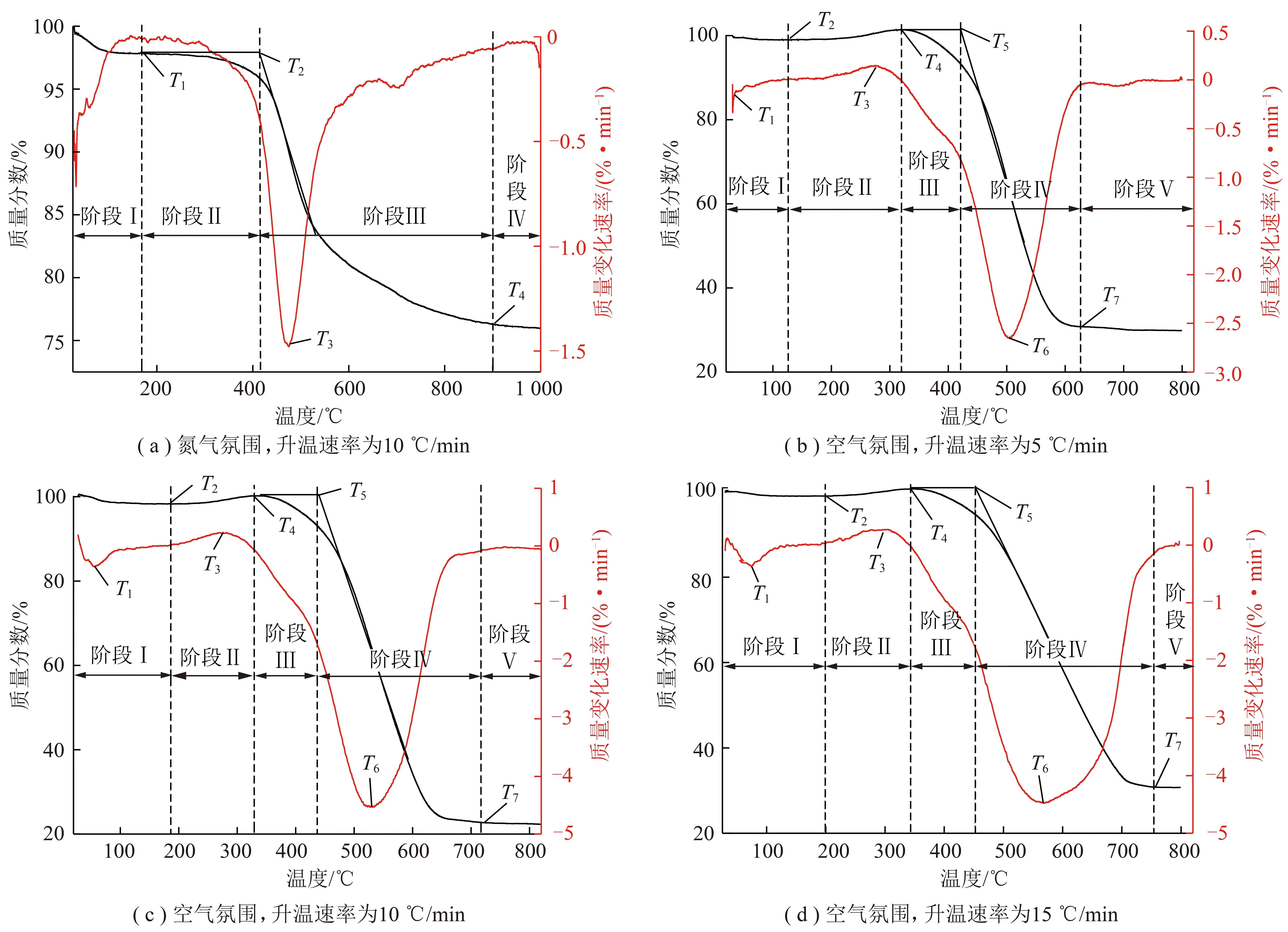
图4 不同升温速率下的TG和DTG曲线Fig.4 TG and DTG curves at different heating rates in inert gas and air atmosphere
根据TG曲线上的特征温度[33-34],将煤从低温氧化到燃尽结束的全过程划分为5个阶段[7-11]。即水分蒸发及气体脱附失重阶段Ⅰ(T0—T2)、化学吸附与缓慢反应增重阶段Ⅱ(T2~T4)、煤热解生成活性基团失重阶段Ⅲ(T4~T5)、挥发分和固定碳燃烧失重阶段Ⅳ(T5~T7)、燃尽恒重阶段Ⅴ(>T7)。需要说明的是,在空气氛围,升温速率为5,10,15 ℃/min下,燃尽恒重阶段剩余的残余质量分数分别为29.87%,21.81%,30.73%,这和表2工业分析中的灰分29.69%接近,说明利用综合热分析开展煤的工业分析也是可行的,同样也证明了实验数据的高度精准性。此外,对比升温速率为10 ℃/min时氮气和空气氛围下的TG曲线,可知在氮气氛围下室温~1 000 ℃内,初始阶段的失重现象是煤中气体或水蒸气的解吸和蒸发所致,后期以煤的热解反应为主,实验终止温度时相对质量分数在76%左右。该工况下没有发生增重现象,这与空气氛围下煤样的TG曲线变化过程具有较大的差异性。

表3 不同升温速率下煤氧复合反应阶段对应的特征温度与质量变化
基于表3和图2,将煤氧复合反应的DSC曲线各阶段特征温度与TG曲线上的各阶段特征温度进行对比,分析2种划分方法中各对应阶段特征温度的差异性,如图5所示。
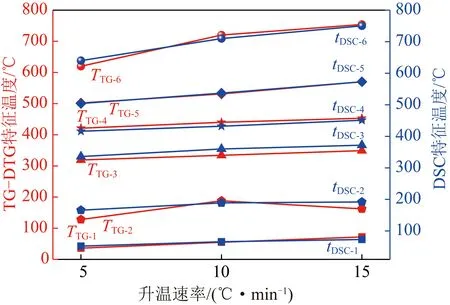
图5 TG-DTG和DSC曲线上特征温度对比Fig.5 Characteristic temperature on TG-DTG and DSC curves
对比煤氧复合反应的TG和DSC曲线各阶段之间的联系性,如图6所示。发现基于TG和DSC曲线划分相应阶段的每个特征温度在不同升温速率下均相差无几,表明煤氧复合反应的TG和DSC曲线中各阶段之间存在耦合关系,这说明基于DSC曲线划分煤氧复合的反应阶段是可行的,也是正确的。

图6 煤氧复合反应中TG和DSC曲线各阶段的对应关系Fig.6 Corresponding diagram of each stage between TG and DSC curves of coal-oxygen complex reaction
3 基于MS的气相产物及反应机理分析
前述煤样的TG-DSC曲线宏观总体反映了煤氧复合过程中的质量与热量变化,这有助于从宏观角度上厘清煤氧复合反应的全过程。如果再借助现代测试技术手段,同时在线实时分析煤氧复合反应生成的气体产物及浓度变化情况,则更有助于从微观角度认识煤氧复合的全过程和反应机理。
煤氧复合反应产生的气体产物种类很多,有碳氧化合物、烷烃化合物、氮氧化合物等[35]。这些气体产物的逸出主要来源于煤的热裂解、热分解和煤氧复合反应等过程。本节以空气氛围升温速率为15 ℃/min的煤样为例,基于NIST化学手册和矿井火灾学,分析甲烷、乙烯、二氧化碳和一氧化碳4种气体产物逸出的MS变化特征。4种气相产物逸出的质谱曲线如图7所示,图中纵坐标采用离子流强度表征气体产物逸出强度随温度的变化,其中最强检测点表示质谱仪在这一时段检测到该气体的生成量最多。
为分析上述4种气体产物的反应历程和反应机理,综合前人相关研究成果[36-40]可知,煤结构主要是由基本结构单元通过桥键连接而成,基本结构单元又由核和芳香核等“规则部分”和连在核周围的官能团(含氧、含硫及含氮官能团等)、烷基侧链、脂肪侧链等“不规则部分”组成,桥键由次甲基键、醚键、次甲基醚键、芳香碳-碳键等形式。为形象表述、直观解释煤结构中局部单元片段热裂解、热分解和煤氧复合反应产生CH4,C2H4,CO2和CO等气体的反应历程和生成机理,特构建了煤结构的局部单元片段,如图8所示。

图7 升温速率为15 ℃/min煤氧复合反应的气相产物逸出质谱曲线Fig.7 MS curves of gas product from coal-oxygen complex reaction at the heating rate of 15 ℃/min
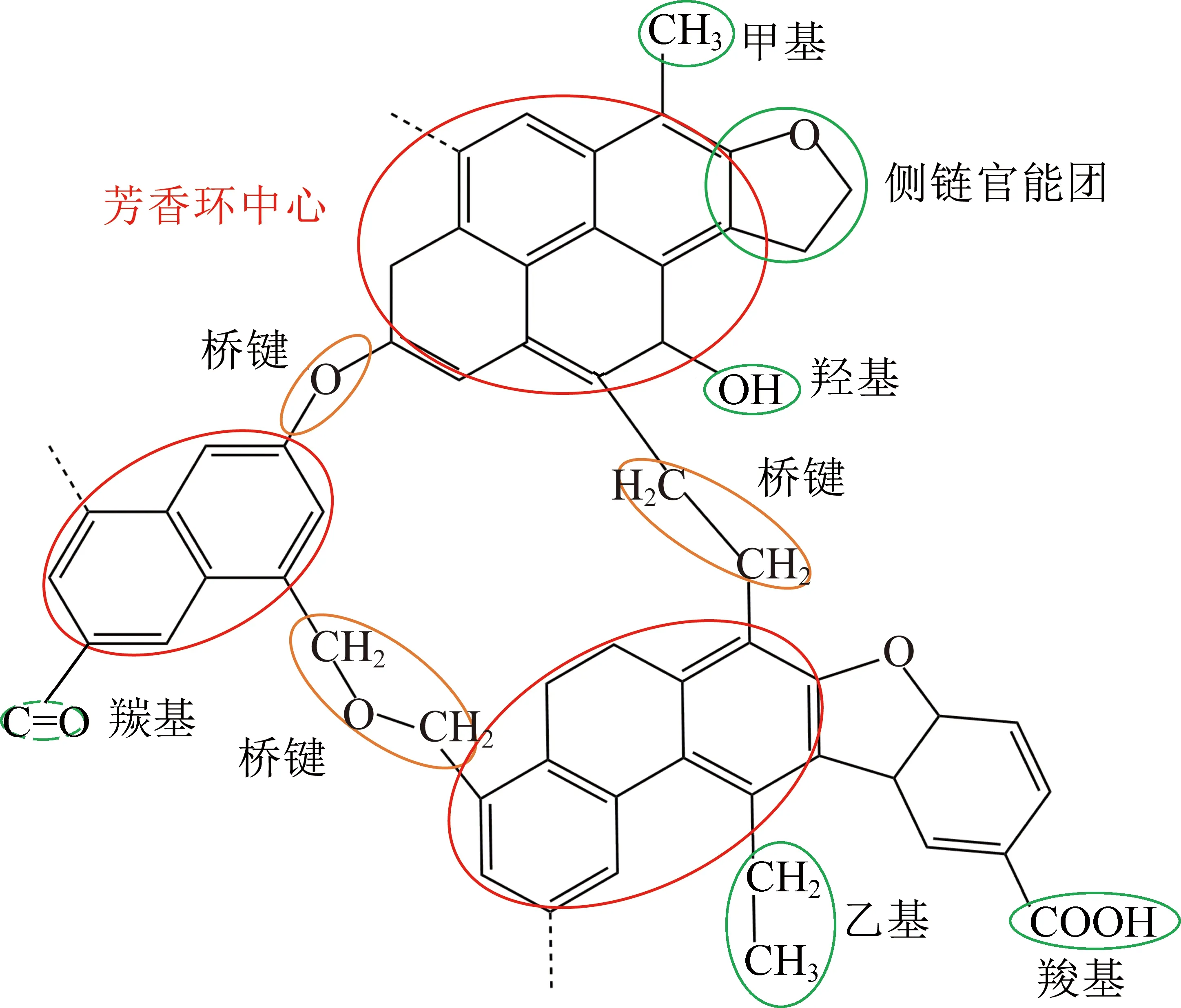
图8 煤结构的局部单元片段示意Fig.8 Schematic diagram of fragment unit of coal structure
3.1 甲烷气体的反应历程及生成机理
观察图7(a)可知,CH4质谱曲线的离子流强度随温度的升高呈先迅速增大,在达到最强点之后随温度的继续升高呈缓慢下降的趋势。根据瓦斯地质学和矿井火灾学知识,CH4的逸出可划分为3个阶段的反应历程。第1阶段的反应历程从30 ℃到200 ℃,对标于DSC划分法的水分蒸发及气体脱附失重阶段(T0~T2),此阶段的CH4主要源于煤中原生CH4的受热脱附以及缓慢的煤氧复合反应等,其反应过程如图9所示。这一阶段CH4的离子流强度随温度的升高而快速增大,CH4大量释放,并在135 ℃时达到最强检测点。

图9 水分蒸发及气体脱附阶段的反应过程示意Fig.9 Schematic diagram of reaction process in water evaporation and gas desorption stage
第2阶段的反应历程为200~450 ℃,对标于DSC划分法的化学吸附和缓慢反应增重阶段、煤热解生成活性基团失重阶段这2个阶段。随着煤温的增加,这一阶段主要发生的反应有化学吸附的煤氧复合初级反应,煤结构中部分官能团(—COOH、—OH、含氧杂环等,如图8所示)受热裂解、脂肪侧链受热裂解、烷基侧链断裂分解等生成CH4[41]。煤结构中部分桥健、官能团断裂生成CH4的反应历程中CH4生成量少于水分蒸发及气体脱附阶段释放的CH4,故其离子流强度呈下降趋势,并有一定的波动性。
第3个阶段的反应历程为450~750 ℃,对标于DSC划分法的挥发分和固定碳燃烧失重阶段。由于煤中挥发分和固定碳的开始燃烧,煤温急剧上升,煤结构中各类不规则的稠环芳烃和含有甲基官能团(—CH3)的脂肪链发生裂解和缩聚反应,释放出部分CH4,CO和CO2等[42],此阶段CH4的生成量少于第2阶段释放的CH4,积聚量较少,检测到的离子流随温度持续缓慢下降。
3.2 乙烯气体的反应历程及生成机理
讨论分析C2H4的生成规律之前,补充说明判识C2H4的依据:通过阅读相关文献和书籍[43-44]可知,煤氧复合过程中烷烃类气体的生成一般有2个路径:一个是游离相中的脂肪烃通过自由基裂解生成烃类气体;另一个来源是芳环上的烷基侧链、炔烃(如丙炔)和官能团等断裂和分解生成的。
根据这一原则,可判断出C2H4和CH4在质谱分析中的离子流强度具有相似性,故在判识出CH4产物的逸出曲线后,具有相似性逸出曲线,且分子量为28的离子流曲线就是C2H4的质谱分析曲线。观察图7(b)可知,C2H4在136 ℃时达到最强检测点,通常情况下煤中没有原生C2H4的存在,故第1阶段检测到的C2H4可以认为是煤氧缓慢的复合反应所致,第2,3阶段检测到的C2H4可认为是煤结构中的部分芳香族官能团、烷基侧链、桥键等结构断裂产生C2H4所致。
3.3 二氧化碳的反应历程及生成机理
观察图7(c)可知,CO2离子流强度,初期随温度的升高先有一小段微弱降低的走势,200 ℃以后随着温度升高逐渐增大,450 ℃左右进入一个短暂的平台期。之后随着温度的升高,CO2离子流强度快速增大,当燃烧质量变化速率及放热速率达到最大时,CO2离子流强度也达到了最大。之后随着煤中挥发分及固定碳的燃烧消耗,其离子流强度快速降低。第1个阶段的反应历程为30~200 ℃,对标于DSC划分法的水分蒸发及气体脱附失重阶段,此阶段的CO2主要源于煤中原生CO2的受热脱附以及缓慢的煤氧复合反应。这一阶段原生CO2解吸量随着温度的升高逐渐结束,煤氧复合产生的CO2量随着温度的升高逐渐增大,在原生CO2解吸量占据主要地位的情况下其解析速率逐渐变小,使离子流强度呈微弱降低趋势。
第2阶段的反应历程为200~450 ℃,涵盖DSC划分法的化学吸附缓慢增重阶段和煤热解生成活性基团失重阶段这2个阶段。这一阶段煤氧复合产生的CO2快速增加,使CO2离子流强度呈较快增大趋势。煤氧复合产生的CO2主要源于煤结构中含氧官能团(—COOH、—OH、含氧杂环等)受热裂解产生较多CO2,还有一部分源于煤结构中羧基等弱侧链的分解。
第3阶段的反应历程从450 ℃左右开始至燃尽结束,对标于DSC划分法的挥发分和固定碳燃烧失重阶段。当温度达到着火点温度(空气氛围、15 ℃/min升温速率下实验煤样的着火点温度为453 ℃)以后,煤中挥发分大量析出,在供氧充分下快速燃烧产生大量CO2,并于560 ℃左右达到峰值,此时CO2离子流强度最强。发生的化学反应历程有煤结构中的交联键(—C—C—和—O—等)断裂,和氧分子发生反应,产生CO2等气体。当超过560 ℃后,煤样中芳香环和脂肪环上连接的含氧羰基(—CO—)[44]、甲氧基(—CH3O)和醌氧基等官能团开始分解断裂,产生少量的CO2,CO等,致使CO2的离子流强度降低。
3.4 一氧化碳的反应历程及生成机理
观察图7(d)并与CO2的离子流强度曲线进行对比,可知CO的离子流曲线的变化趋势大部分都与CO2的离子流强度曲线相似。不同之处在于,CO的质谱曲线出现了2个逸出峰,对应温度分别为530,609 ℃。CO产生的反应过程同样也可划分为3个阶段。第1阶段的划分与CO2产生第1个阶段一样,此阶段的CO是煤中少量原生CO的受热逸出以及煤氧复合常温氧化和缓慢升温氧化反应所致[45-46]。随着温度逐渐升高,煤样内部受热,分子内能逐渐增加,煤氧复合速率逐渐加快[47-48]。进入第2个阶段后,煤中含氧官能团(—COOH、—OH、含氧杂环等)、芳香族官能团、烷基侧链、桥键等结构发生断裂[49],释放出较多的CO和烷烃类气体,使得CO离子流强度快速增大。
当温度进一步升高,进入到第3阶段(450 ℃左右开始至燃尽结束),各类不规则的稠环芳烃发生裂解和解聚反应,释放出更多CO等,致使CO离子流强度快速增大,在530 ℃左右时达到第1次肩峰,出现第1个最强检测点,之后CO离子流强度有一个短暂的降低过程。当温度继续增大,煤结构中的酚羟基和羰基分解,醚键、醛基等断裂,以及含氧杂环放热分解[50],再次释放更多的CO等。导致的结果是CO离子流强度再次大幅增加,并在609 ℃左右时达到第2次肩峰,第2次出现最强检测点。
4 结 论
(1)通过对煤氧复合全过程热量变化的测试与分析,定义了6个特征温度,基于吸放热情况将煤氧复合全过程划分了5个阶段,分别为水分蒸发及气体脱附吸热阶段、化学吸附和缓慢反应放热阶段、煤热解生成活性基团放热阶段、挥发分和固定碳燃烧放热阶段和燃尽结束阶段。确定了相应阶段的温度范围及描绘了相应阶段的本质内涵。
(2)通过计算分析,发现水分蒸发及气体脱附吸热阶段的吸热量随升温速率的增大而增大,放热阶段的放热量也相应呈增加趋势。通过作图比较,发现基于DSC划分法和基于TG划分法的煤氧复合阶段的划分具有高度重合性和一致性,表明煤氧复合全过程中的吸放热效应和增失重现象具有高度的耦合关系,这也证明了DSC划分法的可行性和正确性。
(3)通过气相产物的质谱分析和Chem 3D建模,阐明了甲烷、乙烯、一氧化碳和二氧化碳等气体的逸出情况、反应历程和生成机理。发现CH4和C2H4的生成趋势具有相似性,质谱曲线上的最强检测点对应温度基本相同。CO2逸出曲线呈抛物线,在560 ℃时出现逸出峰。CO逸出曲线具有双峰特征,双峰对应的特征温度分别为530,609 ℃。
