鼻咽癌中GLRX3的表达及其对铁代谢和Wnt/β-catenin信号通路调控机制的研究
2022-11-11荣小涵文浩杰唐金勇
荣小涵,文浩杰,周 娟,崔 毅,唐金勇
(郴州市第一人民医院,南方医科大学附属郴州医院 耳鼻咽喉头颈外科,湖南 郴州 423000)
鼻咽癌(Nasopharyngeal carcinoma,NPC)是一种发生于鼻咽上皮的鳞状细胞癌。鼻咽癌是临床发病率较高的头颈部恶性肿瘤病症之一[1]。据统计,我国鼻咽癌发病人数占全球发病人数的38.29%,死亡人数的40.14%,远高于世界平均水平[2]。且我国鼻咽癌5年的相对生存率仅为43.8%,造成沉重的家庭及社会负担[3]。现阶段鼻咽癌的主要治疗方法为放疗[4],但由于鼻咽癌的高转移性,致使临床治疗效果未达到理想预期。因此,亟待探索更为有效的新疗法。
谷氧还蛋白3(Glutaredoxin 3,GLRX3)是一种在真核生物中保守的氧化还原蛋白,参与多种信号通路的调控。研究发现,敲低GLRX3基因能抑制肿瘤细胞的增殖、迁移等异常行为[5]。在NPC中,GLRX3同样存在高表达现象,且其能促进肿瘤细胞增殖与转移等恶性行为,这提示GLRX3可能参与调节NPC发生及进展[6]。此外,GLRX3蛋白还是一种铁硫蛋白,其在体内以二聚体形式存在时,能够形成2个[2Fe-2S]键,从而达到对铁的调节作用[7]。已有研究发现,GLRX3可作为细胞铁稳态的关键调节剂发挥作用[8-9]。
铁代谢对大部分生物的存活至关重要,它参与机体的许多生理生化过程,如氧储存、酶促反应等。正常铁代谢主要包括3个过程:铁摄取、储存和利用,细胞中铁代谢的水平必须严格把控。铁代谢的失调会增加细胞癌化的风险,促进肿瘤的生长,这可能是铁离子在细胞中具有很强的氧化还原能力,它可以催化反应产生高效的活性自由基(如羟基自由基等)[10],这种自由基可以造成的DNA损伤、抑癌基因的沉默和癌基因的激活等一系列事件,进而诱导正常细胞的恶性转化,最终导致肿瘤的产生[11]。同时,与正常细胞相比,肿瘤细胞需要更多的铁来满足其快速生长的需求。因此,消除肿瘤细胞中过量的铁离子是一具有治疗潜力的研究方向。铁离子螯合剂早在20世纪80年代就被认为是一种能够用于肿瘤治疗的药物[12],它是一类通过结合细胞中过量的铁离子从而影响细胞铁代谢的化合物。铁离子螯合还可能调控AKT、Wnt和自噬途径等多种信号通路的表达,从而抑制细胞增殖、上皮间质转化 (EMT) 和转移[13]。这些发现强调靶向铁代谢的疗法可能在临床上具有极大的应用前景。
因此,本研究通过探索GLRX3与铁代谢对NPC细胞增殖与侵袭的影响,以及对可能调控Wnt/β-catenin 信号通路的机制,以期为鼻咽癌治疗提供新的思路与方向。
1 材料与方法
1.1 材料与仪器 人鼻咽癌上皮细胞(HONE1)、人正常鼻黏膜上皮细胞(NP69)购自美国典型培养物保藏中心(ATCC)。胎牛血清(FBS)、RPMI-1640培养基、Lipofectamine 2000、胰蛋白酶等购自美国Invitrogen公司;shRNA-GLRX3和shRNA-NC的设计与合成由上海吉玛制药技术有限公司完成;兔抗人GLRX3抗体、兔抗人β-catenin抗体、兔抗人Wnt1抗体、兔抗人TFR1抗体、兔抗人Ferritin抗体、兔抗人GAPDH抗体购自美国Cell Signaling Technology公司;辣根过氧化物酶标记的山羊抗兔IgG购自上海古朵生物科技有限公司;Prime ScriptTMRT与TB Green® Premix EX TaqTMⅡ试剂盒购自日本TaKaRa公司;总蛋白提取试剂盒、PVDF膜、细胞培养瓶、细胞培养皿、PBS、4%多聚甲醛等购自上海生工生物工程股份有限公司;Transwell小室购自北京优尼康生物科技有限公司。实时荧光PCR定量仪(ABI公司)、垂直电泳仪、扫膜仪等(美国Bio-Rad公司)、酶标仪(Thermo公司)。
1.2 临床样本收集 收集本院2019年1月至2020年4月进行手术治疗的鼻咽癌患者鼻咽癌组织和相应的癌旁组织各36例,其中男性24例,女性12例,平均年龄为45.6岁。所有患者经病理检查为鼻咽部低分化癌,并均为首次确诊。将样品保存于液氮中备用。本研究经郴州市第一人民医院伦理委员会批准(NO:2022034),所有患者均签署了知情同意书。
1.3 鼻咽组织的免疫组化 取切片至 3 μm的人鼻咽癌上皮与癌旁鼻粘膜组织切片置于防脱玻片上,进行脱蜡复水,抗原修复,一抗兔抗人GLRX3(1∶300)抗体孵育4℃过夜,二抗辣根过氧化物酶标记的山羊抗兔二抗(1∶1 000)孵育室温 30 min,DAB显色,苏木精复染,脱水透明,封片,显微镜下观察结果。
1.4 细胞培养、转染及分组 将人鼻黏膜上皮细胞株NP69(培养基为KMSF)和人鼻咽癌细胞HONE1培养在含1%青霉素、1%链霉素、10 %胎牛血清的RPMI-1640培养基中,37 ℃、5% CO2饱和湿度条件的细胞恒温培养箱中进行细胞培养。待细胞融合度达70%时进行传代培养,以保证细胞的活力。
将HONE1细胞铺于细胞培养皿,在37 ℃、5% CO2温育箱中培养。待细胞融合度达70%,均匀接种至24孔板中,继续培养至融合度为70%。按照Lipofectamine 2000转染说明书进行操作,将转染shRNA-GLRX3的细胞设为GLRX3敲低组(shGLRX3组)、转染shRNA-NC的细胞设为阴性对照组(shNC组),并将未转染的细胞设为空白对照组(Control组),同时将终浓度为100 μM铁离子螯合剂DFO处理的细胞设为DFO组。上述各组细胞培养24 h后用于检测各项相关指标。
1.5 RT-PCR 检测基因的mRNA表达水平 利用TRIzol试剂提取待测细胞中RNA,按Prime ScriptTM RT反转录试剂盒说明书方法反转录成cDNA后,以其为模板按照TB Green® Premix EX TaqTM Ⅱ试剂盒进行RT-PCR。RT-PCR反应条件为:95.0 ℃,30 s 预变性;95.0 ℃,10 s,60.0 ℃,30 s,40个循环。以GAPDH 为内参,采用2-ΔΔCt法计算GLRX3、β-catenin、Wnt1、TFR1、Ferritin的mRNA表达水平,实验重复3 次。实验中的引物序列如下所示:GAPDH的上游引物:5’-GCACCGTCAAGGCTGAGAAC-3’、下游引物:5’-TGGTGAAGACGCCAGTGGA-3’;GLRX3的上游引物:5’-CGCTGTGGTTTCAGCAAGC-3’、下游引物:5’-CTTCAGA TGCTTCTAGCTCCTT-3’;β-catenin的上游引物:5’-GCTGCTGTTTTGTTCCGAA T-3’、下游引物:5’-CTGGCCA TA TCCACCAGAGT-3’;Wnt1的上游引物:5’-TGCTGTC CCTGTGGTATTGT-3’、下游引物:5’-ACAGCTTTCCTTGC CCTTTC-3’;TFR1的上游引物:5’-AATCTCCAGAGCTGCTGCAG-3’、下游引物:5’-AGGAGAGCTGTGCCTACACC-3’;Ferritin的上游引物:5’-ATGCCAGCGAAATCCGCCAGA-3’、下游引物:5’-CAGGAAGAGCAACGTCATCTCTGA-3’。
1.6 Western blot检测蛋白的表达情况 从细胞中提取出的蛋白质用BCA测定浓度后,12%SDS-PAGE 分离胶进行蛋白分离,后转移到PVDF膜上,室温下用5%脱脂牛奶封闭1 h,分别用Ferritin (1∶1 000)和TFR1(1∶1 000)、Wnt1(1∶1 000 )、β-catenin(1∶1 000)、GAPDH (1∶1 000)的一抗4℃孵育过夜;随后用辣根过氧化物酶酶标记的山羊抗兔(1∶5 000)于37 ℃孵育1 h,TBST洗膜后滴加ECL发光液,凝胶成像仪拍照,Image J软件进行分析。
1.7 CCK-8法检测细胞的增殖 在96孔板中每孔接入1 000个细胞,待细胞贴壁后,按方法1.3进行转染与分组,并另外设置一组仅加培养液的空白对照。上述各组分别在培养0、24、48、72 h后弃去每孔中上清,加入10% CCK8溶液100 μL,继续培养1 h后,用酶标仪在450 nm波长处检测各孔的光吸收值,用OD值代表细胞的增殖能力。
1.8 Transwell 侵袭实验 将基质胶铺于每孔小室的底部,用无血清的RPMI-1640培养液重悬各组细胞,向上室内接种200 μL含1.0×105个细胞的悬液,下室加入600 μL含10%牛血清的培养液。每组设置3个重复孔。恒温培养箱培养12 h后,取出小室,轻轻擦拭掉上室底部未穿过膜的细胞,并用4%多聚甲醛固定30 min,浸入0.1%的结晶紫染色液中15 min。在显微镜下计数、拍照记录。

2 结果
2.1 敲低GLRX3可以抑制GLRX3 mRNA和蛋白的表达 免疫组化实验结果显示,GLRX3在鼻咽癌组织中的表达水平较癌旁组织显著升高。RT-PCR结果表明,与癌旁组织相比较,鼻咽癌组织中GLRX3 mRNA的水平,显著增加(P<0.05)。检测正常鼻粘膜细胞NP69与鼻咽癌细胞HONE1中GLRX3 mRNA水平的结果显示,与NP69相比,GLRX3 mRNA在HONE1中的表达显著增加(P<0.05)。同时, RT-PCR实验和WB检测转染后的HONE1中GLRX3 mRNA和蛋白表达的结果显示,与Control组和shNC组相比,shGLRX3组的GLRX3 mRNA和蛋白表达水平均显著降低(P<0.05),而Control组和shNC组之间的GLRX3 mRNA和蛋白表达水平无明显差异(P>0.05),见图1。
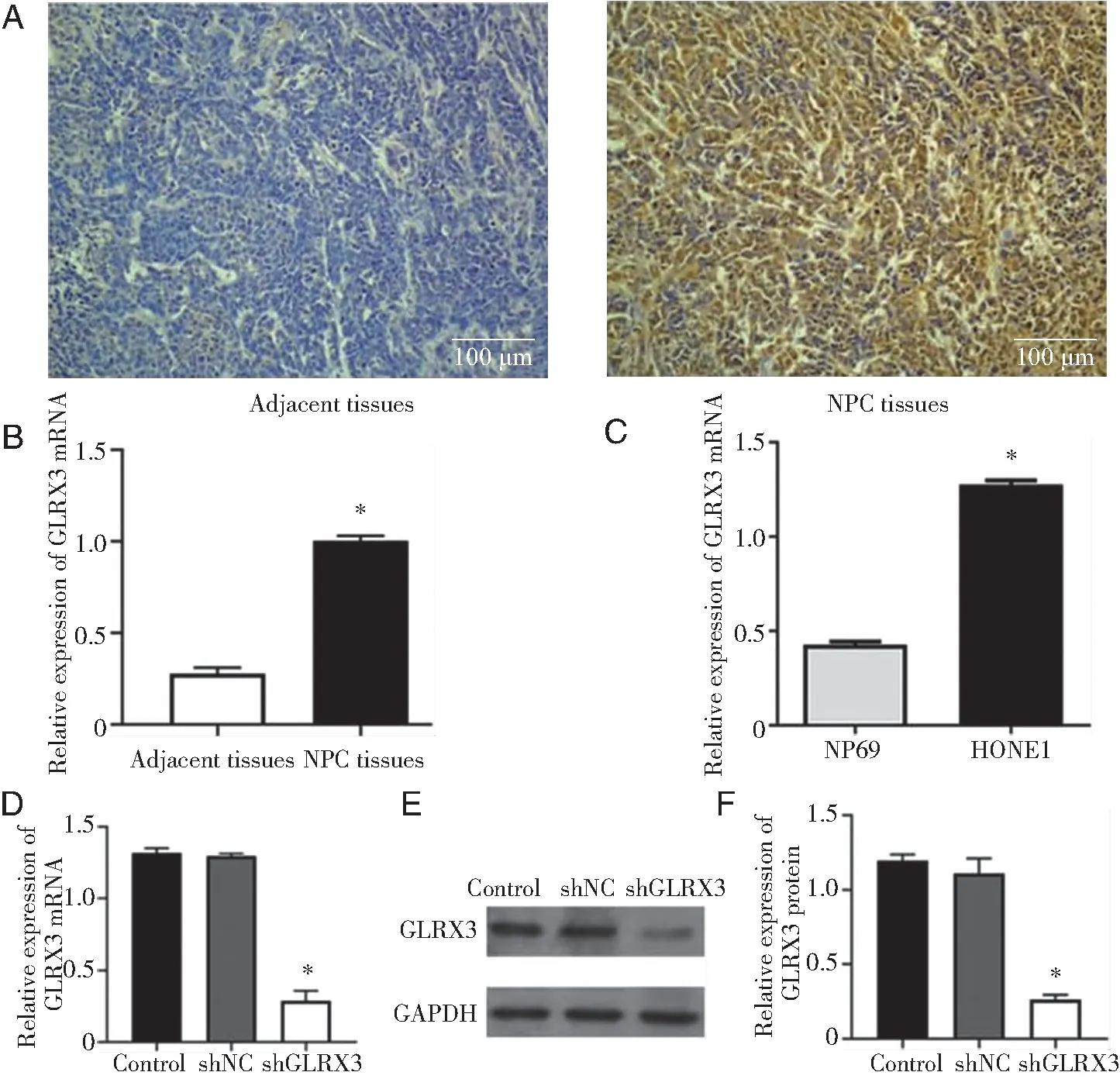
A:IHC检测组织中GLRX3蛋白的表达情况;B:组织中GLRX3 mRNA的表达水平;C:各细胞系中GLRX3 mRNA的表达水平;D:GLRX3在各组转染细胞中的mRNA的表达水平;E、F:各组转染细胞中GLRX3的蛋白的表达水平;*: P<0.05。图1 GLRX3 mRNA和蛋白表达
2.2 敲低GLRX3抑制铁代谢相关蛋白的表达和mRNA水平 Western blot与RT-PCR分别检测各组细胞中Ferritin、TFR1的mRNA和蛋白表达结果显示,与Control组和shNC组相比,hGLRX3组与DFO组的Ferritin、TFR1的mRNA和蛋白表达较均显著降低(P<0.01),前两组无明显差异(P>0.05);而与DFO组相比,shGLRX3组中Ferritin、TFR1的蛋白表达和mRNA水平均没有明显的变化(P>0.05),见图2。
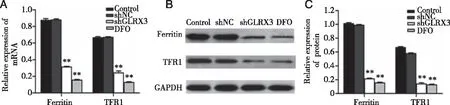
A:铁代谢相关蛋白在各组细胞中的mRNA表达水平;B、C:WB检测各组细胞中铁代谢相关蛋白的表达情况;*、**:分别与Control组、shNC组比较,P<0.05,P<0.01。图2 敲低GLRX3铁代谢相关蛋白的表达
2.3 敲低GLRX3基因能抑制细胞的增殖和侵袭通过CCK-8法检测 各组细胞的增殖情况,与Control组和shNC组相比,shGLRX3组的细胞增殖能力在24、48、72 h时均显著降低(P<0.05),DFO组的细胞增殖能力在48、72 h时显著降低(P<0.01),Control组与shNC组无明显差异(P>0.05);DFO组与shGLRX3组的细胞增殖能力无明显差异(P>0.05)。Transwell实验结果表明,与Control组和shNC组相比,shGLRX3组与DFO组细胞的侵袭能力均显著降低(P<0.05),前两组无明显差异(P>0.05);而与DFO组相比,shGLRX3组的细胞侵袭能力无明显改变(P>0.05),见图3、表1。
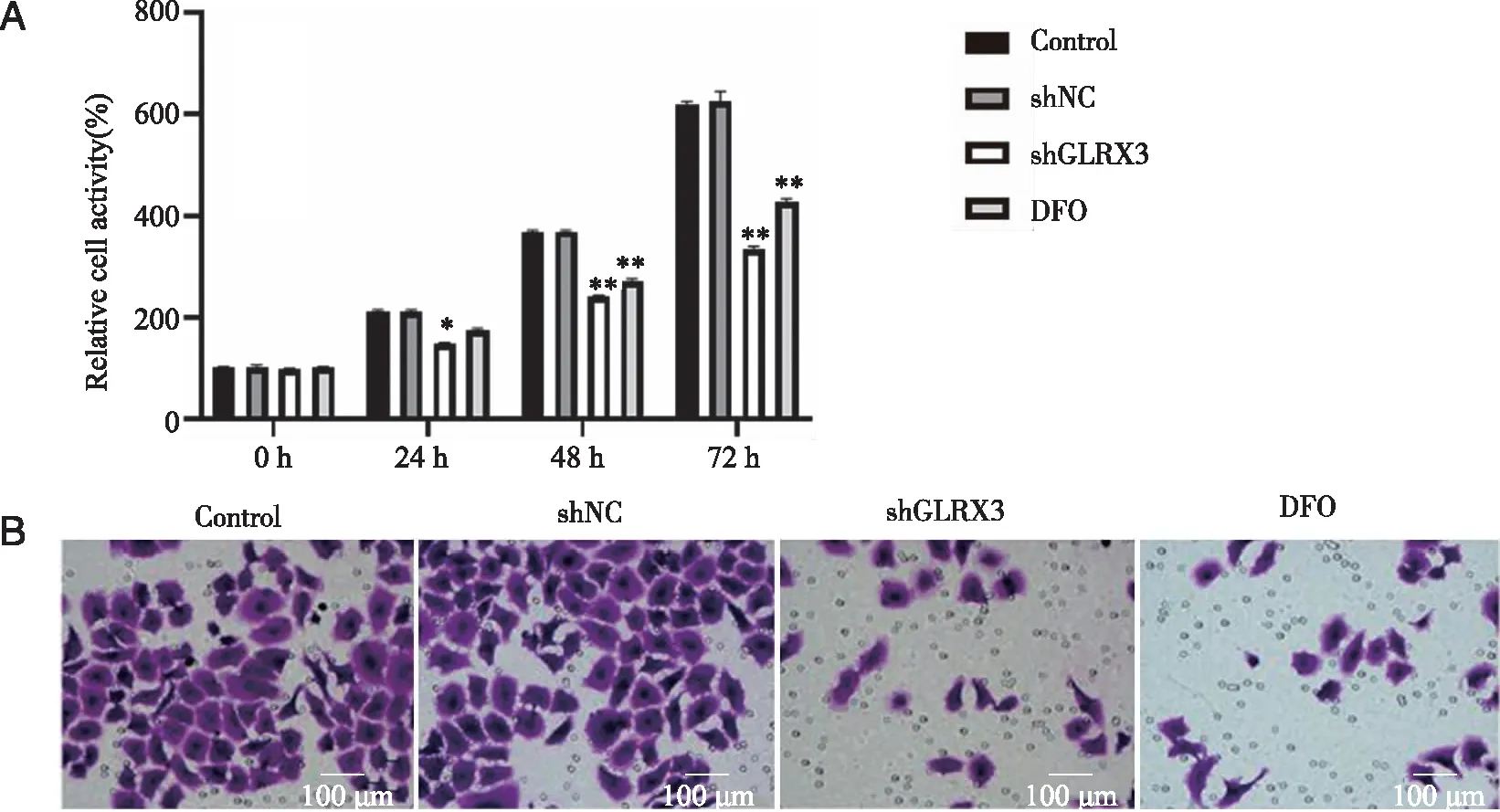
A:CCK-8检测不同时间(0、24、48、72 h)各组细胞的增殖情况;B:Traswell小室检测各组细胞侵袭能力;*、**:与Control组、shNC组比较,P<0.05,P<0.01。图3 细胞的增殖和侵袭能力
表1 各组细胞侵袭能力的比较
2.4 敲低GLRX3基因能抑制Wnt信号通路相关蛋白 RT-PCR与Western blot实验结果表明,与Control组相比较,shGLRX3组与DFO组Wnt1、β-catenin的mRNA和蛋白表达均显著降低(P<0.01)。前两组无明显差异(P>0.05);而与DFO组相比,shGLRX3组的上述检测指标均无明显改变(P>0.05),见图4。
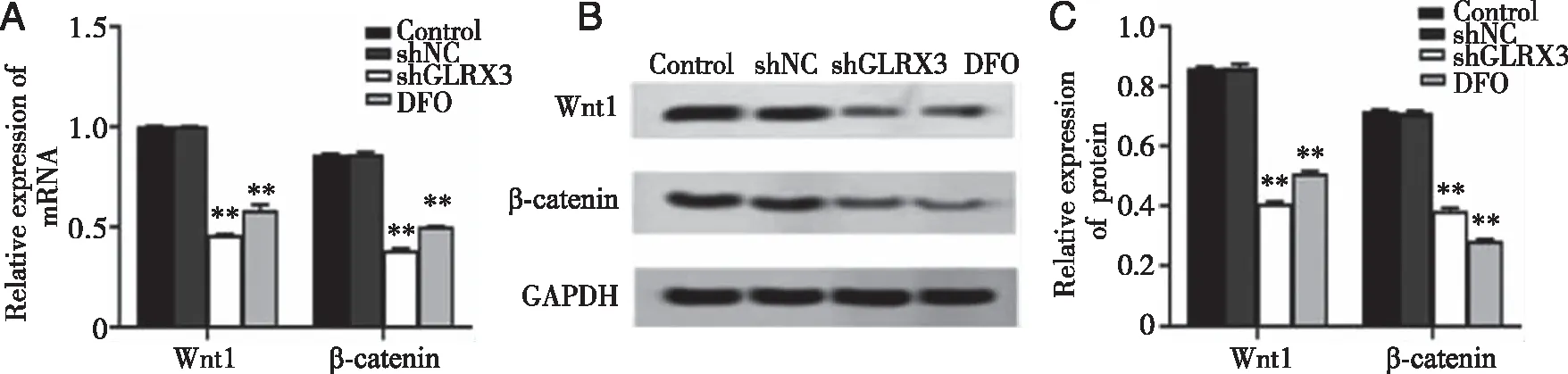
A:RT-PCR检测Wnt信号通路中Wnt1、β-catenin在各组细胞中的mRNA的表达水平;B、C:WB检测各组细胞中Wnt信号通路中Wnt1、β-catenin蛋白的表达情况;*、**:与Control组、shNC组比较,P<0.05,P<0.01。图4 铁离子螯合剂抑制Wnt信号通路
3 讨论
目前,鼻咽癌在我国仍然面临着治疗难的问题。其病理主要是低分化鳞癌,早期的临床症状并不明显,所以临床就诊多为晚期患者。但是随着疾病的发展,鼻咽癌细胞常伴随远处转移,尤以颈部淋巴结转移多见,这种情况增加了鼻咽癌治疗的难度,并造成患者预后的不良[14]。
GLRX3作为一种重要的蛋白,可以通过激活多种信号通路调控组织与细胞的代谢等来参与肿瘤的发生进展。已经有研究表明,GLRX3能够在鼻咽癌细胞和组织中大量表达,并在不依赖ROS的情况下通过EGRF-Akt通路促进鼻咽癌细胞的增殖与转移[14]。目前,GLRX3在鼻咽癌中的复杂作用在很大程度上仍未被发现。本研究我们通过检测GLRX3基因在鼻咽癌组织和相应的癌旁组织中的表达后,证实GLRX3基因在鼻咽癌中呈现显著高表达水平,这与上述研究结果一致。鉴于GLRX3和癌细胞中铁代谢相互作用,我们认为GLRX3可能通过调控铁代谢参与NPC进展。肿瘤细胞能够通过上调铁代谢的相关基因表达增加细胞内铁的贮存。同时,铁可促进细胞增殖,加快肿瘤形成。因此铁离子的含量是癌细胞增殖的一个重要影响因素。在细胞中,储铁蛋白(Ferritin)与转铁蛋白受体1(TFR1)是铁代谢途径中的关键分子。Ferritin是一种储铁蛋白。其在许多癌症组织中过度表达,包括乳腺癌、非小细胞肺癌、肝癌[15-18]。Du等[19]研究表明在急性白血病细胞中Ferritin的过度表达可促进细胞增殖。TFR1,一种能够运输铁的蛋白,对铁吸收和细胞生长调节至关重要。许多研究表明,与正常细胞相比,癌细胞中TFR1的表达增加[20]。
本研究结果发现GLRX3能够影响鼻咽癌细胞中铁代谢相关蛋白的表达。由于以二聚体存在的GLRX3能够形成二键的[2Fe-2S],这提示铁代谢相关蛋白可能在GLRX3基因调控鼻咽癌细胞的增殖与分化中发挥重要作用。研究认为,参与细胞内铁平衡的主要蛋白TFR1可以通过调节细胞铁的利用而控制细胞增殖[21]。在正常细胞膜上,TFR1低表达,维持细胞内较低的铁水平,然而在乳腺癌,肾癌,肺癌组织等癌细胞中,TFR1表达增加,细胞内铁过载,且与分化程度密切相关[22]。因此本研究同时检测各组中TFR1、Ferritin表达情况,分析发现GLRX3高表达的鼻咽癌细胞中,TFR1、Ferritin同样高表达。因而设想GLRX3是鼻咽癌中参与铁代谢的候选肿瘤致癌基因。同时,有研究指出,可通过抑制铁离子含量使铁蛋白在组织中表达下调,来抑制细胞增殖和迁移[13]。本研究在鼻咽癌细胞HONE1中加入铁离子螯合剂DFO后,TFR1、Ferritin表达均降低,并且鼻咽癌细胞的增殖与侵袭能力均降低。这些发现进一步证实,GLRX3可通过调控铁代谢及其相关蛋白的表达来抑制鼻咽癌细胞的增殖与侵袭行为。同时,靶向GLRX3的治疗可能具有与铁螯合剂相似的功能。
Wnt/β-cateni的信号通路在细胞中Wnt的经典调控途径。Wnt蛋白通过与细胞膜上的受体结合,发挥其下游作用机制,其中最重要的一条即Wnt/β-catenin通路[23]。Wnt1是Wnt信号通路激活的重要蛋白。β-catenin可与T细胞因子/淋巴细胞增强因子1(T cell factor/lymphoid enhancer factor-TCF/LEFl)结合,并转录激活一系列Wnt反应蛋白,引起细胞的恶性进展[24-26]。已有研究表明,Wnt/β-catenin 信号通路在鼻咽癌组织中被异常激活[27]。本研究通过转染低表达的GLRX3基因发现鼻咽癌细胞中Wnt信号通路主要分子β-catenin、Wnt1的表达明显降低。这提示了GLRX3可能通过激活Wnt的信号通路来引发鼻咽癌细胞的增殖与转移。
在鼻咽癌细胞中HONE1加入DFO处理后,β-catenin、Wnt1的表达呈现与敲低GLRX3基因一致的实验结果。正常细胞中,我们可以预测在铁升高的情况下,TFR1减少,铁蛋白表达增加。但在鼻咽癌中观察到的TFR1和Ferritin表达均升高。此变化可能是Wnt信号的影响结果。这种信号将进一步加速细胞铁摄取[28]。因此,本研究利用铁离子螯合剂能结合铁的功能,进一步证实了GLRX3通过调控铁代谢对Wnt信号通路的抑制作用。
综上所述,本研究发现在降低NPC组织与细胞中高表达的GLRX3能抑制肿瘤细胞中铁代谢水平,并抑制NPC增殖与侵袭能力,而这可能通过下调Wnt信号通路的活性发挥作用。
