5,6-二溴去甲斑蝥素-维生素C缀合物的合成
2022-11-11王先恒孙成新左琳铭赵长阔
兰 青,王先恒,孙成新,左琳铭,赵长阔
(1.遵义医科大学 药学院, 贵州 遵义 563099,2.遵义医科大学 贵州省基础药理重点实验室, 贵州 遵义 563099)
斑蟊素(Cantharidin,CTD,见图1)是一种三环单萜化合物,分子式为C10H12O4,从传统中药斑蝥虫分离得到的主要活性成分[1],具有抗肿瘤、抗病毒和免疫调节等活性,在临床中低剂量的斑蝥素用于杀虫、壮阳及抗癌治疗[2-3];而较高浓度的斑蝥素可能导致呕吐、腹泻、肾炎、血尿、蛋白尿、水肿等严重的不良反应[4]。去甲斑蝥素(Norcantharidin,NCTD,见图1)是斑蝥素的衍生物[5],通过抑制细胞增殖诱导细胞凋亡[6]。NCTD在杀死癌细胞的同时,能增强免疫力,是一种有效的抗癌药物[7-10]。但严重的不良反应如骨髓抑制和泌尿道刺激,恶心、呕吐等[11]限制了它在临床的应用。药物学家尝试通过结构改造以增强抗肿瘤活性及降低不良反应。
维生素C,又称抗坏血酸,分子式为C6H8O6,是具有不饱和结构的己糖酸内酯(结构见图1)[12],是人体生理代谢所必需的一种化合物,可以使人体生理机能保持稳定。作为一种较强的抗氧化剂及自由基清除剂,维生素C具有预防衰老、增强机体的免疫和抗应激能力,以及调节机体代谢反应的功能[13]。近年来,有关维生素C预防和治疗肿瘤的研究受到广泛关注。维生素C通过促进抑癌基因的表达,促进干细胞分化,发挥抗癌作用,增强免疫能力。在临床上不仅广泛用于辅助治疗多种癌症,也可以多方面增强体液免疫与细胞免疫的防御功能[14-17]。

图1 斑蝥素与去甲斑蝥素及维生素C的化学结构
将不同天然产物拼接成为缀合物,是开发抗肿瘤新药的重要手段。例如:卢颖洁等[18]用左氧氟沙星和川芎嗪为先导化合物,设计得到目标缀合物并测试其体外抗肿瘤活性,结果表明目标产物比先导结构川芎嗪的肿瘤抑制活性更好;李璐等[19]通过将单元查耳酮引入到环丙沙星中,合成环丙沙星-查耳酮缀合物,经测试抗肿瘤活性发现,这些缀合物有更强的选择性和抑制活性。这些结果说明,将天然产物设计成缀合物,能得到比母体活性更强、毒性更低、结构新型的缀合物。
本研究首次以各种不同的小分子氨基酸作为连接臂,键合去甲斑蝥素(NCTD)和维生素C,设计并合成了一系列5,6-二溴去甲斑蝥素-维生素C缀合物;为新型抗肿瘤药物的研发提供参考。
1 材料与方法
1.1 材料
1.1.1 试剂 呋喃[分析纯,梯希爱(上海)化成工业发展有限公司];三氯甲烷、甲醇(分析纯,成都市科龙化工试剂厂);二氯甲烷、乙酸乙酯、氯化苄、二甲亚砜(分析纯,天津市富宇精细化工有限公司);丙酮、四氢呋喃[分析纯,重庆川东化工(集团)有限公司];顺丁烯二酸酐[分析纯,恩化学技术(上海)有限公司];碳酸氢钠(分析纯,上 海化学试剂厂); 层析用硅胶(粒度 200~300 目,青岛海洋化工厂);蒸馏水(自制)。
1.1.2 仪器 仪器采用SZCL-2 型数显智能控温磁力搅拌器(郑州科华仪器设备有限公司);SHZ-D(Ⅲ)型台式循环水式多用真空泵(郑州长城科工贸有限公司);SGW X-4 型显微熔点仪(上海仪电物理光学仪器有限公司);RE-2000A 型旋转蒸发仪(上海亚荣生化仪器厂);FA2004N 型电子天平(上海菁海仪器有限公司)。
1.2 方法
1.2.1 合成路线 目标产物的合成包括3部分:首先,将维生素C与乙酰氯反应得到中间体1,将化合物1与氯苄反应得到化合物2;其次,以顺丁烯二酸酐为起始原料与呋喃反应得5-烯去甲斑蝥素3,化合物3在液溴的作用下得5,6-二溴去甲斑蝥素4,化合物4与不同的氨基酸反应,得化合物5a-j;最后,将化合物2与化合物5a-j在催化剂4-二甲氨基吡啶(4-Dimethylaminopyridine,DMAP)及缩合剂1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(1-Ethyl-3(3-dimethylpropylamine) carbodiimide,EDCI)的作用下,得到目标化合物6a-j。合成路线见图2。
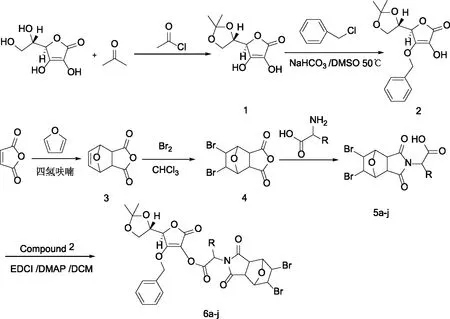
图2 5,6-二溴去甲斑蝥素-维生素C缀合物的合成路线
1.2.2 中间体1,2的制备 将10.0 g维生素C置于干燥的圆底烧瓶中,加入75.0 mL丙酮溶液,不断搅拌至其溶解。逐滴滴加1 mL乙酰氯,反应过夜。抽滤,烘干得到白色粉末维生素衍生物3(8.2 g,产率66.7%)。
称取500.0 mg维生素衍生物3置于反应瓶中,加入2.0 mL 二甲基亚砜(Dimethyl Sulfoxide,DMSO)溶液使其完全溶解。加入485.2 mg碳酸氢钠,50 ℃搅拌反应30 min后逐滴滴加0.1 mL氯化苄溶液,反应过夜。TLC监测反应,反应结束后加入2.0 mL蒸馏水淬灭。用乙酸乙酯3 mL ×3次与之萃取,有机相浓缩得粗产品。柱层析法纯化得到化合物2,为白色固体241.7 mg,产率34.1%。合成路线见图3。

图3 中间体1、2的制备
1.2.3 5,6-二溴去甲斑蝥素氨基酸衍生物5a-j的制备 将10.0 g顺丁烯二酸酐放进干燥的三口烧瓶中,室温下加入15 mL的四氢呋喃溶液搅拌至其完全溶解。缓慢滴加10 mL呋喃。封口置阴凉处放置24 h,晶体析出,抽滤、烘干得到白色晶体,得5-烯去甲斑蝥素3(15.9 g,产率94.0%)。称取2.0 g 5-烯去甲斑蝥素置于干燥的圆底烧瓶中,加入10 mL二氯甲烷溶液并不断搅拌成悬浮状。在冰浴搅拌下用滴液漏斗缓慢向悬浮液中滴加0.6 mL液溴的4 mL二氯甲烷溶液,滴加完毕后缓慢升温至室温反应过夜。反应结束后抽滤,用四氯化碳洗涤3次,烘干,得到白色粉末5,6-二溴去甲斑蝥素22.9 g,产率73.5%。
将5,6-二溴去甲斑蝥素(300.0 mg,0.9 mmol)和L-亮氨酸(121.0 mg,0.9 mmol)置于干燥的反应瓶中,氮气保护,缓慢加热至150 ℃搅拌反应。TLC监测反应,待其反应完成后,加入2 mL二氯甲烷,用2 mL蒸馏水洗3次,用无水硫酸镁干燥,抽滤,得粗产品。用洗脱剂二氯甲烷∶甲醇(CH2Cl2∶MeOH=50∶1)柱层析纯化,得到白色固体5a(293.4 mg,产率72.5%)。按化合物 5a 类似的方法分别制备化合物 5b-j。合成路线见图4(反应条件优化见表1)。
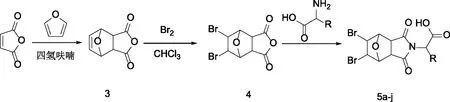
图4 5,6-二溴去甲斑蝥素氨基酸衍生物5a-j的制备
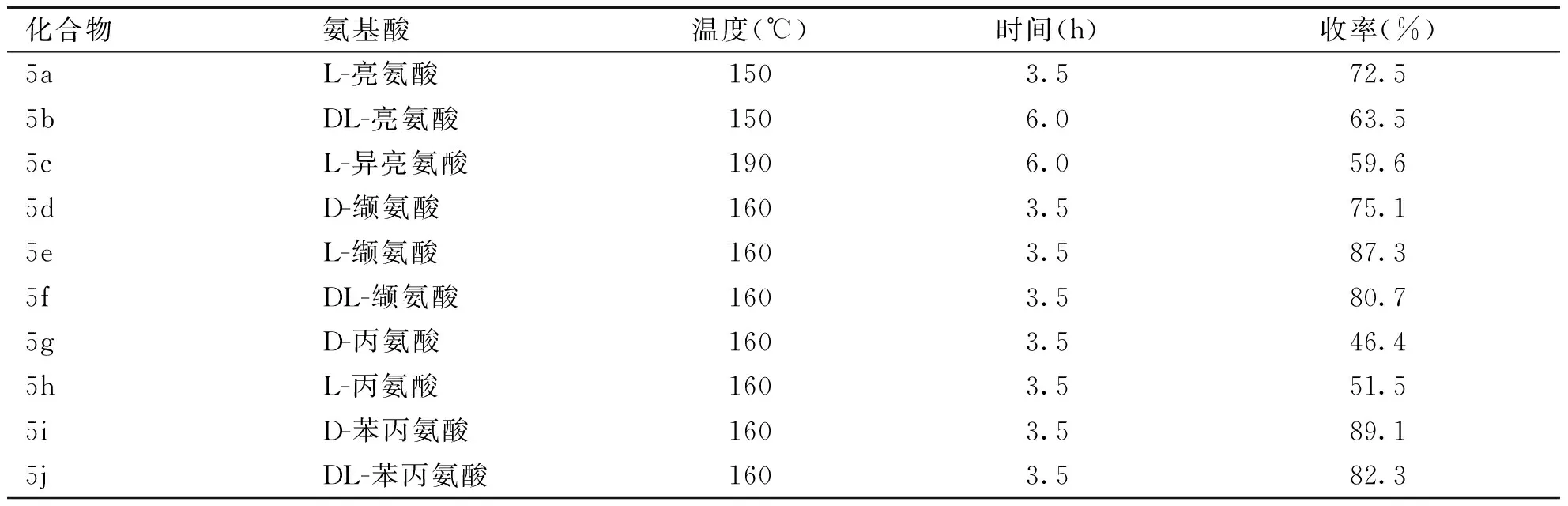
表1 化合物5a-5j的反应条件的优化
1.2.4 5,6-二溴去甲斑蝥素维生素C缀合物6a-j的制备 将5,6-二溴去甲斑蝥素氨基酸衍生物5a-j与化合物2溶解于二氯甲烷中,充入氮气保护,在EDCI 和DMAP的催化作用下得到5,6-二溴去甲斑蝥素-维生素C缀合物6a-j,合成路线见图5。
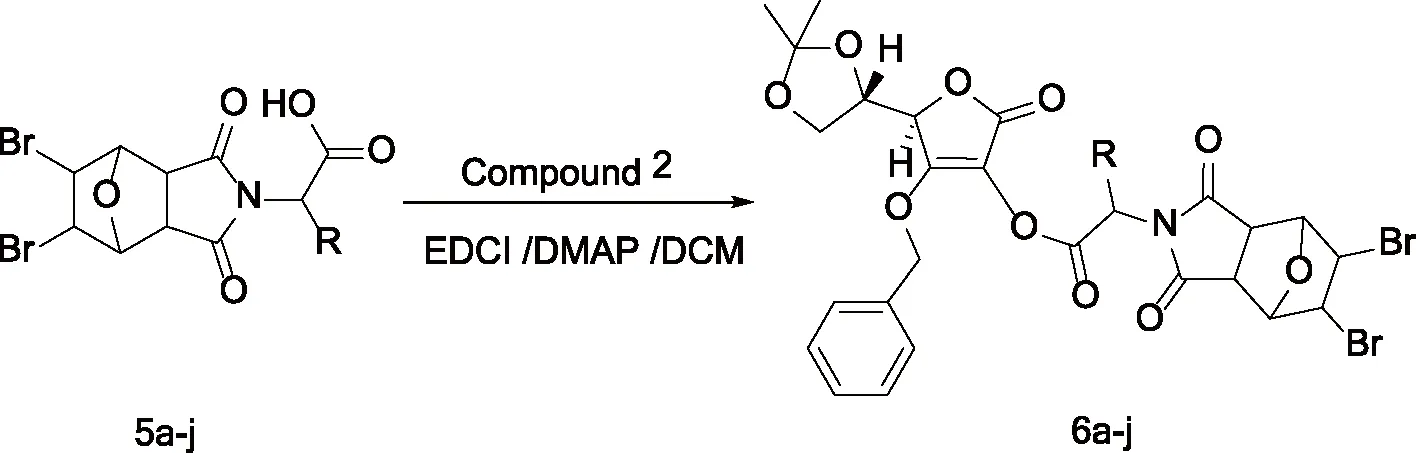
图5 5,6-二溴去甲斑蝥素-维生素C缀合物6a-j的制备
2 结果
2.1 化合物6a(R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3-((2s)-2-(5,6-二溴-1,3-二氧代辛烷-4,7-环氧异吲哚-2-基)-4-戊酸甲酯) 称取化合物5a(77.4 mg,0.2 mmol)与维生素衍生物4(50.0 mg,0.2 mmol)置于反应瓶中,加EDCI(76.7 mg,0.4 mmol)和DMAP(12.7 mg,0.1 mmol),加入4 mL二氯甲烷使其溶解,氮气保护,室温下搅拌反应过夜。TLC监测反应。待其反应停止后,加入2 mL二氯甲烷,用3 mL蒸馏水洗涤3次。有机相用无水硫酸镁干燥,抽滤,得粗产品,用洗脱剂CH2Cl2∶MeOH=300∶1,柱层析纯化得到白色粉末(6a,42.8 mg,产率36.0%),熔点:114.6-116.3 ℃,Rf= 0.6(CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.49-7.30 (m,3H),5.28-5.20 (m,1H),5.02-4.95 (m,1H),4.87 (s,1H),4.73 (d,J=38.2 Hz,2H),4.31 (ddd,J=18.5,5.9,3.1 Hz,1H),4.07 (dd,J=20.0,7.2 Hz,1H),3.95-3.89 (m,1H),3.76 (dd,J=33.0,7.2 Hz,1H),3.13-2.94 (m,1H),1.35 (d,J=13.5 Hz,4H),0.93-0.86 (m,4H)。13C NMR (101 MHz,CDCl3) δ 175.01,174.93,173.62,173.51,166.37,166.32,166.17,160.34,160.29,134.46,134.31,129.09,128.87,128.83,127.91,127.81,114.17,114.12,110.63,86.52,86.45,82.99,82.92,75.32,74.26,73.49,65.19,52.60,52.40,52.25,52.12,51.21,48.07,47.67,45.41,44.96,36.23,36.17,26.88,25.77,25.52,24.54,23.16,23.13,20.99,20.96,14.10。
2.2 化合物6b(R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3- (2-(5,6-二溴-1,3-二氧代辛烷-4,7-环氧异吲哚-2-基)-4-戊酸甲酯) 采用同样方法,5b代替5a,得到白色固体(6b, 118.6 mg,产率49.9%),熔点:130.8-132.3 ℃,Rf=0.7(CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.38 (dd,J=5.6,3.5 Hz,4H),5.32-5.20 (m,1H),5.05-4.95 (m,1H),4.89-4.81 (m,1H),4.74 (dd,J=43.1,5.2 Hz,1H),4.35 (ddd,J=8.5,4.0,2.2 Hz,1H),4.31-4.10 (m,1H),4.07-3.95 (m,1H),3.95-3.89 (m,1H),3.84-3.71 (m,1H),3.13-2.94 (m,1H),2.15 (ddd,J=11.4,9.2,5.7 Hz,1H),1.94-1.81 (m,1H),1.43-1.32 (m,4H),1.27-1.22 (m,2H),0.90-0.84 (m,5H),0.82 (dd,J=4.4,2.0 Hz,2H)。13C NMR (101 MHz,CDCl3) δ 175.00,134.41,134.30,129.10,129.08,129.06,128.87,128.83,127.92,127.82,127.75,127.66,127.62,127.56,110.65,86.57,86.51,86.44,83.04,82.99,82.95,82.92,75.31,74.34,74.25,73.48,65.19,53.41,52.58,52.38,52.24,52.11,51.22,48.07,47.75,47.67,45.41,45.01,44.96,41.31,36.22,36.16,34.63,31.56,29.03,26.88,26.23,26.22,25.76,25.53,25.25,25.16,24.60,24.54,23.16,23.14,22.63,22.59,20.99,20.96,14.10,11.41。
2.3 化合物6c (R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3- ((2S,3R)-2-(5,6-二溴-1,3-二氧代辛烷-4,7-环氧异吲哚-2-基)-3-戊酸甲酯) 采用同样方法,以5c代替5a,得到白色固体(6c,190.1 mg,产率57.4%),熔点:126.4-128.1 ℃,Rf= 0.6 (CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.47-7.32 (m,2H),5.27-5.16 (m,1H),4.88 (ddd,J=19.7,16.5,5.2 Hz,1H),4.73-4.65 (m,1H),4.36-4.26 (m,1H),4.10 (t,J=7.8 Hz,1H),4.03 (dd,J=8.6,6.4 Hz,1H),3.93-3.88 (m,1H),3.81-3.68 (m,1H),3.12-2.93 (m,1H),2.53-2.43 (m,1H),1.45-1.38 (m,1H),1.36 (s,1H),1.33 (d,J=3.4 Hz,3H),1.25-1.12 (m,1H),1.07 (dd,J=6.7,1.4 Hz,1H),0.93 (t,J=7.3 Hz,1H),0.87-0.77 (m,3H)。13C NMR (101 MHz,CDCl3) δ 175.12,173.78,173.70,166.27,166.26,165.56,165.47,160.28,160.19,134.46,134.31,129.13,128.88,128.86,128.83,128.07,127.99,114.15,110.62,86.58,86.54,86.48,86.44,83.01,82.92,75.40,75.36,75.32,74.38,74.33,74.31,74.27,73.60,73.59,73.52,73.50,65.19,57.73,57.70,56.98,52.55,52.35,52.21,52.18,52.13,48.02,47.96,47.67,47.62,45.38,45.32,44.98,44.93,33.94,33.85,33.45,33.37,27.16,25.79,25.78,25.76,25.53,25.50,24.99,16.47,16.45,15.09,15.07,11.20,10.67,10.63。
2.4 化合物6d (R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3-( (2R)-2-(5,6-二溴-1,3-二氧代辛烷氢-4,7-环氧异吲哚-2-基)-3-丁酸甲酯) 采用同样方法,以5d代替5a,得到白色固体(6d,218.9 mg,产率65.2%),熔点:139.6-141.1 ℃,Rf= 0.6(CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.37 (d,J=9.6 Hz,4H),7.23 (d,J=9.9 Hz,1H),5.23 (ddd,J=23.8,12.1,3.9 Hz,2H),4.98-4.76 (m,2H),4.70-4.53 (m,2H),4.39-4.22 (m,2H),4.07 (dt,J=27.7,8.1 Hz,2H),3.91 (d,J=8.0 Hz,1H),3.84-3.68 (m,1H),3.13-2.90 (m,1H),2.70 (dt,J=14.9,7.8 Hz,1H),1.47-1.22 (m,6H),1.12 (d,J=6.8 Hz,3H),0.81 (t,J=8.9 Hz,3H)。13C NMR (101 MHz,CDCl3) δ 175.19,175.15,175.13,175.11,173.78,166.29,166.27,165.56,160.34,160.24,134.49,134.41,134.32,129.13,128.88,128.86,128.83,128.06,127.98,114.04,110.61,110.60,86.57,86.52,86.50,86.44,83.01,82.98,82.95,82.90,75.43,75.40,75.34,74.36,74.30,73.57,73.51,73.49,65.18,58.41,58.39,58.29,58.25,52.58,52.56,52.47,52.35,52.22,52.19,52.11,48.03,48.00,47.66,47.56,45.39,44.98,44.92,27.72,27.67,27.53,27.45,25.80,25.78,25.52,25.51,20.80,20.78,20.64,20.63,18.84,18.81,18.79。
2.5 化合物6e (R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3- ((2S)-2-(5,6-二溴-1,3-二氧代辛烷氢-4,7-环氧异吲哚-2-基)-3-丁酸甲酯) 采用同样方法,以5e代替5a,得到白色固体(6e,102.4 mg,产率44.0%),熔点: 127.3-128.9 ℃,Rf= 0.6(CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.44-7.31 (m,5H),5.24-5.17 (m,1H),5.00-4.81 (m,2H),4.76-4.66 (m,1H),4.63-4.56 (m,1H),4.32 (dtd,J=16.2,8.8,7.7,3.1 Hz,2H),4.10 (dd,J=8.6,6.8 Hz,1H),4.03 (dd,J=8.7,6.4 Hz,1H),3.91 (dt,J=9.0,3.0 Hz,1H),3.83-3.68 (m,1H),3.12-2.91 (m,1H),2.73-2.65 (m,1H),1.35 (dd,J=12.7,3.1 Hz,6H),1.11 (d,J=6.4 Hz,3H),0.81 (d,J=6.8 Hz,3H)。13C NMR (101 MHz,CDCl3) δ 175.17,173.76,166.29,165.41,160.23,129.14,128.88,128.86,128.83,128.07,127.99,110.63,86.56,82.91,74.30,73.48,65.19,52.56,52.54,48.01,47.57,45.40,44.92,27.71,25.52,20.65,18.79。
2.6 化合物6f (R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3-( 2-(5,6-二溴-1,3-二氧代辛烷氢-4,7-环氧异吲哚-2-基)-3-丁酸甲酯) 采用同样方法,以5f代替5a,得到白色固体(6f,93.2 mg,产率83.0%),熔点:120.0-122.1 ℃,Rf= 0.8 (CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.38 (d,J=5.9 Hz,5H),5.22 (ddd,J=24.2,11.4,3.2 Hz,2H),4.98-4.87 (m,1H),4.87-4.79 (m,1H),4.76-4.66 (m,1H),4.60 (ddd,J=8.9,6.0,2.8 Hz,1H),4.32 (dddt,J=17.2,12.0,8.4,4.3 Hz,2H),4.10 (dd,J=8.8,6.8 Hz,1H),4.03 (dd,J=8.6,6.5 Hz,1H),3.91 (dt,J=9.0,2.6 Hz,1H),3.82-3.68 (m,1H),3.13-2.91 (m,1H),2.68 (dq,J=13.3,6.6 Hz,1H),1.35 (dd,J=12.9,3.1 Hz,6H),1.11 (d,J=6.6 Hz,3H),0.81 (d,J=6.5 Hz,3H)。13C NMR (101 MHz,CDCl3) δ 175.16,173.76,166.28,165.41,160.23,134.48,129.13,128.88,128.86,128.83,128.07,127.98,114.04,110.63,86.56,82.91,74.30,73.51,65.18,58.43,52.56,52.20,48.04,47.57,45.40,44.92,27.71,25.78,20.64,18.78。
2.7 化合物6g(R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3-( 2-(5,6-二溴-1,3-二氧代辛烷氢-4,7-环氧异吲哚-2-基)-3-苯基丙酸酯) 采用同样方法,以5g代替5a,得到白色固体(6g,118.6 mg,产率53.0%),熔点:147.5-149.8 ℃,Rf= 0.7 (CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.39 (d,J=3.1 Hz,5H),5.33-5.22 (m,2H),5.10-4.99 (m,1H),4.93 (dd,J=31.2,4.0 Hz,1H),4.88-4.78 (m,1H),4.74-4.67 (m,1H),4.39-4.25 (m,2H),4.14-4.07 (m,1H),4.07-4.00 (m,1H),3.96-3.89 (m,1H),3.83-3.72 (m,1H),3.13-2.96 (m,1H),1.57 (dd,J=7.2,3.8 Hz,3H),1.35 (dd,J=12.7,4.8 Hz,6H)。13C NMR (101 MHz,CDCl3) δ 174.59,173.23,166.28,160.29,134.42,129.14,128.89,128.81,128.14,128.01,114.21,110.64,86.47,82.87,74.38,73.44,65.19,52.58,52.24,48.18,47.79,45.44,45.10,25.77,25.52,14.21。
2.8 化合物6h (R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3- ((2S)-2-(5,6-二溴-1,3-二氧代辛烷氢-4,7-环氧异吲哚-2-基)-3-苯基丙酸酯) 采用同样方法,以5h代替5a,得到白色固体(6h,190.5 mg,产率85.2%),熔点:148.8-150.6 ℃,Rf= 0.6(CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.48-7.32 (m,5H),5.31 (dd,J=6.0,3.9 Hz,1H),5.24 (dd,J=8.1,6.1 Hz,1H),5.05 (ddd,J=10.0,7.2,2.4 Hz,1H),4.93 (dd,J=31.4,4.0 Hz,1H),4.84-4.74 (m,1H),4.71-4.66 (m,1H),4.39-4.26 (m,2H),4.14-4.08 (m,1H),4.07-4.01 (m,1H),3.95-3.89 (m,1H),3.83-3.73 (m,1H),3.13-2.96 (m,1H),1.58 (dd,J=6.9,4.1 Hz,3H),1.35 (dd,J=12.7,4.8 Hz,6H)。13C NMR (101 MHz,CDCl3) δ 174.68,174.59,173.23,166.30,166.23,160.48,160.36,134.41,134.38,134.27,134.24,129.17,129.14,129.11,128.89,128.85,128.83,128.81,128.15,128.02,114.14,110.64,86.52,86.47,86.41,86.34,82.96,82.94,82.87,82.81,75.33,74.46,74.38,73.49,73.43,65.20,52.58,52.41,52.29,52.24,52.12,52.05,48.21,48.10,47.87,47.79,45.48,45.45,45.16,45.10,25.77,25.52,14.21,14.15。
2.9 化合物6i (R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3-( (2R)-2-(5,6-二溴-1,3-二氧代辛烷氢-4,7-环氧异吲哚-2-基)-3-苯基丙酸酯) 采用同样方法,以5i代替5a, 得到白色固体(6i,82.2 mg,产率33.1%),熔点:133.8-134.4 ℃,Rf=0.6(CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.40 (dd,J=3.3,1.5 Hz,5H),7.23 (ddt,J=11.1,7.0,2.3 Hz,3H),7.09 (ddd,J=7.8,4.1,1.4 Hz,2H),5.29-5.25 (m,1H),5.25-5.17 (m,2H),4.84 (dd,J=33.8,5.3 Hz,1H),4.69 (dd,J=6.1,2.9 Hz,1H),4.58-4.46 (m,1H),4.40-4.32 (m,1H),4.27-4.16 (m,1H),4.14-4.07 (m,1H),4.07-3.98 (m,1H),3.81 (ddd,J=10.8,7.9,3.1 Hz,1H),3.62-3.46 (m,2H),3.34 (ddd,J=14.3,11.6,8.2 Hz,1H),2.91-2.72 (m,1H),1.44-1.33 (m,6H)。13C NMR (101 MHz,CDCl3) δ 174.72,174.47,173.37,173.15,166.17,165.49,165.44,160.53,160.36,160.30,135.00,134.96,134.38,134.17,129.24,129.18,129.02,129.00,128.98,128.96,128.94,128.90,128.86,128.70,128.66,128.23,128.03,127.39,127.33,114.20,110.67,86.24,86.19,86.09,86.01,82.68,82.54,82.48,75.34,74.51,74.39,73.47,73.45,65.20,53.66,53.62,52.47,52.26,52.15,52.11,47.78,47.66,45.01,44.89,33.52,33.38,26.24,25.78,25.54,25.16。
2.10 化合物6j (R)-4-苄氧基-5-((S)-2,2-二甲基-1,3-二氧戊环-4-基)-2,5-二氢呋喃-3-( 2-(5,6-二溴-1,3-二氧代辛烷氢-4,7-环氧异吲哚-2-基)-3-苯基丙酸酯) 采用同样方法,以5j代替5a,得到白色固体(3j,113.0 mg,产率44.4%),Rf=0.6,熔点:191.5-193.8 ℃,Rf=0.6 (CH2Cl2∶MeOH=80∶1)。1H NMR (400 MHz,CDCl3) δ 7.40 (dd,J=4.9,2.9 Hz,5H),7.27-7.21 (m,3H),7.12-7.06 (m,2H),5.33-5.27 (m,1H),5.23 (ddt,J=11.0,7.3,3.8 Hz,2H),4.89-4.80 (m,1H),4.69 (dd,J=6.1,3.0 Hz,1H),4.62-4.51 (m,1H),4.39-4.17 (m,2H),4.14-4.01 (m,2H),3.81 (ddd,J=10.6,7.9,3.2 Hz,1H),3.62-3.46 (m,2H),3.38-3.31 (m,1H),2.91-2.73 (m,1H),1.42-1.32 (m,6H)。13C NMR (101 MHz,CDCl3) δ 173.15,135.00,129.24,129.02,128.86,128.67,128.24,128.03,74.39,73.47,65.20,25.77。
3 讨论
3.1 化合物5a-j的合成 把5,6-二溴去甲斑蝥素作为原料,与不同的氨基酸反应,希望以高产率得到目标化合物。因此对反应条件进行优化发现,控制反应温度一致,改变反应时间,时间最优控制为3.5 h,产率最高,随着反应时间的延长,产率随之降低;控制反应时间一致,改变反应温度,温度控制为150~160 ℃,其中160 ℃反应时,产率最佳,温度高于160 ℃,产率反而下降。所以选择温度为160 ℃,时间为3.5 h,为反应条件,以最佳产率合成得到化合物5a-j。
3.2 终产物6a-j的合成 化合物5a-j与化合物4为反应原料,以二氯甲烷为溶剂、碳酸钾为催化剂进行反应。在此反应中,化合物5a-j氨基酸部分作为Linker与化合物4发生偶联反应,产率为3%~8%。根据文献的查阅以及反应条件的优化,选择EDCI为缩合剂、DMAP为催化剂,在氮气保护下发生反应。观察到此反应溶液颜色变化过程∶浑浊→澄清透明→浅黄色→黄色,在溶液颜色变为黄色时,室温条件下反应过夜。最终通过反应条件的优化,将产率提高至33.1%~85.1%。
本文设计并合成得到了一类新型的5,6-二溴去甲斑蝥素-维生素C缀合物。合成涉及2个关键步骤,制备中间体5,6-二溴去甲斑蝥素和维生素衍生物,以及采用不同天然氨基酸作为Linker将5,6-二溴去甲斑蝥素与维生素C衍生物进行偶联反应,得到10个目标产物,并通过核磁共振氢谱、碳谱对目标产物进行了结构表征。此外,在5,6-二溴去甲斑蝥素与维生素衍生物利用天然氨基酸作为Linker进行偶联的关键合成步骤中,以碳二亚胺作为缩合剂、取代吡啶作为催化剂,能够在温和条件下促进偶联反应的发生,提高目标缀合产物的制备产率。
