海藻糖和透明质酸对海藻酸钙负载的益生菌冻干及贮藏存活的影响
2022-11-09袁永凯陈茂深
袁永凯,殷 明,陈 羚,刘 飞,陈茂深,钟 芳,2*
(1 食品科学与技术国家重点实验室,江南大学 食品学院,江苏 无锡 214122;2 江南大学 食品安全国际联合实验室,江苏 无锡 214122)
益生菌是活微生物,达到足够数量时会对宿主健康产生有益影响[1]。然而,益生菌对环境具有敏感性,难以在加工和贮藏过程中确保存活。包埋是将活的益生菌封闭于涂层材料的基质中,从而形成微胶囊或珠子[2]。涂层材料的选择对于能否成功包埋益生菌并保持其存活至关重要。
海藻酸钠是益生菌包埋的常用材料。目前,以海藻酸钠为基质的益生菌包埋方法,如挤压法、外源乳化法和内源乳化法等,原理全部是基于海藻酸钠的离子交联特性,其中最常用的是钙离子[3]。这主要是因为钙离子交联过程对有机体比较温和,同时可以通过对钙离子的解离调控释放包埋的益生菌[4-5]。然而,海藻酸钙(calcium alginate,CA)包埋益生菌的冷冻干燥存活率低,商业化应用十分有限。De Araújo等发现CA包埋的Lactobacillusacidophilus存活为9.78 log CFU/g,而经冷冻干燥后存活降为6.65 log CFU/g[6]。Martin-Dejardin等也报道了相似的结果,即果胶/CA包埋的Bifidobacteriumbifidum存活经冷冻干燥后由8.48 log CFU/mL降为 5.90 log CFU/mL[7]。由此产生的益生菌不仅初始存活率低,而且活菌中也可能已经存在许多生理状态差的菌体,导致在随后的贮藏过程中进一步大量死亡,影响商业产品品质。
CA凝胶中的水分被大分子网络固定,处于不可自由流动的状态。但这部分水与结合水有着本质区别,在冷冻过程中仍具有与普通自由水相同的结晶特性,并可能对益生菌造成损伤。小分子糖,如海藻糖(trehalose,T),是已被公认的有效冷冻保护剂。它们一方面可以减少冰晶的形成;另一方面可以与细胞膜的极性基团形成氢键以代替丢失的水分子,脱水后在生物分子周围形成玻璃态,抑制其拉伸和聚集[8-11]。据报道,在水溶液体系中,T联合透明质酸(hyaluronic acid,HA)可以协同保护有机体的活性,稳定冷冻干燥的胰激肽原酶[12],保护嗜酸乳杆菌和长双歧杆菌[13-14],其中HA的作用是增加体系的玻璃化温度。
基于此,本研究提出将T和HA加入到CA水凝胶中,以应对体系在冷冻干燥过程中面临的各种胁迫。以鼠李糖乳杆菌(LactobacillusrhamnosusGG,LGG)为模型菌株,分析T和HA加入到CA中对LGG冷冻干燥存活率及常温贮藏稳定性的影响,以期为益生菌的CA包埋体系提供更切合的商业应用启示。
1 材料与方法
1.1 材料与试剂
HA(低分子量300 kDa、中分子量1 000 kDa、高分子量1 800 kDa)购于西安百川生物科技有限公司;海藻酸钠由青岛南山生物科技有限公司提供;氯化钙购于上海麦克林生化科技有限公司;MRS肉汤和培养基购于青岛海博生物技术有限公司;氯化碘硝基四唑(iodonitrotetrazolium chloride,INT)购于上海源叶生物科技有限公司;实验中其他试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
AW400TG-B厌氧工作站,英国Electrotek公司;YXQ-50A高压灭菌锅,上海博迅医疗生物仪器股份有限公司;Avanti JXN-26冷冻离心机,美国Beckman公司;Christ Alpha 1-4LDplus冷冻干燥机,德国Christ公司;M2多功能酶标仪,美国Molecular Devices公司;Q700超声破碎机,美国Qsonica Misonix公司;FA-ST水分活度仪,法国GBX公司。
1.3 实验方法
1.3.1 菌种和培养条件
LGG由江南大学食品学院食品生物技术研究中心赠送。LGG悬浮液和60%甘油以体积比1∶1混合,保存于-20 ℃冰箱。
实验前,实验器皿、MRS肉汤和培养基均在115 ℃高压灭菌锅中灭菌20 min。将LGG以2%的接种量接种于MRS肉汤中,于厌氧工作站厌氧培养24 h。培养的LGG经冷冻离心机离心10 min(5 000 g)后,弃掉上清液并用生理盐水清洗2次,重悬于生理盐水中得到新鲜的LGG悬浮液,活性大约为2×109CFU/mL。
1.3.2 LGG包封
负载LGG的CA凝胶球通过挤压法进行制备,过程如下:首先,将含有或不含质量分数为0.5% HA和2.0% T的0.6%海藻酸钠溶液搅拌至完全溶解,静置2 h去除气泡;然后,将LGG菌悬液以1∶20的体积比加入上述溶液中,搅拌30 min使LGG在溶液中充分分散;最后,使用蠕动泵(1 mL/min)将上述含有LGG的溶液滴入质量分数为1.0%的氯化钙溶液中,形成基于CA的凝胶球,滴定高度为10 cm,滴管内径为1 mm。在氯化钙溶液中硬化30 min后,将珠子过滤并用无菌水冲洗。
含有CA、CA/T、CA/HA(300 kDa、1 000 kDa和1 800 kDa)、CA/T/HA(300 kDa、1 000 kDa和1 800 kDa)的负载LGG凝胶球分别被命名为CA、CA/T、CA/HA30、CA/HA100、CA/HA180、CA/T/HA30、CA/T/HA100、CA/T/HA180。
1.3.3 平均直径和球形度表征
使用Image J软件对凝胶球的平均直径和球形度进行表征。拍摄新鲜的负载LGG凝胶球图像,随机选择40颗凝胶球测定其水平和垂直直径。其中,较长的直径为DL,较短的直径为DS,平均直径为DL和DS的平均值,球形度以DL/DS表示。
1.3.4 LGG存活计数
将负载LGG的凝胶球加入0.055 mmol/L柠檬酸钠溶液中并涡旋以释放包埋的LGG。游离的LGG或完全释放的LGG用生理盐水梯度稀释,通过倾倒法混入MRS培养基中。在厌氧工作站中培养48 h后,计算可见菌落形成单位(CFU)。
1.3.5 LGG包埋率计算
对投入到海藻酸钠溶液中的LGG数量和包埋在珠子中的LGG数量进行计数,采用以下公式计算包埋率:
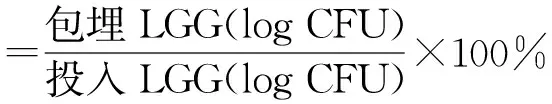
(1)
1.3.6 冷冻干燥及存活率计算
将新鲜的LGG悬浮液和负载LGG的凝胶球分别在-18 ℃和-80 ℃条件下冷冻24 h,再置于-55 ℃冷冻干燥机中冷冻干燥48 h,真空度为5.9 Pa。计算冷冻干燥后存活LGG的数量,采用以下公式计算LGG冷冻干燥存活率:
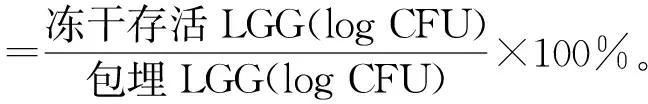
(2)
1.3.7 细胞膜通透性测定
细胞膜通透性测定参考文献[15-16]并做修改。将包埋的LGG释放、收集并重新悬浮(如1.3.4),冰浴条件下超声破碎得到LGG菌悬液,4 ℃条件下10 000 g离心10 min,弃去上清液。沉淀物(即细胞内提取物)重新悬浮,使用多功能酶标仪测定其在280 nm(蛋白质最大吸收波长)和260 nm(核酸最大吸收波长)处的吸光度,利用如下公式分别计算细胞内蛋白质和核酸的减少率:

(3)
1.3.8 LGG代谢活性测定
LGG代谢活性测定参考文献[17-18]并做调整。将包埋的LGG释放、收集(如1.3.4),洗涤2次并重新悬浮于PBS溶液(10 mmol/L,pH=7.0)中。将INT溶液添加到LGG悬浮液中至最终浓度为2 mmol/L,37 ℃孵育30 min,通过多功能酶标仪测定其在595 nm处的吸光度。
1.3.9 LGG贮藏条件及水分活度(water activity,Aw)测定
LGG在25 ℃条件下贮藏60 d,贮藏环境的Aw为0.113、0.313、0.501、0.812,分别由饱和LiCl、MgCl2、K2CO3、NaNO3溶液控制。使用水分活度仪测定饱和溶液的Aw和样品的Aw。
1.4 数据分析
数据以3个独立实验的平均值±标准差进行表示;利用SPSS 19.0软件进行单因素方差分析(ANOVA)和Duncan多重比较分析,P<0.05认为差异性显著。
2 结果与分析
2.1 凝胶球组成对球体平均直径、球形度和LGG包埋率的影响
如图1A所示,负载LGG的凝胶球平均直径随HA的掺入及HA分子量的增加而增加,从约3 mm显著增加到4 mm(P<0.05)。通过挤压法制备的CA凝胶球的平均直径受许多因素影响,如溶液黏度、滴定高度和滴管内径[19]。在其他条件不变的情况下,溶液黏度随HA分子量的增加而增加,致使凝胶球直径显著增加。Park等也报道了多糖溶液黏度与水凝胶颗粒直径的正相关性[20]。
如图1B所示,负载LGG的各类凝胶球球形度DL/DS均接近1,不同组间基本无显著差异,说明制备条件良好,T和HA的存在没有影响凝胶球的高球形度。LGG在各类凝胶球中的包埋率均高于90%(图1C),证明了这种广泛使用的益生菌包封材料及方法的有效性。T以及不同分子量HA的存在并没有降低LGG包埋率,表明组分之间具有优良的相容性。上述一系列结果说明,T联合不同分子量HA可应用于负载LGG的湿态CA凝胶球,能够进行后续研究。
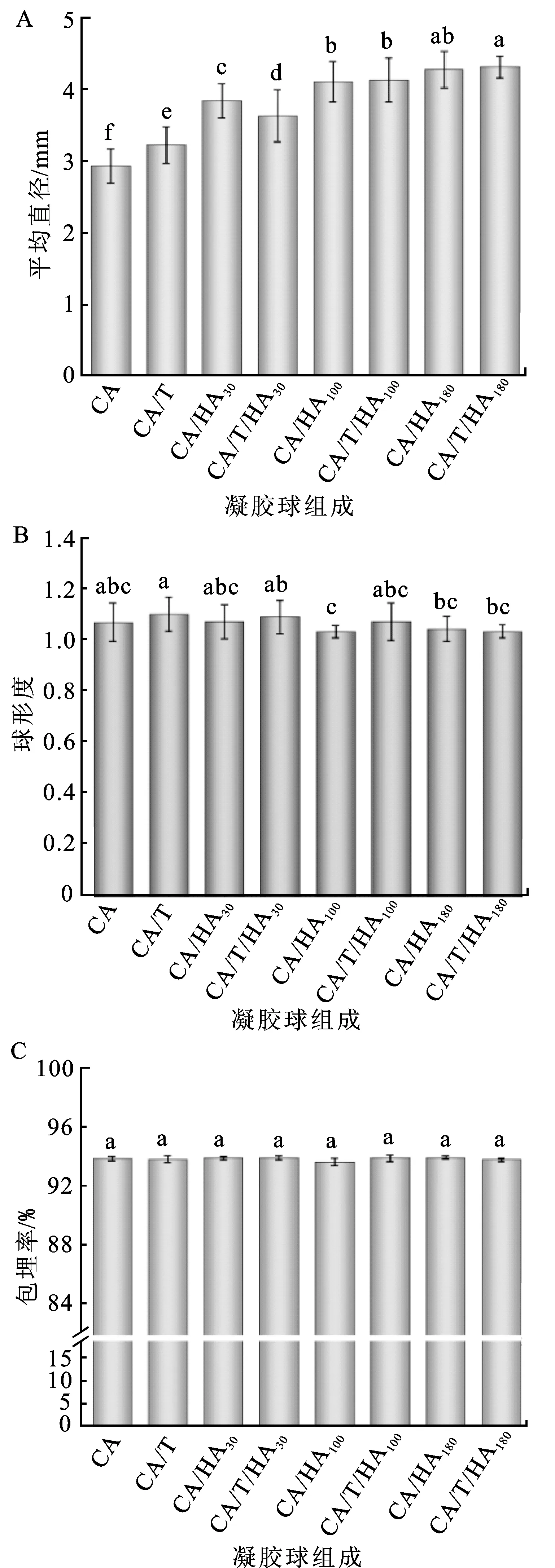
图1 负载LGG的湿态球平均直径(A)、球形度(B)和包埋率(C)Fig.1 Mean diameters(A), sphericities(B) and encapsulation yields(C) of the wet LGG-loaded beads
2.2 凝胶球组成及预冷冻温度对LGG冷冻干燥存活率的影响
CA凝胶球的LGG冷冻干燥存活率如图2所示,使用LGG裸菌作为对照。在预冷冻温度为-18 ℃时,冷冻干燥后CA组中的LGG存活率为66.24%,低于对照组,证实CA包埋在冷冻干燥过程中不能很好地保护益生菌。与CA组相比,CA/HA30、CA/HA100和CA/HA180组显示出更高的LGG冷冻干燥存活率,而CA/T组的存活率高于CA/HA30、CA/HA100和CA/HA180组,表明加入HA或T一定程度上保护了凝胶球中的LGG,且T效果更好。但上述各组的LGG冷冻干燥存活率仍然低于对照组。值得注意的是,T和HA联合使用能够显著提高LGG的冷冻干燥存活率,CA/T/HA30和CA/T/HA180组显著高于对照组,说明T和HA可以协同保护冷冻干燥过程中CA凝胶球中的LGG。

图2 包埋和未包埋LGG的冷冻干燥存活率Fig.2 Survival rates of LGG with or without encapsulation after freeze-drying注:图中不同小写字母表示组间差异显著(P<0.05)。
与-18 ℃相比,预冷冻温度为-80 ℃时各组的LGG冷冻干燥存活率显著(P<0.05)提高。更低的预冷冻温度具有更快的冷冻速率,导致形成的冰晶更小,LGG菌体受冰晶损害的程度更低。Zhao等也报道了类似的结果,其研究表明更低的预冷冻温度有利于冷冻干燥后Lactobacillusbrevis和Oenococcusoeni的存活[21]。与-18 ℃情况相似,预冷冻温度为-80 ℃时T和HA联合使用也可以显著提高LGG的冷冻干燥存活率(P<0.05)。
2.3 凝胶球组成及预冷冻温度对冷冻干燥后LGG细胞膜通透性和胞内代谢活性的影响
细胞膜是细胞微环境与外界的屏障,其完整性遭到破坏会导致细胞受损。本研究探究了不同包埋配方对冷冻干燥后LGG细胞膜通透性的影响,以揭示上述LGG冷冻干燥存活率存在差异的生理原因。细胞膜通透性通过细胞内蛋白质和核酸的含量变化进行反映,其结果如表1和表2所示。当预冷冻温度为-18 ℃时,CA/T组和CA/HA组的胞内蛋白降低率(40.74%~49.58%)显著(P<0.05)低于CA组(55.18%),而CA/T/HA30组的胞内蛋白降低率(27.20%)最低。当预冷冻温度为-80 ℃时,CA/T组和CA/HA组的胞内蛋白降低率(22.86%~25.29%)也显著(P<0.05)低于CA组(32.59%),而CA/T/HA30组的胞内蛋白降低率(13.35%)最低。同时,核酸降低率也表现出相似趋势。上述结果表明,HA和T能够提高凝胶球中LGG冷冻干燥存活率的原因之一是二者降低了LGG的细胞膜通透性,从而更好地保护了LGG。

表1 冷冻干燥后LGG的胞内蛋白降低率Tab.1 Decrease ratios of LGG intracellular protein after freeze-drying 单位:%

表2 冷冻干燥后LGG的胞内核酸降低率Tab.2 Decrease ratios of LGG intracellular nucleic acid after freeze-drying 单位:%
细胞膜通透性的改变通常会打破细胞内微环境平衡,进而导致细胞死亡。胞内代谢活性是细胞内微环境的一种重要评价指标,通过对胞内代谢活性进行评估,可以反映包埋对冷冻干燥后LGG胞内环境的影响。胞内代谢活性的测定借助人工电子受体INT,其可以通过活性细菌的电子传输系统被还原为四唑晶体的细胞内沉积物[22]。由表3可以看出,当预冷冻温度为-18 ℃时,CA/T组(55.78%)和CA/HA组(46.64%~51.47%)的胞内代谢活性显著(P<0.05)高于CA组(36.33%),而CA/T/HA30组(71.86%)的胞内代谢活性最高。当预冷冻温度为-80 ℃时,各组LGG的胞内代谢活性由大到小也为CA/T/HA、CA/T、CA/HA、CA。以上结果说明HA和T有效抑制了冷冻干燥后LGG胞内代谢活性的降低。

表3 冷冻干燥后LGG的胞内代谢活性Tab.3 Intracellular metabolic activities of LGG after freeze-drying 单位:%
基于冷冻干燥后LGG细胞膜通透性和胞内代谢活性的测定结果可知,HA联合T能够提高CA凝胶球中LGG的冷冻干燥存活率是由于二者有效降低了LGG的细胞膜通透性,进而抑制了LGG胞内代谢活性的降低,有利于维持胞内稳态。
2.4 冷冻干燥凝胶球组成对LGG常温贮藏稳定性的影响
选择上述LGG冷冻干燥存活率高的预冷冻温度-80 ℃和凝胶球样品CA/T、CA/T/HA30、CA/T/HA100、CA/T/HA180进行60 d的常温贮藏实验,探究冷冻干燥凝胶球组成对LGG常温贮藏稳定性的影响,并以LGG裸菌作为对照。如表4所示,对照组、CA/T组、CA/T/HA30组、CA/T/HA100组、CA/T/HA180组的LGG初始存活分别为9.16 log CFU/g、9.72 log CFU/g、9.70 log CFU/g、9.54 log CFU/g、9.58 log CFU/g。当环境Aw为0.113和0.313时,对照组的LGG存活显著(P<0.05)降低至5.74 log CFU/g和4.44 log CFU/g;当环境Aw增加至0.501和0.812时,对照组已经检测不到LGG存活;这说明LGG裸菌无法在设置的实验条件下很好地保持存活。而对于其他各实验组,无论环境Aw条件如何,LGG存活全部高于对照组,表明所设计的复合载体对LGG具有常温贮藏有效性。

表4 冷冻干燥LGG在不同环境Aw下室温贮藏60 d后的存活Tab.4 Survival of freeze-dried LGG stored for 60 d in different environmental Aw at room temperature 单位:log CFU/g
分析各实验组在不同环境Aw下的LGG存活,发现随着环境Aw的增加,LGG存活不断下降,表明环境Aw是影响益生菌贮藏存活的重要因素。当环境Aw为0.113时,CA/T组、CA/T/HA30组、CA/T/HA100组、CA/T/HA180组的LGG存活分别下降0.9、0.41、0.55、0.76 log CFU/g,说明在该环境Aw条件下CA/T/HA30组的贮藏性能最好。当环境Aw为0.313时,CA/T组、CA/T/HA30组、CA/T/HA100组、CA/T/HA180组的LGG存活分别下降2.56、2.74、2.82、2.91 log CFU/g,说明在该环境Aw条件下,HA的存在降低了LGG贮藏存活,且高分子量HA的LGG存活损失更多。当环境Aw为0.501时,CA/T组、CA/T/HA30组、CA/T/HA100组、CA/T/HA180组的LGG存活分别下降2.79、2.89、3.01、3.31 log CFU/g。当环境Aw继续增加至0.812时,CA/T组、CA/T/HA30组、CA/T/HA100组、CA/T/HA180组的LGG存活分别下降2.83、3.05、3.23、3.53 log CFU/g。在高环境Aw条件下,HA的存在依然降低了LGG贮藏存活,且高分子量HA的LGG存活损失更多,这与HA良好的保水特性有关。
贮藏前后各样品的Aw如图3所示。CA/T组、CA/T/HA30组、CA/T/HA100组、CA/T/HA180组的样品初始Aw均在0.15以内。当环境Aw(0.113)接近或者低于样品Aw时,各组的LGG贮藏存活趋势与初始冷冻干燥存活率一致。当环境Aw(0.313、0.501、0.812)远高于样品Aw时,各组的LGG贮藏存活趋势不再与初始冷冻干燥存活率保持一致,而是与样品Aw呈反比。
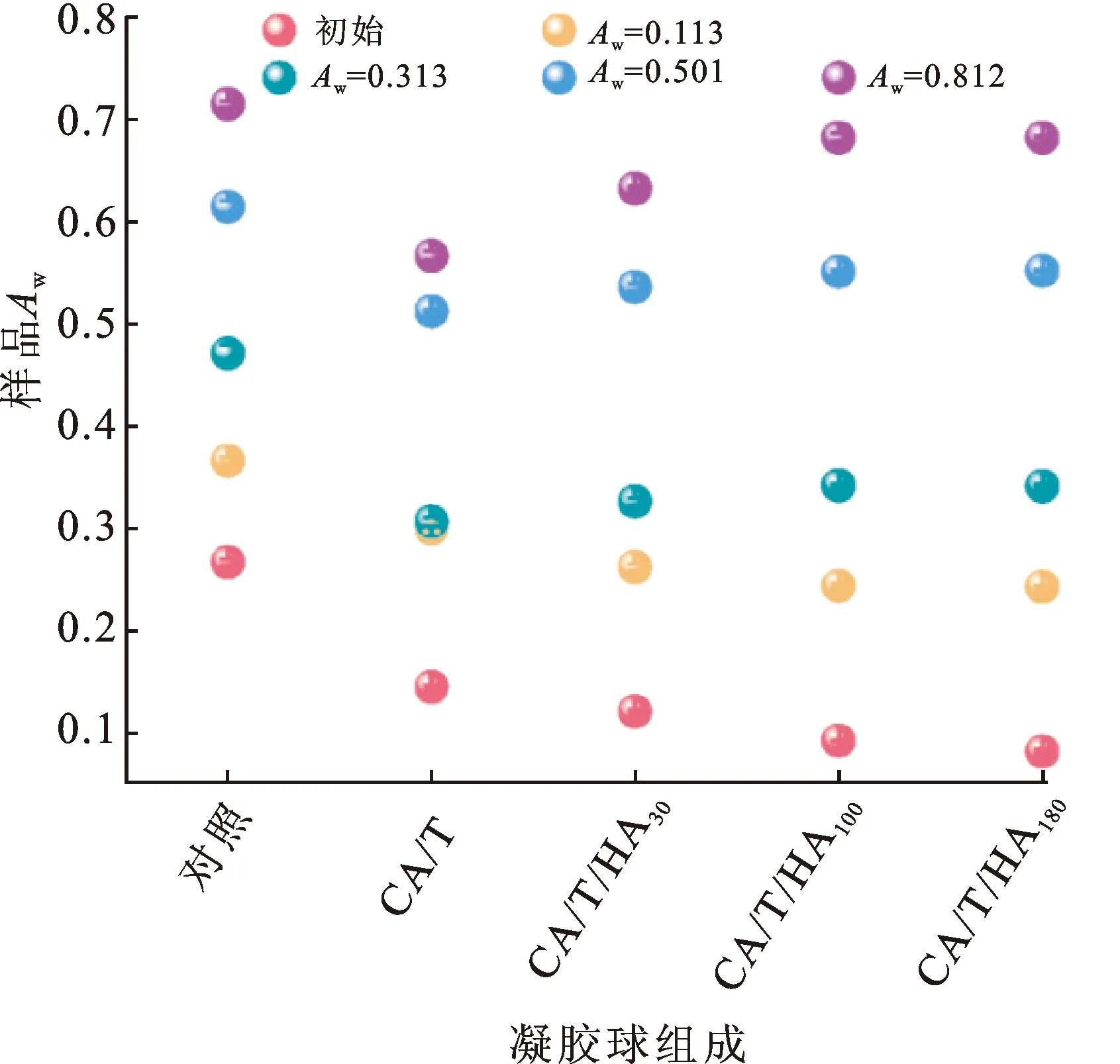
图3 冷冻干燥LGG在室温不同环境Aw下贮藏60 d的样品AwFig.3 The sample Aw of freeze-dried LGG stored at room temperature under different environmental Aw for 60 d注:网络版为彩图。
实际上,益生菌的贮藏稳定性主要受菌体初始生理状态(细胞膜通透性和胞内代谢活性)和贮藏环境(环境Aw)两方面的影响,贮藏结果是二者平衡的结果。在低环境Aw(0.113)下,菌体初始生理状态起主导作用;在高环境Aw(0.313、0.501、0.812)下,贮藏环境起主导作用。该规律的前提是样品初始Aw较低,如对照组不仅菌体初始生理状态较差,而且初始Aw较高,导致无法有效贮藏。另外,与CA/T/HA组相比,CA/T组具有更低的吸湿性,更适合Aw>0.3的应用场景。
3 结论
T和HA可以联合用于CA包埋体系中,以提高LGG的冷冻干燥存活率,这是由于二者可以有效降低LGG的细胞膜通透性,进而抑制LGG胞内代谢活性的降低,维持胞内稳态。更快的预冷冻速率有利于LGG在冷冻干燥后存活。与LGG裸菌相比,基于CA的T或T/HA复合LGG包埋体系能够在各环境Aw下有效常温贮藏LGG。益生菌的贮藏存活主要受菌体初始生理状态和贮藏环境两方面的影响,在低环境Aw下,贮藏稳定性由菌体的初始生理状态主导;在高环境Aw下,贮藏稳定性由贮藏环境主导。具有低吸湿性的CA/T更能适应Aw>0.3的应用场景。
