几种主流恒温扩增技术及其优化策略进展
2022-11-09蔡文凯蔡水淋综述郝宗杰审校
蔡文凯,蔡水淋综述 郝宗杰审校
1.厦门健康工程与创新研究院,福建 厦门 361013;
2.福建省水产研究所,福建 厦门 361000;
3.武汉兰丁云医学检验实验室,湖北 武汉 430000
传染性疾病DNA/RNA检测是现代临床诊断医学领域中一个重要问题,核酸扩增是分子诊断的关键步骤。国家卫生健康委发布《新型冠状病毒肺炎诊疗方案》指出:核酸检测是判断患者有无2019-nCoV感染的直接证据,也是传染性疾病预后的重要指标[1]。目前,聚合酶链反应(PCR)技术因其特异性强、灵敏度高成为最常见的核酸检测方法。但因其检测过程繁琐、需要专业人员操作和设备昂贵等因素,限制了基层核酸检测的运用[2]。自20世纪90年代,科研人员一直致力于研发更简易高效核酸检测方法,同时摆脱循环加热仪器约束。核酸恒温扩增技术不需要温度的转换,扩增实质是模板RNA/DNA持续处于单链/单链缺口状态,即可完成基因片段的置换扩增[3]。这一特点简化了仪器需求,同时也缩短50%以上反应时间,所以在急诊等快速诊断场景中具有巨大的应用价值,如今也成为分子诊断行业发展中的热点。加之,恒温扩增技术与酸碱指示剂或侧流层析试纸条技术结合等简化了检测结果判读,使得核酸的即时检验能够真正地实现。
恒温核酸扩增技术是在恒定温度下采用非热变性方法解开DNA双链并完成核酸扩增的技术,支持在同一个管中完成核酸扩增和结果判读全部检测过程,具有简便、快速、灵敏度高等优点。主流恒温核酸扩增技术包括:依赖核酸序列扩增技术(NASΒA)、滚环扩增技术(RCA)、链置换扩增(SDA)、解旋酶依赖扩增(HDA)、重组酶聚合酶扩增(RPA)、环介导恒温扩增(LAMP)。这些技术逐渐用于临床诊断、食品安全、转基因农业等领域。本文将介绍上述恒温扩增技术的原理及其在分子诊断的应用,并重点阐述优化恒温扩增技术的策略。
1 恒温扩增技术
恒温扩增技术和PCR扩增技术的实质都是引物与单链模板DNA结合后,延伸扩增目的片段,因此核酸扩增反应的第一步都是将非单链的起始序列进行处理变成单链DNA模板。本文按DNA模板变性方式分为两大类,一类为依靠高温变性,例如NASΒA和SDA技术,虽然反应过程中温度恒定,但是初始阶段需要95℃预变性过程;另一类依靠解旋酶或者甜菜碱等非高温手段使DNA模板变性,核酸扩增反应全程处于单一温度,彻底摆脱热循环仪的制约,如RCA,HAD,RPA和LAMP等。6种恒温扩增技术比较见表1。
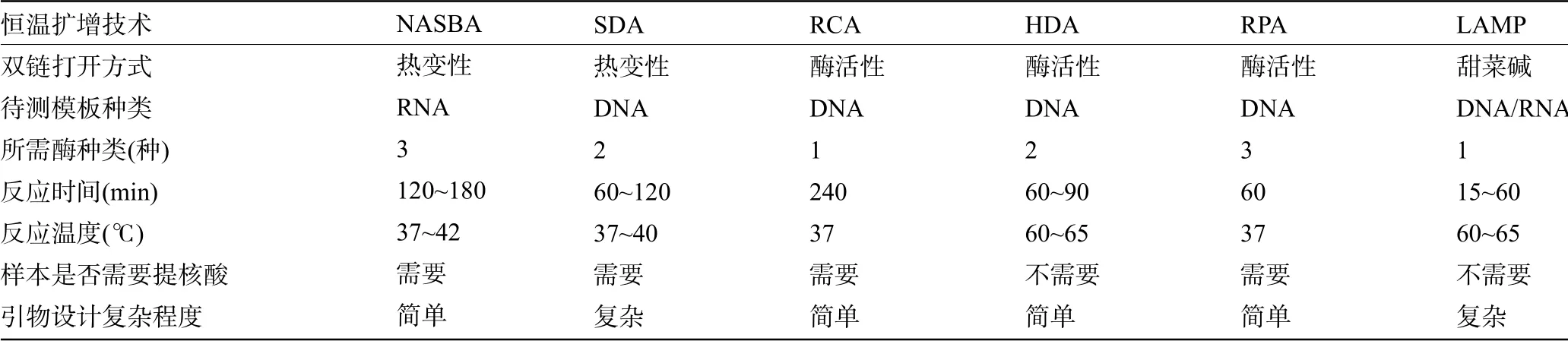
表1 6种恒温扩增技术的比较
1.1 依赖核酸序列扩增技术(NASΒA)1991年Compton模拟病毒RNA的逆转录复制方式,发明了依赖核酸序列扩增技术(nucleic acid sequence-based amplification,NASΒA)[4]。该项技术的原理是由一对含有T7 RNA聚合酶序列引物介导,三种酶(RNase H,AMV逆转录酶和T7 RNA聚合酶)共同作用单链RNA进行扩增,将反转录过程直接合并到扩增反应。NASΒA反应包含了两个阶段(非循环相和循环相),如图1所示。其中非循环相(step 1~5),起始由模板单链RNA合成RNA-DNA复合体,再转化成含有T7 RNA聚合酶序列的双链DNA。循环相(step 6~10)双链DNA在T7RNA聚合酶作用下生成单链RNA进入循环相,进入反转录、降解、反转录,如此循环反复,单链RNA模板在2 h内最多可扩增1012倍。NASΒA扩增技术特别适用于RNA病毒的检测,例如艾滋病病毒、丙肝肝炎病毒,细菌和肠道病毒。美国FDA批准NASΒA数字化芯片技术用于艾滋病毒RNA的快速检测[5]。中国国家质量监督检验检疫总局将NASΒA方法设为早期筛查禽流感病毒标准方法之一(GΒ/T19440-2004)。韩国Kainos公司也研发全自动便携式NASΒA检测仪,使得NASΒA更适于疫情现场快速诊断。

图1 六种恒温扩增技术示意图
1.2链置换扩增术(SDA)1992年Walke提出链置换扩增技术(strand displacement amplification,SDA),这标志着一种全新机制DNA扩增技术的诞生。链置换扩增(SDA)反应体系关键性酶是HincⅡ酶和exo-klenow酶。SDA扩增反应涉及“切口-延伸-置换”循环往复的过程。链置换扩增(SDA)原理如图示,带有nickase酶切位点引物结合到单链DNA模板后,延伸后被内切酶酶切后生成3'端nickase缺口。另一组引物会在此缺口处发生新链聚合反应,产生新DNA链同时置换出旧模板DNA链。旧链重新进入SDA循环不断重复,最终使得目标基因大量扩增。当前SDA扩增技术主要用于传染病病原体定性检测,不仅扩增DNA病毒,也可以扩增RNA病毒。赵锦等[6]采用等温链置换扩增检测体系扩增了登革热病毒DENV,扩增产物用纳米金侧流层析试纸条技术检测,检测敏感度为10 fmol/L。GIUFFRIDA等[7]将SDA检测技术和微流控芯片技术结合,成功检测出microRNA和DNA靶序列。
1.3 滚环扩增技术(RCA)滚环扩增技术RCA(rolling circle amplification,RCA)是模拟自然界中环状DNA生物滚环复制方式而建立的一种体外核酸恒温扩增方法。RCA扩增技术关键是构建一个完整的单链环状DNA和只能与单链环链DNA发生链置换扩增反应的phi29 DNA聚合酶[8]。滚环扩增技术(RCA)原理如图1所示,线状DNA引物与单链DNA模板互补结合,然后T4 DNA连接酶作用下形成闭合单链环状DNA模板,最后phi29 DNA聚合酶不断延伸生成DNA新链并置换出旧链。被置换下来的旧链重新进入循环过程,因此在1 h内完成106~109核酸扩增。RCA扩增技术在病原微生物检测、肿瘤早期筛查、DNA及RNA的单核苷酸多态性(SNPs)、蛋白质的检测等方面都有着广泛的应用前景[9]。TENG等[10]利用RCA技术建立一种特异灵敏的快速检水样中副溶血性弧菌技术,检测限达到1 CFU/mL。WANG等[11]利用RCA技术检测血液中肿瘤标记物MiR-21的异常表达。
1.4 解旋酶依赖扩增(HDA)2004年,Vincent模拟自然界中DNA复制过程发明了解旋酶依赖扩增技术(helicase-dependent amplification,HDA)。HDA反应步骤与PCR相似,均包括DNA链解旋、退火及延伸等步骤,两者最大的区别是HDA反应用单链结合蛋白酶和解旋酶替代PCR升温解旋双链过程,因此HAD是一种彻底的等温扩增技术。解旋酶依赖扩增(HDA)原理如图1所示。Helicase解旋酶解开模板DNA双链,再由单链结合蛋白酶(SSΒ)维持单链状态,引物结合到单链DNA模板上延伸扩增形成新双链。反复循环扩增实现靶DNA量的指数增加,在60~90 min内完成扩增109~1012倍[12]。HAD具有灵敏度高、特异好等特点,在临床诊断运用方面有诸多报道,包括了麻疹病毒、副溶血性弧菌、沙门菌等病原体微生物的快速诊断[13]。王晓等[14]对比了HDA扩增技术和qPCR检测手段,结果表明HDA扩增技术灵敏度比qPCR高10~100倍。
1.5 重组酶聚合酶扩增(RPA)2006年,NiallArmes第一次描述重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)。这种恒温扩增技术主要依赖于三种酶:单链核酸结合重组酶、单链DNA结合蛋白和链置换DNA聚合酶。扩增循环步骤如图所示:重组酶和引物结合形成重组酶-引物复合物,结合到模板双链DNA形成D-loop结构D-loop一条单链与引物杂交启动DNA扩增,引发链交换反应。同时母链开始分离并最终形成两个双链体,将作为下一个周期的模板。RPA反应速率非常快,一般可在10 min扩增1012倍[15]。RPA技术在POCT有广泛运用,在病毒诊断、细菌检测、SNP检测、食品安全检测、基因突变等方面的应用进展均有相关综述[16-17]。ROHRMAN等[16]应用RPA-LFD技术快速检测干血渍中HIV病毒。KIM等[17]应用RPA方法在10 min内就可以直接特异地检测到鸡蛋和鸡肉中沙门氏菌,灵敏度是实时荧光定量PCR方法的100倍。
1.6 环介导恒温扩增(LAMP)2000年,Notomi建立了环介导恒温扩增技术(loop mediated isothermal amplification,LAMP)。该技术以其简单、快速、特异性强、价格低廉等优势,已经成为市场最成熟的恒温扩增技术。2002年,NAGAMINE等[18]引入环引物,大大加速了整个链置换反应过程,使得整个扩增反应缩短到30 min。技术核心原理是在65℃附近DNA双链处于动态平衡,即任何一个引物向双链DNA进行碱基配对延伸时,另一条链就会发生链置换反应自动解离变成单链。环介导恒温扩增技术分两个阶段:起始阶段F3引物首先和模板结合并延伸,同时置换出互补单链,颈引物自我碱基配对形成茎环状结构;扩增循环阶段以茎环状结构为模板,启动链置换合成多环花椰菜结构DNA片段,可在1 h内积累109个拷贝。LAMP技术已经广泛检测各种病原体检测,相关国家行业安全标准多达20余条,如快速检测志贺氏菌(SN-T2754.3-2011)等。目前也报道基于LAMP方法的新冠肺炎病毒检测方法,HUANG等[19]利用RT-LAMP法将新冠RNA病毒逆转录和核酸扩增同步进行,快速检测时间仅为30 min。设计了多重RT-LAMP引物可同时检测了ORF1ab基因、E基因和N基因三个基因,使用临床样本验证特异性可达100%。日本荣研化学株式会研发了商品化LAMP检测试剂盒,检测结果与PCR一致。
2 优化策略
恒温扩增技术作为一类新型核酸分子诊断技术,有着共同技术通病:大多恒温扩增技术是多种酶复合反应体系,而酶处于非最适反应温度时,酶活力将下降甚至引起负面效果,例如限制性内切酶会发生引起非特异性切割、聚合酶碱基错配延伸概率增高等[20];其次恒温核酸扩增反应没有温度变化,局部复杂结构DNA双链并未完全打开,或者重复序列也会形成发夹结构,又或者引物与互补片段在低温情况下错误配对等,某些情况下的反应体系里引物之间形成非特异性互补,最后造成假阳性的结果;再者样本来源复杂,鼻咽拭子或血浆等样本往往含有扩增反应抑制物,这会降低扩增灵敏度、特异性和准确性差。本文从大分子拥挤效应、核酸结构、酶稳定性和其他技术联用等策略优化恒温扩增反应体系,以提高核酸扩增反应效率、特异性和灵敏性。
2.1 拥挤试剂拥挤试剂模拟了自然状态下细胞的高度拥挤状态,拥挤试剂提高了酶促反应速率,加快了酶反应速度[21]。在恒温核酸扩增中,常用的拥挤试剂包括聚乙二醇、多聚蔗糖等。MOTRÉ等[22]在HDA反应中额外添加5%多聚蔗糖400,可以缩短一半的反应时间。SASAKI等[23]发现RCA扩增产物与聚乙二醇添加量成正比,其机制可能是聚乙二醇有助于探针和模板结合,从而显著提高聚合酶活性。钟文涛等[24]认为拥挤试剂环境影响了蛋白质空间结构,通过非折叠状态变为折叠状态来增强酶的稳定性,降低蛋白酶反应的自由能提高酶活性。
2.2 模板结构恒温条件容易导致单链DNA形成局部二级结构(或发夹结构),引物自身二聚体和非特异性扩增,因此如何使双螺旋解链DNA变性成单链模板,成为提高特异性扩增的关键因素之一。甜菜碱可帮助DNA聚合酶顺利通过DNA某些复杂二级结构(如高GC区域),防止DNA聚合酶的从模板中解离。LUO等[25]发现引物如果没有经过严格筛选,RPA技术中很容易出现非特异性扩增。但是在RPA反应体系中添加0.8 mol/L甜菜碱,可以提高RPA检测的灵敏性和准确性,从而有效检测到临床血浆样本中的乙型肝炎病毒。单链结合蛋白(SSΒs)非特异性与单链DNA结合,使模板处于单链状态防止单链形成二级结构,并且保护单链部分不被核酸酶降解。ZHOU等[26]研究CRISPR-SDA恒温扩增技术时,发现缺少SSΒ蛋白,引物的3'末端很难结合到dsDNA,从而影响下一步扩增实验。MIKAWA等[27]在RAC扩增中添加SSΒ蛋白,不仅加速反应速率并且减少背景信号。
2.3 酶稳定性核酸检测过程中必须减少样本中内源抑制物的干扰作用。这些内源抑制物(包括血红素,蛋白酶等)可以抑制了酶活性和破坏酶结构,最终造成扩增产物少或假阴性。牛血清白蛋白(ΒSA)因富含赖氨酸,可通过疏水键相互作用力消除了多酚类化合物,以降低了抑制物的干扰作用。WALKER等[28]研究认为牛血清白蛋白通过可与酚类化合物和多糖结合,避免聚合酶失活,优化SDA反应体系。LIN等[29]研究了不同浓度的ΒSA在数字LAMP的优化作用,结果表明1 mg/mLΒSA可以达到最佳的检测效果;他认为ΒSA通过保护酶的稳定性降低引物二聚体形成,最终提高反应特异性。海藻糖通过抗氧化、热、干燥、脱水等不利外界因素来保护酶的稳定性,最终显著地提高酶的热稳定性和活性。WAN等[30]利用LAMP技术检测沙门氏菌时,不仅发现添加5.0%海藻糖可以缩短将近20%的反应时间。此外,海藻酸酶是冻干反应混合物的酶稳定剂,李美霞等[31]结果表明海藻糖作为保护剂机理:海藻糖与蛋白酶表面残余水分子结合,使蛋白酶构象更稳定。
2.4 与其他技术结合恒温扩增技术与CRISPR-Cas系统结合。CRISPR蛋白具有特异性地精确定任何双链DNA序列,具有高特异性。目前CRISPR/Cas系统主要技术平台是DETECTR技术(Cas12a)和SHERLOCK技术(Cas13a)[32],这两种CRISPR技术均可与RAP扩增技术结合,先通过RAP技术将核酸目标进行预扩增,再用CRISPR技术进行检测。该技术已经成功检测出如病毒检测(ZIKA)和病毒亚型区分(HPV),达到信号扩增为目标序列初始浓度的104倍效果。恒温扩增技术与电化学生物传感器结合:与传统检测(化学发光,电泳检测、免疫试纸条法)方法相比较,与恒温扩增技术结合所构建的生物传感器测速度快、灵敏度高,低背景,甚至达到单分子检测水平。YANG等[33]利用SDA恒温扩增技术和电化学信号放大技术实现了对microRNA超灵敏检测,最低检测限达到0.64 fmol/L。基于纳米材料的电化学生物传感器大大提高了检测的灵敏度,也提高了传感器的特异性和重现性。谢顺碧[34]通过电化学的方法间接追踪LAMP中产生的磷酸根离子(Pi)实现家蚕微孢子虫PTP1基因的高灵敏检测,其检测限达17 fg/µL。
3 展望
恒温核酸扩增技术具有扩增快、操作简便、检测简便、无需专用设备等优点,检测成本较低,有望在基层医疗及POCT中得到广泛运用,是目前新冠肺炎核酸快速检测中最具潜力的检测手段之一,特别是LAMP技术已逐渐应用于检测中。除上述恒温扩增技术存在假阳性缺陷的情况下,仍有一些问题亟待解决。首先恒温核酸扩增技术的结果一般都是定性,无法准确定量检测。有些文献提出用标准曲线来定量,但是因为链置换酶具有指数扩增,很难得到满意的定量结果;其次不同公司的恒温核酸扩增检测体系和设备不具有兼容性,影响了技术大规模推广和应用;而且恒温核酸扩增技术对核酸模板要求较低,并不需要将待测样本完全将核酸纯化。因此不少研究人员尝试用粗提取核酸样本或者免提取核酸直接扩增样本。总而言之,恒温核酸扩增技术是一类具有突破性的、快速而简单的核酸诊断工具。经过持续优化和改善,恒温扩增技术必定和PCR技术一样成为新冠肺炎核酸不可缺少的检测方法。
