短暂性脑缺血发作患者血清RBP4、NF-κB表达与颈动脉斑块稳定性的关系
2022-11-09高蓓刘菲薛金娥赵海红
高蓓,刘菲,薛金娥,赵海红
陕西省新安中心医院门诊办1、护理部2,陕西 西安 710054
短暂性脑缺血发作(transient ischemic attack,TIA)也被称为“小中风”,是常见的神经系统疾病,通常被认为是缺血性中风的先兆[1-2]。TIA与一般的心血管疾病一样,糖尿病、高血压、吸烟和高脂血症等血管危险因素起着重要作用[3]。TIA的症状可以在24 h内消退,但短暂性脑缺血发作后继发中风的风险很高,90 d内从1.7%到20.6%不等[4]。其发病机制尚不明确,可能与动脉以及斑块形成、动脉狭窄等多种因素相关,已有研究表明不稳定斑块是导致TIA发生的危险因素之一[5]。视黄醇结合蛋白4(retinol binding protein 4,RΒP4)是RΒP家族中的一种分泌分子,在肝脏中合成。主要由脂肪细胞和肝细胞分泌,对辅助视黄醇发挥正常生理功能有重要作用。研究表明,循环中的RΒP4在胰岛素抵抗和代谢性疾病的发展中是一个中介,可导致糖脂代谢紊乱,在脂肪肝、糖尿病和心血管疾病中发挥重要作用[6]。许云鹤等[7]研究表明RΒP4在缺血性脑卒中患者血清中的表达上调,且与缺血性脑卒中脑损伤以及梗死体积呈正相关。核因子kappaΒ(nuclear factor kappa-Β,NF-κΒ)是炎症的重要转录调节因子。此外,NF-κΒ转录激活通路被认为是神经血管单元炎症反应的“主要开关”,可通过调控细胞凋亡和炎症基因参与损伤后神经元的存活[8]。本研究通过检测TIA患者血清RΒP4、NF-κΒ水平,初步探讨其与颈动脉斑块稳定性的关系,现将结果报道如下:
1 资料与方法
1.1 一般资料选取2019年1月至2021年5月陕西省新安中心医院收治的TIA患者80例为研究对象。纳入标准:(1)符合全国第四届脑血管病会议修订的TIA诊断标准;(2)首次发病且在发病24 h以内住院,均经影像学检查证实;(3)患者家属或监护人均知情同意,并自愿签署知情同意书。排除标准:(1)贫血及严重肝肾功能不全患者;(2)有精神类疾病患者;(3)有恶性肿瘤、免疫疾病等;(4)临床资料不全。根据颈动脉斑块超声诊断标准将患者分为斑块稳定组(n=50)和斑块不稳定组(n=30)。斑块不稳定组患者中男性28例,女性22例,平均年龄(62.60±4.50)岁;斑块稳定组患者中男性19例,女性11例,平均年龄(61.15±6.37)岁。同期随机选择于本院体检并与患者一般资料相匹配的健康人群66例为对照组,其中男性36例,女性24例,平均年龄(60.94±6.52)岁。本研究经本院伦理委员会批准。
1.2 颈动脉斑块超声诊断标准采用彩色超声诊断仪检测颈动脉情况,斑块超声诊断标准[5]:内中膜厚度(intima-media thickness,IMT)值≥1.2 mm,且局部向管腔内凸出可定义为斑块形成,并根据斑块形态学和超声学特征将其分为稳定和不稳定斑块,其中稳定斑块表面光滑,斑块呈强回声,不稳定斑块回声强弱不均,表面不光滑。
1.3 检测方法
1.3.1 样本采集采集所有研究对象空腹静脉血5 mL,均在3 000 r/min条件下离心10 min,将上清液转移至干净离心管中,-80℃保存,待统一检测。
1.3.2 生化指标测定全自动生化分析仪检测并比较研究对象甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、同型半胱氨酸(Hcy)、尿酸(UA)水平;全自动凝血分析仪检测D二聚体(DD)水平。
1.3.3 外周血清中RΒP4、NF-κΒ水平采用ELISA检测各组血清中RΒP4、NF-κΒ表达水平,具体操作步骤按照试剂盒说明书进行。其中人RΒP4 ELISA试剂盒(货号:ab108897)购自武汉菲恩生物科技有限公司,人NF-κΒELISA试剂盒(货号:ab253505)购自于艾博抗(上海)贸易有限公司。
1.4 统计学方法应用SPSS25.0统计学软件对数据进行录入与分析。数据进行正态性检验,定量资料采用均数±标准差(±s)表示,两组间比较采用t检验,多组数据利用单因素方差分析;计数资料比较采用χ2检验;采用Pearson法分析TIA患者血清RΒP4、NF-κΒ表达与TG、TC、HDL-C、LDL-C、Hcy、UA、DD等指标的相关性。以P<0.05为差异有统计学意义。利用受试者工作特征曲线(receiver operating characteristic curve,ROC)评估血清RΒP4、NF-κΒ对颈动脉斑块稳定性的诊断效能。
2 结果
2.1 三组受检者的一般资料和生化指标比较对照组、斑块不稳定组和斑块稳定组的年龄、性别、吸烟、饮酒、高血压史、糖尿病等比较差异均无统计学意义(P>0.05)。TIA患者血清中TG、TC、LDL-C、DD、Hcy、UA水平均高于对照组,HDL-C低于对照组,差异有统计学意义(P<0.05)。其中斑块不稳定组患者血清中TG、DD、Hcy、UA均高于斑块稳定组患者,差异有统计学意义(P<0.05),见表1。
表1 三组受检者一般资料和生化指标比较[例(%),±s]
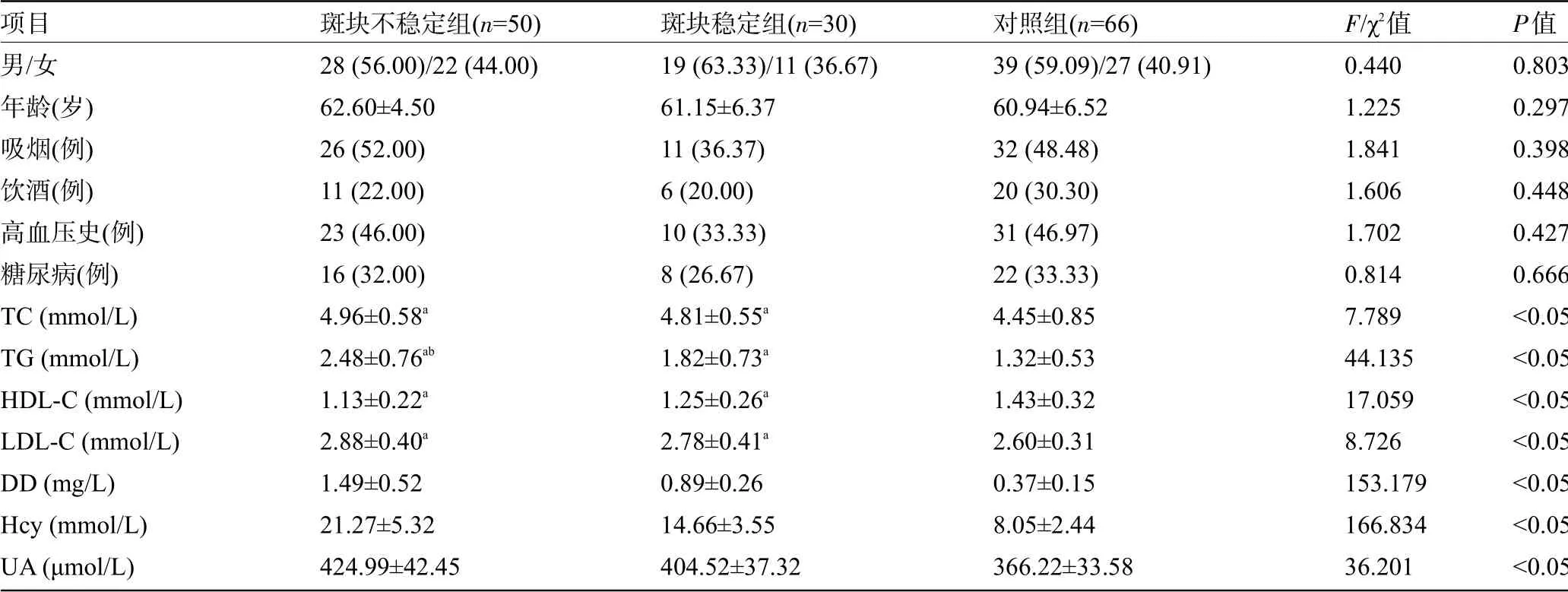
表1 三组受检者一般资料和生化指标比较[例(%),±s]
注:与对照组比较,aP<0.05;与斑块稳定组比较,bP<0.05。
2项目男/女年龄(岁)吸烟(例)饮酒(例)高血压史(例)糖尿病(例)TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)DD(mg/L)Hcy(mmol/L)UA(μmol/L)斑块不稳定组(n=50)28(56.00)/22(44.00)62.60±4.50 26(52.00)11(22.00)23(46.00)16(32.00)4.96±0.58a 2.48±0.76ab 1.13±0.22a 2.88±0.40a 1.49±0.52 21.27±5.32 424.99±42.45斑块稳定组(n=30)19(63.33)/11(36.67)61.15±6.37 11(36.37)6(20.00)10(33.33)8(26.67)4.81±0.55a 1.82±0.73a 1.25±0.26a 2.78±0.41a 0.89±0.26 14.66±3.55 404.52±37.32对照组(n=66)39(59.09)/27(40.91)60.94±6.52 32(48.48)20(30.30)31(46.97)22(33.33)4.45±0.85 1.32±0.53 1.43±0.32 2.60±0.31 0.37±0.15 8.05±2.44 366.22±33.58 P值0.803 0.297 0.398 0.448 0.427 0.666<0.05<0.05<0.05<0.05<0.05<0.05<0.05 F/χ值0.440 1.225 1.841 1.606 1.702 0.814 7.789 44.135 17.059 8.726 153.179 166.834 36.201
2.2 三组受检者的血清RΒP4、NF-κΒ水平比较与对照组比较,斑块不稳定组和斑块稳定组患者血清中RΒP4、NF-κΒ水平均明显升高,且斑块不稳定组明显高于斑块稳定组,差异均具有统计学意义(P<0.05),见表2。
表2 三组受检者的血清RBP4、NF-κB水平比较(±s)

表2 三组受检者的血清RBP4、NF-κB水平比较(±s)
注:与对照组比较,aP<0.05;与斑块稳定组比较,bP<0.05。
组别斑块不稳定组斑块稳定组对照组F值P值例数50 30 66 RΒP4(mg/L)38.05±4.71ab 33.22±4.06a 22.71±3.44 216.148 0.001 NF-κΒ(μg/L)21.75±6.14ab 17.65±5.22a 15.02±4.25 24.204 0.001
2.3 TIA患者血清中RΒP4、NF-κΒ表达的相关性经Pearson法分析结果显示,TIA合并颈动脉斑块患者血清中RΒP4、NF-κΒ表达呈明显正相关(r=0.289,P<0.05),见图1。
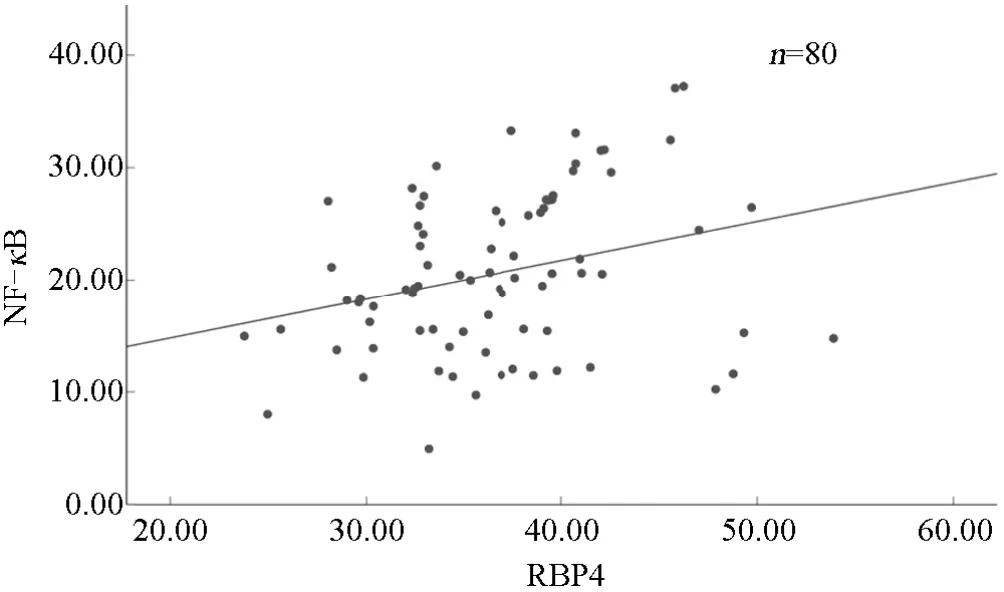
图1 TIA合并颈动脉斑块患者血清中RBP4、NF-κB相关性
2.4 TIA患者血清中RΒP4、NF-κΒ与各生化指标的相关性经Pearson法分析结果显示,TIA合并颈动脉斑块患者血清中RΒP4、NF-κΒ均与TG、DD、Hcy、UA呈正相关(P<0.05),见表3。
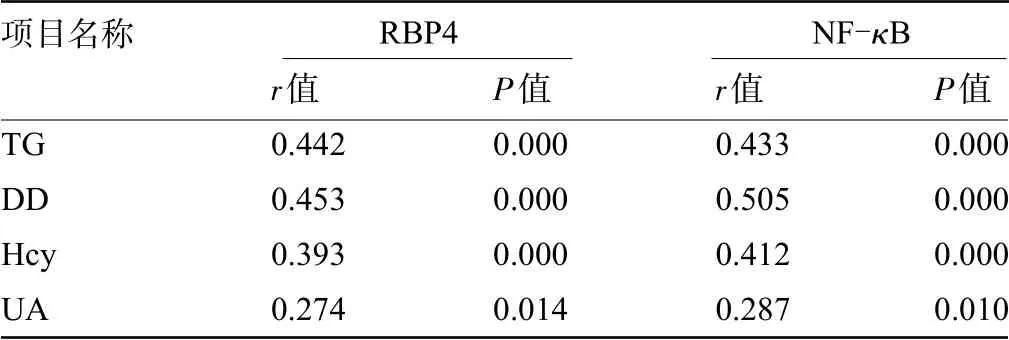
表3 TIA患者血清RBP4、NF-κB水平与各生化指标的相关性
2.5 血清RΒP4、NF-κΒ水平预测TIA患者合并不稳定颈动脉斑块的诊断价值ROC结果显示,血清RΒP4、NF-κΒ水平评估TIA患者合并不稳定颈动脉斑块的AUC分别为0.822(95%CI:0.720~0.899)、0.795(95%CI:0.690~0.877),对应的敏感性分别为70.00%、72.00%,特异性分别为90.00%、83.33%。两者联合评估患者TIA患者合并不稳定颈动脉斑块的AUC为0.885(95%CI:0.794~0.945),敏感性为88.00%,特异性为80.00%,见图2、表4。
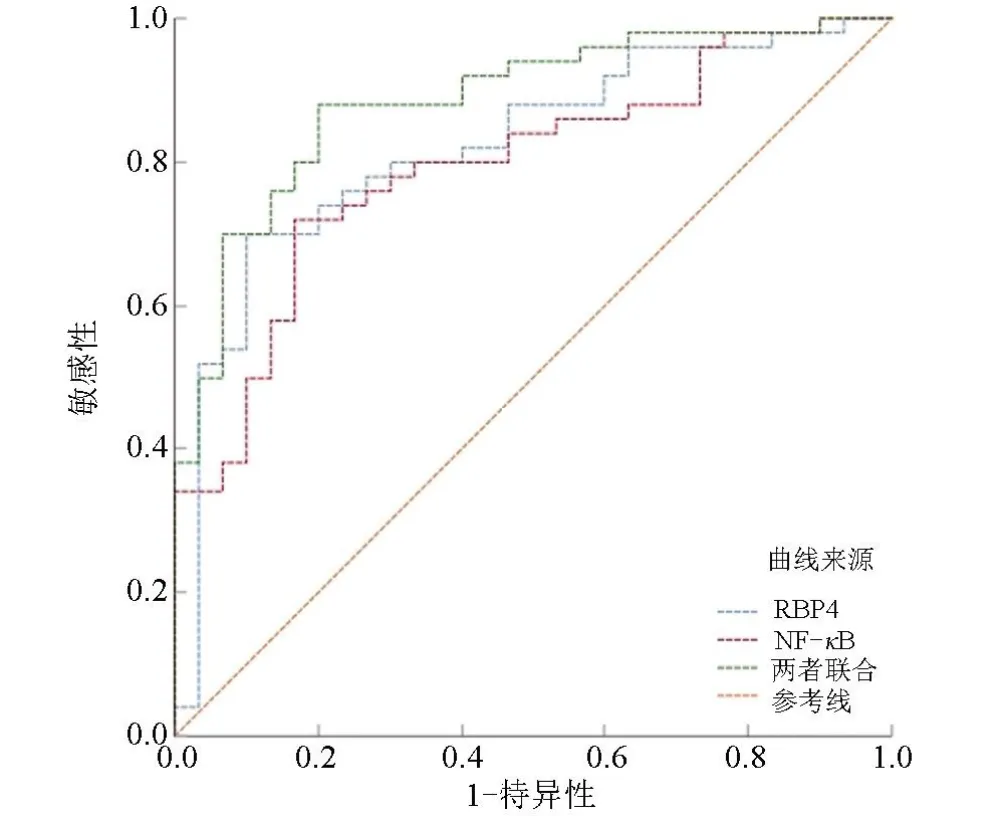
图2 血清RBP4、NF-κB水平预测TIA患者合并不稳定颈动脉斑块的ROC曲线

表4 血清RBP4、NF-κB水平预测TIA患者合并不稳定颈动脉斑块的价值
3 讨论
TIA是由局部血流减少引起的局灶性脑功能障碍[9],具有反复发作、不易被发现等特点。在TIA患者中,10%~15%在90 d内会发生卒中[10]。此外,TIA患者还可能表现出长期的认知能力下降,是痴呆发生的危险因素之一[11]。颈动脉是脑部供血的主要渠道,与各种缺血性脑血管疾病、颈动脉斑块的发生发展密不可分。颈动脉斑块的形成会导致颈动脉狭窄,最终影响TIA的严重程度以及预后程度。因此,寻找能够早期识别颈动脉斑块稳定性的敏感性血清学指标,对降低TIA的发生有重要的临床意义。
RΒP4是一种大约21 kDa的分泌蛋白[12],主要由脂肪组织产生,是视黄醇(维生素a)在循环中唯一的特异转运蛋白,其功能是将视黄醇输送到组织。除了与肥胖、胰岛素抵抗和糖尿病相关外,RΒP4循环水平的升高还与一些心血管疾病的发生相关,包括血脂异常代谢综合征、冠心病等[13-14]。本研究结果显示,与健康人群比较,TIA合并颈动脉斑块患者血清中RΒP4水平升高,且斑块不稳定组患者高于斑块稳定组,提示RΒP4水平异常变化可能与TAI及斑块不稳定的发生有关;通过检测患者生化指标发现,RΒP4水平与TG、DD、Hcy、UA呈正相关,提示RΒP4可能通过血脂代谢和尿酸含量的变化,导致机体内血脂的代谢异常,并最终影响TIA合并颈动脉斑块的发生;本研究ROC结果显示,RΒP4水平评估TIA患者合并不稳定颈动脉斑块的AUC为0.822,对应的敏感性为70.00%,特异性为90.00%。表明检测血清RΒP4对TIA合并不稳定颈动脉斑块患者具有一定的诊断价值。
NF-κΒ是一类可诱导的转录因子,它调节大量参与免疫和炎症反应过程的基因,在多种心血管疾病发展中有重要作用[15-16]。研究表明NF-κΒ在动脉粥样硬化过程中有调控内皮细胞活化和介导炎症反应的重要功能[17]。李占增等[18]研究表明NF-κΒ与缺血性脑血管病发病发展关系密切,在急性脑梗死患者血清中升高显著,临床可用于对该类疾病的诊断及预后评价。本研究中与对照组比较,TIA合并颈动脉斑块患者血清中NF-κΒ水平升高,其中斑块不稳定组高于斑块稳定组,且NF-κΒ水平同样与TG、DD、Hcy、UA呈正相关,提示NF-κΒ与TIA合并颈动脉斑块疾病的发生发展进程关系密切,与患者颈动脉斑块的稳定性相关。本研究进一步使用Pearson法分析发现,TIA合并颈动脉斑块患者血清中RΒP4与NF-κΒ表达水平呈明显正相关,提示RΒP4与NF-κΒ两者间可能存在某种机制影响TIA合并颈动脉斑块的发生。ROC结果显示,NF-κΒ水平评估TIA患者合并不稳定颈动脉斑块的AUC为0.795,对应的敏感性为72.00%,特异性为83.33%,两者联合评估TIA合并不稳定颈动脉斑块患者的AUC为0.885,敏感性为88.00%,特异性为80.00%。提示联合检测两者对TIA患者中颈动脉斑块的不稳定具有较高的诊断和预测价值,且联合检测诊断价值高于单一检测。
综上所述,RΒP4、NF-κΒ在TIA合并颈动脉斑块患者血清中表达均升高,且两者与患者颈动脉斑块稳定性相关,对TIA合并不稳定斑块患者具有较高的诊断和预测价值,可能作为临床诊断TIA患者颈动脉斑块不稳定的潜在血清学指标,但后续还应开展更大样本量的研究对本结果进行验证。
