TGF-β1基因多态性与妊娠期糖尿病发病的关联性
2022-11-09杨亚莉郭永平马颖宋文侠张雅丽
杨亚莉,郭永平,马颖,宋文侠,张雅丽
宝鸡市妇幼保健院产科,陕西 宝鸡 721000
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期出现或首次发现的任何程度的糖代谢异常,其特征是妊娠期胰岛β细胞对胰岛素的反应存在潜在的缺陷,可对围产期和产妇产后结局造成不良影响[1]。胰岛素抵抗增强是GDM发病的重要环节,报道表明,转化生长因子-β1(transforming growth factor-β1,TGF-β1)是一种多功能促炎细胞因子,可激活促使炎症调节启动的关键细胞因子NF-κΒ活性,从而增强炎症反应,并上调肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)表达,最终诱导胰岛素抵抗增强[2-3]。既往研究发现,TGF-β1基因突变导致其表达水平异常可能与糖尿病肾病[4]、心肌梗死[5]、子痫前期[6]等一系列疾病发生有关,但关于TGF-β1基因多态性与GDM发病风险关系的报道较少。本研究通过探讨TGF-β1基因多态性与GDM发病风险的关系,旨在进一步明确GDM发病机制。
1 资料与方法
1.1 一般资料前瞻性选择2019年1月至2020年12月于宝鸡市妇幼保健院产科检查并分娩的106例孕妇进行研究,所有孕妇在妊娠24~28周进行75 g葡萄糖负荷试验,根据试验结果将其分为GDM组(n=60)和正常组(n=46)。GDM组纳入标准:(1)符合《2016 SOGC临床实践指南:妊娠期糖尿病》[7]中有关GDM的诊断标准,以下任何一项升高即可确诊:空腹血糖≥5.1 mmol/L;餐后1 h血糖≥10.0 mmol/L;餐后2 h血糖≥8.5 mmol/L;(2)入组前接受有关治疗。排除标准:(1)合并孕前及妊娠期间高血压;(2)有严重心、肝、肾等功能脏器疾病;(3)有自身免疫系统疾病;(4)急性、慢性感染者。正常组为正常妊娠孕妇。两组孕妇的年龄、孕产次等基线资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。此外,根据White分类法将GDM组分为A1级(n=25)和A2级(n=35)。A1级是指经饮食运动治疗后,孕妇空腹血糖低于5.3 mmol/L,餐后2 h血糖低于6.7 mmol/L,无需给予胰岛素干预;A2级则与A1级相反。本研究经医院医学伦理委员会批准。全部孕妇及其家属知情并签署知情同意书。
表1 两组孕妇的基线资料比较(±s)

表1 两组孕妇的基线资料比较(±s)
组别GDM组正常组t/χ2值P值例数60 46年龄(岁)30.27±4.91 29.68±5.34 0.590 0.556孕次(次)2.14±0.39 2.21±0.37 0.936 0.351产次(次)1.56±0.34 1.49±0.31 1.091 0.278
1.2 检测方法(1)标本采集及DNA提取:采集所有受试者清晨空腹肘静脉血4 mL,其中2 mL应用ELISA法检测血清TGF-β1水平,另外2 mL进行抗凝处理,采用Qiagen DNA提取试剂盒提取DNA,DNA标本浓度标化至50 ng/μL,备用;(2)TGF-β1基因多态性检测:目的基因片段扩增采用聚合酶链式反应-限制性片段长度多态性(RFLP-PCR)法:PCR反应程序:93℃预变性3 min,93℃变性15 s,60℃退火1 min,72℃延伸30 s,共45个循环,最后72℃延伸10 min;PCR反应体积为30 μL,根据PCR产物凝胶电泳分带,确定基因型。TGF-β1+869T/C引物为F:5'-TTCCCGAGCCCTCCTA-3',R:5'-GCCGCAGCTTGGACAGGATC-3'。
1.3 观察指标统计TGF-β1基因+869T/C位点基因型以及等位基因频率;比较两组孕妇血清TGF-β1水平;比较GDM组TGF-β1基因+869T/C位点三种基因型患者血清TGF-β1水平;比较不同基因型GDM患者糖脂代谢指标水平,包括空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycated hemoglobin,HbA1c)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density liptein cholesterol,LDL-C)。
1.4 统计学方法应用SPSS 19.0统计学软件分析数据。计数资料比较采用χ2检验;计量资料以均值±标准差(±s)表示,组间比较采用独立t检验,TGF-β1基因+869T/C位点三种基因型血清TGF-β1水平比较行单因素方差检验分析。以P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1基因+869T/C位点多态性分布所有标本均成功进行了基因分型,TGF-β1基因+869T/C基因型分布符合Hardy-Weinberg平衡(χ2=2.671,P=0.263),电泳结果见图1。

图1 +869T/C位点基因型电泳结果
2.2 两组孕妇的TGF-β1基因型及等位基因频率比较GDM组孕妇的TGF-β1+869T/C位点TT基因型、T等位基因频率明显低于正常组,CC基因型、C等位基因频率明显高于正常组,差异均有统计学意义(P<0.05),而两组孕妇的TC基因型频率比较差异无统计学意义(P>0.05),见表2。

表2 两组孕妇TGF-β1+869T/C基因型及等位基因频率比较[例(%)]
2.3 两组孕妇的血清TGF-β1水平比较GDM组孕妇的血清TGF-β1水平为(213.68±28.93)ng/mL,明显高于正常组的(165.81±25.36)ng/mL,差异有统计学意义(t=8.901,P=0.001),而A1级与A2级孕妇的血清TGF-β1水平[(208.97±27.72)ng/mL vs(217.04±30.58)ng/mL]比较差异无统计学意义(t=1.047,P=0.299)。
2.4 GDM组TGF-β1基因+869T/C位点三种基因型孕妇的血清TGF-β1水平比较GDM组TGF-β1+869T/C位点CC基因型孕妇的血清TGF-β1水平明显高于TT、TC基因型,TC基因型孕妇的血清TGF-β1水平明显高于TT基因型,差异均有统计学意义(P<0.05),见表3。
表3 GDM组TGF-β 1基因+869T/C位点三种基因型孕妇的血清TGF-β1水平比较(±s)
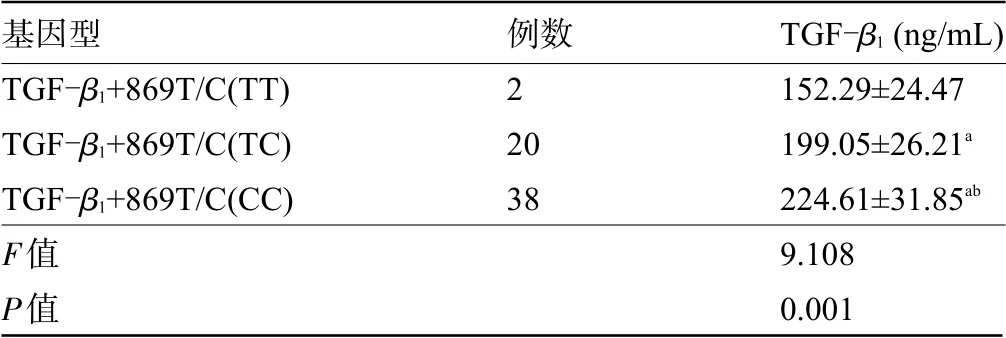
表3 GDM组TGF-β 1基因+869T/C位点三种基因型孕妇的血清TGF-β1水平比较(±s)
注:与TT比较,aP<0.05;与TC比较,bP<0.05。
基因型TGF-β1+869T/C(TT)TGF-β1+869T/C(TC)TGF-β1+869T/C(CC)F值P值例数2 20 38 TGF-β1(ng/mL)152.29±24.47 199.05±26.21a 224.61±31.85ab 9.108 0.001
2.5 不同基因型GDM孕妇的糖脂代谢指标比较CC基因型GDM孕妇的FPG、TG水平明显高于TT+TC基因型,HDL-C水平明显低于TT+TC基因型,差 异 均 有 统 计 学 意 义(P<0.05),而HbA1c、TC及LDL-C水平与TT+TC基因型比较,差异均无统计学意义(P>0.05),见表4。
表4 不同基因型GDM孕妇糖脂代谢指标比较(±s)
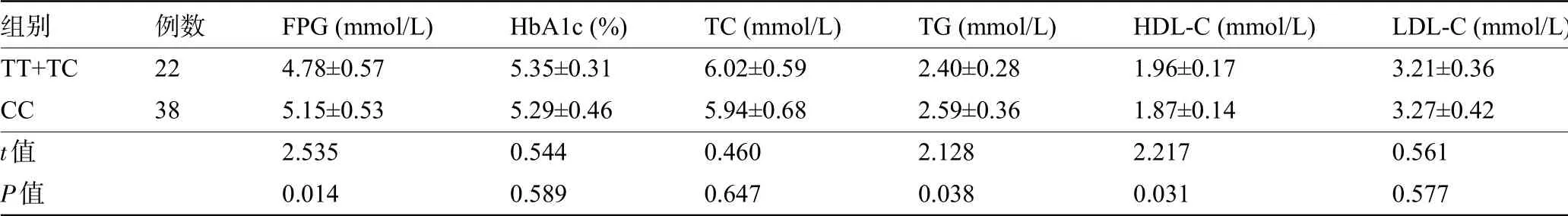
表4 不同基因型GDM孕妇糖脂代谢指标比较(±s)
组别TT+TC CC t值P值例数22 38 FPG(mmol/L)4.78±0.57 5.15±0.53 2.535 0.014 HbA1c(%)5.35±0.31 5.29±0.46 0.544 0.589 TC(mmol/L)6.02±0.59 5.94±0.68 0.460 0.647 TG(mmol/L)2.40±0.28 2.59±0.36 2.128 0.038 HDL-C(mmol/L)1.96±0.17 1.87±0.14 2.217 0.031 LDL-C(mmol/L)3.21±0.36 3.27±0.42 0.561 0.577
3 讨论
GDM是妊娠期常见的并发症之一,可对患者健康及其生活质量造成不利影响,此外,GDM还是影响新生儿不良结局的危险因素[8]。GDM症状较为隐蔽,患者缺乏典型糖尿病表现,从而延误其治疗时机,因此早期预测GDM的发生至关重要[9]。GDM发病与后天环境及先天遗传因素存在密切关联,越来越多的研究表明,遗传易感性与GDM的发生有关[10-11]。既往报道表明,TNF-α、IL-6、NF-κΒ等细胞因子可能通过介导胰岛素抵抗增强,进而诱导GDM发生发展[12]。故探讨上述细胞因子异常分泌的机制,寻找发生变化的基因位点并分析与GDM发病风险的关系,有助于明确GDM发生的机制,以早期对GDM进行筛查和预防。
TGF-β1是转化生长因子家族成员之一,与细胞生长、增殖和分化、组织纤维化、肿瘤进展和转移、伤口愈合、胚胎发生和免疫调节有关[13]。TGF-β1能够刺激细胞外基质蛋白转录,高水平TGF-β1与细胞外基质积聚、纤维化以及胰岛素抵抗有关,而胰岛素抵抗增强是GDM最重要的特征之一[14]。YENER等[15]研究表明,GDM患者TGF-β1水平明显升高,高血糖和胰岛素抵抗所致的炎症反应可能是TGF-β1表达上调的主要原因。一项TGF-β1基因+869T/C多态性与GDM的研究[16]也显示,TGF-β1基因+869T/C位点单核苷酸多态性可能与GDM易感性有关。因此,TGF-β1基因可能在GDM发生过程中起着重要作用。目前研究发现,TGF-β1基因至少存在9个单核苷酸多态性位点,其中多项研究支持+869T/C位点单核苷酸多态性与GDM有关[17]。本文研究结果显示,GDM组TGF-β1+869T/C位点TT基因型、T等位基因频率明显低于正常组,CC基因型、C等位基因频率明显高于正常组,两组TC基因型频率比较,差异无统计学意义,表明TGF-β1+869T/C位点单核苷酸多态性可能与GDM发病风险有关,与张燕等[18]、陈海霞等[19]报道相符。另外,GDM组血清TGF-β1水平明显高于正常组,差异有统计学意义(P<0.05),而A1级GDM患者与A2级GDM患者血清TGF-β1水平比较,差异无统计学意义(P>0.05),GDM组TGF-β1+869T/C位点CC基因型患者血清TGF-β1水平明显高于TT、TC基因型患者,TC基因型患者血清TGF-β1水平明显高于TT基因型患者,与上述疾病基因型分布结果一致,提示携带C等位基因可能促进TGF-β1合成,从而调节胰岛素基因转录以及胰岛β细胞功能,最终参与GDM发生、发展。本研究结果还显示,CC基因型GDM患者FPG、TG水平明显高于TT+TC基因型GDM患者,HDL-C水平明显低于TT+TC基因型GDM患者,推测+869T/C位点多态性可能与GDM患者糖脂代谢异常有关。一项关于体外GDM小鼠模型实验发现,miR-335-5p可通过升高血糖水平以及增强胰岛素抵抗,进而抑制胰岛β细胞分泌,激活GDM小鼠TGF-β1信号途径,为临床治疗提供参考[20]。文献研究也表明,TGF-β1与胰岛细胞受损相关,在2型糖尿病发病机制中起重要作用。因此,+869T/C位点多态性可能通过升高血糖水平,对胰岛β细胞分泌功能造成影响,最终导致GDM发生[21]。
本研究创新之处在于,发现了TGF-β1基因+869T/C位点多态性与GDM发病风险的关联性,并结合TGF-β1表达及糖脂代谢进行分析,初步阐明了TGF-β1基因+869T/C位点变异影响GDM发生的可能原因。但本研究收集例数有限,后续有待收集更多样本数以扩大研究。此外,其他多态性位点是否协同参与GDM的发生尚不清楚,TGF-β1基因变异影响GDM发生的详细机制有待深入探究。
综上所述,TGF-β1基因+869T/C位点多态性可能与GDM发病风险有关,TGF-β1+869T/C位点CC基因型可能通过上调TGF-β1表达参与GDM发生发展,C等位基因为其风险因素,并可能与患者糖脂代谢异常相关,提示临床应尽早规范筛查和管理GDM,以利于改善妊娠结局。
