白玉豆中α-淀粉酶抑制剂的提取、纯化及其性质研究*
2022-11-08崔彦阁许军星
崔彦阁,许军星,李 琳,张 萍,孙 路
(河北省衡水市第二人民医院,河北 衡水 053000)
引 言
白玉豆是豆科菜豆属一年或多年生草本植物,其外形圆润,色泽洁净如玉,因此得名。其主要产于我国江西、浙江、福建等长江中下游省份,有着悠久的种植历史[1]。根据农产品检测机构的测试显示,白玉豆的营养价值高,含有α-AI、多种氨基酸、抗性淀粉和微量元素等多种对人体有益成分,能够起到排毒养颜、开胃消炎等作用[2]。
α-AI 进入人体会抑制人体胰腺分泌的α- 淀粉酶(α-1,4- 葡聚糖-4- 葡聚糖水解酶)的催化作用,抑制人体吸收的淀粉或糖原转变为葡萄糖的过程,能有效治疗2 型糖尿病患者餐后的高血糖[3~5]。而且α-AI 被人体摄入后还会抑制小肠中的胰淀粉酶的催化作用,抑制人体对食品含有的淀粉的吸收,有利于减少体脂。从多种植物中提取α-AI 并纯化的工艺已有所开展,并且已有多种检测及试验证实了其对糖尿病的预防和治疗功效[6~7]。陈一昆等[8]提取芸豆中的α-AI 用于SD 大鼠,验证了α-AI降低脂肪减轻体重的功效;Shi 等[9]通过将α-AI 添加到高脂饮食诱导的肥胖的大鼠的饮食中,肥胖大鼠的体重增长减缓且肠道微生态得到了改善;Wang等[10]发现α-AI 仅会减少体脂降低血糖浓度,并不会引起显著的临床变化和不良反应,对人体安全。为拓宽α- 淀粉酶抑制剂获取途径,同时提高白玉豆的加工附加值,本文对从白玉豆中获取α-AI 的条件及产物性质进行了研究。
1 材料与方法
1.1 试剂与仪器
白玉豆(市售);猪胰α- 淀粉酶、可溶性淀粉、BCA 蛋白检测试剂盒(Sigma 公司);氯化钠(阿拉丁试剂有限公司);食用乙醇(上海生工生物工程技术服务有限公司);3,5- 二硝基水杨酸(阿拉丁试剂有限公司)。
冷冻离心机(Allegra X-30R,beckmancoulter 公司);真空冷冻干燥机(FD-1B-55,博医康实验仪器有限公司);pH 计(DELTA320,梅特勒- 托利多仪器);电子天平(BS 224 S,赛多利斯仪器);紫外可见分光光度计(TU-1800,普析通用仪器);可见分光光度计(722s,上海精密科学仪器);粉碎机(JZ7114,上海微型电机厂);恒温水浴锅(DZKW-D-2,天津天泰仪器有限公司);真空旋转蒸发仪(R-200,B CHI);层析柱(自制);酶标仪(SpectraMaxR 190,美谷分子仪器有限公司);恒温培养箱(DNP-9082,上海精宏试验设备有限公司)。
1.2 试验方法
1.2.1 白玉豆中α- AI 抑制剂的提取与纯化
将白玉豆在24℃去离子水中清洗后粉碎。称取200g 粉碎后的白玉豆过60 目筛,溶于1L 的1.5%(wt)的氯化钠溶液中室温浸提4h,经过滤后混合滤液。将滤液经过20min 水浴加热至70℃,按4000r/min 转速离心0.5h,收集上层的清液。在清液中添加食用乙醇,得到70%食用乙醇的混合液,在4℃下静置1h,之后以10000r/min 转速离心15min,取出沉淀物,为提取的白玉豆α-AI 的粗品。
将适量的白玉豆α-AI 粗品用定量的0.025mol/L(pH 值为4.5)HAc-NaAc 缓冲液充分溶解,混合溶液使用CM 纤维素柱层析(2.6cm×40cm),之后用0~1mol/L NaCl 的0.025mol/L(pH 值为4.5)HAc-NaAc 洗脱液以1mL/min 流速梯度洗脱,收集蛋白峰并逐一检测α-AI 活性,收集蛋白峰与α-AI 抑制活性峰重合的洗脱液,透析浓缩冷冻干燥后进一步纯化。用SephedexC-75 凝胶柱层析(1.0cm×80cm)以及含0~1mol/L NaCl 的0.025mol/L(pH 值为4.5)HAc-NaAc 溶液以0.5mL/min 的流速进行梯度洗脱,发现突出的蛋白主峰,逐一检测α-AI 活性。收集蛋白峰与α-AI 抑制活性峰重合的洗脱液,经透析浓缩后冷冻干燥,得到α-AI 样品。
1.2.2 α- AI 的温度及酸碱稳定性研究
为准确分析温度及酸碱度对α-AI 的影响,以试验用的α-AI 溶液配置质量浓度约0.6mg/mL 稀溶液,标准状态下的α-AI 对猪胰腺α- 淀粉酶的抑制率在65%~85%。在25,35,45,55,65,75 和85℃与pH 值1~12 (pH 梯度为1) 的条件下进行α-AI 的温度和酸碱稳定性研究。
1.2.3 α- AI 的提取单因素试验
在白玉豆中α-AI 的提取与纯化方法中,影响α-AI 提取与纯化的变量分别为固定豆粉的细度、料液比和盐溶时间,以此进行单因素试验分别研究各因素的影响。试验条件设为:豆粉的细度60 目,提取时间10h,溶剂比例1∶10g/mL。单因素的试验条件为豆粉细度(40,60,80,100 和120 目)、提取时间(2,4,6,8 和10h)和溶剂比例(1∶5,1∶10,1∶15 和1∶20(g/mL))。判断指标选择半数抑制浓度IC50。
淀粉在α- 淀粉酶的催化作用下发生水解,产生可将3,5- 二硝基水杨酸(DNS)还原的麦芽糖和葡萄糖[11],因此通过淀粉水解产生的麦芽糖含量来衡量α-AI 对α- 淀粉酶的抑制效果。吸光度(y)与麦芽糖标准溶液浓度(x) 的关系为[12]y=7.653x-0.5687(R2=0.9973)。
样品测定:将50μL 淀粉酶溶液(2mg/mL)与添加100μL 稀释后α-AI 和200μL PBS 缓冲溶液充分混合,恒温水浴20min(37℃)后加入400μL 可溶性淀粉(5mg/mL),再恒温水浴10min(37℃),添加250μL 的DNS,沸水浴10min 后空冷至室温,在520nm 处测量其吸光度。在试验过程中,另外设置标准组、标准对照组和试验对照组,标准组中不添加α-AI,标准对照组中不加淀粉酶液和α-AI,试验对照组中不加淀粉酶液,体积通过PBS 控制到相同水平。α-AI 抑制率P 通过式(1)计算[13]。

其中A1、A2、A3和A4分别为波长520nm 下标准组、标准对照组、试验组和试验对照组的吸光度。通过α-AI 浓度和P 的关系可以得到α-AI 对猪胰淀粉酶的半数抑制浓度IC50。
1.2.4 α- AI 的沉淀条件的确定
水溶液中的白玉豆α-AI 可以使用有机溶剂作为沉淀剂沉淀分离,常用的有机溶剂有甲苯、乙醇、异丙醇等。由于α-AI 的主要用途是合成减肥食品与糖尿病药物,从人体安全角度考虑,选择乙醇作为沉淀剂。在白玉豆提取液中分别添加占终溶液体积分数为30%,50%,70%和90%的食用乙醇,经过一定时间的沉淀反应后检测上层清液中的α-AI 活性,结果显示含70%乙醇的混合溶液的上层清液不含α-AI。
2 结果与分析
2.1 CMII 纤维素离子交换柱层析结果
本研究通过进行CMII-cellulose 对白玉豆α-淀粉酶抑制剂的层析预试验,确定层析过程中的参数为试验方法中所设,层析时每管采集5mL。层析过程的洗脱曲线如图1 所示。
从图1 可知,白玉豆α-AI 粗品经过CMII-cellulose 离子交换柱层析,得到1 个蛋白主峰,通过对每管进行α-AI 的抑制活性进行测试,发现蛋白主峰同活性尖峰重合,采集α-AI 的抑制活性大于50%的洗脱液,透析浓缩冷冻干燥,得到α-AI初步纯化样品。
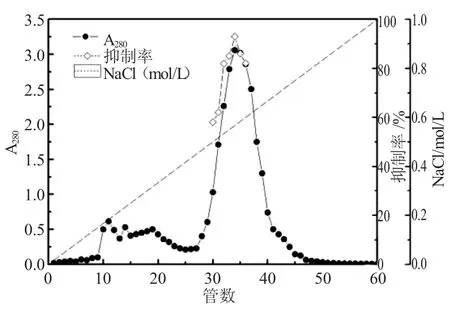
图1 白玉豆α-AI CMII 纤维素离子交换柱层析洗脱曲线(2.6cm×40cm)Fig. 1 The CMII cellulose ion exchange column chromatography elution curve of Baiyu bean α-AI (2.6cm×40cm)
2.2 SephadexG-75 凝胶柱层析结果
将α-AI 初步纯化样品进行SephadexG-75 纤维素离子柱层析,结果如图2 所示。结果发现蛋白主峰同活性尖峰重合,采集α-AI 的抑制活性大于50%的洗脱液,透析浓缩冷冻干燥,得到α-AI 纯化样品。

图2 白玉豆α-AI SephadexG-75 凝胶柱层析洗脱曲线(1.6cm×90cm)Fig. 2 The SephadexG-75 gel column chromatography elution curve of Baiyu bean α-AI (1.6cm×90cm)
2.3 α-AI 的温度及酸碱稳定性试验结果
温度对α-AI 抑制率的影响如图3(a)所示。在25~75℃时,α-AI 对猪胰腺α- 淀粉酶抑制率均大于82%,且波动不大,温度超过75℃后,对猪胰腺α- 淀粉酶抑制率急剧下降,证明α-AI 是一种非热敏性蛋白。因此可以在纯化过程中进行70℃水浴加热以去除热敏性蛋白而不影响α-AI。
图3(b)显示α-AI 在不同pH 值环境下对猪胰腺α- 淀粉酶抑制率,表征α-AI 在不同pH 值的稳定程度。结果显示,α-AI 在pH 值3.0~10.0 之间抑制率较高活性较好,可以稳定存在,在pH 值6.0~8.0 之间其抑制率最大,在pH 值为2 与pH 值大于10 时其活性损失较大,但可以表现出一定抑制特性。
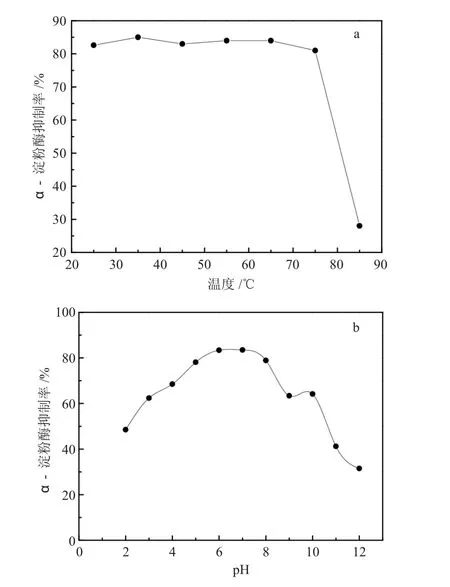
图3 温度(a)和pH 值(b)对α-AI 稳定性的影响Fig. 3 The effects of temperature (a) and pH (b) on the stability of α-AI
FerlS 等[14]在黑豆中分离出在pH 值为3.0~4.0时稳定的α-AI;Hideki 等[15]通过对日本TEPRA Bean 进行提取,得到在pH 值3.0~7.0 具有较高稳定性的α-AI。试验分离得到的α-AI 与文献报道相比,对pH 值的稳定区间更大,使用范围更广。
2.4 α-AI 提取的单因素试验结果
豆粉的细度对α-AI 半数抑制浓度的影响如图4(a)所示。结果表明,随着豆粉细度增加,IC50呈现V 字型变化,先减小后增大,在细度60 目时IC50达到最小值,α-AI 活性最高。这种现象的原因可能在于随着细度增加,提取过程中豆粉的表面积不断增大,接触的氯离子增多,α-AI 盐溶效果增强,表现出IC50下降;这种效果在细度较小时细度的增加导致的表面积增大比较显著,其存在峰值,超过峰值时,豆粉的细度如果再增加反而会使IC50增加,这是由于豆粉细度的增加伴随着大量的豆粉粉碎,在这个过程中α-AI 会大量损失,同时在提取过程中,豆粉之间的团聚几率也随着豆粉的细度增加而上升,导致提取液与豆粉的有效接触面积降低,减少了提取的α-AI 含量,因此豆粉细度过大才会出现α-AI 的活性降低,IC50增加。
料液比对α-AI 的半数抑制浓度的影响如图4(b)所示。IC50的数值随料液比的下降呈先减小后增大趋势,在料液比为1∶10(g/mL)时达到最小值,此时α-AI 活性最高。原因可能在于提取溶剂不仅会提取α-AI 也会提取其他蛋白质,当提取溶剂达到一定比例时α-AI 的提取量达到峰值,此时提取溶剂增加,α-AI 提取量不变,其他蛋白质的提取增加,造成α-AI 在总蛋白含量中的比例减少,使得IC50提高。提取溶剂含量过高反而对后期浓缩不利,因此料液比1∶10(g/mL)为提取α-AI 的最佳料液比。
提取时间对淀粉酶抑制剂的活性影响如图4(c)所示。α-AI 对淀粉酶的IC50值随着提取时间的推移先减小后略有上升,提取时间8h 时达到最低值,原因可能是提取时间增加有利于α-AI 的析出,但盐溶时间过长也会导致部分结构不稳定的杂质蛋白同样析出,使α-AI 的含量比例下降,造成抑制活性下降,IC50值出现上升趋势。因此提取时间选择8h 为宜。
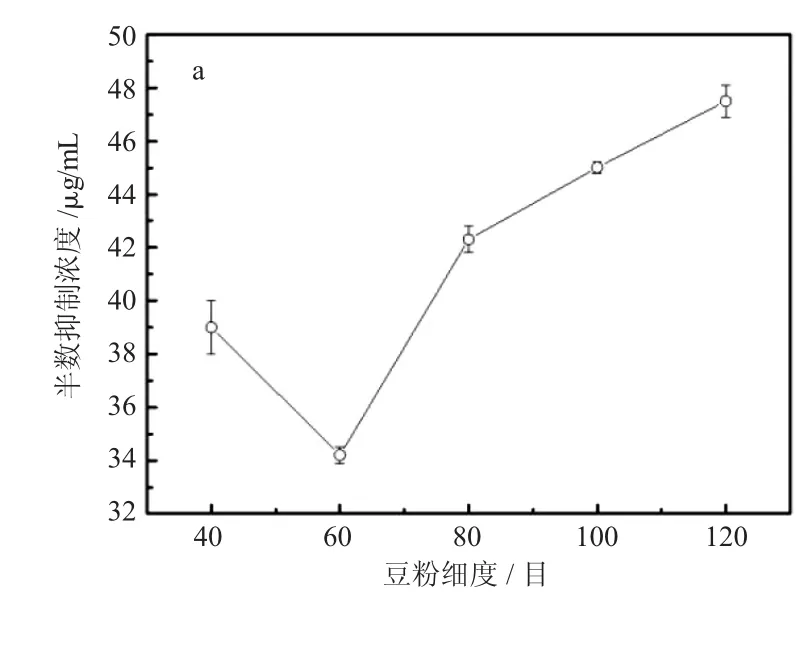

图4 豆粉的细度(a)、料液比(b)和提取时间(c)对α-AI 活性影响Fig. 4 The effects of bean powder fineness (a), material-liquid ratio(b) and extraction time (c) on the activity of α-AI
3 结 论
试验从白玉豆中提取α-AI 并进行纯化,评价其温度和酸碱稳定性,结果表明,α-AI 为耐热性蛋白,在温度75℃以上时,该样品的抑制活性才急剧下降,在pH 值3~10 范围内能够稳定发挥作用。通过单因素试验得到从白玉豆提取α-AI 最佳提取工艺:豆粉细度60 目、料液比1∶10(g/mL)、盐溶时间8h。白玉豆提取的α-AI 可通过CMII 纤维素离子交换柱层析与SephadexG-75 凝胶柱层析纯化。
