基于18F-FDG PET/CT 图像建立的多元影像组学模型对乳腺癌原发灶HER-2表达状态的预测价值
2022-11-08刘建井边海马文娟王子阳朱磊戴东徐文贵
刘建井 边海 曼 马文娟 王子阳 陈 薇 朱磊 戴东 徐文贵
1 天津医科大学肿瘤医院分子影像及核医学诊疗科,国家恶性肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心,天津 300060;2 天津医科大学肿瘤医院放射科,国家恶性肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心,天津300060;3 天津医科大学肿瘤医院乳腺影像诊断科,国家恶性肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心,天津 300060;4 天津市肿瘤医院空港医院核医学科,国家恶性肿瘤临床医学研究中心,天津 300308
2020 年的癌症统计数据显示,乳腺癌已取代肺癌成为全球第一大癌症,在我国女性患者中,乳腺癌的发病率占新发癌症的首位,癌症死亡人数占比位居第4[1]。乳腺癌治疗方案的制定、疗效评价及预后都与乳腺癌分子亚型密切相关[2-3]。除了外科手术及放化疗外,分子靶向药物和内分泌治疗在乳腺癌治疗中的应用越来越广泛。大量临床研究结果表明,曲妥珠单抗[Trastuzumab,商品名:赫赛汀(Hecepertin)]对高表达人表皮生长因子受体2(human epidermal growth factor 2, HER-2)的转移性乳腺癌的疗效显著[4-7],明显延长了患者的生存期。相关研究结果表明,20%~30%的乳腺癌患者HER-2过表达,HER-2 过表达常与乳腺癌的发生、发展密切相关,预示患者预后不良[8-10]。因此,及时准确地评判乳腺癌的HER-2 表达状态对临床医师筛选曲妥珠单抗受试人群和预后预测至关重要。目前,临床医师需要通过对靶病灶进行组织病理学检查才能获得HER-2 的表达情况,但这种方法存在有创、对标本要求高、操作难度大、容易漏诊等缺点;此外,由于肿瘤存在异质性,靶病灶的激素受体和HER-2 的表达状态在时间和空间上经常存在差异[11-12]。因此,亟需一种更加安全有效的检查方法预估乳腺癌患者HER-2 的表达状态,辅助临床医师更好地筛选曲妥珠单抗的受试人群,以减轻患者的经济负担,在进行个体化治疗的同时最大限度地改善患者预后。
18F-FDG PET/CT 作为一种集解剖成像与功能代谢显像为一体的检查手段,在乳腺癌诊疗中的应用日益广泛。许多临床研究结果证实,SUV 等代谢参数与乳腺癌患者的激素受体状态、分子亚型及预后具有相关性,但仍存在一定的分歧[13-18]。影像组学的兴起,让人们越来越深刻地认识到PET/CT图像可能包含比我们肉眼所能看到的更多有用信息。本研究评估PET 代谢参数与乳腺癌HER-2表达状态的关系,建立并评估基于PET/CT 图像的多元影像组学特征模型对乳腺癌原发灶HER-2表达的预测价值。
1 资料与方法
1.1 一般资料
收集2010 年1 月1 日至2019 年12 月31 日于天津医科大学肿瘤医院分子影像与核医学诊疗科行18F-FDG PET/CT 检查并经组织病理学检查结果证实的原发性乳腺癌患者的临床和影像学资料进行回顾性研究。
纳入标准:(1)经术后或穿刺组织病理学检查结果证实为原发性乳腺癌;(2)接受18F-FDG PET/CT 检查前未行放化疗、靶向药物及手术切除等抗肿瘤治疗;(3)18F-FDG PET/CT 图像清晰,能够进行PET 相关参数测量和靶区勾画;(4)组织病理学资料齐全,可确定乳腺癌分子分型;(5)无其他恶性肿瘤病史;(6)所有患者均签署了知情同意书。排除标准:(1)临床资料不完整;(2)图像质量不佳,影响靶区勾画或PET 参数测量;(4)哺乳期或妊娠患者。本研究符合《赫尔辛基宣言》的原则。
根据纳入和排除标准,本研究共纳入273 例女性乳腺癌患者,年龄26~78(51.8±10.8)岁,89.74%(245/273)为浸润性导管癌。根据HER-2 表达状态的不同,将患者分为HER-2 阳性组和HER-2 阴性组。比较2 组患者的年龄、组织病理学类型、HER-2表达状态、分子分型、腋下淋巴结转移情况、分期等临床资料。
1.2 扫描方法
所有患者均行18F-FDG PET/CT 全身扫描,显像仪器为美国GE 公司Discovery Elite 型PET/CT 仪,显像剂18F-FDG 由天津肿瘤医院分子影像及核医学诊疗科制备,合成设备为美国GE 公司MINI trace回旋加速器和Tracerlab FX-FDG 化学合成器,合成试剂为德国ABX 公司的FDG 试剂套盒,制备的18F-FDG 的pH 值约为7.0,放射化学纯度≥95%。扫描前受检者需禁食4~6 h 以上,测量身高(cm)、体重(kg),控制空腹血糖水平<11.1 mmol/L,18F-FDG注射剂量按照3.70~4.81 MBq/kg 计算。注射显像剂后患者在安静、温暖、弱光的环境中平卧休息50~60 min,于扫描前15 min 排空膀胱。患者取仰卧位,双手上举,扫描范围从颅顶至股骨中段。先进行全身螺旋CT 扫描,参数:管电压120 kV、自动曝光控制技术(30~210 mA,噪声指数25)、层厚5 mm、螺距0.75。随后同机采集PET 图像,采用三维+飞行时间技术+点扩展函数(SharpIR)法进行采集,采集矩阵192×192,采集时间2 min/床位,并应用迭代算法重建经CT 衰减校正后的PET 图像。采集数据结束后将数据传入Xeleris 工作站。
1.3 PET 代谢参数的测量及影像组学特征的提取及建模
将入组患者的原始图像调入美国GE 公司Advantage Workstation 4.6 后处理工作站,应用美国GE 公司PET Volume Computed Assisted Reading软件勾画ROI,以乳腺癌原发病灶SUVmax的42%为阈值,分别测量靶病灶的SUVmax、平均标准化摄取值(mean standard uptake value,SUVmean)、标准化摄取值峰值(peak of standard uptake value,SUVpeak)、肿瘤代谢体积(metabolic tumor volume,MTV)和病灶糖酵解总量(total lesion glycolysis,TLG)。应用美国国立卫生研究院image J 1.50i 软件分别对乳腺癌原发病灶最大截面及其邻近层面的PET 图像、CT 图像(软组织窗)进行手动勾画ROI。上述操作均由2 位具有5 年以上PET/CT 阅片经验的核医学科医师进行,当出现意见分歧时,由另1 位具有10 年以上PET/CT 阅片经验的核医学科医师进行复核后做出最终判断。在分割的肿瘤ROI 上,应用MATLAB 软件计算所有的影像组学特征。应用SMOTE 算法来解决不同组间数据量的欠平衡[19-20]。
通过以下步骤筛选稳定的影像组学特征:(1)采用Wilcoxon 检验计算具有显著差异的影像组学特征,显著性水平阈值设置为P=0.05;(2)计算两两影像组学特征之间的相关性(R),去除高维的特征冗余,冗余特征定义为相关性R>0.8 的2 个影像组学特征中ROC 的AUC 较小的特征;(3)采用最小绝对收缩选择算子(the least absolute shrinkage and selection operator,LASSO)回归筛选预测效能较高的影像组学特征组合;LASSO 通过确定常数λ的值,得出降维后的影像组学特征及相应组学特征的权重;(4)将保留特征以及特征相应的特征权重进行线性组合,计算每例患者的影像组学分数(rad-score)。
采用完全随机方法将样本中70%的患者作为训练集,剩余30%的患者作为测试集。应用AUC分别在训练集和测试集中评估PET 代谢参数与影像组学模型对乳腺癌原发灶HER-2 表达状态的预测性能。因本研究的样本量相对较小,故使用十折交叉验证以减小由于数据集划分带来的误差,并计算这些影像组学特征模型的平均性能。
1.4 统计学分析
应用 SPSS 22.0 及R(3.2.2 版)软件进行统计学分析。符合正态分布的计量资料以x¯±s表示,分类变量以例数或百分数表示。采用Wilcoxon 秩和检验比较组间各PET 代谢参数是否存在差异。计数资料的比较采用χ2检验,计量资料的比较采用两独立样本t检验(方差齐),不符合正态分布的计量资料采用Mann-WhitneyU秩和检验进行比较。P<0.05 为差异有统计学意义。
2 结果
2.1 患者的临床特征及其比较
在所有乳腺癌患者中,Luminal A 型20 例、Luminal B 型167 例、HER-2 过表达型45 例、三阴性(即TN)型41 例。其他临床特征见表1。

表1 273 例原发性乳腺癌患者的临床特征Table1 Clinical characteristics of 273 patients with primary breast cancer
HER-2 阳性组患者106 例、阴性组患者167例,2 组患者的临床特征比较见表2。2 组患者在年龄、病理学类型及肿瘤分期间差异均无统计学意义(均P>0.05),而HER-2 阴性组患者中合并腋下淋巴结转移的比例较HER-2 阳性组患者稍高,且差异有统计学意义(P<0.05)。
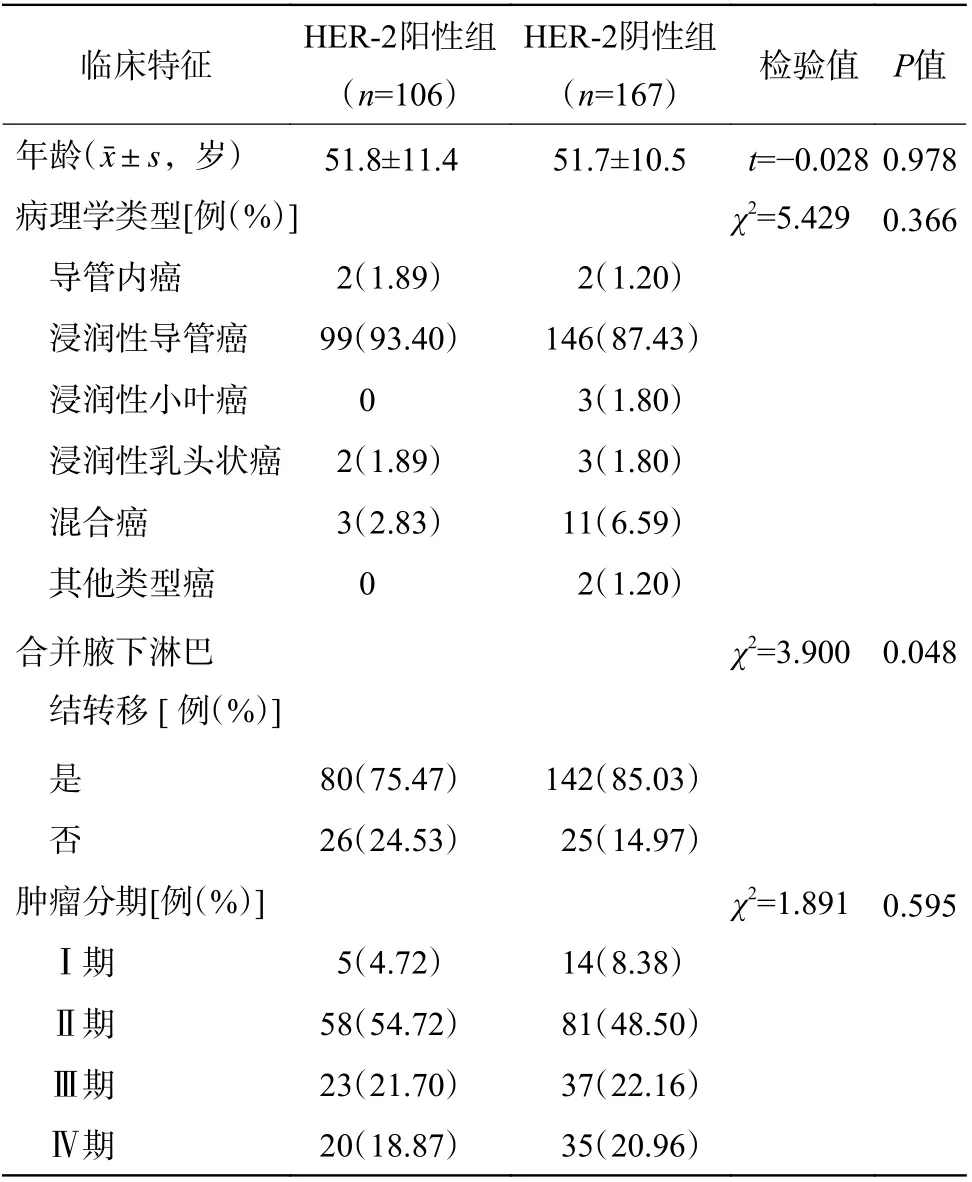
表2 HER-2 阳性组、阴性组原发性乳腺癌患者临床特征的比较Table2 Comparison of clinical characteristics between HER-2 positive group and HER-2 negative group of primary breast cancer patients
2.2 2 组患者PET 代谢参数比较
由表3 可知,HER-2 阳性组患者的SUVmax、SUVmean、SUVpeak均略高于HER-2 阴性组患者,但差异均无统计学意义(均P>0.05);2 组患者的MTV 和TLG 间的差异也均无统计学意义(均P>0.05)。2 组患者PET 代谢参数差异的典型病例如图1 所示。
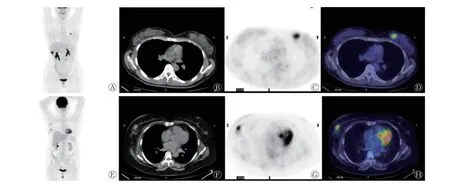
图1 HER-2 阳性患者与HER-2 阴性患者乳腺癌原发灶18F-FDG PET/CT 显像对比图 A~D 分别为HER-2 阳性患者(女性,45 岁)的全身MIP 图和乳腺癌原发灶CT、PET、PET/CT 融合图,乳腺癌原发灶位于左乳内上象限,病灶的SUVmax=6.93、SUVmean=4.32、SUVpeak=5.07、MTV 为4.69 cm3、TLG 为20.26 g。E~H 分别为HER-2 阴性患者(女性,54 岁)的全身MIP 图和乳腺癌原发灶CT、PET、PET/CT 融合图、乳腺癌原发灶位于右乳外上象限,病灶的SUVmax=6.30、SUVmean=3.92、SUVpeak=4.74、MTV 为4.40 cm3、TLG 为17.26 g。HER-2 为人表皮生长因子受体2;FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;MIP 为最大密度投影;SUVmax 为最大标准化摄取值;SUVmean 为平均标准化摄取值;SUVpeak 为标准化摄取值峰值;MTV 为肿瘤代谢体积;TLG 为病灶糖酵解总量Figure1 18F-FDG PET/CT images comparison of primary lesions of breast cancer between HER-2 positive and HER-2 negative patients

表3 HER-2 阳性组、阴性组原发性乳腺癌患者PET 代谢参数的比较( x¯±s)Table3 Comparison of PET metabolic parameters between HER-2 positive group and HER-2 negative group of primary breast cancer patients( x ¯±s)
2.3 影像组学模型对乳腺癌原发灶HER-2 表达状态的预测价值
从PET/CT 图像中提取了1 710 个定量影像组学特征(基于PET 图像和CT 图像的组学特征各855 个)。应用LASSO 回归和十折交叉验证确定均方误差最低时的常数λ值为0.02099837,根据λ值筛选用于构建模型的PET/CT 图像影像组学特征(图2)。最终筛选出具有较好预测价值的37 个影像组学特征建立组学特征模型,其中,PET 影像组学参数8 个、CT 影像组学参数29 个(图3)。降维后每例患者的影像组学分数见图4。
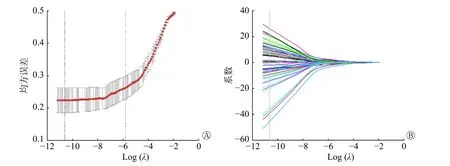
图2 原发性乳腺癌PET/CT 代谢参数的最小绝对收缩选择算子十折交叉验证图(A)及影像组学特征降维图(B) A 图中虚线为通过十折交叉验证选择的最佳λ,其具有最小均方误差(红点);B 图为在最佳λ 处(灰线)选定的影像组学特征组合在预测乳腺癌人表皮生长因子受体2 表达模型中对应的权重系数分布。PET 为正电子发射断层显像术;CT 为计算机体层摄影术Figure2 The least absolute shrinkage and selection operator cross validation diagram (A) and dimension reduction diagram of image omics characteristics (B) of PET/CT metabolic parameters of primary breast cancer
图3 273 例原发乳腺癌患者影像组学模型纳入特征及对应权重系数 特征由上至下依次为PET_纹理特征_灰度共生矩阵特征_能量;PET_小波特征_灰度区域大小矩阵特征_高通低通_小区域高灰度强调;CT_小波特征_灰度区域大小矩阵特征_低通高通_大区域高灰度强调;CT_小波特征_灰度行程矩阵特征_高通高通_行程方差;CT_小波特征_灰度区域大小矩阵特征_低通低通_区域大小不均匀性;CT_小波特征_灰度共生矩阵特征_低通高通_长行程强调;CT_小波特征_灰度行程矩阵特征_低通低通_灰度方差;CT_小波特征_灰度行程矩阵特征_高通低通_行程方差;CT_小波特征_灰度区域大小矩阵特征_低通低通_小区域低灰度强调;CT_小波特征_灰度区域大小矩阵特征_高通高通_灰度不均匀性;CT_小波特征_灰度区域大小矩阵特征_低通低通_灰度不均匀性;PET_小波特征_灰度区域大小矩阵特征_高通低通_小区域高灰度强调;CT_小波特征_灰度共生矩阵特征_高通高通_自相关性;PET_小波特征_低通高通_峰度;CT_纹理特征_灰度区域大小矩阵特征_小区域低灰度强调;CT_小波特征_灰度共生矩阵特征_高通高通_相关性;CT_小波特征_灰度共生矩阵特征_低通高通_自相关性;CT_小波特征_灰度行程矩阵特征_低通高通_长行程低灰度强调;PET_纹理特征_邻域灰度差矩阵特征_强度;CT_小波特征_灰度区域大小矩阵特征_高通高通_灰度不均匀性;CT_小波特征_灰度共生矩阵特征_低通低通_相关性;CT_小波特征_灰度区域大小矩阵特征_高通低通_大区域低灰度强调;CT_小波特征_灰度区域大小矩阵特征_低通高通_灰度不均匀性;PET_纹理特征_灰度区域大小矩阵特征_区域大小不均匀性;CT_小波特征_灰度共生矩阵特征_高通高通_能量;CT_小波特征_灰度区域大小矩阵特征_高通低通_小区域低灰度强调;CT_小波特征_灰度区域大小矩阵特征_高通低通_灰度不均匀性;CT_小波特征_灰度区域大小矩阵特征_高通低通_灰度不均匀性;CT_小波特征_灰度共生矩阵特征_高通低通_相关性;CT_小波特征_灰度行程矩阵特征_低通高通_灰度方差;PET_纹理特征_灰度区域大小矩阵特征_小区域强调;CT_小波特征_高通高通_偏度;CT_小波特征_灰度区域大小矩阵特征_高通高通_小区域强调;CT_小波特征_灰度区域大小矩阵特征_高通低通_低灰度区域强调;CT_小波特征_灰度区域大小矩阵特征_低通高通_区域大小不均匀性;PET_纹理特征_灰度区域大小矩阵特征_大区域强调;CT_小波特征_灰度行程矩阵特征_低通高通_灰度方差。8、16、32、64 代表将像素强度重新采样到23、24、25、26。PET 为正电子发射断层显像术;CT 为计算机体层摄影术Figure3 Inclusion characteristics and corresponding weight coefficients of imaging omics model in 273 patients with primary breast cancer

图4 273 例原发性乳腺癌患者的影像组学分数散点图Figure4 Scatter plot of image omics scores of 273 primary breast cancer patients
由图5 可见,基于18F-FDG PET/CT 图像建立的多元影像组学特征模型在预测乳腺癌HER-2 表达状态方面的表现显著优于传统PET 代谢参数(SUVmax、SUVmean、SUVpeak、MTV 和TLG)。在训练集中,该影像组学特征模型AUC、准确率、灵敏度和特异度分别为0.913(95%CI:0.871~0.954)、0.882(95%CI:0.832~0.922)、0.849(95%CI:0.759~0.910) 和0.910(95%CI:0.841~0.952);在测试集中,该影像组学特征模型AUC、准确率、灵敏度和特异度分别为0.820(95%CI:0.723~0.918)、0.830(95%CI:0.738~0.900)、0.875(95%CI:0.701~0.959)和0.807(95%CI:0.683~0.892)。
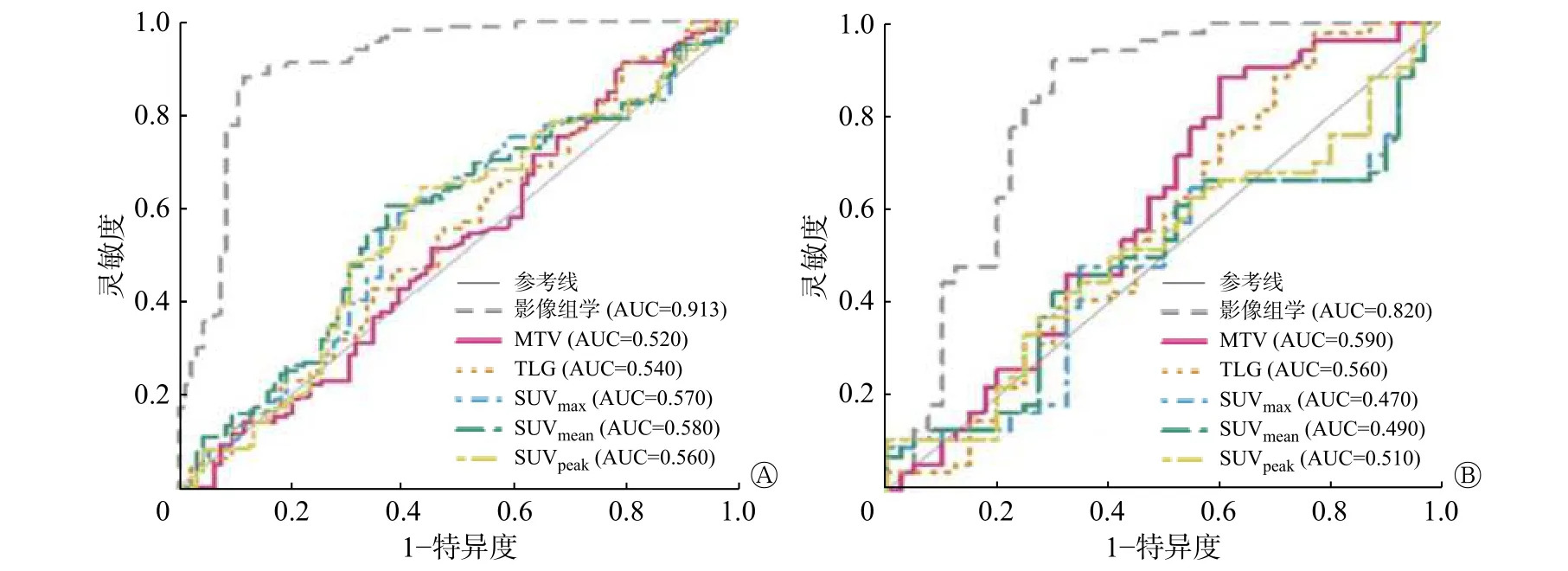
图5 PET 代谢参数和影像组学模型对乳腺癌HER-2 表达状态预测性能的受试者工作特征曲线 A 为训练集;B 为测试集。PET 为正电子发射断层显像术;HER-2 为人表皮生长因子受体2;CT 为计算机体层摄影术;AUC 为曲线下面积;MTV 为肿瘤代谢体积;TLG 为病灶糖酵解总量;SUVmax 为最大标准化摄取值;SUVmean 为平均标准化摄取值;SUVpeak 为标准化摄取值峰值Figure5 Receiver operator characteristic curve of PET metabolic parameters and imaging omics model for predicting performance of HER-2 expression in breast cancer
为进一步验证其准确率和稳定性,使用十折交叉验证来计算该模型的平均预测性能。经验证,该预测模型的AUC、准确率、灵敏度、特异度的均值分别为0.818、0.847、0.908、0.764。
3 讨论
乳腺癌已经成为世界第一大癌症,统计资料显示,自2000 年以来,我国女性乳腺癌的发病率呈上升趋势[21]。肿瘤的异质性给肿瘤的临床诊疗带来了许多困难,也对乳腺癌的精准诊疗提出了挑战。从某种程度上讲,乳腺癌的分子亚型是反映乳腺癌异质性的绝佳方法,有助于患者的个性化治疗[2-3]。对于HER-2 阳性的乳腺癌患者,由细胞膜上的HER-2 激活启动复杂的细胞内信号传导,导致富含HER-2 的乳腺癌细胞的代谢增强、侵袭性增强[22]。HER-2 的靶向治疗药物曲妥珠单抗的临床疗效显著,可有效延长患者的生存期[23],其已被写入相关诊疗指南。本着精准诊疗的原则,在治疗前对靶标HER-2 表达状态进行精确评估是必不可少的。及时准确地检出HER-2 的表达状态有助于个性化治疗方案的制定,在改善患者预后的同时可以减轻患者和社会不必要的经济负担。然而,目前临床上检测HER-2 表达水平的方式高度依赖以侵入方式获取的活体组织或手术标本的组织病理学检查,该检查流程复杂、耗时长、干扰因素多,并且可能会在操作过程中因不充分或过度固定、抗原修复和抗体敏感性等原因而导致结果偏倚。因此,临床上亟需一种非侵入性、简单、全面且稳定地预估HER-2 表达状态的检测方法,这也是备受临床关注的热点问题。18F-FDG PET/CT 作为一种融合影像学检查方法在乳腺癌诊疗中的价值日益突显,PET 代谢参数和影像组学特征可以在一定程度上揭示肿瘤的异质性,有望对这一临床问题的解决提供一定的帮助。
本研究通过对273 例乳腺癌患者的临床资料和18F-FDG PET/CT 图像进行回顾性研究发现,不同HER-2 表达状态的乳腺癌患者在年龄、性别、病理类型、临床分期及原发灶PET 代谢参数(SUV、MTV、TLG)方面的差异均无统计学意义,据此我们认为,上述临床特征和PET 代谢参数对预测乳腺癌原发灶HER-2 表达状态的意义不大;HER-2阴性组患者中腋下淋巴结转移的比例稍高,分析原因可能是样本量过小导致的偏倚造成的;在训练集和测试集中,基于18F-FDG PET/CT 图像建立的影像组学特征模型对乳腺癌原发灶HER-2 表达状态的预测性能明显优于PET 代谢参数,经验证发现该模型稳定性良好,预测性能尚佳。综上,我们认为基于18F-FDG PET/CT 图像建立的多元影像组学模型对乳腺癌原发灶HER-2 表达状态有较高的预测价值,有助于临床医师筛选曲妥珠单抗受试人群,改善患者的预后。
许多临床研究结果表明,不同分子亚型乳腺癌患者原发病灶对18F-FDG 的摄取具有差异性[13-14],具有更高侵袭性的分子亚型(如非Lumianl 型或三阴性型)的乳腺癌病变往往会表现出葡萄糖高代谢,这一现象可以被18F-FDG PET/CT 捕获并反映在SUV 参数中[17-18,24]。本研究中2 组患者间5 个PET 代谢参数差异均无统计学意义,分析原因可能是由于按照本研究的分组方式,将部分低葡萄糖代谢的Luminal 亚型和高葡萄糖代谢的三阴性型乳腺癌都归入了HER-2 阴性组,从而抵消了一部分不同亚型病灶间糖代谢的差异所致。本研究结果与一些学者的研究结果类似,汤泊等[25]的研究结果也显示,18F-FDG PET/CT 常规代谢参数(SUVmax、MTV 和TLG)在HER-2 不同表达组间的差异均无统计学意义(均P>0.05)。但是,也有不少研究者对此结果持反对意见,其认为PET 代谢参数对乳腺癌HER-2 表达状态有一定的预测价值,Kitajima等[17]报道,SUVmax以6.75 作为临界值时可有效预测乳腺癌HER-2 的高表达状态,其预测灵敏度为65.4%、特异度为75.2%、AUC 为0.704;Cokmert等[26]也进行过类似的报道,有所不同的是该研究中的SUVmax以10.05 作为临界值时预测效能最佳,AUC 为0.648。由此可见,不同研究报道的SUVmax临界值差异较大,结果尚存争议。不过,大多数学者认为,PET 体积参数(如MTV、TLG)主要被用来表示肿瘤负荷,往往与患者预后的关系更加密切[27-28],而与肿瘤病灶的恶性程度和侵袭性关系不太紧密。
影像组学的出现为医学图像的分析提供了新的方法,我们可以深度挖掘医学图像中蕴含的海量信息,进一步揭示病灶形态、大小、代谢、功能甚至肿瘤异质性等方面的信息。既往的一些研究结果也证实了影像组学特征与乳腺癌HER-2 表达状态息息相关[29-31]。Li 等[30]报道,基于MRI 的放射组学特征可区分HER-2 阳性和HER-2 阴性表达,其AUC为0.65。Nie 等[31]则使用基于乳腺X 线摄影图像的影像组学特征构建模型来预测乳腺癌患者富含HER-2 的分子亚型,其AUC 为0.66。Moscoso 等[32]发现PET 纹理特征与HER-2 状态相关,但AUC<0.70。与这些临床研究结果相比,本研究具有更大的样本量(273 例),提取的影像组学特征参数更多,基于PET 图像和CT 图像总共提取了1 710 个影像组学特征参数,运算数据量更大,分析更全面。本研究纳入的病例数量与提取的特征数量差异较大,属于特征数量远大于样本数量的分类问题。在特征选择中LASSO 为L1 正则化,会施加较大的惩罚项从而控制特征的数量,避免维度灾难。本研究基于LASSO 选择后使用其权重进行模型构建更有利于模型的意义解读,若使用其他模型(如神经网络、遗传算法、集成学习等)对数据意义的解读较为困难。在进行影像组学特征筛选时,所有权重不为0 的影像组学特征是按照权重系数由大到小顺序进行排列的,即权重的绝对值越大,表明其特征对结果的预测效能越好。本研究共筛选出37 个影像组学特征用于构建模型,在训练集中预测模型的AUC 为0.913,在测试集中预测模型的AUC 为0.820,准确率、灵敏度和特异度都在0.8 以上。
经验证,该模型的稳定性和平均预测性能都较好,据此我们初步认为,与传统的PET 代谢参数相比,基于PET/CT 图像建立的影像组学特征模型可以较好地预测乳腺癌原发灶HER-2 的表达状态,从而辅助临床筛选曲妥珠单抗的受试人群,改善患者预后。但本研究仍存在一些局限性。(1)本研究为单中心研究,样本量较小,部分结果容易产生偏倚,后续有必要进一步扩大样本量并引入第三方数据进行验证;(2)由于本研究为回顾性研究,图像采集、重建、参数测量等难以做到标准化,甚至可能影响PET 代谢参数测量的准确性和可重复性;(3)本研究仅针对原发性乳腺癌病变进行研究,并未涉及转移性病变,考虑到原发灶与转移灶间可能存在的异质性,因此有必要进一步设计涉及原发性和转移性病变的相关研究加以补充。
利益冲突所有作者声明无利益冲突
作者贡献声明刘建井负责研究命题的设计、临床资料的搜集、数据的统计、论文的撰写;边海曼负责临床资料的搜集、影像资料的调取、ROI 的勾画;马文娟负责影像组学模型的建立与验证;王子阳负责影像组学参数的提取、图像的绘制;陈薇、朱磊负责临床资料的搜集、图像的判读;戴东负责论文思路的指导、影像组学部分的技术支持;徐文贵负责研究思路的指导、研究过程的协调推进、论文的修改
