外泌体在恶性肿瘤发生发展中的作用及临床应用
2022-11-07储钜航钱明平
储钜航, 钱明平
(1. 同济大学医学院,上海 200092; 2. 同济大学附属第十人民医院甲乳科,上海 200072)
外泌体是由多囊泡体(multivesicular bodies, MVBs)与细胞膜融合后向细胞外分泌的纳米级膜性囊泡,平均大小为100 nm,可携带多种具有生物活性的物质,以介导细胞间复杂的细胞通信来维持正常生理状态或诱发疾病[1]。受体细胞摄取外泌体的方式有配体受体相互作用、吞噬作用、内吞作用和质膜融合等,见图1。最初发现时,这些细胞外囊泡只被认为是清除细胞碎片的垃圾处理器,它们在许多重要生物过程中所发挥的作用多年来一直被低估。2007年,Valadi等[2]率先描述了外泌体能够在细胞之间携带和转移mRNA和microRNA,确立了它们作为细胞间信息传递载体的作用。新近研究表明[3-5]外泌体在机体生理或病理过程中均可以向周围细胞传递多种分子信号,此外,所有的真核细胞都可以将外泌体分泌到血液、母乳、脑脊液、腹水、尿液、精液和唾液等体液中发挥其生理或病理作用。
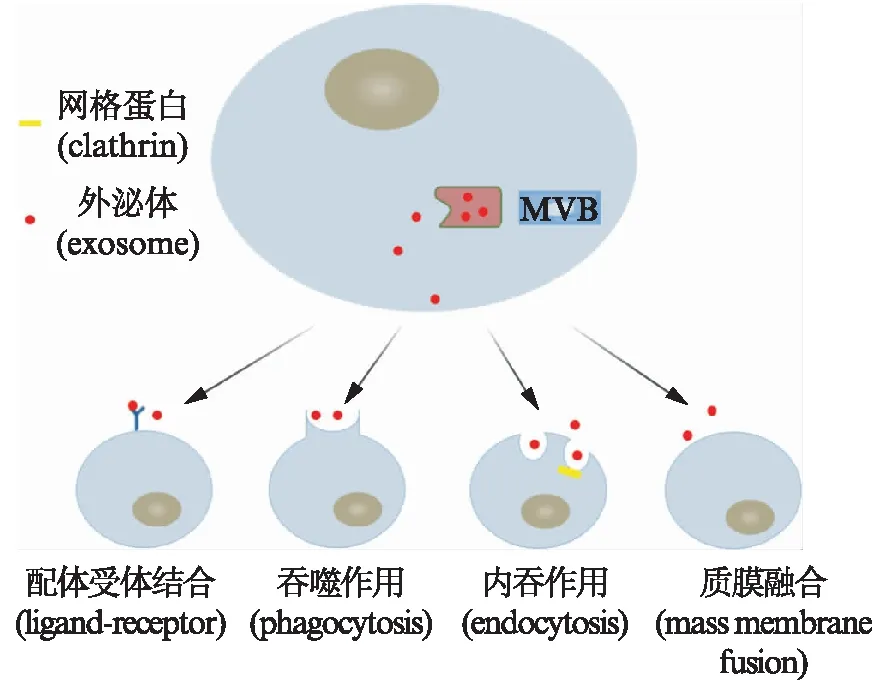
图1 受体细胞摄取外泌体的方式Fig.1 Exosome uptake by recipient cells
癌变具有高度异质性,是多种基因和多种细胞因子共同参与的复杂动态过程,随着外泌体等新介质的研究展开,对肿瘤发生的认识也在不断深入[6]。肿瘤细胞来源的外泌体(tumor-derived exosomes, TDEs)通过传递不同类型的生物活性物质发挥调控肿瘤转移前微环境、介导肿瘤细胞发生上皮细胞-间充质细胞转化(epithelial-mesenchymal transition, EMT)、调控血管通透性及肿瘤细胞对远处转移病灶的选择性等作用,进而介导癌细胞的远处转移及靶器官转移特异性[1]。越来越多的人认为外泌体与区域癌化(field cancerization, FC)、信号传递、肿瘤相关成纤维细胞的生成、血管生成、免疫抑制和耐药性等方面[7]密切相关。本文将围绕上述几个方面进行综述,总结外泌体在癌症发生发展过程中的作用。
1 外泌体与肿瘤发生
癌症发生过程中,正常细胞逐步演变成恶性病变,这些病变最终会导致局部恶性肿瘤的发生,继而发生远处转移。当细胞通过遗传或散发性事件获得癌症驱动基因的转化突变时,肿瘤就会发生[8]。大多数的癌症是通过偶发事件发生的,通常是由于暴露在环境致癌物中或感染[9],其中炎症起重要作用。炎症反应是一种保护性宿主反应,旨在启动对损伤的修复或消除疾病的病因,急性和慢性炎症都是已知的癌变前兆[10],炎症诱导癌变的机制之一是通过产生活性氧(reactive oxygen species, ROS)和活性氮(reactive nitrogen species, RNS) 破坏DNA,诱导细胞癌变,当机体被细菌或寄生虫感染时,炎症便会启动,活化的中性粒细胞和巨噬细胞能够通过激活NADPH氧化酶、黄嘌呤氧化酶、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和髓过氧化物酶(myeloperoxidase, MPO)产生ROS和RNS。为了清除感染源,这些氧化剂会破坏核酸、蛋白质和脂质,进而导致基因突变和肿瘤发生。近年来,有证据表明外泌体参与炎症相关消化系统肿瘤的发生发展,如结肠癌、肝细胞癌(hepatocellular carcinoma, HCC)、胆管癌和胃癌等。
炎症性肠病(inflammatory bowel disease, IBD)是一种与结肠癌风险增加相关的慢性自身免疫性疾病,IBD患者肠腔内有大量多形核中性粒细胞(polymorphonuclear neutrophil, PMN)浸润,浸润的PMN可以释放MPO,导致ROS的生成,ROS可诱导基因毒性应激,导致单链或双链断裂,引起癌变[11]。宏蛋白质组学显示在新发IBD患儿中,某些外泌体可通过分泌MPO参与结肠癌的发生[12]。
HCC是另一种通过肝纤维化和肝硬化发展而来的炎症性癌症。肝纤维化可由肝实质细胞持续损伤引起,常见病因有病毒性肝炎、酒精中毒等,这些因素触发ROS的释放和肝星状细胞(hepatic stellate cells, HSCs)的激活导致肝纤维化[13]。小鼠巨噬细胞分泌的外泌体和人血浆外泌体中含有的NADPH氧化酶和细胞色素P450均可参与ROS的产生,增强肝星状细胞的活化和胶原合成,导致肝纤维化,但具体机制尚不清楚[14]。外泌体miR-192是丙型肝炎病毒(hepatitis C virus, HCV)诱导肝纤维化的关键调控因子之一,其可以通过外泌体从HCV复制的肝细胞转移到造血干细胞中。miR-192通过TGF-β1上调造血干细胞中的纤维化标志物,激活造血干细胞,使其分泌炎症细胞因子并上调纤维连接蛋白和胶原蛋白的基因表达,导致肝纤维化[15]。胆管细胞来源的外泌体也被证明介导长链非编码RNA H19向肝细胞转移,促进肝胆汁淤积和纤维化,这些分别与胆管癌和HCC的发生息息相关[16]。
2 外泌体与肿瘤进展
肿瘤进展用于描述恶性肿瘤发生局部或远处转移,转移是恶性肿瘤的全身性疾病形式,肿瘤细胞与局部或远处的微环境相互作用,导致继发性恶性肿瘤生长。肿瘤微环境的改变在恶性肿瘤进展中发挥重要作用,其中免疫细胞组成失衡、成纤维细胞表型变化和内皮细胞的改变等都是恶性病变的特征[17]。EMT的诱导及其逆转证明了癌症进展过程中细胞具有可塑性,是肿瘤进展的关键步骤。EMT使上皮细胞获得间充质特征,使它们能够单独迁移、渗出,在血液中存活,最终植入到远处器官。相反,在转移生长过程中,细胞通过间充质-上皮转化(mesenchymal-epithelial transition, MET)恢复上皮特征并形成继发性肿瘤,外泌体在其中起重要作用。此外,外泌体在FC、细胞间信号传递、肿瘤相关成纤维细胞的生成、血管生成、免疫抑制和治疗耐药性中的作用同样促进肿瘤生长与转移[18]。
2.1 外泌体与FC
有研究者在口咽癌周的上皮组织中注意到在发展为肉眼可见的恶性肿瘤之前,细胞经历了一系列遗传学的改变,转化为组织学正常但遗传学异常的癌前细胞,癌前细胞在组织中增殖积累,形成癌前区域,在致癌因素的持续作用下,某些癌前细胞进一步积累基因改变并最终转化为组织学异常的恶性肿瘤细胞,这些改变多是由关键的癌症相关基因突变引起,这些变化可能导致细胞增长速度加快、死亡率降低或免疫逃避增加,同时那些位于癌前区域的癌前细胞仍然存在,仍有可能转化为癌。目前,FC被认为是多种癌症发展的基础,包括肺癌、结肠癌、皮肤癌、前列腺癌和膀胱癌等[19-20]。TDEs是引发和诱导肿瘤微环境中周围细胞分子改变的积极参与者并促进多灶性肿瘤发生,最终导致FC。将健康细胞来源的外泌体和TDEs进行比较,证明了与健康细胞来源的外泌体相比,TDEs可以介导正常细胞癌变。来自亚砷酸盐转化的肝细胞外泌体circRNA-100284可以通过加速细胞周期和促进细胞增殖介导健康肝L-02细胞的恶性转化,而来自正常细胞的外泌体没有这种能力[21]。对比胰腺正常细胞,人类胰腺癌细胞外泌体在NIH-3T3细胞转化中起到了启动剂的作用。TDEs可将促瘤生物分子转移到受体细胞,使信号通路异常激活并诱导突变,最终导致靶细胞发生不可逆的变化[22]。
2.2 外泌体与信号传递
肿瘤进展的另一种方式是以外泌体为载体向邻近细胞传递旁分泌信号。Steenbeek等证实[23]来自侵袭性黑色素瘤的外泌体可显著增强侵袭性较弱或转移性较差癌细胞的增殖能力、侵袭潜能和EMT标志物的表达。卵巢癌细胞来源的外泌体传递旁分泌信号与化疗耐药性增加有关。缺氧介导的肿瘤进展在卵巢癌中很常见,Dorayappan等[24]发现与缺氧诱导的外泌体共同培养的癌细胞显示顺铂外流,从而提高了癌细胞存活率。此外,使用抑制剂阿米洛利阻断外泌体释放的同时使用顺铂治疗可导致卵巢癌细胞凋亡增加和增殖减少,故抑制癌细胞中调节外泌体分泌的蛋白可以限制TDEs传递旁分泌信号,以提高化学治疗的有效率。
一项关于外泌体miR-93在HCC发生发展中的作用的研究显示外泌体miR-93具有促进肿瘤细胞增殖和侵袭的能力,并表明外泌体miR-93过表达预示着HCC患者预后不良[25]。说明TDEs通过细胞间的信号传导在介导肿瘤进展、转移和化疗耐药方面的关键作用,并为改善临床结局提供了靶点。
2.3 外泌体与肿瘤相关成纤维细胞
肿瘤细胞的转移需要不同类型细胞之间的相互作用,而成纤维细胞向肿瘤相关成纤维细胞(tumor-associated fibroblasts, CAFs)转化的激活在促进肿瘤生长和转移中起着重要作用[1],CAFs多通过细胞外基质重塑和生长因子信号传导触发EMT促进肿瘤转移。膀胱癌细胞的外泌体TGFb介导成纤维细胞转化为CAFs,而CAFs的条件培养基促进非侵袭性膀胱癌细胞的EMT、细胞生长、迁移和侵袭,由此形成恶性循环[26]。
肿瘤来源的外泌体miR-1247-3p通过下调其靶标B4GALT3介导成纤维细胞向CAFs的激活,进而激活β1-整合素-NF-κB途径,促进肝癌的肺转移[27]。此外,CAFs产生的外泌体miR-181d-5p促进EMT并对乳腺癌细胞凋亡有抑制作用[28],来源于CAFs的外泌体也被证明通过激活TGF-β信号通路增加肿瘤细胞对放疗的耐药性,促进结直肠癌细胞的干细胞性[29]。揭示了CAFs相关的外泌体在促进肿瘤进展和通过宿主器官EMT促进转移级联方面的独特功能。
2.4 外泌体与肿瘤血管生成
肿瘤的生长需要足够的氧气和营养来维持其微环境及转移。外泌体通过转运血管内皮生长因子(vascular endothelial growth factor, VEGF)、基质金属蛋白酶(matrix metalloproteinase, MMP)和microRNA等众多促血管生成生物分子参与癌症进展中的血管生成[30]。TDEs通过将胃癌细胞中的miR-130a或miR-155递送到人内皮细胞促进血管生成[31],TDEs可调节内皮细胞以刺激肿瘤血管生成。外泌体诱导的肿瘤细胞增殖导致氧气和营养供应不足,使肿瘤微环境缺氧,进一步驱动EMT的发展,缺氧促进外泌体分泌增加,低氧外泌体的多种功能促进了肿瘤进展和转移,与来自食管鳞状细胞癌的正常氧外泌体相比,低氧外泌体被证明在体外和体内都能增强血管生成[32]。除此之外,Hoshino等[33]发现外泌体在远处器官转移前生态位的形成中也发挥重要作用。
2.5 外泌体与免疫抑制和耐药
肿瘤细胞逃避免疫监视的能力已被认为是癌症转移的关键特征之一,并有助于产生耐药性。肿瘤细胞可以通过分泌外泌体抑制免疫细胞功能和增殖,包括CD4+、CD8+T细胞、自然杀伤细胞(natural killer, NK)和巨噬细胞等[34-35]。Zhao等[36]发现胰腺癌细胞的TDEs显著降低了两种主要的细胞因子TNF-α和IFN-γ以及NK细胞的产生,削弱了NK细胞对肿瘤干细胞的细胞毒性,而肿瘤干细胞可能是导致肿瘤转移和耐药的原因之一。来自高转移性乳腺癌细胞的外泌体直接抑制T细胞增殖并抑制NK细胞活性,进而抑制转移前器官的抗癌免疫反应。巨噬细胞是非特异性免疫反应的关键参与者,在HCC微环境中十分重要[37],肿瘤源性刺激作用于巨噬细胞,可以使其极化成经典(M1)或替代(M2)表型,M1巨噬细胞具有抗肿瘤活性,M2巨噬细胞具有促肿瘤活性,在HCC从早期向晚期发展过程中,肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)从M1型逐渐转变为M2型[38-39]。体外实验中,HCC来源的外泌体将长链非编码RNA TUC339转移至邻近巨噬细胞,调节M1/M2极化,抑制抗肿瘤免疫应答,TUC339还参与细胞因子和趋化因子受体信号通路,进一步影响肿瘤免疫抑制和耐药,加速HCC的进展,具体机制有待进一步阐明[40]。
靶向治疗在乳腺癌治疗中举足轻重,曲妥珠单抗是首个被批准用于治疗HER2+乳腺癌的单克隆HER2抗体,可显著提高患者的无病生存率,但大多数患者在治疗1年后就对HER2靶向药物产生耐药性。已有证据表明外泌体介导的抗体药物中和作用参与乳腺癌患者曲妥珠单抗耐药[41]。从SK-BR-3和BT-474乳腺癌细胞株分离的外泌体过表达HER2,可直接与曲妥珠单抗结合并在体外阻断其活性。
3 外泌体与恶性肿瘤诊断
外泌体携带各种类型的物质,包括突变的DNA片段、RNA和与各种表型相关的蛋白质,并提供关于个体肿瘤状态的大量信息,外泌体已经成为一种新的工具,用来随访癌症发展。自从外泌体miRNA-21首次被发现作为癌症诊断和预后的血清标志物以来,越来越多含有非编码RNA的外泌体被广泛研究,它们可以提供有效的诊断信息,并有助于监测癌症进展。血清外泌体miR-301a是一种候选癌基因[42],可作为神经胶质瘤的一种新的诊断和判断预后的生物标志物。
通过对大量血清样本的分析发现胰腺癌患者血清中外泌体glypican-1(GPC1)的水平明显高于健康人[43],这为外泌体监测早期胰腺癌提供了重要的依据,外泌体GPC1水平可能是一种极具价值的非侵袭性诊断和筛查工具。体内实验表明,从血浆中分离出的循环外泌体DNA可用于鉴定亲代肿瘤细胞的突变[44],进而提供癌症特异性突变信息。在非小细胞肺癌(non-small cell lung cancer, NSCLC)的诊断中,EGFRT790M突变是一个关键的生物标志物[45]。此外,血浆外泌体中携带的MiR-451a是一种新型的生物标志物,可用于预测NSCLC患者根治性切除术后的复发和预后[46]。
4 外泌体作为药物载体参与治疗
外泌体作为一种内源性、膜透性的载体,可将核酸和蛋白质等活性大分子转移到受体细胞内进行细胞间信息交换[47]。外泌体可以直接接触靶细胞胞膜并融合释放内容物或通过内吞作用被靶细胞摄取,还可以通过识别细胞表面受体传递信息。一旦外泌体进入受体细胞,它们的内容物就被释放出来,其中的成分可以驱动各种生物过程的变化,包括基因表达、免疫反应和信号转导[48]。
临床实践中,为了提高肿瘤治疗的有效性,迫切需要将药物精确地递送到肿瘤细胞,与其他材料相比,外泌体可被细胞吸收,并能稳定地转运药物,可以克服生物利用度差的缺点,降低非靶向细胞毒性和免疫原性,故外泌体具有作为肿瘤免疫治疗药物和疫苗载体的优势[49]。Naseri等[50]利用从骨髓间充质干细胞中分离出来的外泌体运载LNA(锁定核酸)修饰的抗miR-142-3p寡核苷酸,抑制4T1和TUBO乳腺癌细胞系中miR-1423p和miR-150的表达水平,减少肿瘤细胞增殖,并证实这种外泌体是合适的纳米级载药载体,能将寡核苷酸导入肿瘤组织以发挥作用。Aqil等[51]证实与游离姜黄素相比,口服外泌体姜黄素增强了抗增殖、抗炎和抗肿瘤的活性。一些多肽、非编码RNA或化疗药物可以通过不同的途径加入外泌体中,以发挥更好的抗肿瘤作用,这使外泌体成为增强抗肿瘤治疗和逆转耐药性的有效载体。
化学治疗是肿瘤治疗的基石,利用外泌体运载化疗药物开始应用在癌症治疗中。对于阿霉素与外泌体的结合研究较多,含阿霉素的外泌体被用于多种癌症的治疗,包括乳腺癌、肺癌、结肠癌和胰腺癌[52]。在结肠癌小鼠模型中,阿霉素负载的外泌体可使肿瘤体积减小,在小鼠炎性肿瘤模型中,含有阿霉素的外泌体具有有效的抗肿瘤作用。同时,负载阿霉素的外泌体在治疗乳腺癌方面也表现出很好的效果。
随着研究的不断深入,可以充分利用外泌体作为自然载体的优势,外泌体相关的癌症治疗将会取得巨大突破,使广大癌症患者受益。
5 展 望
外泌体具有高度异质性,包含与细胞起源相关的分子标记物,从癌症患者体液中分离出来的外泌体已被证明含有癌症特异性物质,可以反映细胞或组织状态的改变,可作为实时监测肿瘤负荷和治疗效果的生物标志物。同时,外泌体已被证明在肿瘤的起始和进展过程中发挥重要作用,尽管这些过程错综复杂,但随着外泌体等新介质及其作用的阐明,人们对肿瘤发生发展的理解将更加透彻。
外泌体参与许多病理生理过程并能稳定地转运药物,克服了生物利用度差的缺点,降低非靶向细胞毒性和免疫原性,故外泌体具有作为肿瘤免疫治疗药物和疫苗载体的优势。近年来,将功能性蛋白质、miRNA和各种化疗药物等加入外泌体中用于治疗肿瘤的研究受到了推动,但目前以外泌体为基础的癌症治疗策略仍有很长的路要走。了解TDEs在促进肿瘤生长、侵袭、血管生成、EMT和耐药性中发挥的作用为更好的认识癌症开辟了新思路,为减缓癌症进展和转移提供了治疗手段,同时应运而生的新疗法为肿瘤患者带来了新的希望,相信随着科学的发展,外泌体会在临床疾病尤其是恶性肿瘤的诊疗中得到更加广泛的应用。
