子宫内膜癌患者BRCA1和GPER的表达及其与预后的关系
2022-11-07吴乾渝
赵 婧, 李 倩, 吴乾渝
(1. 同济大学附属第一妇婴保健院妇科,上海 201204; 2. 同济大学附属东方医院妇科,上海 200120)
子宫内膜癌(endometrial carcinoma, EC)为妇科常见三大恶性肿瘤之一,2020年国际癌症研究机构发布的报道,EC在全球185个国家新发病例达417 367例,仅次于宫颈癌[1]。目前有关EC的具体发病机制尚不明确。遗传性乳腺癌-卵巢癌综合征(hereditary breast and ovarian cancer, HBOC)与乳腺癌易感基因(breast cancer susceptibility gene, BRCA)的突变密切相关,然而近年来研究发现BRCA1基因突变者发生EC的风险同样增加,尤其是侵袭性的浆液性EC的风险最高[2-4]。目前认为对BRCA基因突变的患者,尤其是在使用他莫西芬治疗的患者行子宫切除术可以预防EC[5-6]。G蛋白偶联受体(G protein-coupled estrogen receptor, GPER)或G蛋白偶联受体30(G-protein-coupled receptor 30, GPR30),被认为是与经典核受体不同的一种新型雌激素受体,GPER可与雌激素及其相关化合物直接结合,介导快速的非基因组效应,同时激活细胞内多条信号传导通路: ERK、PI3K/Akt、cAMP/PKA,从而促进肿瘤发生发展[1,7]。与传统ER不同,GPER可以独立发挥作用,并负责快速激活雌激素非基因组效应,研究提示它莫西芬可作为GPER的激动剂,直接与其结合发挥其在子宫内膜病变中的促生长作用[8]。BRCA基因参与DNA双链断裂的修复、调节细胞生长及凋亡,有研究报道BRCA1突变提示EC风险增加[9]。Beiner等[10]报道了BRCA携带者EC风险增加的主要原因是他莫昔芬的使用。选择性雌激素受体调节剂他莫昔芬作为GPER的配体具有直接激动GPER的活性。GPER在接受他莫西芬治疗的患者中表达更高[11]。在子宫内膜癌细胞系中,他莫昔芬可以通过GPER来促进细胞迁移[12]。本团队通过前期生信研究发现BRCA1和GPER可能通过MAPK、DDIT、EGF信号通路发生交互作用。并利用TCGA数据库发现BRCA1和GPER在癌与癌旁组织中的mRNA表达量有显著差异。雌激素在免疫系统的调节中发挥着重要作用,但关于GPER激活在癌症环境中的调节作用的信息很少。因此本研究团队推测BRCA1基因突变缺失可能通过相关信号通路导致GPER活化,从而发挥其雌激素快速非基因组效应,导致EC发生发展。本研究将通过探讨BRCA1、GPER在EC中的表达水平及预后分析为探讨EC发病机制提供新的理论依据,为EC临床诊断、治疗、手术方式选择、判断预后提供新参考。
1 资料与方法
1.1 组织样本资料

1.2 标本采集与处理
1.2.1 免疫组化 取约2 cm×1 cm×1 cm的组织,制成石蜡包埋组织。切片,脱蜡,抗原修复,3%的H2O2蒸馏水溶液,一抗(GPR30抗体: abcam型号39742;BRCA1抗体: abcam型号16780)按1∶100稀释,4 ℃过夜孵育,第2天PBS浸洗,再滴加二抗(HRP 1∶100),孵育30 min(37 ℃)。磷酸盐缓冲液(PBS)浸洗。DAB显色,镜下观察,抗体标记的阳性部位准确终止显色。
1.2.2 免疫荧光 取约2 cm×1 cm×1 cm的组织,制成石蜡包埋组织。切片、烤片、二甲苯溶蜡,乙醇梯度水化。每片加入100 μL混合一抗(用BSA对抗体1∶100稀释,GPER抗体与BRCA1抗体稀释在一起,GPER抗体需与BRCA1抗体抗性不同)。次日PBS浸洗,兔抗和s鼠抗两种荧光二抗(abcam型号150077;abcam型号150115)按1∶200用BSA进行稀释(两种抗体混合在一起),每片加入100 μL混合二抗,室温孵育1 h。PBS浸洗,DAPI染核。

1.3 统计学处理
采用SPSS 27.0软件进行统计学分析。BRCA1、GPER表达与EC病理类型、FIGO分期、组织分化、肌层浸润深度、淋巴结转移的表达差异采用χ2检验分析。BRCA1、GPER与不同病理种类子宫内膜癌的相关性分析使用多元Logistic回归分析。预后影响因素分析使用COX回归分析,P<0.05为差异有统计学意义。
2 结 果
2.1 BRCA1与EC临床病理参数统计结果
采用IHC方法检测了35例子宫内膜癌组织中BRCA1蛋白的表达情况,如图1所述,BRCA1在细胞质、细胞核内均有表达,阳性率51.43%。随后进一步分析了35例EC组织BRCA1阳性表达与EC患者临床病例参数的相关性,发现EC患者BRCA1阳性表达在病理类型、组织分化、肌层浸润3个方面病理特征差异有统计学意义(P<0.05)。在年龄、FIGO分期、淋巴转移、预后这4项病理指标差异均无统计学意义(P>0.05),见表1。
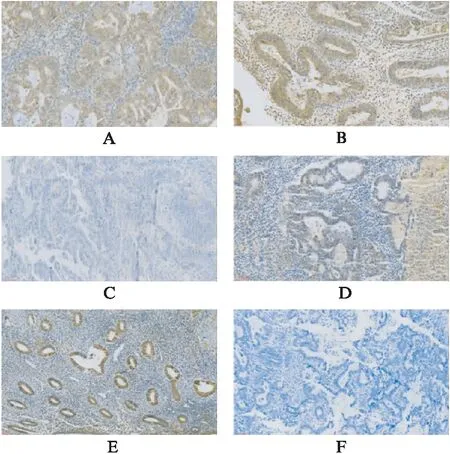
图1 不同病理类型子宫内膜癌BRCA1蛋白表达情况Fig.1 Expression of BRCA1 protein in endometrial carcinoma with different pathological typesA、B: 子宫内膜样癌;C: 子宫内膜浆液性癌;D: 子宫内膜透明细胞癌;E: 正常子宫内膜;F: 阴性对照;标尺: 60 μm
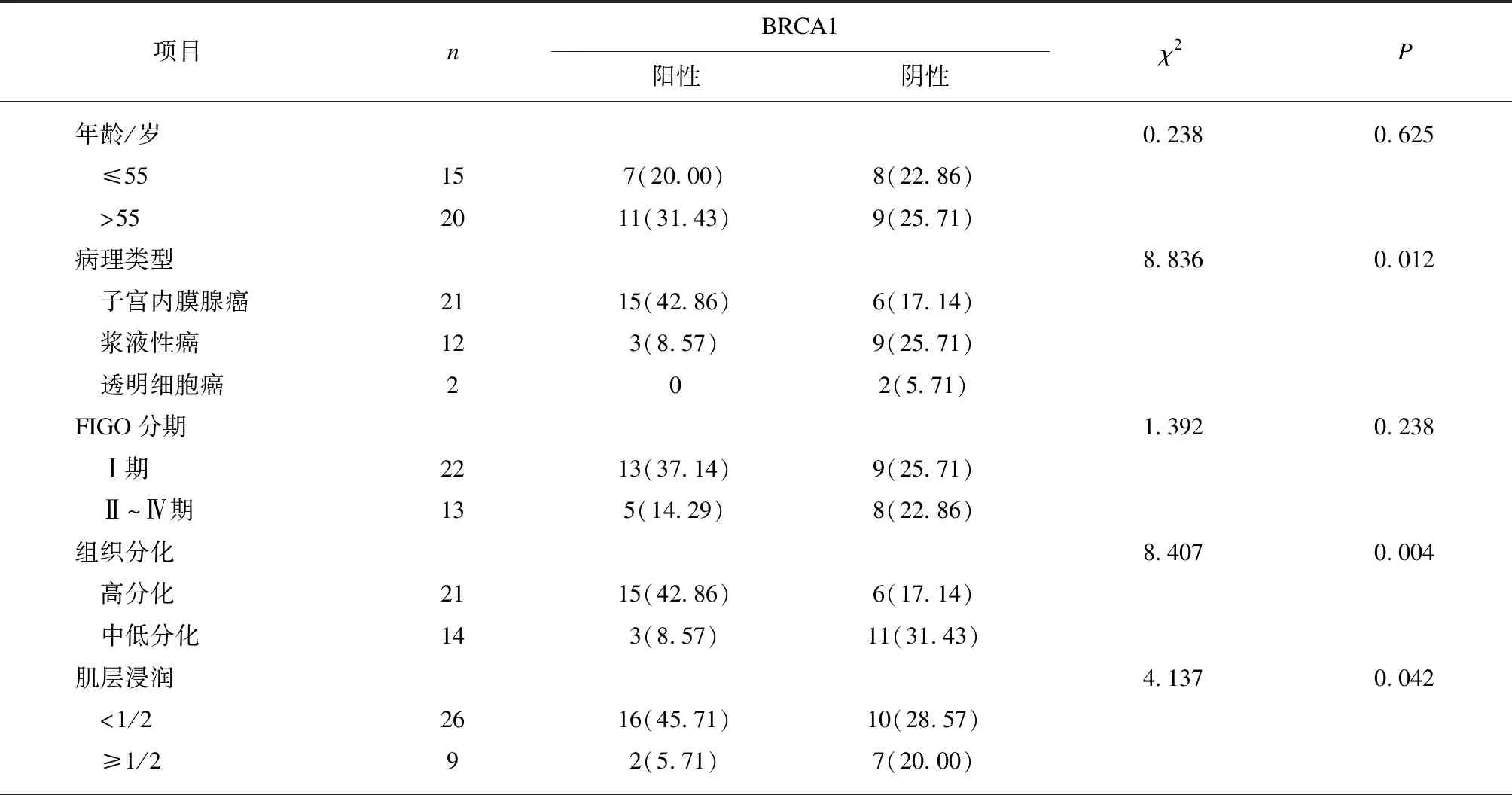
表1 子宫内膜癌患者不同临床病理特征BRCA1蛋白表达情况
续表
2.2 GPER与EC临床病理参数统计结果
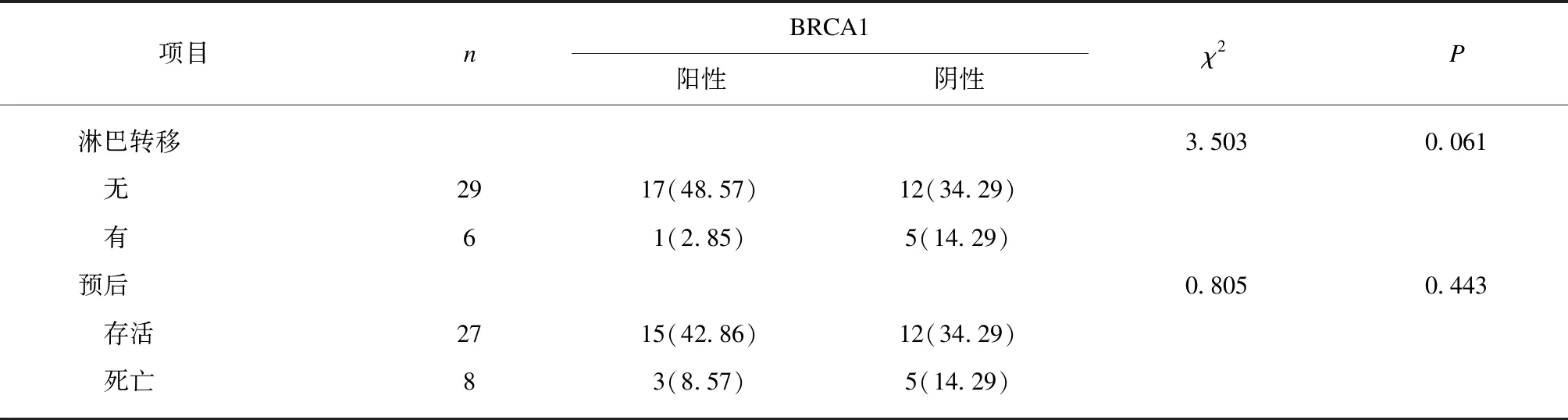
采用同样的方法检测了35例子宫内膜癌组织中GPER蛋白的表达情况,如图2所述,GPER主要表达于细胞膜、细胞质内,少数在细胞核内表达,阳性率71.43%。随后进一步分析了35例EC组织GPER阳性表达与EC患者临床病例参数的相关性,EC患者GPER阳性表达在不同FIGO分期、预后差异有统计学意义(P<0.05),在年龄、病理类型、组织分化、肌层浸润、淋巴转移病理特征差异均无统计学意义(P>0.05),见表2。
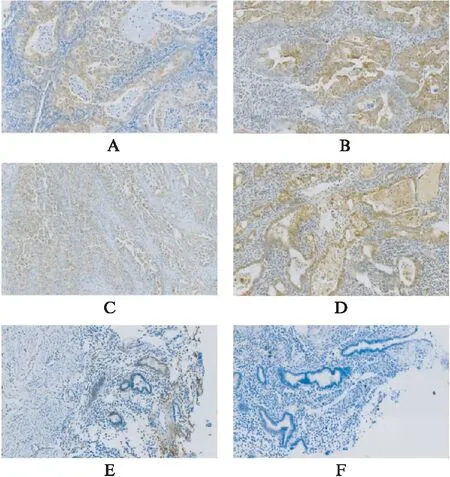
图2 不同病理类型子宫内膜癌GPER蛋白表达情况Fig.2 Expression of GPER protein in different pathological types of endometrial carcinomaA、B: 子宫内膜样癌;C: 子宫内膜浆液性癌;D: 子宫内膜透明细胞癌;E: 正常子宫内膜;F: 阴性对照;标尺: 60 μm
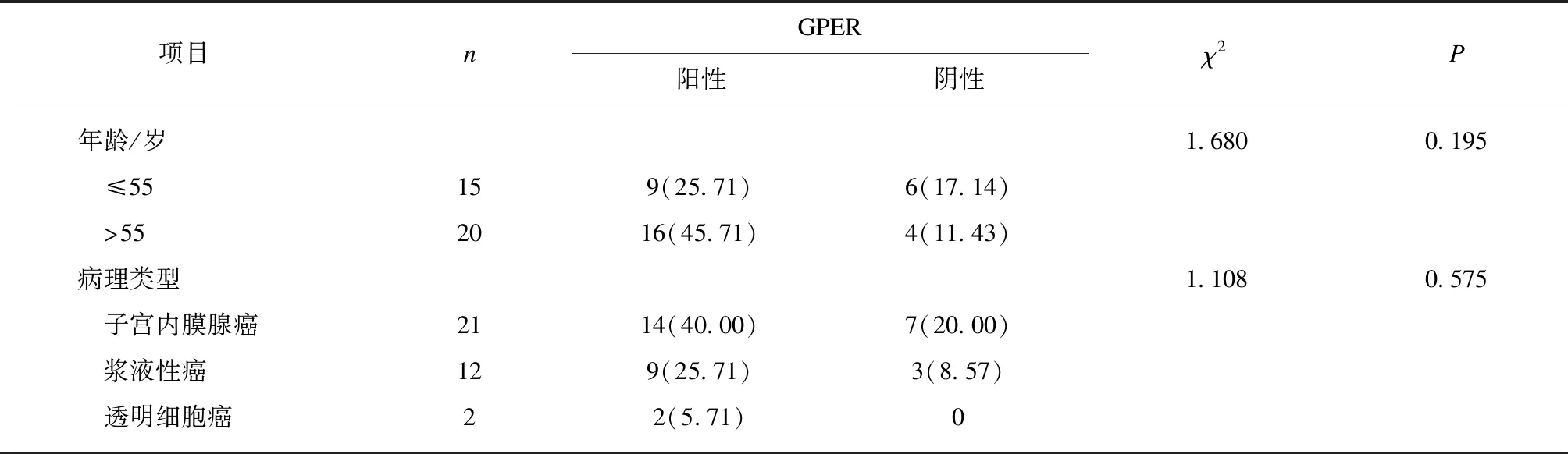
表2 子宫内膜癌患者不同临床病理特征GPER蛋白表达情况
续表
2.3 EC组织中BRCA1、GPER表达结果
EC组织中BRCA1与GPER表达关系使用χ2检验,差异有统计学意义(P<0.05)。BRCA1、GPER二者在子宫内膜腺癌中的表达呈负相关(P<0.05),见图3。在子宫内膜浆液性癌及透明细胞癌中差异均无统计学意义(P>0.05)。
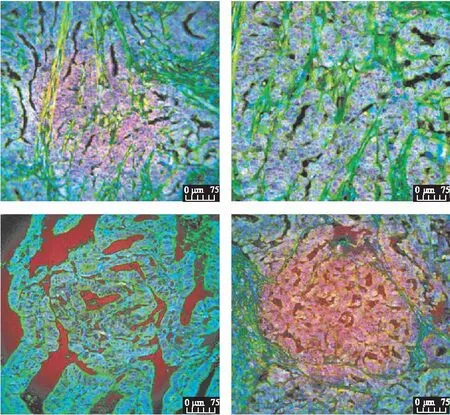
图3 子宫内膜腺癌中BRCA1、GPER的表达情况Fig.3 Co-expression of BRCA1 and GPER in endometrial adenocarcinoma放大倍数200;使用DAPI标记细胞核,荧光二抗(红光)标记BRCA1,荧光二抗(绿光)标记GPER;标尺: 75 μm
2.4 EC预后影响因素分析
最后分析了BRCA1和GPER与EC患者预后的相关性。采用单因素Cox回归分析显示,年龄、病理类型、组织分化、FIGO分期、GPER的表达均为可能影响EC总体生存的危险因素(P<0.05)。将这些危险因素进一步纳入多因素Cox回归风险模型,结果显示,年龄、FIGO分期、GPER的表达为EC患者预后的独立因素(P<0.05),见表3。GPER阴性患者具有更高的死亡风险(P<0.05),见图4。BRCA1的表达与患者预后差异无统计学意义(P>0.05),见图5。
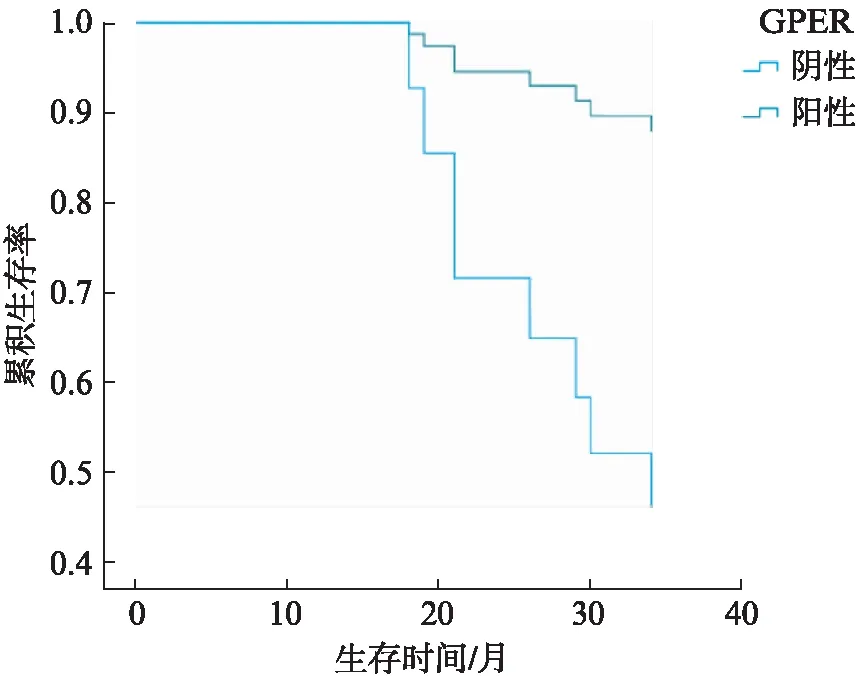
图4 GPER表达的不同与患者生存曲线的比较Fig.4 Survival curves of EC patients with positive and negative GPER expression
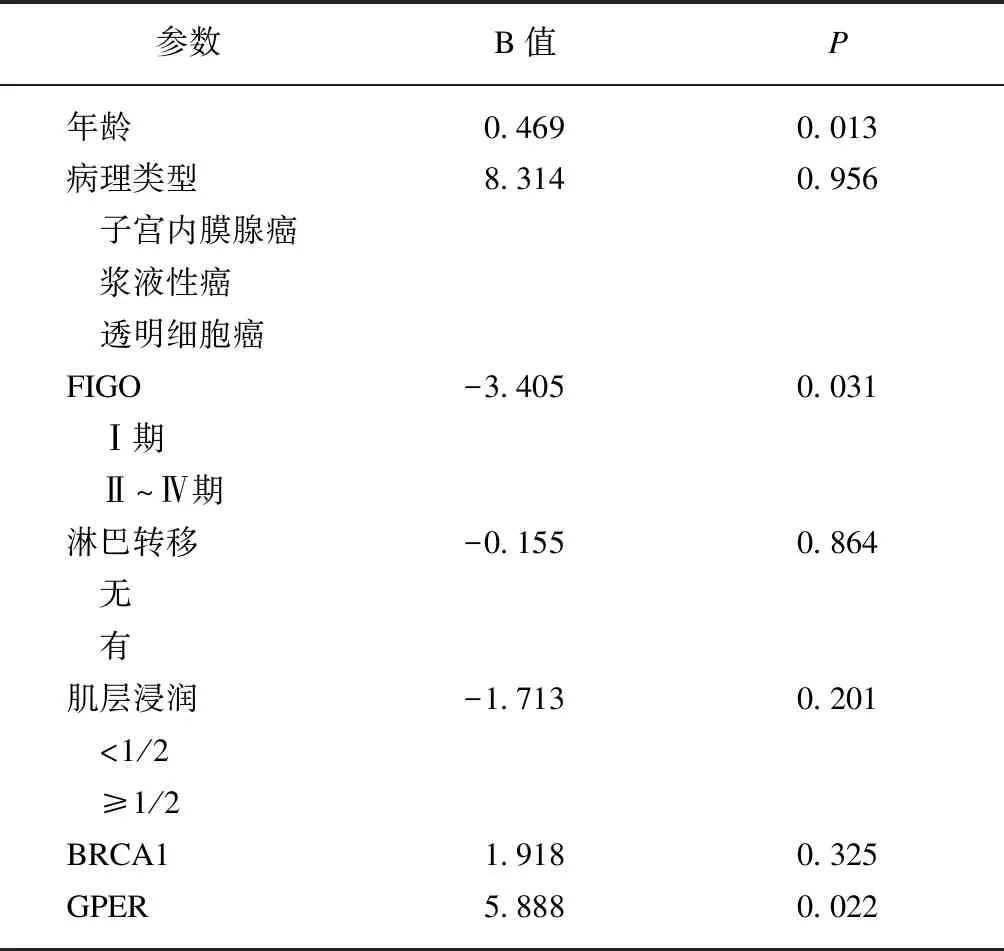
表3 预后影响因素分析
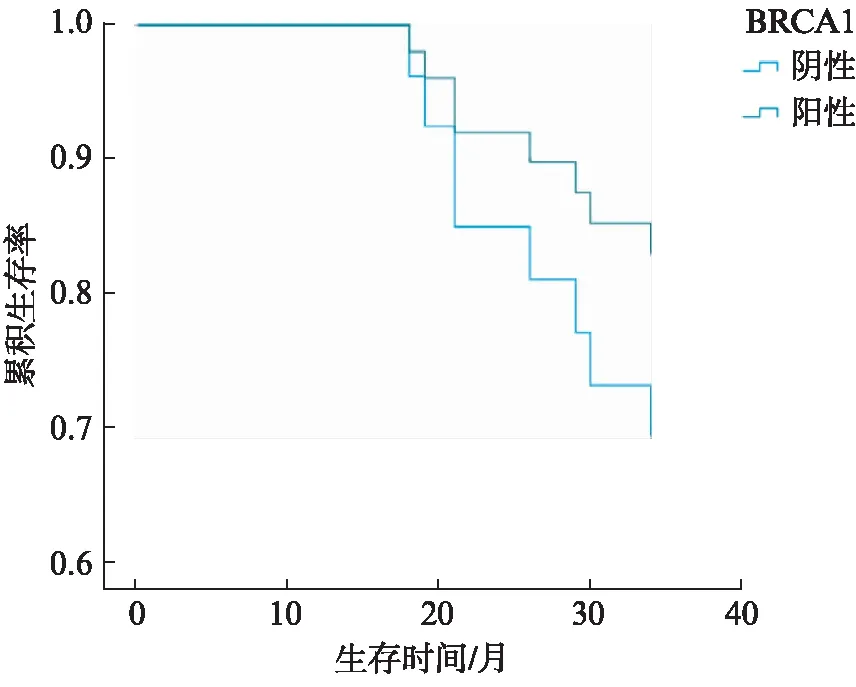
图5 BRCA1表达的不同与患者生存曲线的比较Fig.5 Survival curves of EC patients with positive and negative BRCA1 expression
3 讨 论
目前我国每年新发EC病例约5万例。近年来分子生物学的研究认为EC的发生可能与癌基因、抑癌基因的异常表达有关[13]。目前现有的治疗手段仍不能使子宫内膜癌患者的预后达到理想状态[14]。因此研究EC发生发展的分子机制,可为EC临床诊断、治疗、改善患者预后提供重要理论参考。

超重、肥胖、家族史、糖尿病、不孕和种族是EC发生的主要危险因素,持续暴露于内源性或外源性雌激素刺激,被认为是约90%病例的原因。GPER能与雌激素快速结合并激活非基因组效应[25]。研究认为GPER与肥胖、免疫抑制、代谢综合征发展和组织内雌激素合成的关键事件有关,为雌激素诱导的癌变提供了另一种观点: GPER的功能不依赖于ER的存在,因此可能单独促进雌激素诱导的癌变[26]。在乳腺癌和卵巢癌中,GPER的表达与转移、肿瘤大小有关[27],Yu等[28]研究发现GPER在乳腺癌中的表达量显著升高。相反的也有报道GPER在早期卵巢癌及低度恶性卵巢癌组织标本中表达,并且在随着疾病进展出现GPER表达的下降,与无病生存密切相关[29]。最新研究报道GPER在细胞不同部位的表达与患者预后相关[30]。
在本研究中,BRCA1的表达在EC病理类型、组织分化、肌层浸润方面差异有统计学意义(P<0.05),BRCA1的表达与预后、FIGO分期、淋巴转移、年龄无相关性(P>0.05)。对于BRCA突变的卵巢癌和转移性乳腺癌患者,PARP抑制剂正在成为标准治疗的一部分,其疗效明显[31]。免疫治疗能否联合靶向用于子宫内膜癌的一线治疗值得期待。对于BRCA突变患者是否同时行子宫切除建议进行仔细全面的风险、效益评估,子宫切除术的决定应根据患者的年龄、BMI、乳腺癌史和手术风险等因素进行个性化定制。此外子宫切除术的心理影响和轻微增加的EC风险也应考虑在内。术前与患者就子宫切除术的所有因素、优势和风险进行彻底的讨论是必要的[32]。GPER的表达与FIGO分期、预后有关(P<0.05),与患者年龄、病理类型、组织分化、肌层浸润、淋巴转移无相关性(P>0.05)。COX回归分析显示FIGO分期、年龄、GPER表达情况是EC预后独立危险因素。GPER被发现在细胞内的不同位置表达,虽然GPER属于膜受体家族,但GPER在胞膜和细胞内均可检测到,这可能与GPER的内吞作用有关,即GPER在细胞膜和细胞内存在一个重新分部过程[12],该过程被认为可以调节肿瘤进展,在骨肉瘤细胞中GPER不同的亚细胞定位发挥不同的生物学作用[33]。GPER在细胞核的表达提示较差的总生存期和较差的5年无进展生存期[30]。而且疾病的进程也会影响GPER的表达,疾病状态可能会调整该受体表达水平[12]。GPER的小鼠敲除模型显示,GPER的过表达及其在质膜中的位置是乳腺癌进展的重要事件[34],而在他莫西芬治疗的ERα阳性的乳腺癌患者中,质膜中GPER的缺失的患者具有良好的长期预后[35]。同样在本研究中GPER基因表达水平较低的患者预后情况较差,说明GPER可以作为判断EC预后的分子标志物。本研究中GPER与BRCA1在EC中表达差异有统计学意义(P<0.05)。尤其在子宫内膜腺癌中BRCA1、GPER相关性明显(P<0.05)。推测GPER与BRCA1在EC发生发展中可能存在相互作用,GPER和BRCA1之间信号通路的研究是下一步的研究方向。
综上,BRCA1、GPER与EC病理特征密切相关,联合二者检测对于对BRCA基因突变相关HBOC综合征高危人群的筛查、治疗、判断预后及随访有指导意义,同时PARP免疫治疗能否靶向用于BRCA基因突变EC患者的一线治疗值得期待。GPER作为一种新型雌激素受体与EC患者预后相关,可为治疗靶点提供新参考。
