长链非编码RNA CCAT2在不同亚型乳腺癌的表达特征及亚结构分布
2022-11-07谢荷樱俞作仁
谢荷樱, 王 陶, 赵 倩, 俞作仁,
(1. 锦州医科大学上海东方临床医学院,上海 200120; 2. 同济大学附属东方医院转化医学研究中心,上海 200120)
乳腺癌是威胁全球生命健康最严重的恶性肿瘤之一。据2020年世界卫生组织国际癌症研究机构(International Agency for Research on Cancer, IARC)的统计学数据,女性乳腺癌已超过肺癌成为发病率最高的恶性肿瘤[1]。乳腺癌具有明显异质性[2],在临床病理上分为Luminal A、Luminal B、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)过表达和基底样4种亚型[3]。不同亚型乳腺癌,其临床表现、治疗手段和预后各不相同,且手术是现阶段最主要的治疗方式[4]。Luminal型乳腺癌具有激素受体,内分泌治疗有效,且预后良好[3,5];HER2过表达亚型主要以抗HER2靶向治疗为主[6-7];基底样亚型通常缺乏雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)及HER2,大多数归属三阴性乳腺癌,对激素治疗不敏感,临床以化疗为主,但恶性程度高,转移性强,预后不良[8-9]。
非编码RNA是一类不编码功能性蛋白,但其是一种参与基因表达调控等多种功能的RNA[10-11]。根据RNA链长度分为微小非编码RNA(small non-coding RNA, small mRNA)和长链非编码RNA(long non-coding RNA, lncRNA)[10]。microRNA是研究较多的一类短链非编码RNA,可使靶mRNA降解或抑制其翻译[12-13]。LncRNAs则数量多、保守性差、细胞亚结构分布不同、生物学功能复杂[14-16]。细胞核lncRNA主要调节基因转录、染色质修饰和细胞核结构[16-17]。细胞质lncRNA主要负责基因转录后调控、RNA互作、细胞器功能及代谢调控等[11,18-19]。LncRNAs在肿瘤的发生和进展中发挥重要作用,参与细胞增殖、分化、凋亡、侵袭、迁移和转移等各个环节[20-21]。
前期研究工作通过高通量筛选发现lncRNA结直肠癌相关转录本2(colon cancer-associated transcript 2, CCAT2)在乳腺癌细胞表达异常,呈现乳腺癌亚型依赖性的表达特征,在三阴型乳腺癌表达高且发挥促癌功能[22]。本研究通过TCGA数据库及乳腺癌细胞的基因表达分析,发现CCAT2在Luminal型乳腺癌异常低表达,且显著低于三阴性乳腺癌(P<0.01)。其表达水平与患者生存率及预后密切相关。进一步分析发现,CCAT2在Luminal型及三阴性乳腺癌的细胞亚结构分布不同,提示其亚型依赖性的功能与表达水平及亚结构分布有关。
1 材料与方法
1.1 细胞和培养
人乳腺癌细胞系MDA-MB-231、MCF-7、T-47D、SUM159和Hs578T细胞源自美国模式培养物集存库ATCC(American Type Culture Colle-ction),长期在同济大学附属东方医院转化医学研究中心留种及培养。培养基为达尔伯克(氏)改良伊格尔(氏)培养基(Dulbecco’s modified Eagle’s medium, DMEM)、100 U/mL青霉素和100 μg/mL链霉素、10%胎牛血清(fetal bovine serum, FBS);培养条件为37 ℃、5%CO2的培养箱。
1.2 RNA提取及反转录聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR)
利用TRIzol试剂[赛默飞世尔科技(中国)有限公司]提取细胞RNA。利用HiScript®Ⅲ RT SuperMix反转录试剂盒(南京诺唯赞生物科技股份有限公司)进行RNA反转录反应。利用SYBR Green Master Mix[赛默飞世尔科技(中国)有限公司]和Applied Biosystems QuantStudio 6[赛默飞世尔科技(中国)有限公司]进行荧光定量PCR反应。GAPDH作为内参基因。基因扩增引物如下。CCAT2,F: 5′-CCGA-GGTGATCAGGTGGACTTTC-3′;R: 5′-GTCTTCTG-GGCTGATGTTGC-3′。GAPDH,F: 5′-TGCACCAC-CAACTGCTTAGC-3′;R: 5′-GGCATGGACTGTGG-TCATGAG-3′。
1.3 细胞核质分离
将收集好的细胞沉淀用磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤一次,加入200 μL缓冲液A(10 mmol/L HEPES, pH=7.9,10 mmol/L KCl, 0.1 mmol/L EDTA, 0.1 mmol/L EGTA, 1 mmol/L DTT, 0.15% NP40,1%蛋白酶抑制剂),剧烈振荡后冰上孵育15 min,离心(离心半径7.69 cm, 13 000 r/min,5 min)后取上清液,主要为细胞质成分;剩下的细胞沉淀继续缓冲液A洗涤2次,PBS洗涤3次,每次轻吹起沉淀。之后加缓冲液B(20 mmol/L HEPES, pH=7.9,400 mmol/L NaCl,1 mmol/L EDTA,1 mmol/L EGTA,1 mmol/L DTT,0.5% NP40,1%蛋白酶抑制剂)剧烈振荡后冰上孵育15 min后离心(离心半径7.69 cm, 13 000 r/min,5 min),底部沉淀主要为细胞核成分。
1.4 蛋白免疫印迹反应
50 μg细胞裂解物利用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS/PAGE)分离蛋白质。一抗(1∶2 000稀释)包括甘油醛-3-磷酸脱氢酶[glyceraldehyde-3-phosphate dehydrogenase, GAPDH,sc-47724,圣克鲁斯生物科技(上海)有限公司],组蛋白H3[ab1791,翌圣生物科技(上海)有限公司]。二抗(1∶ 3 000稀释)为辣根过氧化物酶标记抗兔IgG[7074S,赛信通(上海)生物试剂有限公司]和辣根过氧化物酶标记抗小鼠IgG[7076S,赛信通(上海)生物试剂有限公司]。
1.5 原位杂交
利用In situ原位杂交试剂盒(上海吉玛制药技术有限公司),按照说明书步骤,细胞接种在48孔板内爬片,密度为70%时依次完成加100 μL 4%多聚甲醛固定,缓冲液A通透细胞,100 μL封闭液封闭细胞等步骤后,利用100 μL探针混合液,杂交过夜,依次使用0.1%缓冲液F、2×缓冲液C、PBS洗涤,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)工作液染核。最后加抗淬灭剂后,在荧光显微镜下观察。18S rRNA探针: 5′-CTGCCTTCCTTGG-ATGTGGTAGCCGTTTC-3′;CCAT2探针: 5′-T+TA-CCTGGGCAGT+TGAG-AAACGAGA+ATCA+TT-TGGACGACGCCT+TCATT+TCCT+TGCTGGG+TTCCTGCCCTT+TG-3′,均由吉玛公司合成及纯化。
1.6 统计学处理
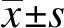
2 结 果
2.1 CCAT2在不同亚型乳腺癌的临床相关性分析
利用Kaplan-Meier Plotter数据库,对Luminal型及三阴性乳腺癌CCAT2表达及其与临床总生存率的相关性开展了研究。如图1所示,在Luminal型亚型的乳腺癌,患者总生存率与CCAT2表达水平呈显著性正相关(图1A);而在三阴性乳腺癌,患者总生存率与CCAT2表达水平呈负正相关(图1B)。这些结果提示,CCAT2在Luminal型乳腺癌可能发挥抑癌效应,有助于患者康复。而在三阴型乳腺癌发挥促癌作用,其表达不利于患者预后。这和本团队前期发表的工作一致[22],CCAT2在三阴性乳腺癌促进肿瘤细胞干性及远处转移。
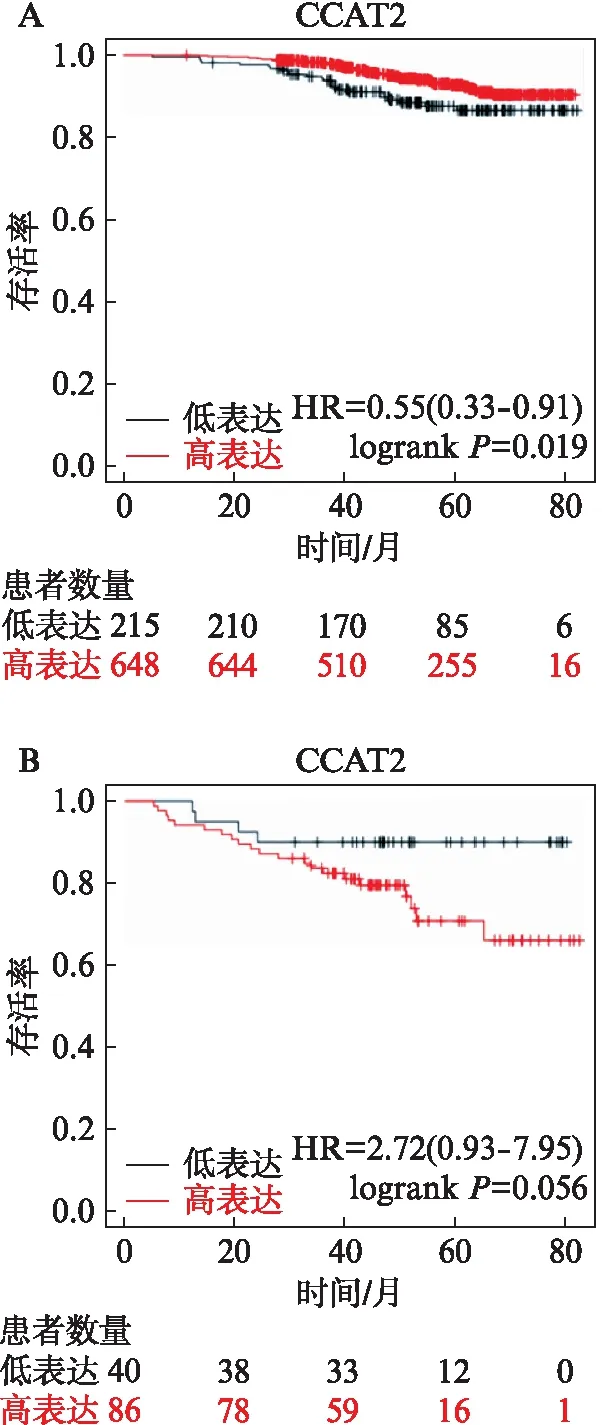
图1 Luminal型乳腺癌和三阴性乳腺癌中CCAT2表达水平与总生存率之间的相关性Fig.1 Correlation between the expression levels of CCAT2 and overall survival in Luminal and triple negative subtypes of breast cancerA: Luminal型乳腺癌;B: 三阴性乳腺癌
2.2 CCAT2在不同亚型乳腺癌的表达特征分析
为了进一步明确CCAT2在不同亚型乳腺癌的表达特征,本研究团队体外培养了Luminal型乳腺癌细胞MCF-7、T-47D以及三阴性乳腺癌细胞Hs578T和SUM159,制备RNA,通过RT-PCR检测了CCAT2的表达。如图2A所示,CCAT2在Luminal型乳腺癌细胞MCF-7和T47D的表达水平显著低于其在三阴型乳腺癌细胞Hs578T和SUM159的表达。进一步分析了TCGA数据库808例Luminal型乳腺癌、114例三阴型乳腺癌、36例HER2阳性(HER2+)乳腺癌患者及96例正常对照,如图2B所示,CCAT2在Luminal型及HER2+乳腺癌组织的表达显著低于正常组织(P<0.05),进一步提示CCAT2在ER+乳腺癌的抑癌功能。
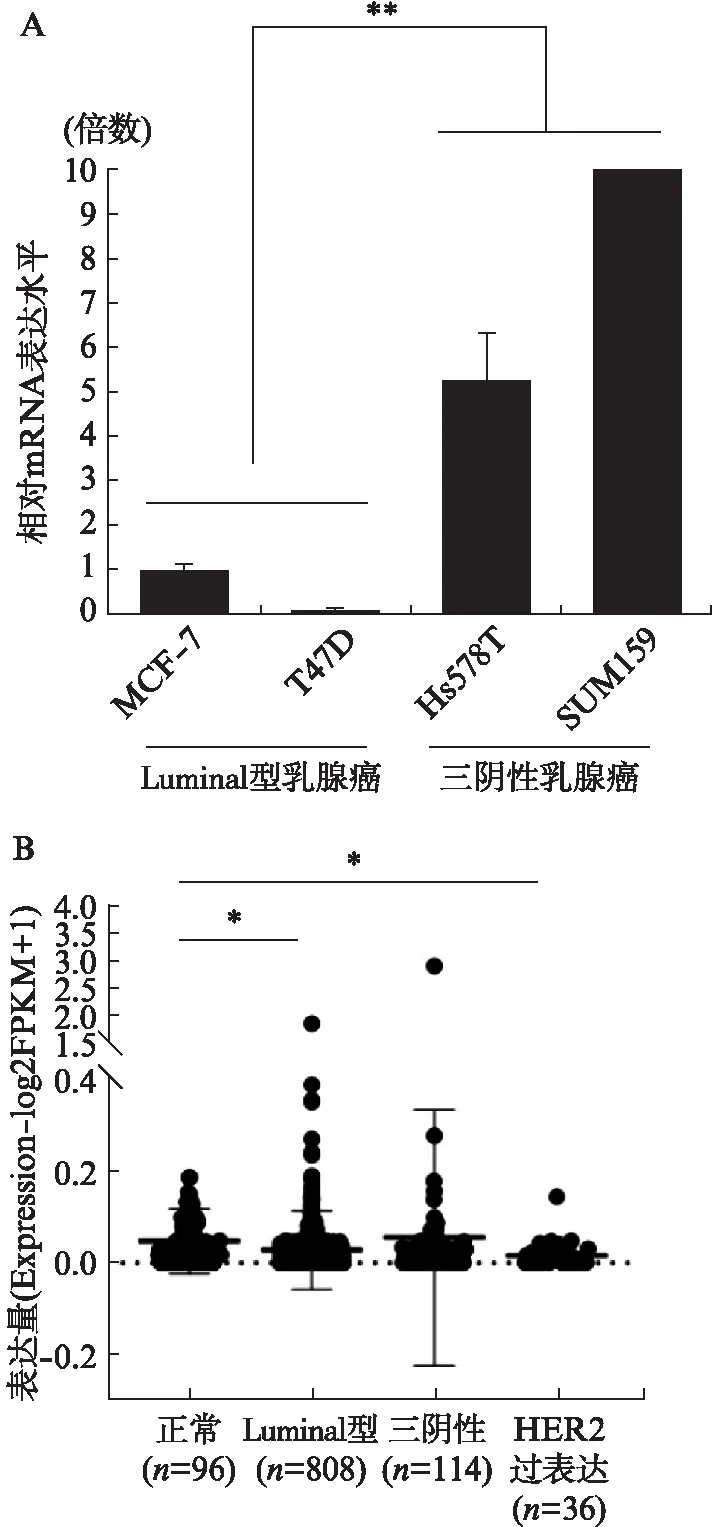
图2 CCAT2在不同亚型乳腺癌细胞株及临床患者的表达特征分析Fig.2 Expression of CCAT2 in different subtypes of breast cancer cell lines and patientsA: CCAT2在Luminal型乳腺癌和三阴性乳腺癌细胞中的表达水平;B: CCAT2 在Luminal型、三阴性、HER2过表达型乳腺癌临床患者的表达水平;*P<0.05,**P<0.01
2.3 CCAT2在不同亚型乳腺癌的细胞亚结构分布分析


图3 CCAT2在不同亚型乳腺癌细胞株细胞核和细胞质的表达分布Fig.3 The distribution of CCAT2 in nucleus and cytoplasm of MDA-MB-231, MCF-7 and T47D cellsA: 蛋白印迹法验证质核分离后标签蛋白的表达;B: CCAT2在MDA-MB-231细胞核与细胞质中的表达分布;C: CCAT2在MCF-7细胞核与细胞质中的表达分布;D: CCAT2在T47D细胞质与细胞核的表达分布
为进一步验证上述CCAT2质核分布的研究结果,本研究团队合成了CCAT2原位杂交探针,分别在Luminal型乳腺癌细胞MCF-7和三阴性乳腺癌细胞MDA-MB-231开展了免疫荧光定位分析。以18S rRNA作为阳性对照(图4A)。结果显示,CCAT2在MCF-7细胞的细胞质与细胞核均有分布(图4B),但在MDA-MB-231细胞中,CCAT2集中分布在细胞核(图4C)。CCAT2在MCF-7细胞质的荧光强度显著高于其在MDA-MB-231细胞质的荧光强度,支撑了上述质核分离的研究结果。
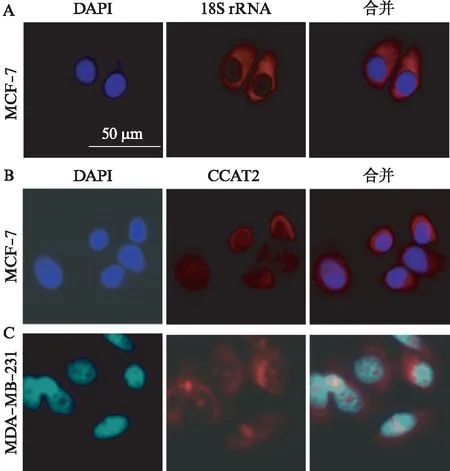
图4 原位杂交实验显示CCAT2在Luminal型乳腺癌MCF-7细胞及三阴性MDA-MB-231细胞的不同定位分布Fig.4 FISH showed the localization of CCAT2 in MCF-7 and MDA-MB-231 cells, 18S rRNA was used for the positive control of cytoplasmA: 18S rRNA作为细胞质分布的阳性对照;B: CCAT2在MCF-7细胞中的荧光定位;C: CCAT2在MDA-MB-231细胞中的荧光定位
3 讨 论
非编码基因曾被认为是基因转录的副产品,是“垃圾基因”[23]。但21世纪以来研究表明非编码基因具有重要调控功能。尤其人类基因组计划的完成,揭示了人细胞基因组97%以上序列属于非编码基因。在肿瘤发生发展中,非编码基因包括lncRNA发挥重要的调控作用,包括对肿瘤干细胞及肿瘤微环境的调节[24-25]。比如lncRNA结直肠肿瘤差别表达基因(colorectal neoplasia differentially expressed, CRNDE)在结直肠癌、乳腺癌、肝癌及白血病患者均异常高表达,调控肿瘤干细胞,患者预后不良[26]。本团队前期发表的工作发现lncRNA CCAT2在三阴性乳腺癌细胞高表达后,促进肿瘤发生及发展。但CCAT2在Luminal型乳腺癌的表达特征及功能尚未见研究报道。
LncRNA功能与其在细胞的亚分布密切相关[27]。Zhang等[28]发现,LINC00641主要分布在宫颈癌细胞的细胞质中,抑制细胞增殖、侵袭和迁移,并抑制上皮细胞-间充质转化(epithelial-mesen-chymal transition, EMT)。其他研究发现人肺腺癌转移相关转录本1(metastasis associated lung adeno-carcinoma transcript 1, MALAT1)主要定位在胃癌细胞的细胞核,促进癌细胞增殖及肿瘤[29-31]。本研究发现在乳腺癌细胞中,CCAT2主要分布在细胞核,少量分布在细胞质。但在不同亚型乳腺癌中,CCAT2在Luminal型乳腺癌细胞质的比例(25%)显著高于其在三阴性乳腺癌细胞质的比例(10%)。尤其重要的是,本研究发现CCAT2在Luminal型乳腺癌可能发挥抑癌效应,其表达水平与患者生存率呈正相关。而其在三阴性乳腺癌发挥相反的功能。推测CCAT2乳腺癌亚型依赖性的不同功能可能与它的细胞亚结构分布有关。在细胞质中,线粒体参与能量代谢,细胞凋亡等关键生物过程,且与核基因组相互作用。LncRNAs可在细胞核和线粒体之间异常分布,提示其可能参与了癌细胞代谢重编程的调节[32-35]。目前,本研究还没有涉及CCAT2在线粒体的分布情况,这将是后续值得探究的问题。相关研究报道,长链非编码基因常常和miRNA互相作用,调控肿瘤发生及发展[36]。在Luminal型乳腺癌中,CCAT2在细胞质中表达水平升高,可能和miRNA相互作用,从而调节下游靶基因;也可能和RNA结合蛋白作用,从而调节相关信号通路[37]。当lncRNA分布在细胞核时,可能和转录因子或转录调控因子结合形成复合物,并特异性结合到基因组DNA,调控相关基因的表达[37-38]。
本文阐述了长链非编码基因CCAT2在不同亚型乳腺癌中具有不同的表达特征,这将有助于阐明CCAT2调控乳腺癌的功能和分子机制,也可能为治疗不同亚型乳腺癌提供新的思路,为探索非编码基因的生物学功能提供一个新视角。
