藜麦蛋白提取工艺优化及其功能特性研究
2022-11-07权帆王文斌朱玲丽方建华付成丽崔宏伟郑斌丽吴淑清
权帆,王文斌,朱玲丽,方建华,付成丽,崔宏伟,郑斌丽,吴淑清*
(1.长春大学 食品科学与工程学院,长春 130022;2.浙江李子园食品股份有限公司,浙江 金华 321031)
藜麦(ChenopodiumquinoaWilld.)也称奎藜、灰米、金谷子,是藜科一年生草本开花植物[1],含有丰富的碳水化合物、蛋白质、矿物元素等营养物质,同时具有酚类、三萜皂苷、γ-氨基丁酸等多种生物活性成分[2]。因其营养全面、比例均衡的特点,藜麦引起了越来越多的关注[3]。
藜麦富含其他谷物无法比拟的高品质全蛋白[4],平均含量在12.5%~16.7%[5]。藜麦蛋白是由清蛋白、球蛋白、谷蛋白和醇溶蛋白构成的,其中清蛋白和球蛋白含量占总蛋白质的44%~77%,谷蛋白和醇溶蛋白相对较少[6]。目前,蛋白质提取方法有碱溶酸沉法、酶法、超声提取法、盐析法等[7],以碱溶酸沉法为主要提取方法;对藜麦蛋白的功能特性研究较少,而pH对蛋白的功能特性有显著影响,直接影响食品的感官品质。
本试验采用碱溶酸沉法从藜麦粉中提取蛋白质,通过单因素试验结合响应面优化试验,确定藜麦蛋白的最佳提取条件,同时研究不同pH值对其功能特性的影响。为利用藜麦蛋白研究开发新型食品奠定了基础,也为后期改善特定的功能特性提供了理论依据。
1 材料与方法
1.1 材料与试剂
藜麦:山西绿色山区农副产品销售公司;大豆油:益海嘉里食品营销有限公司。
牛血清蛋白(BSA)、考马斯亮蓝G-250、氢氧化钠:国药集团化学试剂有限公司;石油醚、无水乙醇:分析纯,天津市富宇精细化工有限公司;磷酸:分析纯,天津市大茂化学试剂厂;盐酸:北京市大兴区安定镇工业总公司。
1.2 设备与仪器
HH-4型数显恒温水浴锅 常州天瑞有限公司;721型可见分光光度计 上海菁华科技有限公司;TG16G型高速离心机 金坛区白塔新宝仪器厂;PHS-3C型pH计 上海浦春计量仪器有限公司;ZIRBUS VaCo 5型冷冻干燥机 吉林省华业科教仪器设备有限公司;MF0910P型马弗炉 华港通科技(北京)有限公司;FSH-2A型可调高速匀浆机 常州万合仪器制造有限公司。
1.3 方法
1.3.1 藜麦基础成分的测定
蛋白含量按照GB 5009.5-2016测定;水分含量按照GB 5009.3-2016测定;脂肪含量按照GB 5009.6-2016测定;膳食纤维含量按照GB 5009.8-2014测定;灰分含量按照GB 5009.4-2016测定。
1.3.2 藜麦预处理
挑选颗粒饱满、大小均一的藜麦浸泡30 min,于烘箱中45 ℃烘制8 h,冷却后粉碎,过80 目筛,用石油醚脱脂(藜麦粉∶石油醚为1∶4,g/mL),搅拌2 h后,静置12 h过滤,弃掉上清液,于烘箱中45 ℃烘制2 h,将脱脂后的藜麦粉放在通风处24 h以挥发残留的石油醚,之后置于干燥环境下保存,备用。
1.3.3 藜麦蛋白提取流程
对预处理后的藜麦粉加水溶解,按照一定的料液比,用0.5 mol/L NaOH调溶液至适宜pH,在适宜温度下提取一定时间后,5000 r/min 离心10 min,收集上清液后,用0.5 mol/L HCl调pH至4.5,10000 r/min离心15 min,收集沉淀,水洗沉淀,调pH至中性,经真空冷冻干燥后得到藜麦蛋白。
1.3.4 藜麦蛋白提取率的测定
1.3.4.1 绘制标准曲线
分别吸取0.0,0.06,0.12,0.24,0.48,0.72 mL的0.1 mg/mL蛋白质标准溶液于10 mL试管中,对应加入1,0.94,0.88,0.76,0.52,0.28 mL蒸馏水,再分别加入5 mL考马斯亮蓝G-250溶液,充分混匀,静置2 min。用蒸馏水作空白对照,在595 nm处测其吸光度,以标准蛋白质浓度(mg/mL)为横坐标、吸光度为纵坐标绘制蛋白质标准曲线,得到方程y=0.5753x+0.0075(R2=0.996)。
提取液蛋白含量测定:吸取1 mL提取液,再加入5 mL的考马斯亮蓝G-250溶液,充分混匀,静置2 min。用蒸馏水作对照组,于595 nm处测其吸光度,根据标准曲线计算提取液的蛋白质含量。
样品蛋白含量测定:按照GB 5009.5-2016进行。
1.3.4.2 提取率的测定
藜麦蛋白质提取率(%)=提取液蛋白质含量/样品蛋白含量×100%。
1.3.5 单因素试验
藜麦蛋白提取基本条件:料液比1∶10,pH 10.5,温度 45 ℃,提取时间 2 h。研究料液比(1∶8、1∶10、1∶12、1∶14、1∶16,g/mL)、提取时间(1.0,1.5,2.0,2.5,3.0 h)、提取温度(35,40,45,50,55 ℃)、pH 值(9.0,9.5,10.0,10.5,11.0)对蛋白提取率的影响。以蛋白提取率为指标,每个水平进行3次重复试验取平均值。
1.3.6 响应面优化设计
在单因素试验基础上,对料液比、提取时间、提取温度及pH值进行优化,以藜麦蛋白提取率为响应值,设计响应面试验因素水平表,见表1。

表1 响应面试验因素水平
1.3.7 藜麦蛋白纯度的测定
精确称取适量藜麦蛋白粉并记录质量,按照GB 5009.5-2016《食品中蛋白质的测定》,重复3次试验取平均值得蛋白纯度。
1.3.8 藜麦蛋白功能特性研究
1.3.8.1 溶解性研究
参照高艳慧[8]的方法并略作调整,称量0.1 g藜麦蛋白粉充分溶于10 mL蒸馏水中,用0.5 mol/L的HCl和NaOH分别调节样品溶液pH值至2,4,6,8,10,12,于磁力搅拌器中搅拌30 min,8000 r/min离心10 min,用考马斯亮蓝法测所得上清液的蛋白质含量。
溶解性(%)=上清液蛋白含量/样品蛋白含量×100%。
1.3.8.2 乳化性与乳化稳定性研究
a.乳化性
参照吕凯波等[9]的方法并略作调整,称量0.1 g藜麦蛋白粉溶解于10 mL蒸馏水中,用0.5 mol/L的HCl和NaOH分别调节样品溶液pH值至2,4,6,8,10,12,分别加入等体积的大豆油,快速搅拌1 min后以2000 r/min离心10 min。
乳化性(%)=乳化后高度/离心管样液总高度×100%。
b.乳化稳定性
将上述离心后的样品溶液于80 ℃恒温水浴30 min,待样液完全冷却后以2000 r/min离心10 min。
乳化稳定性(%)=乳化后高度/乳化前高度×100%。
1.3.8.3 起泡性和泡沫稳定性研究
参照张思思[10]的方法并略作调整,称取一定量的藜麦蛋白粉,配制1%的蛋白溶液,用0.5 mol/L的HCl和NaOH分别调节样品溶液pH值至2,4,6,8,10,12,用高速匀浆机以15000 r/min搅打2 min,随后倒入离心管中,记录上层泡沫体积,静置30 min后,再次记录上层泡沫的体积。计算蛋白的起泡性和泡沫稳定性。
起泡性(%)=搅拌停止时泡沫体积/蛋白溶液体积×100%。
泡沫稳定性(%)=30 min后泡沫体积/起初泡沫体积×100%。
1.3.8.4 持水性研究
参照杨希娟等[11]的方法并略作调整,用蒸馏水配制浓度为10 mg/mL的藜麦蛋白溶液,用0.5 mol/L的HCl和NaOH分别调节样品溶液pH值至2,4,6,8,10,12,常温静置1 h后,以4000 r/min的转速离心10 min,除去上清液,称取离心管和沉淀物的质量。
持水性(g/g)=(离心管沉淀物质量-样品质量)/样品质量。
1.3.8.5 持油性研究
参照Mohammed等[12]的方法并略作调整,称量0.1 g藜麦蛋白粉加入10 mL大豆油,用0.5 mol/L的HCl和NaOH分别调节样品溶液pH值至2,4,6,8,10,12后静置1 h,以4000 r/min离心10 min,弃去上清液后,称量样品的质量。
持油性(g/g)=(离心管沉淀物质量-样品质量)/样品质量。
2 结果与分析
2.1 藜麦基本营养成分的测定
藜麦基本营养成分的测定见表2。

表2 藜麦基本营养成分测定表
2.2 单因素试验
2.2.1 料液比对藜麦蛋白提取率的影响
由图1可知,随着料液比的增加,蛋白提取率呈现先上升后下降的趋势,料液比为1∶12 (g/mL)时,藜麦蛋白提取率达到最大。当料液比为1∶8~1∶12 (g/mL)时,随着料液比的增加,藜麦蛋白提取率显著上升;当料液比为1∶14~1∶16 (g/mL)时,藜麦蛋白提取率基本不变。这是由于料液比过小时,藜麦溶解不充分,不利于蛋白质的溶出;增大料液比,藜麦粉与水充分溶解,有利于蛋白分子溶出;但料液比过大时,蛋白溶出量达到饱和,藜麦蛋白提取率变化不大。因此,选择料液比1∶10~1∶14 (g/mL)进行响应面试验。
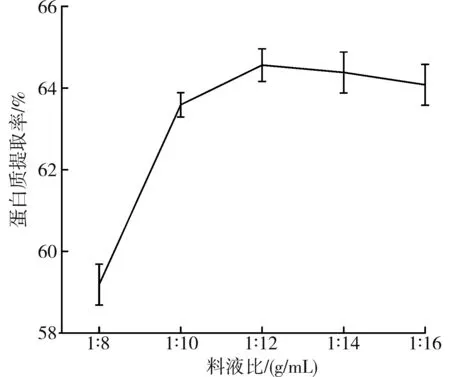
图1 料液比对藜麦蛋白提取率的影响
2.2.2 提取时间对藜麦蛋白提取率的影响
由图2可知,在提取时间为2.5 h时,藜麦蛋白提取率达到最大;当提取时间为1.0~2.5 h时,随着提取时间的增加,藜麦蛋白提取率显著上升。这是由于溶液长时间搅拌,藜麦蛋白溶解更加完全,蛋白质溶出量增加;当提取时间大于2.5 h时,藜麦蛋白提取率略微下降,可能是因为提取时间过长,增加了非蛋白物质浸出,进一步影响蛋白质的沉淀和纯度[13],同时耗能增加,生产成本也随之增加。因此,选择提取时间2.0~3.0 h进行响应面试验。
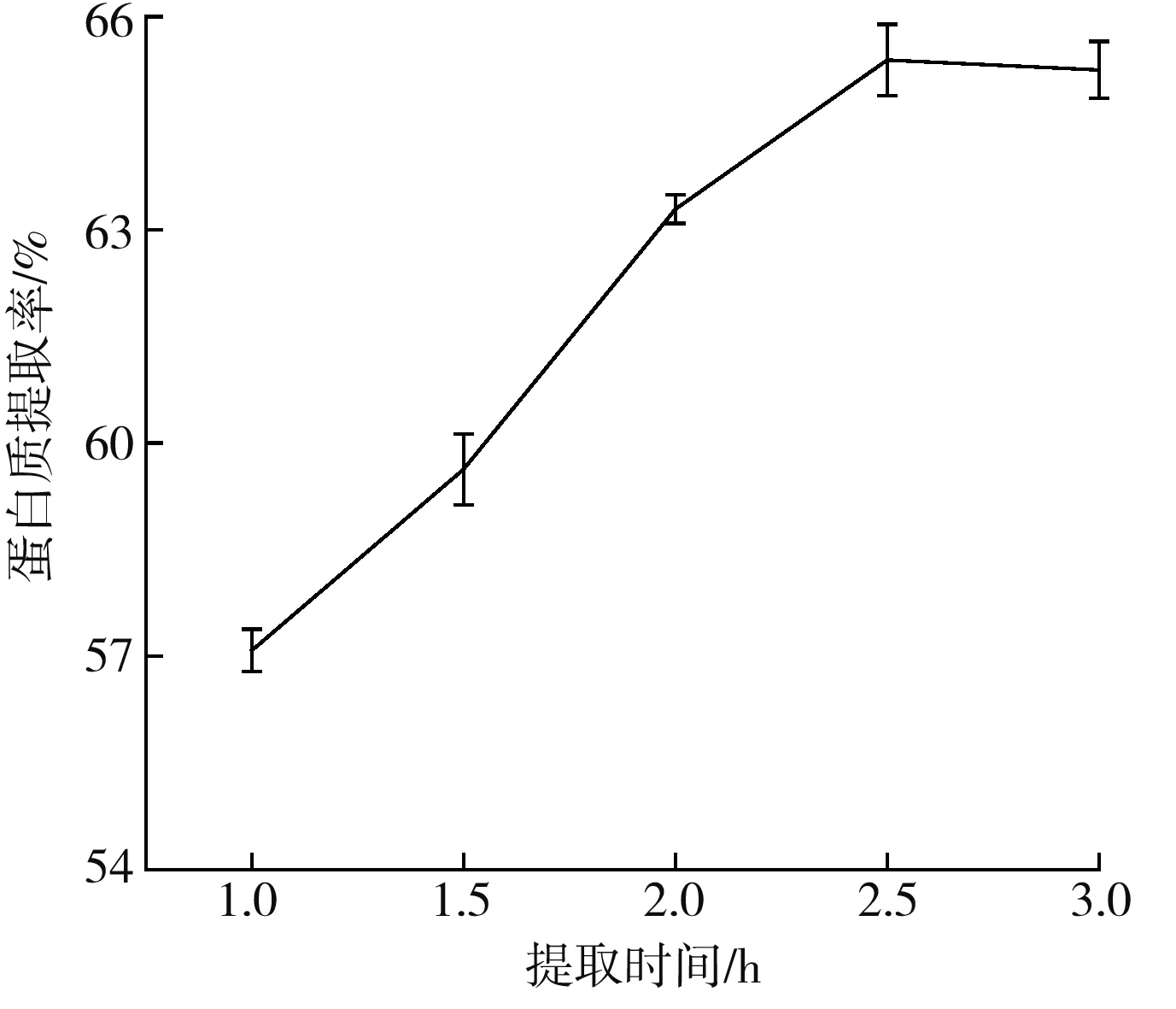
图2 提取时间对藜麦蛋白提取率的影响
2.2.3 提取温度对藜麦蛋白提取率的影响
由图3可知,蛋白提取率随着提取温度的增加呈先上升后下降的趋势,在45 ℃时达到最大。当提取温度为35~45 ℃时,随着提取温度的增加,藜麦蛋白提取率显著上升;当提取温度为45~55 ℃时,藜麦蛋白提取率下降。这是由于升温使蛋白质分子运动加剧,有利于蛋白质的溶解;但温度过高,蛋白质的内部疏水基团会产生反应,从而影响蛋白质的提取率[14]。因此,选择提取温度40~50 ℃进行响应面试验。
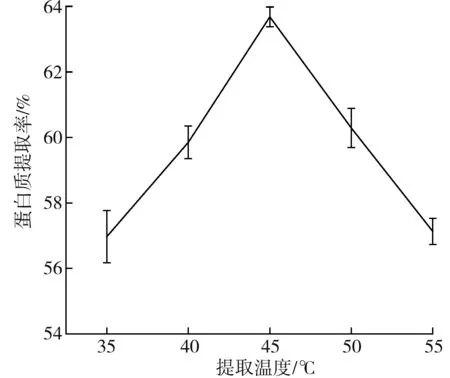
图3 提取温度对藜麦蛋白提取率的影响
2.2.4 pH值对藜麦蛋白提取率的影响
由图4可知,当pH值为9.0~10.5时,藜麦蛋白的提取率显著增加;当pH值大于10.5时,藜麦蛋白的提取率增加缓慢。这是由于随着pH的升高,带负电荷的蛋白质使分子间排斥力增强,增加蛋白质溶出量;但pH过高可能会使蛋白分子间的氢键、离子键及空间结构遭到破坏,使部分蛋白质变性[15]。综合考虑,选择pH 10.0~11.0进行响应面试验。

图4 pH值对藜麦蛋白提取率的影响
2.3 响应面试验
2.3.1 响应面试验设计及结果
对料液比、提取时间、提取温度、pH值进行优化,以藜麦蛋白提取率为响应值,进行响应面优化试验。利用 Design Expert V8.0.6.1软件设计试验,结果见表3。
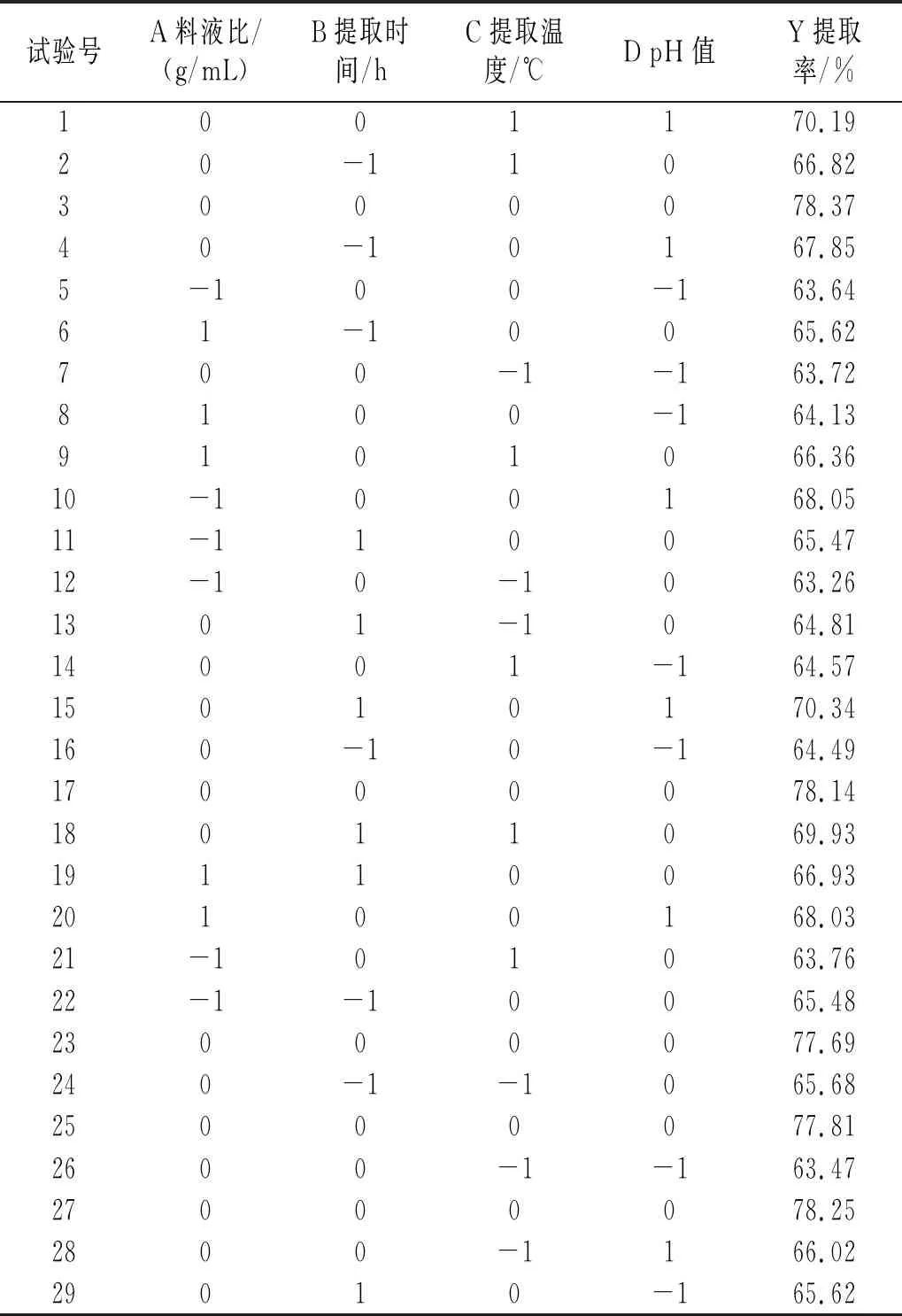
表3 响应面试验设计及结果
2.3.2 回归模型拟合及方差分析
对表3结果进行回归方程拟合,得到响应面回归方程:Y=+78.05+0.41A+0.57B+1.20C+2.03D+0.33AB+0.60AC-0.13AD+0.93BC+0.34BD+0.83CD-7.00A2-5.18B2-6.49C2-5.44D2。
回归模型方差分析见表4。
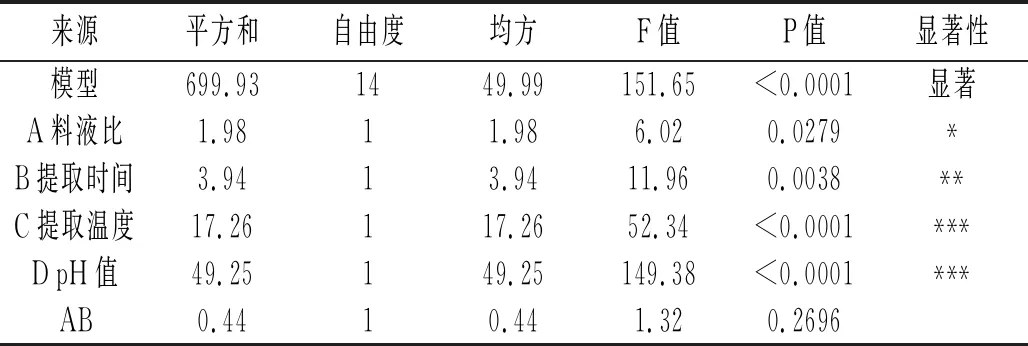
表4 回归模型方差分析
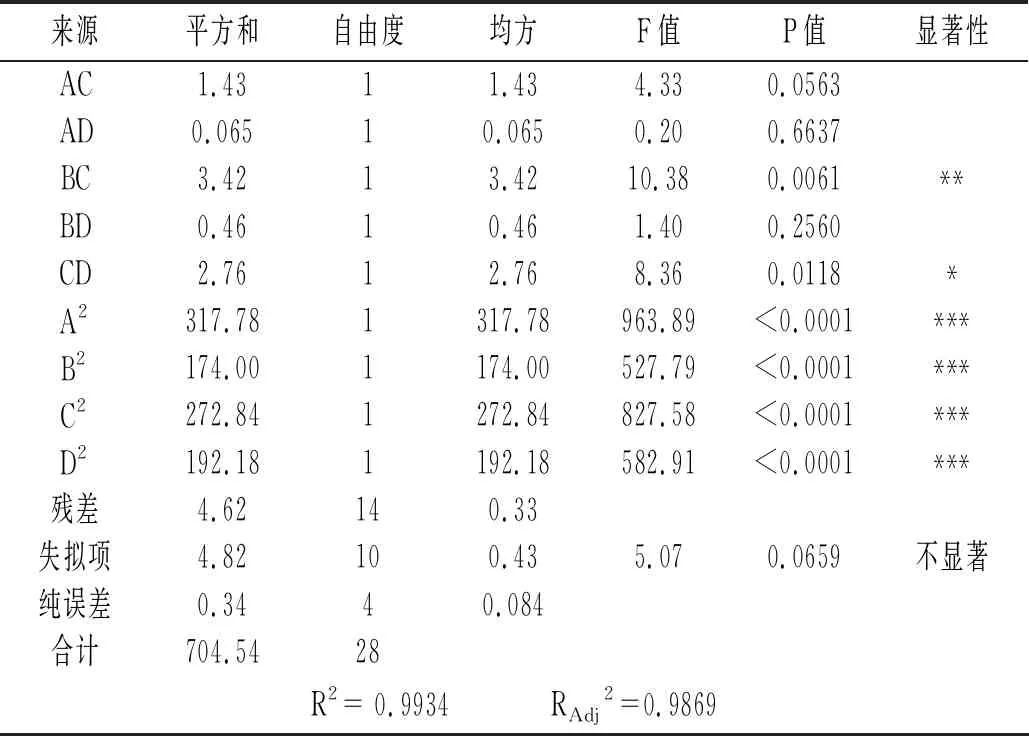
续 表
由表4可知,该模型的P值<0.0001,失拟项不显著(P=0.0659>0.05),相关系数R2=0.9934,说明模型极其显著,可较好地反映藜麦蛋白提取中各因素与响应值的关系并预测最佳提取条件。由P值大小可知,C、D影响极显著,A影响显著,B影响较显著。由F值可知,影响藜麦蛋白提取率的因素主次顺序为pH值>提取温度>提取时间>料液比。
2.3.3 响应面分析
利用Design Expert V8.0.6.1软件,得到AC、BC和CD的交互作用对藜麦蛋白提取率影响的等高线图及3D响应面图,见图5。

图5 AC、BC和CD交互作用对藜麦蛋白提取率的影响
由图5可知,AC、BC和CD交互作用的等高线图均变化较明显,且BC和CD等高线呈椭圆形,说明AC、BC和CD的交互作用对藜麦蛋白提取率的影响较显著;3D图中,AC、BC和CD交互作用的曲线较陡峭,且随着因素水平的增加,藜麦蛋白提取率呈现先上升后下降的趋势。
2.3.4 验证试验
分析响应面试验结果,得到藜麦蛋白的最佳提取条件为:料液比1∶12.07 (g/mL)、提取时间2.54 h、提取温度45.56 ℃、pH 10.60,预测蛋白提取率为78.35%。在实际操作过程中,将最佳提取条件调整为:料液比1∶12.0 (g/mL)、提取时间2.5 h、提取温度46 ℃、pH 10.5,进行3次验证试验,得到蛋白提取率为(78.86±0.79)%,与预测值接近,说明该模型能够较好地反映藜麦蛋白提取率。采用凯氏定氮法对藜麦蛋白粉的纯度进行测定,结果为87.58%。
2.4 藜麦蛋白功能特性的研究
2.4.1 溶解性
溶解性是蛋白质的重要功能特性之一,与其乳化性、持水性、起泡性等多项功能特性有关。由图6可知,当pH值为4时,溶解性最差,仅为35.11%;当 pH值大于4时,溶解性显著提高。这是因为溶液在碱性环境中蛋白远离等电点,可能是较高的pH值导致蛋白质内部因静电排斥而造成分子伸展,进而提高了蛋白溶解性[16]。

图6 pH值对藜麦蛋白溶解性的影响
2.4.2 乳化性与乳化稳定性
乳化性是指蛋白质在单位质量下能维持油水界面的面积;乳化稳定性是指蛋白质维持稳定状态且与水或油混合不产生两相分层不稳定现象的特性。由图7可知,随着pH的增加,藜麦蛋白的乳化性与乳化稳定性均为先下降后上升,当pH为4时达到最小。这是由于蛋白在等电点处的溶解度最低,导致溶液不能迅速固定在油与水界面上;之后随着pH值增加,蛋白表面的负电荷增加,使其排斥作用增强,致使蛋白水化层厚度也增加,从而增加了蛋白的乳化稳定性[17]。
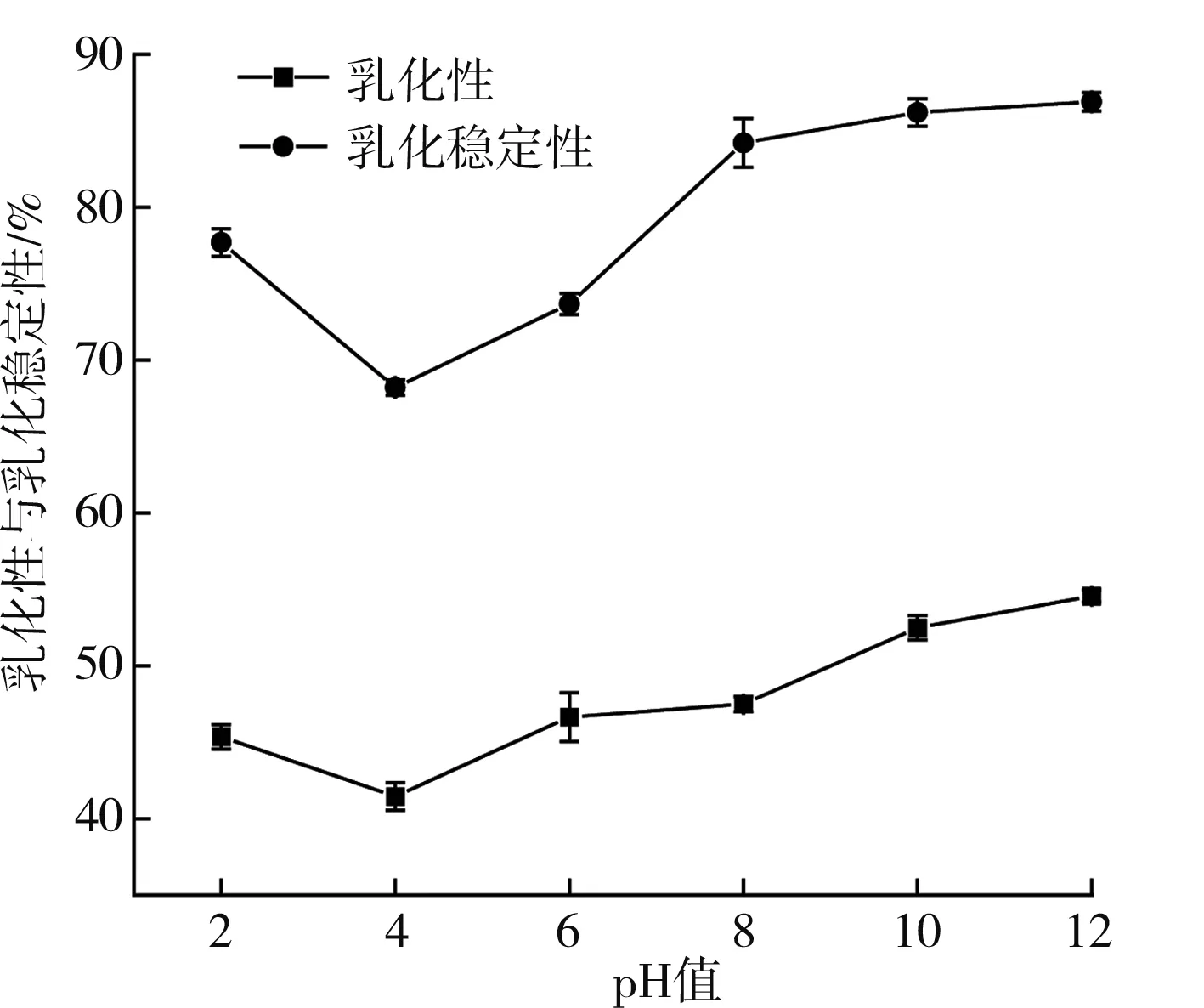
图7 pH值对藜麦蛋白乳化性与乳化稳定性的影响
2.4.3 起泡性与泡沫稳定性
蛋白质的起泡性是指蛋白质起泡的能力,泡沫稳定性是指维持稳定泡沫的能力。由图8可知,当pH为4时,起泡性与泡沫稳定性都达到最低;之后随着pH的增加,起泡性与泡沫稳定性都有不同程度的增加。这是因为在碱性环境中,蛋白质的净电荷增加,减弱了疏水相互作用力,使得蛋白质容易分散到水与空气界面,使界面得以加强,促进泡沫的形成和稳定[18]。

图8 pH值对藜麦蛋白起泡性与泡沫稳定性的影响
2.4.4 持水性
蛋白质持水性是指蛋白质截留水、阻止水渗出的能力。由图9可知,当pH为4时,持水性达到最低,为1.84 g/g;当pH为4~10时,蛋白的持水性明显升高,之后趋于平稳。这是由于当pH值处于等电点时,蛋白质分子总电荷为零,分子间相互作用最大,使蛋白质缔合和收缩,呈现最低的膨胀和水化,pH值增加,蛋白质膨胀和水化性能也增加,使持水能力变强[19]。

图9 pH值对藜麦蛋白持水性的影响
2.4.5 持油性
持油性是指蛋白质结合脂质的能力。由图10可知,pH为4时持油性最低;随着pH的增加,蛋白的持油性升高。这是由于当pH在蛋白等电点附近时,蛋白容易聚集沉淀,持油性最小;随着pH的升高,蛋白分子发生伸展、解离,内部非极性键暴露,进而增加与油脂结合能力[20],使蛋白持油性提高。
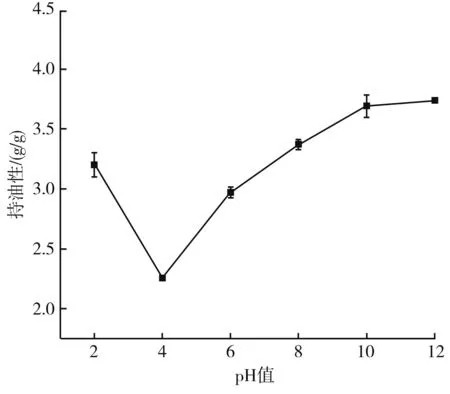
图10 pH值对藜麦蛋白持油性的影响
3 结论
通过单因素试验并结合Box-Behnken试验设计的方法,得到藜麦蛋白最佳提取条件为:料液比1∶12.0 (g/mL)、提取时间2.5 h、提取温度46 ℃、pH 10.5,此时蛋白提取率为(78.86±0.79)%,纯度为87.58%。此外,藜麦蛋白有较好的溶解性和起泡性,一定的持水(油)性和乳化稳定性,较差的乳化性。pH值对藜麦蛋白的功能特性有显著影响,即当溶液pH在藜麦蛋白等电点附近时,蛋白的溶解性、乳化性、乳化稳定性均较差;当pH偏离等电点时,上述功能特性均得到不同程度的提高,该研究对藜麦相关产品的加工或贮藏过程有着重要作用,可增加藜麦蛋白利用率。
