雪莲SikCDPK1启动子的克隆和活性分析
2022-11-05史光珍王兆晔孙琦朱新霞
史光珍 王兆晔 孙琦 朱新霞
(石河子大学生命科学学院 绿洲城镇与山盆系统生态兵团重点实验室,石河子 832003)
新疆天山雪莲(Sasussured involucrata Kar.et Kir)能够在常年积雪不化、空气稀薄、紫外线辐射强烈的高山、悬崖峭壁的石缝中生长,是一种优良的耐极端气候植物[1],研究与其相关的逆境基因,对提高植物抗逆性意义重大。
钙依赖蛋白激酶(calcium-dependent protein kinases, CDPKs)是钙信号转导途径中的主要感受器和效应器,在环境刺激、植物生长发育和激素信号传递等过程起重要作用[2]。启动子是一种具有调节基因功能的顺式作用因子,位于结构基因上游,能与RNA聚合酶特异性结合,有效地控制转录的起始、表达效率、表达时间和表达特异性[3]。分析研究启动子的核心区域序列、响应元件类型、数量和响应模式,有利于洞察目的基因的功能及其表达调控机制。
本课题组前期克隆了SikCDPK1基因,发现它在干旱、低温胁迫下转录水平增加[4]。但SikCDPK1基因上游启动子的序列、结构和其响应机制仍未明确。因此本研究拟在此基础上,对雪莲SikCDPK1启动子进行克隆,探究其序列特征和潜在的响应元件,进一步构建含有报告基因GUS的植物表达载体P0∷GUS及5'端缺失的表达载体(P1∷GUS,P2∷GUS,P3∷GUS),通过瞬时转化烟草、低温和干旱胁迫、GUS染色来研究SikCDPK1启动子的活性,为探明 SikCDPK1基因的上游调控序列和进一步解析雪莲SikCDPK1基因响应胁迫的调控机制奠定基础。
1 材料与方法
1.1 材料
雪莲由本实验室组培培养,本氏烟草(Nicotiana benthamiana)种子、大肠杆菌(Eschrichia coli)感受态细胞DH5α、根癌农杆菌GV3101、植物表达载体pCAMBIA1304均由本实验室保存。
1.2 方法
1.2.1 雪莲SikCDPK1基因启动子的克隆和顺式作用元件分析 根据本课题组前期克隆的SikCDPK1基因序列,分别设计了3条嵌套的特异性引物SP1、SP2和SP3,同时合成4条具有低Tm值的短的随机简并引物AD1-AD4和一条特异性引物AD5(表1),以雪莲基因组DNA为模板,根据引物的长短和特异性的差异设计不对称的温度循环,通过TAIL-PCR技术分3次反应来扩增SikCDPK1的上游序列。第1轮PCR反应体系为DNA模板1 μL、随机简并引物AD1-AD4 各 0.5 μL,引物 SP1 0.5 μL,ddH2O 8 μL,2×Taq PCR mix 10 μL。在第2轮反应中,将第1轮PCR产物稀释100倍作为第2轮反应的模板,SP1更换为SP2,其余条件不变;在第3轮反应中,将第2轮反应产物稀释100倍作为模板,SP2更换为SP3,其余条件不变。PCR反应程序参考Liu等[5]的方法。PCR反应结束后,利用1%的琼脂糖凝胶分别对3轮TAIL-PCR扩增结果进行检测,选取第3轮结果中符合大小的特异性条带,使用DNA凝胶回收试剂盒进行回收纯化。然后进行连接,转化至大肠杆菌。利用pMD-19T载体的通用引物M13F/R进行菌液PCR和测序。获得启动子序列后,通过plantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子顺式作用元件。

表1 本研究所用引物Table 1 Primers used in this study
1.2.2 启动子驱动的GUS植物表达载体的构建 为了深入研究SikCDPK1启动子的功能,在全长启动子P0的基础上,根据顺式调控元件设计了3个不同长度的5'端序列缺失的上游引物(带Hind III和Spe I酶切位点)(表1),并以此为模板,扩增含有不同截短长度的SikCDPK1启动子片段。同时,用Hind III和Spe I双酶切植物双元表达载体pCAMBIA1304,回收目的片段,经同源重组重新连接。重组质粒经菌液PCR和测序验证后,获得不同长度的pSikCDPK1∷GUS表达载体,分别命名为P0∷GUS,P1∷GUS,P2∷GUS,P3∷GUS(图 1)。

图1 SikCDPK1启动子驱动的GUS表达载体Fig. 1 GUS expression vectors driven by SikCDPK1 promoters
1.2.3 农杆菌介导的烟草瞬时转化与GUS酶活测定 将构建好的载体转化到根癌农杆菌GV3101中,用注射器将菌液注射至烟草叶片,在黑暗条件下保温、保湿培养24 h之后,恢复正常光照培养24 h。对所有注射过的烟草分别进行冷胁迫或PEG处理,处理时间为0、1、3、6、12和 24 h。在不同处理时间点分别用打孔器取样,分别对样品进行GUS染色和 GUS酶活力测定。
2 结果
2.1 启动子的克隆
在已经获得的SikCDPK1基因序列基础上,利用TAIL-PCR法扩增雪莲SikCDPK1的启动子序列。经过3轮PCR,第一轮扩增的PCR产物均无特异条带(图2-A),第2轮PCR产物出现特异条带(图2-B),第3轮PCR 产物第2、3、4泳道出现单一的特异条带(图2-C),对该片段回收、测序后与SikCDPK1基因比对,确认其为 SikCDPK1的5'侧翼序列。该序列长度1 042 bp,命名为pSikCDPK1。
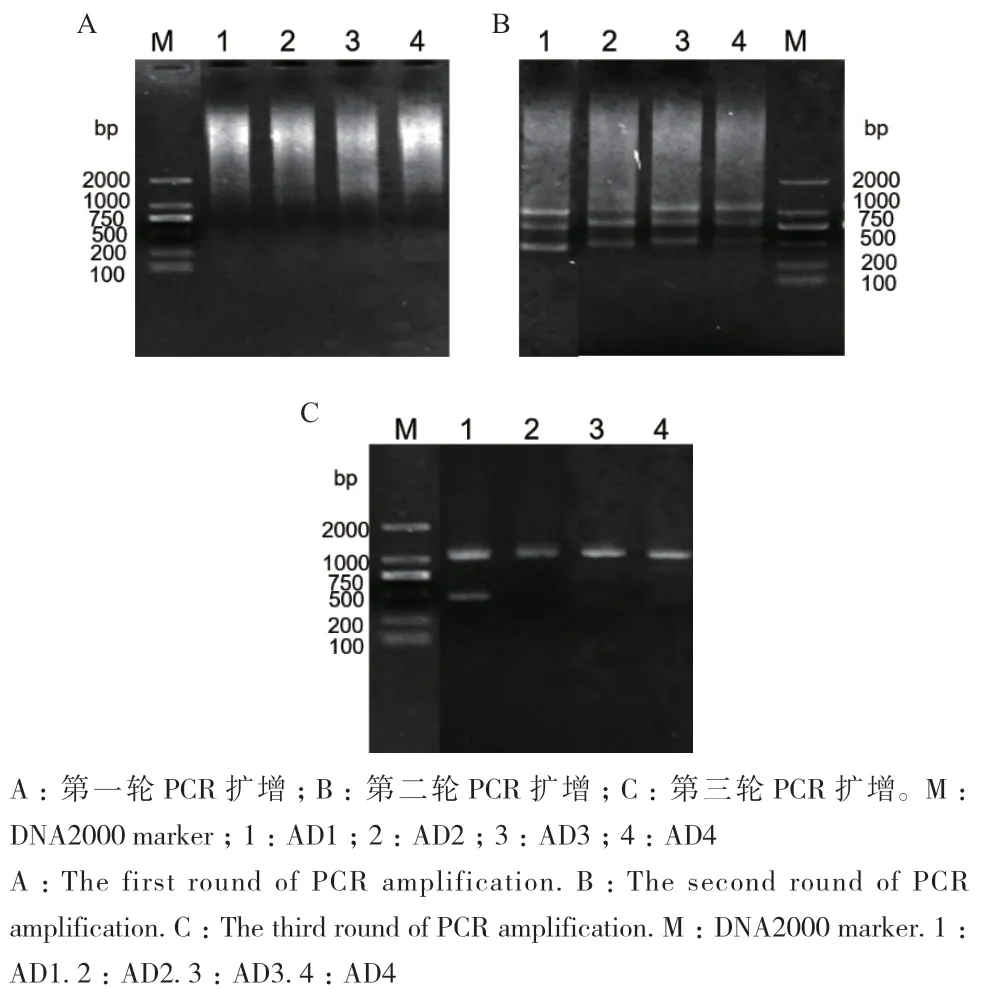
图2 SikCDPK1基因启动子的克隆Fig. 2 Cloning of SikCDPK1 promoter
2.2 启动子序列的功能预测
利用PlantCARE对克隆获得的pSikCDPK1序列分析发现,序列中含有多个CAAT box 及TATA box保守元件,还有激素类响应元件,如参与MeJA的CGTCA-motif、TGACG-motif 元件,ABA诱导响应元件ABRE和DPBFCOREDCDC3,赤霉素响应元件TATC-box等,此外参与冷、脱水、盐诱导、光响应的顺式调控元件也在SikCDPK1启动子中存在。不同顺式作用元件的序列、功能、核心序列及其在启动子区的分布情况见表2。
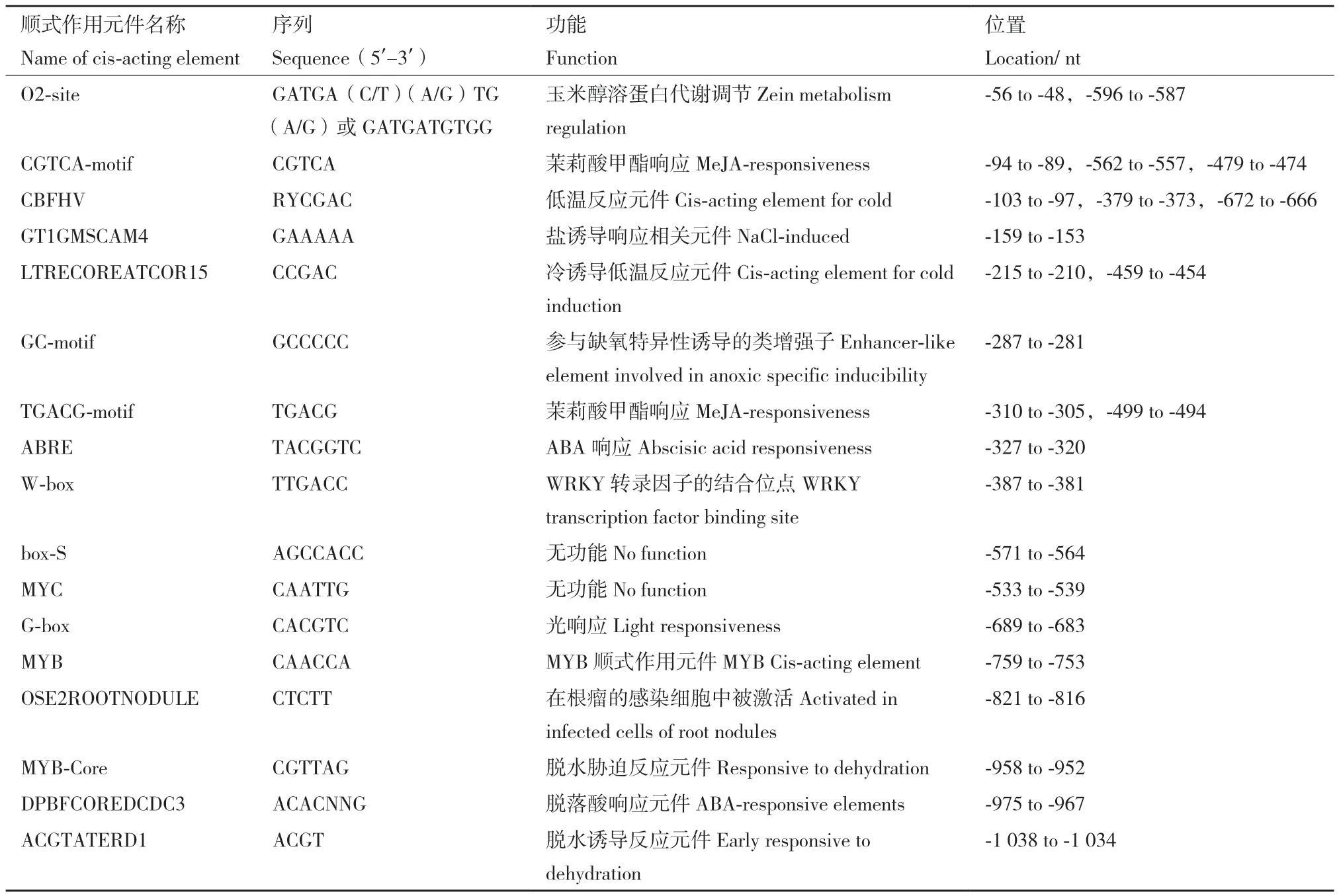
表2 启动子 pSikCDPK1序列中的顺式作用元件及功能Table 2 Cis-elements and functions in the promoter pSikCDPK1 sequence
2.3 启动子驱动的GUS表达载体构建
将克隆的启动子片段 pSikCDPK1和3个5'端缺失启动子(P1、P2、P3)分别连接到植物表达载体pCAMBIA1304(有GUS,无启动子)上,对重组质粒分别进行PCR(图3-A)、测序和酶切鉴定,获得大小为1 042、821、480和181 bp的目标基因片段和大于4 500 bp的载体片段(图3-B,C),表明4个启动子表达载体构建成功。

图3 SikCDPK1启动子的PCR扩增及表达载体双酶切鉴定Fig. 3 PCR amplification of promoter SikCDPK1 and double restriction identification of expression vector
2.4 启动子的GUS活性分析
将构建好的4个启动子表达载体转入到根癌农杆菌GV3101中,瞬时转化烟草,用GUS进行染色,观察烟草叶片的着色程度。如图4所示,阴性对照(非转基因型烟草)叶片中看不到任何着色情况(图4-A);由35S启动子驱动的GUS阳性对照,叶片着色深(图4-B);SikCDPK1启动子驱动GUS的叶片着色表现为整个叶片都有蓝色,着色程度相对35S弱(图4-C),缺失片段P1(821 bp)着色较其他缺失体明显,面积大,且颜色相对较深(图4-D),P2(480 bp)着色程度相对较低(图4-E),面积大,P3(181 bp)仅零星有蓝色斑点(图4-F),着色面积最小且着色程度最低。说明启动子全长P0与缺失体P1、P2、P3均能启动报告基因的表达,启动活性大小依次为 P0>P1>P2>P3。
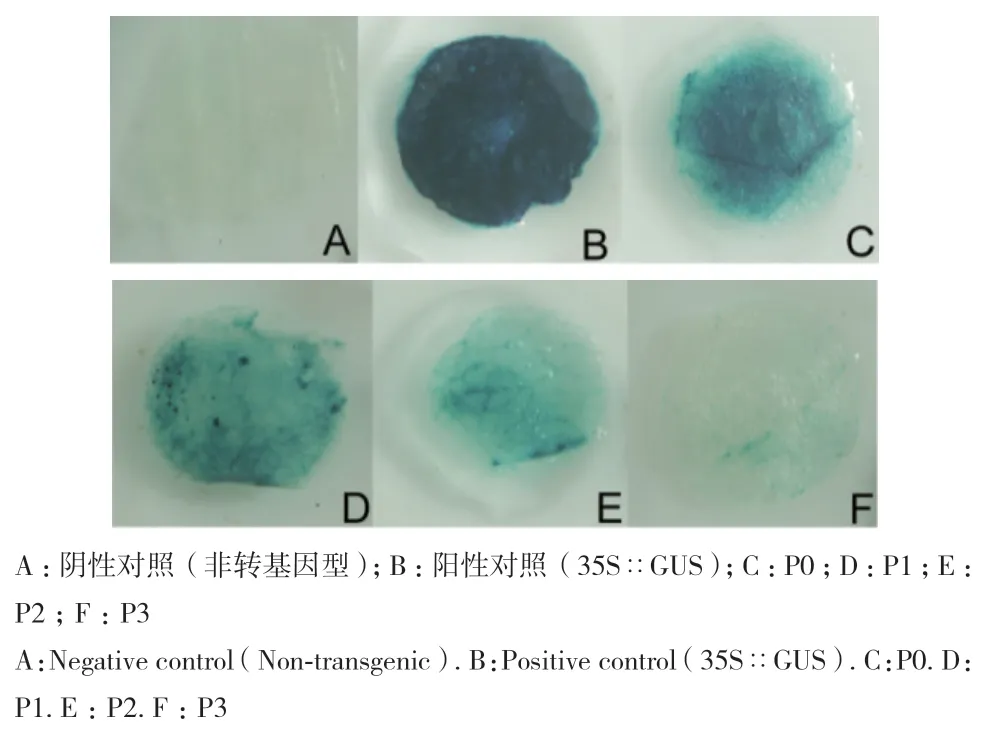
图4 SikCDPK1启动子瞬时转化烟草GUS染色分析Fig. 4 GUS staining analysis of transient transformed tobacco with SikCDPK1 promoter
2.5 pSikCDPK1启动子响应低温和模拟干旱处理的表达活性
利用农杆菌介导法注射烟草叶片,以35S启动子驱动的植株作为阳性对照,通过GUS染色来分析SikCDPK1启动子在逆境胁迫条件下对报告基因的诱导特性。结果(图5-A)表明,低温处理下阳性对照组中烟草叶片着色都较深,pSikCDPK1启动子驱动的GUS叶片着色情况随着低温处理时间的延长呈现出先加深再减弱的情况,它们的GUS酶活也是随着低温胁迫时间的延长呈现出先上升后下降的趋势,在3 h时达到了顶峰,此时GUS酶活为28.972 7 nmol 4-MU·min-1·mg-1。PEG处理条件下,pSikCDPK1启动子驱动的GUS叶片着色情况与在低温胁迫条件下的情况基本相似,即随着胁迫处理时间的延长呈现出先加深再减弱的情况(图5-B),它们的GUS酶活也是随着低温胁迫时间的延长呈现出先上升后下降的趋势,在3 h时达到了顶峰,GUS酶活为29.907 9 nmol 4-MU·min-1·mg-1。说明pSikCDPK1在低温、干旱下,都能驱动GUS基因在烟草中的表达,pSikCDPK1活性和胁迫时间有关,下游报告基因表达强度和启动子活性有关。
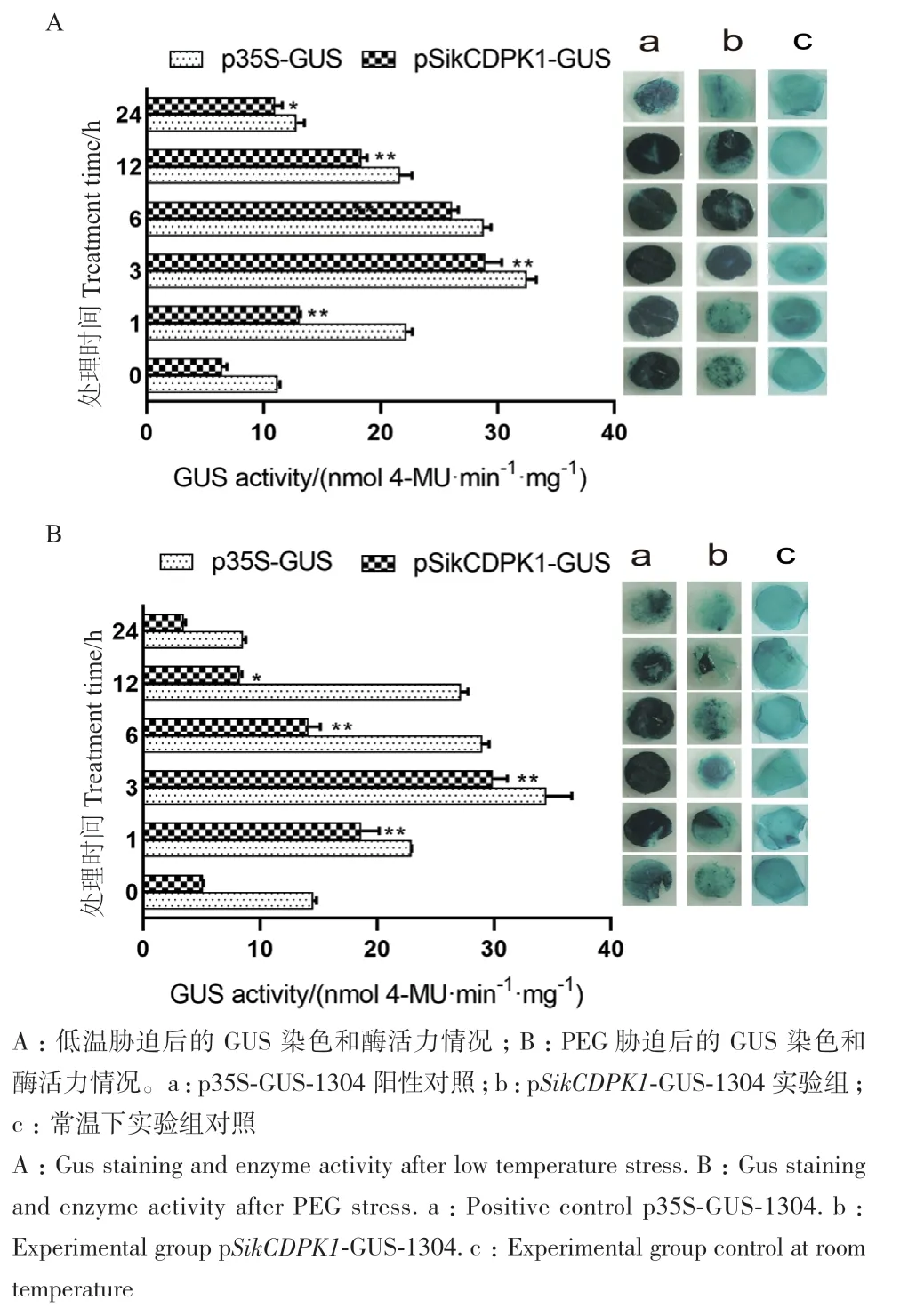
图5 胁迫处理下GUS染色分析及酶活力的测定Fig. 5 Gus staining analysis and enzyme activity determination under stress treatment
3 讨论
CDPKs是植物对抗逆境胁迫的一种重要的蛋白,CDPKs能够在感知Ca2+信号时直接激活和调节靶蛋白,从而使靶蛋白正常发挥功能,在植物面对非生物胁迫时起到重要作用[6]。CDPKs相关功能的研究在雪莲中也有一定的进展[4],然而,目前对于这类基因功能的研究多是依据基因表达的时空模式或转基因株系的表型分析,对基因的调控机制研究甚少。
启动子通常被称为“转录网关”,在植物基因的表达调控中起关键作用,启动子的表达活性水平调控受到与启动子中各种响应元件结合的转录因子以及其所形成的复合物来决定[7]。瞬时表达是检验启动子是否具备启动下游结构基因表达的活性功能的常用验证方法[8]。启动子的核心区域对基因的表达调控起关键作用,5'端分段缺失是寻找启动子启动活性关键区域的有效方法。为了探究SikCDPK1 基因启动子的核心区域,本研究分别构建了全长启动子和3个5'端缺失启动子驱动的GUS重组表达载体,通过瞬时转化烟草,利用GUS组织化学染色颜色深浅判断不同长度启动子的活性,结果发现不同长度启动子的活性强弱不同,最小的缺失片段P3着色面积小且浅,说明该区间启动活性较弱。缺失片段P2、P1着色依次加深,全长P0着色最浓,初步推断该启动子的核心启动子区域可能位于P0与P2(-1 042- -408 bp)之间。
启动子是重要的调控元件,在一定程度上决定了基因的表达时间和空间次序,通过研究启动子的活性和功能,有助于深入研究基因的功能和表达调控机制。SikCDPK1基因可提高转基因植物的耐干旱、低温的能力。本研究发现,雪莲SikCDPK1的启动子区域中含有1个W-box、1个GT1和2个LTRE等与非生物胁迫及激素诱导相关的顺式作用元件。其中W-box是可和特定WRKY转录因子相结合,而WRKY转录因子的不同成员可参与包括病害、高温、干旱、高盐等,还与SA、JA、ET等信号通路相关[9-14]。LTRE元件是与低温胁迫相关的元件[15-19]。GT1元件在大豆中存在,且是响应盐胁迫的主要顺式作用元件[20]。为了解雪莲SikCDPK1基因响应逆境的表达调控特性,本研究通过TAIL-PCR技术克隆到SikCDPK1基因的启动子序列,启动子序列预测发现该启动子区域除了含有启动子活性重要位点TATA-box和CAAT-box[21]外,还含有MYB-core、ACGTATERD1、LTRECOREATCOR15、CBFHV等和干旱、低温相关的顺式作用元件。在大豆和茶树的相关研究中也有这些元件存在,发现它们在干旱和低温诱导的基因表达中起作用[20,22]。
为探究这些元件是否在SikCDPK1基因的启动子中起作用,本研究分别对全长启动子驱动的烟草进行了不同时间的冷胁迫和PEG处理,并进行了GUS染色和酶活性测定,发现冷和PEG处理都可诱导GUS基因的表达,GUS基因的酶活性随着冷和干旱处理时间的延长呈现先上升后下降的趋势,在处理3 h时酶活性最高,这说明低温和干旱处理都可在短期内快速增强pSikCDPK1的启动活性,pSikCDPK1活性和胁迫时间有关,pSikCDPK1的活性越高,下游报告基因表达的强度越强。推测SikCDPK1基因启动子可能也会通过MYB-core、ACGTATERD1、LTRECOREATCOR15、CBFHV 等干旱、低温相关的顺式作用元件,调控SikCDPK1基因对干旱、低温的响应时间和响应程度。
SikCDPK1基因启动子序列中还发现有参与茉莉酸甲酯响应的CGTCA-motif、TGACG-motif,参与ABA诱导响应的ABRE和DPBFCOREDCDC3,参与赤霉素响应的TATC-box等激素响应元件,这些响应元件的具体功能以及调控方式也有待进一步研究和探讨。这些研究将为深入探讨SikCDPK1基因的上游调控序列和解析SikCDPK1基因响应逆境胁迫的调控机制提供了理论依据。
4 结论
成功克隆了雪莲SikCDPK1基因的启动子,通过GUS 组织化学染色和GUS酶活性测定证实了SikCDPK1启动子具有启动活性,低温和干旱胁迫可在短期内快速增强SikCDPK1启动子的活性,SikCDPK1基因启动子可通过其相关顺式作用元件调控下游基因的表达强度。
