ε-聚赖氨酸对阪崎克罗诺杆菌细胞结构与生物被膜形成的影响
2022-11-05石成龙汪锡武李安琪钱森和王洲赵世光刘艳2薛正莲
石成龙 汪锡武 李安琪 钱森和,2 王洲,2 赵世光,2 刘艳,2薛正莲,2
(1. 安徽工程大学生物与食品工程学院,芜湖 241000;2. 安徽省工业微生物分子育种工程实验室,芜湖 241000)
阪崎克罗诺杆菌是一种食源性条件致病菌,为兼性厌氧革兰阴性氏杆菌,隶属于肠杆菌科[1]。在婴幼儿奶粉、肉制品、果蔬等多种食品中常被检测到,其中奶粉是该菌的主要感染源[2]。可导致危及生命的侵袭性疾病,如婴儿坏死性小肠结肠炎、脑膜炎和败血症,致死率高达40%-80%[3]。
食品生产设备表面和环境中的阪崎克罗诺杆菌以生物被膜的形式存在[4]。与游离菌相比,生物被膜内的细菌耐受性更强,可保护病原体免受恶劣环境的侵害,是食品持续污染的重要来源[5]。细菌生物被膜因其耐受性而难以去除,传统的消毒程序对生物被膜不能完全有效,并可能导致耐药菌的产生。因此,为了提高食品及加工环境的安全性,需要进一步开发无毒副作用的绿色环保型抗菌剂。天然抗菌肽具有抑制细菌生长、消除生物被膜的潜力,且在环境中容易降解,并且几乎无毒。是食品保鲜及加工行业值得注意的一种抗菌剂。植物源抗菌化合物可能作为一种控制污染食品动物及其产品的耐抗生素的人畜共患病原体的新手段具有重要价值。
ε-聚赖氨酸是一种由白色链霉菌产生的天然阳离子多肽[6],含有25-35个氨基酸残基。具有抗菌活性强、安全性高[7]、热稳定性好等特点。在120℃下热处理20 min后,ε-PL的抗菌活性并没有受到影响。且You等[8]实验结果表明,在小鼠摄入实验中,持续每日摄入ε-PL不会导致肠道微生物群的永久性变化,为其安全性提供关键证据,表明ε-PL对生物体无毒无害,在生物体中能够直接降解成赖氨酸[7]。ε-PL已被日本、韩国等国家的机构批准作为食品防腐剂。中国也于2014批准ε-PL能够用于果蔬的保鲜。近年来,应用到食品加工行业中的抗生素种类以及剂量不断增加,细菌耐药性问题也随之严重,而ε-PL作为一种无毒、安全、可生物降解的天然抗菌剂,与传统抗生素相比,在发挥抑菌作用的同时不易产生耐药性,目前,已有相关报道将ε-PL应用于果蔬、肉类等保鲜防腐技术。如卢绪志等[9]的实验结果表明,ε-PL可抑制肉类中微生物的生长及相关酶的活力;巴良杰等[10]利用含500 μg/mL ε-PL的保鲜纸贮存果李,结果表明,ε-PL保鲜纸抑制了果实的腐烂率、失重率及MDA含量的增加,削弱了果实的呼吸强度,保持了果实良好的感官品质。同时,ε-PL对单增李斯特菌、沙门氏菌、金黄色葡萄球菌、致病性大肠杆菌等重要食源性致病菌都具有良好的抑菌效果[11]。但尚未有文献报道ε-PL对乳源性条件致病菌阪崎克罗诺杆菌是否有抑制作用,在本研究中,以阪崎克罗诺杆菌质控菌株为供试菌来研究ε-PL对阪崎克罗诺杆菌及其生物被膜的作用机制,初步探索其对阪崎克罗诺杆菌的抗菌机制,以期为ε-PL在食品加工中的进一步应用和研究提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 阪崎克罗诺杆菌ATCC51329,为实验室保藏菌株。
1.1.2 培养基及溶液 (1)TSB液体培养基:胰蛋白胨17 g/L,大豆蛋白胨3 g/L,氯化钠5 g/L,磷酸二氢钾2.5 g/L,葡萄糖2.5 g/L,调pH至7.3±0.2。(2)TSB固体培养基:在液体培养基的基础上加入2.0%的琼脂。(3)TSB半固体培养基:在液体培养基的基础上加入0.5%的琼脂。所有培养基均121℃,1×105Pa灭菌15 min。(4)磷酸缓冲盐溶液(phosphate buffer saline,PBS):KH2PO40.24 g/L,Na2HPO41.44 g/L,NaCl 8 g/L,KCl 0.2 g/L,调pH至7.4。
1.1.3 主要试剂与仪器 PI染色试剂盒,生工生物工程股份有限公司;SYTO 9染色试剂盒,赛默飞世尔科技公司;碱性磷酸酶活力测试试剂盒,南京建成生物工程研究所;ε-PL(纯度≥98%),郑州拜纳佛生物工程股份有限公司;磷酸二氢钾、葡萄糖、胰蛋白胨、氯化钠、琼脂粉、结晶紫,大豆蛋白胨,均为国产分析纯。主要仪器如下:全自动酶标仪(美国赛默飞)、荧光倒置显微镜(德国徕卡)、透射电子显微镜(日本日立)、电热恒温鼓风干燥箱(金坛市杰瑞尔电器有限公司)、隔水式恒温培养箱(宁国沙鹰科学仪器有限公司)、台式低速离心机(湖南湘仪实验室仪器开发有限公司)等。
1.2 方法
1.2.1 菌株活化 挑取供试菌单菌落接种于10 mL TSB液体培养基中,37℃、180 r/min过夜培养后,将培养液按1%的接种量转接到10 mL新鲜TSB液体培养基中,37℃、180 r/min振荡培养至OD600为0.4,备用。
1.2.2 ε-聚赖氨酸抗菌活性的测定
1.2.2.1 ε-PL 对阪崎克罗诺杆菌的最小抑菌浓度测定 采用肉汤稀释法进行ε-PL对阪崎克罗诺杆菌最小抑菌浓度的测定,将供试菌菌悬液接种在ε-PL终浓度为 4 096、2 048、1 024、512、256、128、64、32 μg/mL的96孔板中,以不加ε-PL溶液作为对照组,在37℃下恒温培养24 h,于波长600 nm处测定OD值。与对照孔相比,完全抑制被测菌株可见生长的最低抑菌剂浓度被确定为MIC浓度[12]。
1.2.2.2 ε-PL 对阪崎克罗诺杆菌生长的测定 将活化后的菌悬液按1%的接种量转接到50 mL新鲜TSB液体培养基中,并向新鲜TSB液体培养基中分别加入ε-PL溶液,使ε-PL终质量浓度为1/8×MIC、1/4×MIC、1/2×MIC、1×MIC、2×MIC,以不加 ε-PL溶液作为对照组,每个浓度重复3次,37℃恒温中200 r/min震荡培养,间隔2 h吸取各体系中200 μL液体,加入96孔板中测定吸光度。24 h作为一个周期来绘制时间生长曲线。
1.2.3 ε-PL 对阪崎克罗诺杆菌细胞膜壁结构的影响 将活化的菌液4 000 r/min 离心10 min,收集菌体。使用PBS洗涤3次并重悬。向其中加入ε-PL溶液以形成1×MIC和2×MIC的终浓度,以不加ε-PL溶液作为对照组。
1.2.3.1 核酸通透性分析 将供试菌液于37℃、180 r/min振荡器中培养,每隔2 h取样一次,4 000 r/min离心10 min取上清,测OD260值。研究ε-PL对菌体细胞膜通透性的影响。
1.2.3.2 碱性磷酸酶含量分析 将供试菌液37℃静置培养0、3、6、9、12 h取样,使用碱性磷酸酶测试盒测定AKP酶活,研究ε-PL对菌体细胞壁通透性的影响。
1.2.4 透射电镜观察ε-PL 对阪崎克罗诺杆菌细胞形态的影响 阪崎克罗诺杆菌接种至TSB培养基中,调整菌液浓度为107CFU/mL,加ε-PL溶液,使ε-PL终浓度分别为1×MIC、2×MIC,空白对照组加同体积的培养基,置37℃、150 r/min摇床中培养6 h。取菌液离心,无菌PBS洗涤至上清无色透明为止,弃上清,收集细菌沉淀。以2.5%的戊二醛溶液固定2-4 h,然后再用1%的磷钨酸钠缓冲液混合,用无菌毛细吸管吸取混合菌悬液滴在铜网膜上,样品干燥后,通过透射电子显微镜观察ε-PL对细菌形态的影响。
1.2.5 ε-PL对阪崎克罗诺杆菌表面疏水性的影响 供试菌液制备同1.2.4,将供试菌液37℃静置培养6 h,将2 mL供试菌液与800 μL二甲苯混匀,震荡2 min,室温垂直静置30 min,测定下液相的OD600,细菌表面疏水性计算公式:
疏水性(%)=[(菌液稀释后OD600-菌液静置后下液相的OD600)/菌液稀释后的OD600]×100%
1.2.6 ε-PL对阪崎克罗诺杆菌泳动性的影响 供试菌液制备同1.2.4,将供试菌液37℃静置培养6 h,取1 μL供试菌液滴加至半固体琼脂培养基中,37℃静置培养12 h,测量供试菌泳动直径,每组实验重复3次,取平均。
1.2.7 亚抑菌浓度ε-PL 对阪崎克罗诺杆菌生物被膜形成的影响 将活化后的菌悬液按1%接种量加至TSB培养基中。37℃、180 r/min振荡器中培养,将培养至对数期中期,超净工作台中分装至玻璃试管中,向其中加入ε-PL溶液以形成1/8×MIC、1/4×MIC的终浓度,以不加ε-PL溶液作为对照组。37℃、在恒温恒湿培养箱中静置培养,每隔12 h取样一次。使用0.1%结晶紫染液进行染色,33%的冰醋酸进行脱色,观察生物被膜形成情况。
1.2.8 ε-PL对阪崎克罗诺杆菌生物被膜清除的影响 将活化后的菌悬液按1%接种量加至TSB培养基的玻璃试管中。在37℃恒温培养箱中静置培养36 h,倒掉培养基,使用PBS洗涤3次,向其中加入ε-PL溶液以形成1×MIC和2×MIC的终浓度,以不加ε-PL溶液作为对照组。分别放置在静置和震荡环境中浸泡处理3、9、20 h,结晶紫染色法检测生物被膜清除效率[13]。细菌生物被膜清除率由公式:
生物被膜清除率(%)=[(清除处理前OD595-清除处理后OD595)/清除处理前OD595]×100%
1.2.9 激光共聚焦显微观察生物被膜清除效果 使用无菌盖玻片作为生物被膜附着载体,样品制备同1.2.8,用PBS溶液清洗清除处理后样品3次后使用30 mmol/L PI和50 mmol/L STYO 9染色液进行染色处理,在黑暗条件下染色反应15 min,使用倒置荧光显微镜观察,在室温下评估细胞膜通透性[1]。
1.2.10 数据处理与分析 采用OriginPro 2018进行数据处理、作图和数据差异性分析。
2 结果
2.1 ε-PL对阪崎克罗诺杆菌抑菌活性评价
通过比较ε-PL处理前后的吸光度变化及视觉观察,对抑菌活性进行测定,实验结果如图1-A所示,随ε-PL质量浓度升高,OD600值逐渐减小,表示ε-PL对阪崎克罗诺杆菌的抑菌效果越强。当ε-PL的终质量浓度为256 μg/mL时,其OD600值为对照组OD600值的16.08%,几乎完全抑制了菌体的生长,表明ε-PL对阪崎克罗诺杆菌ATCC51329的MIC值为256 μg/mL。
测定阪崎克罗诺杆菌在ε-PL不同浓度作用下浮游菌的OD600,绘制其生长曲线结果如图1-B。对照组在2-8 h快速生长,10 h后趋于稳定,OD600稳定于1.4左右,而ε-PL可抑制阪崎克罗诺杆菌浮游菌株生长,并且随着药物浓度的升高其抑制作用越强,浮游菌的生长受到明显抑制。1/8×MIC、1/4×MIC ε-PL浓度下对阪崎克罗诺杆菌浮游菌株生长的影响不显著,属于亚抑菌浓度。1/2×MIC ε-PL浓度下培养发现,菌体生长对数期延缓,终点OD600约为对照组的70%,菌体生长受到影响。而ε-PL质量浓度大于1×MIC时,OD600几乎没有增长,实验中的菌液也接近澄清,说明此时ε-PL几乎能够完全抑制阪崎克罗诺杆菌生长。
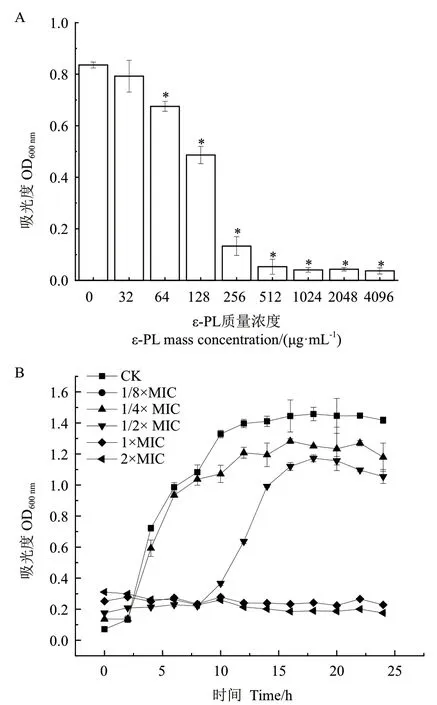
图1 ε-PL对阪崎克罗诺杆菌的抑菌评价Fig. 1 Bacteriostatic evaluation of ε-PL against C. sakazakii
2.2 ε-PL对阪崎克罗诺杆菌膜壁特性的影响
2.2.1 胞外核酸分析 细菌上清液的紫外吸收情况如图2-A所示。与对照相比,亚抑菌浓度1/8×MIC、1/4×MIC ε-PL浓度下,紫外吸收未随时间改变而升高,核酸泄露量没有发生明显改变,亚抑菌浓度处理并未引起细胞膜通透性的改变。与对照相比,1/2×MIC ε-PL处理1 h后趋于稳定,OD260达到了0.398,较起始增加了33.67%;1×MIC ε-PL处理4 h后趋于稳定,OD260达到了0.772,较起始增加了66.19%;2×MIC ε-PL处理3 h后趋于稳定,OD260达到了0.853,较起始增加了70.22%,实验组在260 nm波长处的吸光值均显著大于对照组。
2.2.2 胞外碱性磷酸酶分析 暴露于ε-PL下的阪崎克罗诺杆菌AKP浓度变化如图2-B所示,亚抑菌浓度1/8×MIC、1/4×MIC、1/2×MIC组AKP浓度并未随处理时间变化而明显增加。在前3 h内,1×MIC、2×MIC组中AKP浓度均快速增加。对照组AKP浓度达到(0.529±0.187)U/L,1×MIC组和2×MIC组的AKP浓度要高于对照组,且AKP浓度随着ε-PL浓度的升高而增大,1×MIC组AKP浓度达到(2.115±0.187)U/L,2×MIC组AKP浓度达到(3.173±0.324)U/L。3 h后,1×MIC、2×MIC组中AKP浓度基本维持稳定。
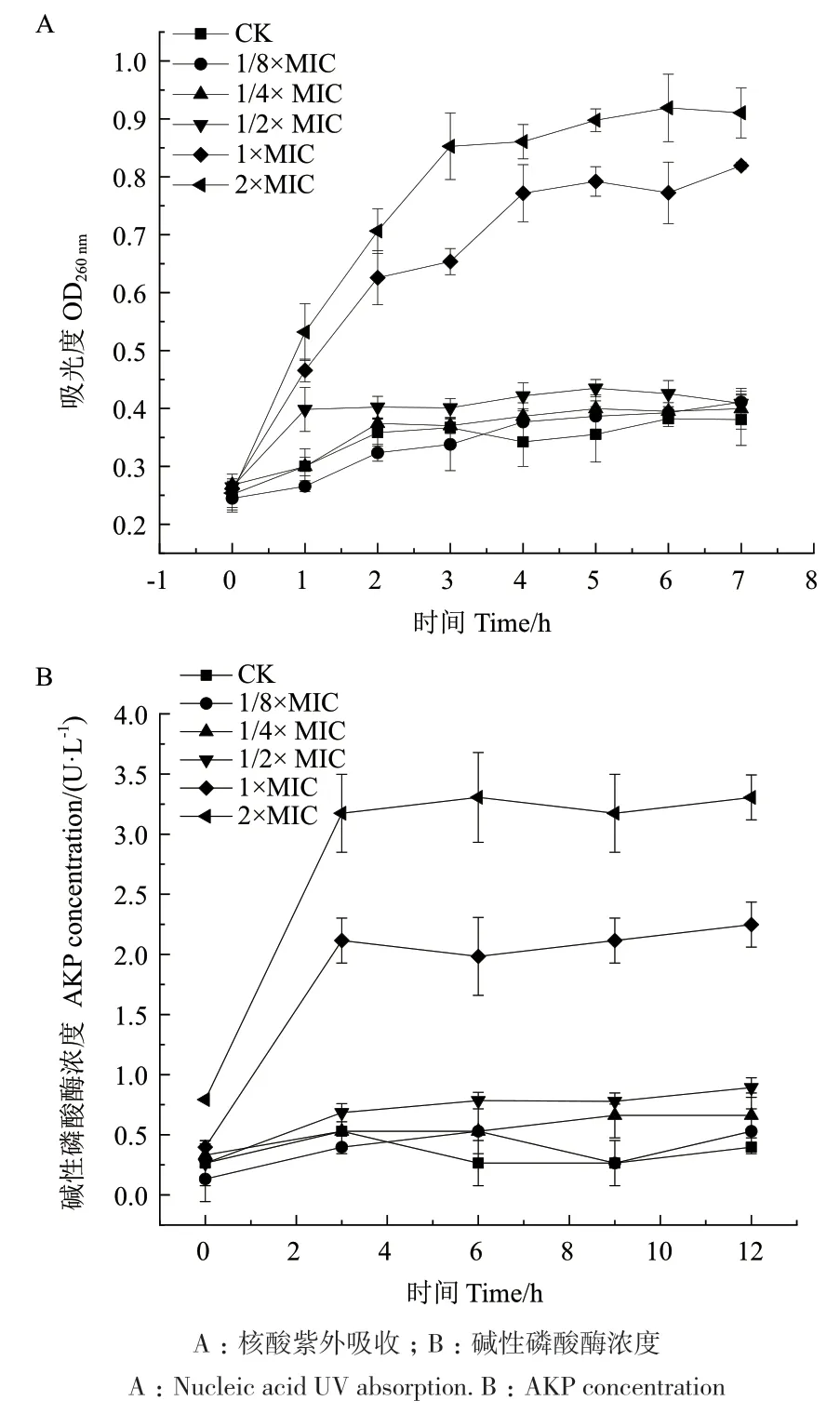
图2 ε-PL对阪崎克罗诺杆菌膜壁特性的影响Fig. 2 Effect of ε-PL on membrane wall properties of C.sakazakii
2.3 透射电镜观察
由图3可知,对照组(图3-A)菌体整体表现为杆状,菌体细胞形态保持完整,细胞膜结构光滑完整无破损,细胞内容物充实致密。经1×MIC的ε-PL处理后(图3-B),菌体出现了明显的凹陷、孔洞等受损情况,外观已发生改变。而经2×MIC的ε-PL处理后(图3-C),菌体细胞壁与细胞膜受损严重,部分细胞壁膜、细胞器和细胞核区消失,甚至细胞质内出现空化现象,菌体严重变形。
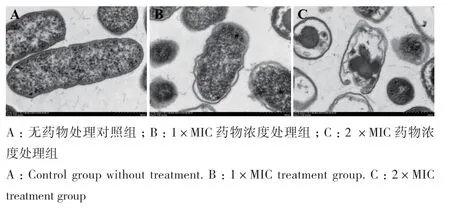
图3 ε-PL处理后阪崎克罗诺杆菌的透射电镜图像(×15.0 k)Fig. 3 Transmission electron microscope image of C. sakazakii after ε-PL treatment(×15.0 k)
2.4 菌体表面疏水性测定
由图4可知,经ε-PL处理后阪崎克罗诺杆菌表面疏水性明显下降,且呈ε-PL浓度依赖性。ε-PL处理3 h后,2×MIC组表面疏水性为66.31%,低于相同作用时间的1×MIC组(69.9%)和CK组(73.8%);ε-PL作用6 h时,2×MIC和1×MIC处理组阪崎克罗诺杆菌表面疏水性分别为47.3%和56.6%,而对照组基本维持不变。
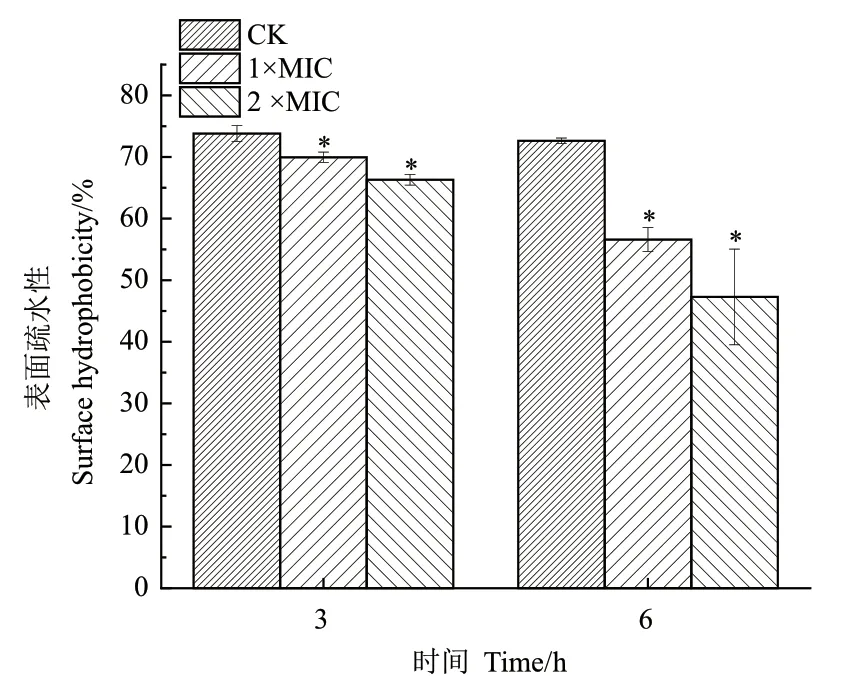
图4 ε-PL对阪崎克罗诺杆菌表面疏水性的影响Fig. 4 Effect of ε-PL on the surface hydrophobicity of C. sakazakii
2.5 泳动性测定
如图5所示,对照组阪崎克罗诺杆菌其泳动圈直径为(6.17±0.25)cm,经1×MIC和2×MIC浓度的ε-PL处理后,阪崎克罗诺杆菌泳动圈直径分别显著下降至(4.87±0.12)cm和(3.63±0.21)cm。说明ε-PL可以抑制阪崎克罗诺杆菌的泳动能力,且呈现浓度依赖效应。

图5 ε-PL对阪崎克罗诺杆菌泳动性的影响Fig. 5 Effect of ε-PL on the motility of C. sakazakii
2.6 ε-PL对阪崎克罗诺杆菌生物被膜形成的影响
时间杀灭曲线如图6所示,阪崎克罗诺杆菌生物被膜的形成可分为:0-24 h黏附期,24-48 h成熟期,48-96 h衰亡期。亚抑菌浓度的ε-PL可以大大减少生物被膜的产生。细菌生物被膜生长到36 h时,对照组生物被膜生长达到成熟期,其OD595达到了0.917,1/8×MIC浓度下生物被膜生长量的OD595达到了0.326,同对照组相比,抑制率达到64.45%。1/4×MIC浓度下生物被膜生长量的OD595达到了0.183,同对照组相比,抑制率达到79.39%。随着浓度的增加,生物被膜的形成明显减少。
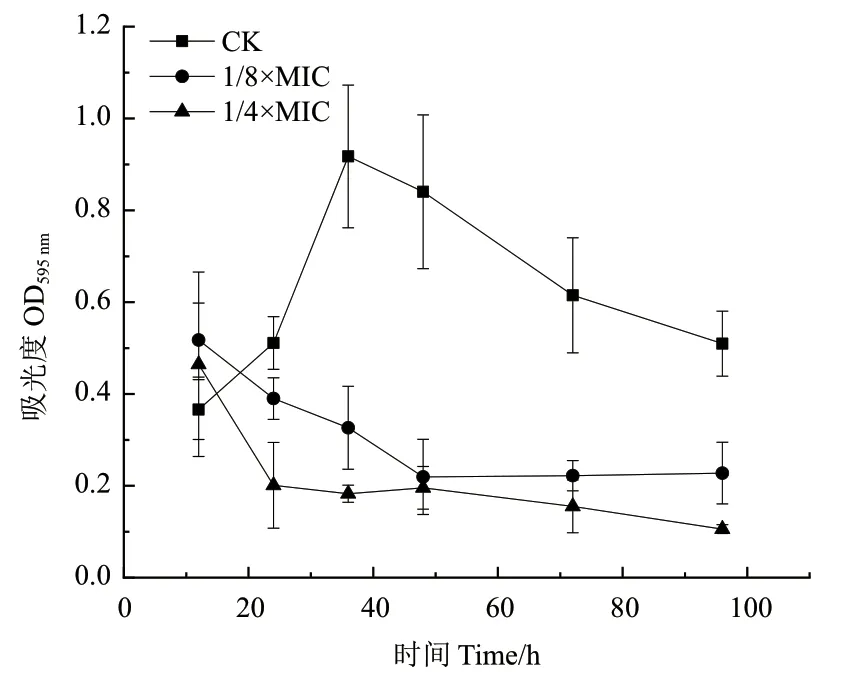
图6 ε-PL对阪崎克罗诺杆菌生物被膜形成量的影响Fig. 6 Effect of ε-PL on the amount of C. sakazakii biofilm formation
2.7 ε-PL对阪崎克罗诺杆菌生物被膜清除效果分析
由图7可知,静置处理时清除率随作用时间的延迟而提高,静置处理20 h时,清除率基本达到稳定,1×MIC处理的清除率达到58.00%,2×MIC处理的清除率达到63.20%,而联合物理振荡会缩短清除时间、提高清除率,振荡处理3 h时,清除效果基本稳定,清除率不再随时间的延长而大幅提高,1×MIC处理的清除率达到58.02%,2×MIC浸泡处理的清除率达到79.74%。

图7 ε-PL对阪崎克罗诺杆菌生物被膜清除率的影响Fig. 7 Effect of ε-PL on the biofilm clearance of C. sakazakii
2.8 荧光染色法检验生物被膜清除效果
由图8知,在ε-PL对生物被膜的清除不同处理方式中,静置20 h与振荡3 h清除效果基本稳定,下图为荧光显微镜下ε-PL对成熟生物被膜清除后剩余被膜菌通透性变化。图8-A-C为ε-PL静置处理20 h下对照组、1×MIC组、2×MIC组,由于处理时间较长,生物被膜菌死亡较为严重,荧光以红色为主,对成熟生物被膜的清除效果较弱。图8-D-F为ε-PL振荡处理3 h下对照组、1×MIC组、2×MIC组,对照组中因处理时间短而存在较多活细菌,荧光以绿色为主。视野下整体红色荧光占比随药物处理浓度升高而升高,菌密度随药物处理浓度升高而降低,实验结果同2.7结果相吻合。

图8 不同处理方式对生物被膜菌存活的影响(×200)Fig. 8 Effects of different treatment methods on the living of biofilms(×200)
3 讨论
目前已有相关学者开展ε-PL相关的抑菌机理研究,鲍佳佳等[14]实验发现ε-PL可抑制铜绿假单胞菌的生长和生物被膜的形成,并能清除部分预形成生物被膜。Shen等[15]比较分析了ε-聚赖氨酸处理和未处理的鼠伤寒沙门氏菌细胞的转录谱,发现卷曲淀粉样纤维和纤维素生成、群体感应和鞭毛运动相关基因的表达水平下调,而与可拉酸合成相关基因的表达水平上调。Ning等[16]考察了溶血素Lysqdvp001与ε-PL对副溶血性弧菌的协同抗菌作用。发现Lysqdvp001和ε-PL协同诱导副溶血性弧菌细胞损伤和形态学破坏,同时二者联用可去除聚苯乙烯、玻璃和不锈钢表面约44%-68%的副溶血弧菌生物被膜。陈晓青等[17]研究发现ε-PL对金黄色葡萄球菌具有抑制作用,ε-PL浓度升高时对金黄色葡萄球菌生长的抑制作用随之增强。1/2 MIC的ε-PL能显著降低金黄色葡萄球菌生物被膜的形成能力。
抗生素耐药菌株的出现一直是食品行业面临的一大难题。ε-PL已被应用于食品抑菌中以减少抗生素的使用。阪崎克罗诺杆菌是重要的乳源性条件致病菌,给乳制品加工行业带来巨大安全隐患,然而ε-PL对阪崎克罗诺杆菌的作用机制尚未见报道。本研究通过测定ε-PL对阪崎克罗诺杆菌的抑菌活性及对其生物被膜的清除、抑制作用,为ε-PL应用于乳制品加工食品安全提供理论基础。
细菌细胞膜壁结构的完整性是保证细菌正常代谢存活的重要条件之一。若细菌细胞膜结构受到破坏,核酸和蛋白质等大分子细胞内容物流出,通过测定核酸的释放情况,可进一步分析细胞膜的通透性[18]。Liu 等[19]在 ε-PL 对指状青霉的抑菌机制研究中发现,ε-PL破坏了细胞质膜的完整性导致内容物发生泄漏,而且ε-PL还可引起膜脂过氧化产生丙二醛(malondialdehyde,MDA),造成病原菌细胞进一步损伤。因此,用260 nm处的紫外吸收值测定核酸从细胞质中泄漏的量,评估细胞膜受损程度。碱性磷酸酶(AKP)是一种分布在细胞膜壁中间的酶,当细菌细胞膜壁结构保持完整时,在细胞外无法检测到其活性[20]。当细胞壁结构被破坏后,菌体抗渗透压能力下降,AKP泄漏出来[21]。因此,可通过检测细菌胞外的AKP活力变化来观察其对细胞壁的破坏情况。
结果表明,1/8×MIC、1/4×MIC、1/2×MIC等亚抑菌浓度的ε-PL不会大幅度改变阪崎克罗诺菌的细胞膜壁特性,与测定的时间杀灭曲线结果相吻合。而1×MIC、2×MIC等高浓度ε-PL的处理增加了阪崎克罗诺菌的细胞膜壁的通透性,以至于实验组外环境中260 nm波长处的吸光值显著升高、AKP活力增加。这是由于ε-PL为阳离子型多肽,会取代细胞壁表面的阳离子,与细胞膜中的磷脂头基结合,引起负曲率折叠的形成,损伤细胞膜,导致细胞壁结构发生改变而丧失正常功能[22]。由此可推断ε-PL发挥抑菌作用需要一定的阈值浓度,抑菌浓度下可以破坏细胞膜壁的完整性,加速核酸、AKP等细胞内容物从细菌胞内泄漏。一般认为ε-PL对细胞膜的作用属于物理作用,即毡毯模型理论[23]。
利用透射电子显微镜观察ε-PL的处理对阪崎克罗诺菌的细胞膜壁损伤的影响,结果表明,ε-PL的处理会使阪崎克罗诺菌菌体受损,出现空洞、空化等现象。一般认为,ε-PL对革兰氏阴性菌的敏感性要高于革兰氏阳性菌,可能和细胞壁组分有关,革兰氏阴性菌细胞壁表面分布着大量的脂多糖,带有大量负电荷,而革兰氏阳性菌细胞壁表面仅有少量磷壁酸带有负电荷,革兰氏阴性菌比革兰氏阳性菌更容易吸附ε-PL[24]。由于ε-PL在细胞表面的静电吸附作用,促使细胞膜和细胞壁剥离,内容物流出,使细胞受到生理损伤,且菌体受损程度与作用浓度有关。这与Hyldgaard等[25]研究ε-PL对大肠杆菌的抑菌作用结果相似。同时与本文细胞膜壁通透性实验结果保持一致。
生物被膜是由细菌自身分泌基质聚合物包裹细菌群形成的复杂网状结构,它能够定植在生物和非生物表面[26]。生物被膜的存在给公共卫生带来了极大的挑战,其原因是细菌通过生物被膜的保护作用,使菌体免受不良环境的侵害,生物被膜的存在能增强菌体抵抗抗生素等其他外部压力高度耐受的能力[27]。生物被膜菌对抗生素等抗菌药的抑制力是浮游菌的10-1 000倍[28],而ε-PL作为一种抗生素替代品,可用于抑制和清除细菌生物被膜的形成,同时减少食品加工领域的微生物耐药性的发生[29]。在生物被膜形成的黏附阶段,细菌需要运动到介质表面并通过黏附因子相互作用附着在介质的表面,从而形成菌落的聚集,为生物被膜的形成提供了基础平台。细菌的泳动性和表面疏水性与细菌生物被膜生长密不可分。表面疏水性影响着微生物在含水层中的迁移,表面疏水性越大,微生物的黏附性越大,越易形成生物被膜,越不易迁移。细菌的泳动性有利于细菌生物被膜的形成以及细菌在介质表面的黏附聚集,细菌迁移运动在生物被膜形成过程中具有极其重要的作用[30]。
实验结果表明,ε-PL处理后阪崎克罗诺杆菌表面疏水性明显下降,ε-PL作为阳离子型多肽,与菌体细胞表面阴离子型脂多糖结合,导致细菌细胞表面疏水性降低,最终起到破坏细胞壁膜的作用。此结果与杨昆等[31]的结果保持一致。同时证明ε-PL可以抑制阪崎克罗诺杆菌的泳动能力,且呈现浓度依赖效应。相关研究表明,黄芩苷同样对阪崎克罗诺杆菌具有抑制效果,通过实时定量PCR检测出黄芩苷可通过下调阪崎克罗诺杆菌与运动有关基因的表达[32]。该实验结果与郭都等[33]的研究结果保持一致。说明ε-PL能够降低阪崎克罗诺杆菌的表面疏水性,减弱其吸附能力,调控阪崎克罗诺杆菌的迁移能力,干扰其与运动相关基因的表达。
生物被膜中附着态细菌对于抗生素和宿主免疫系统等环境压力的抵抗能力大大增强,生物被膜一旦形成很难清除[34],所以从根源阻止生物被膜的形成是被膜防控的常用手段。从现实应用角度出发,采用亚抑菌浓度探究ε-PL对阪崎克罗诺杆菌生物被膜形成的影响,即减少ε-PL的使用剂量,探究在不影响细菌生长的情况下其生物被膜形成的抑制率。结果表明,ε-PL可以在不影响菌体生长的情况下对阪崎克罗诺杆菌生物被膜的形成具有良好的生物被膜抑制活性。推断亚抑菌浓度ε-PL可能通过破坏阪崎克罗诺杆菌的种间信息交流,影响阪崎克罗诺杆菌初始黏附,从而对其生物被膜的形成产生抑制。和Topa等[34]利用亚抑菌浓度的肉桂醛对铜绿假单胞菌生长及生物被膜形成的研究结果保持一致。
SYTO 9可以自由地穿透任何细胞的细胞膜,与胞内核酸相结合,并发出绿色荧光[35],PI也是一种核酸染料,但是细胞外PI只有在细菌细胞膜受损后才穿透破损细胞膜,能进入细菌插入到DNA,发出增强的红色荧光[36]。可以通过荧光显微镜观察细胞膜的破损情况[37]。
荧光染色实验证明ε-PL可穿透生物被膜,作用于生物被膜内的菌体,严重地破坏了阪崎克罗诺杆菌细胞膜的完整性,且呈浓度依赖性。也为ε-PL作用可有效清除阪崎克罗诺杆菌生物被膜提供了直接证据。顾玉卿等[38]实验结果表明,当冬凌草甲素纳米脂质体浓度大于MIC时,其对嗜水气单胞菌生物被膜的形成具有显著的抑制作用和清除效果,实验结论与本文一致。
目前采用物理手段如超声处理、紫外线辐射等处理病原菌,均可破坏病原菌细胞结构,有助于ε-PL在病原菌细胞膜上的吸收,二者能有效协同抑制病原菌的生长[39]。使用ε-PL对成熟的阪崎克罗诺杆菌生物被膜进行浸泡处理,并联合物理振荡,比较处理前后生物被膜量的变化,可以评估ε-PL对生物被膜的清除效果。实验结果表明,ε-PL处理对阪崎克罗诺杆菌生物被膜清除率随处理时间和处理浓度的增加而提高,且结合物理震荡能提高清除效率。推测ε-PL清除生物被膜是通过空化生物被膜结构、减少被膜菌之间的相互黏连,ε-PL穿过生物被膜作用于细菌,减弱细菌的代谢及相关产物合成,甚至杀死细菌,使生物被膜的结构出现疏松的孔状,导致生物被膜的脱落[40]。结合物理振荡可加速ε-PL穿透生物被膜结构,促进了生物被膜结构趋向瓦解。Li等[41]研究表明,山苍籽精油能以浓度依赖的方式破坏副溶血性弧菌的结构,有效地减少胞外多糖的分泌,破坏已形成的生物被膜,实验结果与本文结论保持一致。
4 结论
ε-聚赖氨酸能改变阪崎克罗诺杆菌细胞膜壁通透性、破坏细胞结构,抑制阪崎克罗诺杆菌生长繁殖。同时可降低阪崎克罗诺杆菌细胞表面的疏水性、运动性,抑制生物被膜的形成,对成熟生物被膜也具有清除作用,且结合物理振荡可提高清除效率。ε-聚赖氨酸具备开发为新型抗菌药物的潜力,可作为抗生素替代药物进一步深入研究。
