无色杆菌77的基因组构成及其趋化和耐药特性
2022-11-05李霁虹荆玉玲马桂珍郭荣君李世东
李霁虹 荆玉玲 马桂珍 郭荣君 李世东
(1. 江苏海洋大学环境与化学工程学院,连云港 222005;2. 中国农业科学院植物保护研究所,北京 100193)
土壤中不同生态位点微生物发挥着不同功能。菌丝际是真菌与土壤发生强烈反应的土壤微域[1]。菌丝际细菌既影响真菌功能,也影响植物生长[2]。黄瓜枯萎病是我国设施蔬菜生产中的重要病害,该病害在全国各地几乎都有发生,可导致黄瓜减产甚至绝收。该病害的病原菌尖孢镰刀菌黄瓜专化型(Fusarium oxysporum f. sp. cucumerinum,Foc)以腐生方式存活于土壤时可能为某些细菌类群提供了生态位点,并通过与真菌的互作,抑制或促进病害的发生[3]。Sun 等[4]发现连作后,黄瓜根际土壤中枯萎病菌数量增加,枯萎病菌菌丝际无色杆菌属细菌丰度上升,但是对枯萎病的抑制作用减弱;主坐标分析(principal co-ordinates analysis,PCoA)和置换多元方差分析(permutational multivariate analysis of variance,Permanova)发现连作、植物生长时期以及枯萎病菌接种是影响枯萎病菌菌丝际细菌群落构成的驱动因子,因此推测无色杆菌对根分泌物和真菌分泌物具有趋化和利用特性。深入了解无色杆菌与枯萎病菌的互作对理解连作条件下病害加重原因,寻找新的防控策略具有重要意义。
前人对菌丝际细菌和真菌之间的互作机理研究表明,真菌分泌物中碳水化合物、有机酸、低分子糖类等有机物质[5]为细菌生长提供了营养,不仅促进菌丝际细菌的生长和代谢活动,还影响菌丝际细菌的群落结构组成[6]。介导菌丝际细菌与真菌互作的化合物因真菌种属不同而有所不同。De Weert等[7]发现荧光假单胞菌WCS365对番茄枯萎病菌产生的镰刀菌酸有趋化响应,其Che基因突变株在枯萎病菌菌丝上的定殖能力明显减弱;Haq等[8]发现草酸是介导细菌Paraburkholderia terrae 向真菌Lyophyllum sp.和 Trichoderma asperellum菌 丝 趋 化的物质;孙宁康等[9]发现解磷细菌R. aquatilis对丛枝菌根真菌菌丝分泌物中的有机酸、氨基酸、核苷酸等物质有明显趋化响应。Nazir等[10]发现细菌Burkholderia terrae BS001与真菌Lyophyllum sp.共培养时,Lyophyllum sp.会分泌甘油,且很容易被细菌BS001利用,但Lyophyllum sp.与大肠杆菌Escherichia coli K12 共培养时并不产生甘油。有关无色杆菌在Foc菌丝际的定殖机理研究尚无报道。
本研究报道无色杆菌Achromobacter 77的基因组构成,其对根分泌物和真菌分泌物的趋化特性和利用能力以及其耐药特性,为深入研究细菌77在Foc菌丝际的定殖机理提供依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 无色杆菌77、黄瓜枯萎病菌中等致病力菌株Foc-M7,由本实验室分离、保存。
1.1.2 培养基 WA-N培养基:NaCl 5 g,KH2PO41 g,(NH4)2SO40.1 g,琼脂粉20 g,去离子水定容至1 000 mL,pH 6.7。
0.25% WA-N 培 养 基 :NaCl 5 g,KH2PO41 g,(NH4)2SO40.1 g,琼脂粉2.5 g,去离子水定容至1 000 mL,pH 6.7。
LB培养基:胰蛋白胨(tryptone)10 g,酵母提取物(yeast extract)5 g,NaCl 10 g,琼脂粉 20 g,去离子水定容至1 000 mL。
LB培养液:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,去离子水定容至1 000 mL。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉20 g,去离子水定容至1 000 mL。
1.2 方法
1.2.1 DNA提取 将细菌77接种于LB培养液中,28℃、180 r/min培养14 h,12 000 r/min离心5 min去上清。使用Wizard®基因组DNA纯化试剂盒(Promega)提取菌株77的基因组DNA。使用OD260/280=1.8-2.0,DNA总量≥15 μg,浓度大于等于50 ng/μL的高质量DNA进行建库测序。基因组测序在上海美吉生物医药科技有限公司完成。
1.2.2 Illumina 文库构建 将1 μg基因组DNA利用Covaris(M220)对其进行片段化,剪切成约400 bp片段的DNA样本。用NEXTflexTMRapid DNA-Seq试剂盒(Bioo Scientific)进行文库制备。操作步骤:将A&B接头;筛选掉接头自连片段;琼脂糖凝胶电泳进行片段筛选,保留一端是A接头、一端是B接头的片段;NaOH变性,产生单链DNA片段;桥式PCR扩增。
1.2.3 单分子文库构建 将15 μg基因组DNA利用G-tubes(Covaris,MA)将其处理成约10 kb的片段,根据PacBio的说明书(Pacific Biosciences,CA)进行片段纯化,末端补平,两端分别连接SMRT bell测序接头。
1.2.4 Illumina 测序 制备的文库在Illumina HiSeq 10 × 仪器上进行双端测序(2×150 bp)。操作步骤:加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只加入单种碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3' 端黏性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
1.2.5 PacBio 单分子测序 得到的测序文库用0.45倍 体 积 的 Agencourt AMPure XP beads(Beckman Coulter Genomics,MA)试剂进行3次纯化,然后,将文库单链环退火,结合到固定的ZMW(zero-mode waveguides,零模波导孔)底部的聚合酶上,加入测序反应试剂,每个碱基配对合成后会发出相应的光并被检测,每合成一个碱基即显示为一个脉冲峰,配上高分辨率的光学检测系统,进行实时检测。
1.2.6 基因组组装 原始下机数据以fastq格式存储。为使组装更加准确,需对原始数据进行质量控制,去掉测序质量较低、含N比例较高及质量修剪后长度较小的reads,得到高质量的clean data。利用canu(1.8)及HGAP(2.3.0)软件进行PacBio数据组装,将reads组装成contigs,然后人工成环,得到完整的染色体和质粒基因组。最后利用Illumina测序数据对组装结果进行校正。
1.2.7 基因注释与功能预测 利用PacBio RS II(SMRT)和Illumina平台(Hiseq 10×)生成的数据进行生物信息学分析,所有分析均在上海美吉生物的I-Sanger云平台(www.i-sanger.com)上进行。利用 Glimmer(3.02)[11]对基因组中的编码序列(CDS)进行预测;采用GeneMarkS[12]软件预测质粒;分别采用 tRNA-scan-SE(2.0)[13]和 Barrnap(https://github.com/tseemann/barrnap)进行tRNA和rRNA预测。利用 BLAST、Diamond[14]、HMMER 等序列比对工具以 及 Swiss-Prot[15]、GO、COG[16]、KEGG[17]数 据库对预测到的耐药基因、趋化基因等进行蛋白功能注释,并使用Diamond软件对分泌系统(KEGG数据库)、碳水化合物活性酶(CAZy数据库,http://www.cazy.org/)等进行分析及分类。
1.2.8 菌株77的趋化特性 采用改良的游动平板法[18]检验细菌77对多种已报道的菌丝分泌物成分的趋化响应。具体方法如图1所示。将边长13 cm的无菌方型培养皿等分为上下两部分,作为同处理的两组平行实验。A、C两点之间,B、C两点之间相距1 cm,A和B位置分别点接1 μL待测化合物(浓度为1 mmol/L)和1 μL无菌水,C位置点接1 μL浓度为1×107CFU/mL的细菌77菌液,每种化合物做3个平板的重复。28℃避光培养12 h后,观察细菌趋化圈并使用Epson PerfectionV850 Pro扫描仪进行平板扫描拍照。

图1 细菌77对真菌分泌物及根分泌物的趋化响应示意图Fig. 1 Demonstration of chemotactic response of strain 77 to fungal and root exudates
待测物质包括:(1)真菌分泌物或根分泌物:其中属于TCA循环中间物的化合物有[19]:琥珀酸、延胡索酸、α-酮戊二酸、苹果酸、柠檬酸;糖类:麦芽糖[18]、果糖[20]、鼠李糖、葡萄糖、甘露糖、海藻糖[21];氨基酸[20]:精氨酸、苯丙氨酸[22]、脯氨酸、丝氨酸;醇类:甘露醇、肌醇、山梨醇[23]。(2)尖孢镰刀菌特有分泌物:镰刀菌酸[24]。(3)根特有分泌物:水杨酸[20]、对羟基苯甲酸、对羟基苯乙酸、苯乙酸。
1.2.9 趋化化合物对菌株77生长的影响 在三角瓶中加入100 mL LB培养液,然后分别加入水杨酸、延胡索酸、α-酮戊二酸、对羟基苯乙酸、苹果酸、琥珀酸、镰刀菌酸,使其终浓度为 0、0.5、1、2、4、6、8、10 mmol/L,每处理3重复。取77菌液(OD600=0.8)60 μL加入到上述培养液中,于180 r/min、28℃培养24 h。从每瓶培养液中取600 μL转移到96孔板中,每孔200 μL,使用酶标仪测定样品的OD600值。通过比较菌株77的生长情况,明确趋化化合物对菌株77生长的影响。
1.2.10 菌株77对抗生素的抗性 采用滤纸片法检验细菌77对卡那霉素(氨基糖苷类)、氯霉素(氯霉素类)、氨苄青霉素(β-内酰胺类)、四环素(四环素类)等常用抗生素的抗性。将细菌77菌液与LB培养基混合倒板,使培养基中77终浓度为1×107CFU/mL,待凝固。将直径1 cm滤纸片放入不同浓度抗生素溶液中浸湿,取出后放在无菌培养皿上晾干,然后转移到含菌平板上,每平板放置4个不同抗生素浓度的滤纸片,28℃过夜培养后观察抑菌圈大小。
2 结果
2.1 菌株77基因组组装结果
原始测序数据经过数据质控过滤和短序列组装后,得到菌株77的全基因组。菌株77基因组大小为5 868 070 bp,有1条scaffold,包含1条染色体,无质粒,GC含量为65.89%(表1)。使用Circos软件绘制菌株77的基因组圈图(图2)。

图2 菌株77的基因组圈图Fig. 2 Circle map of the genome of strain 77
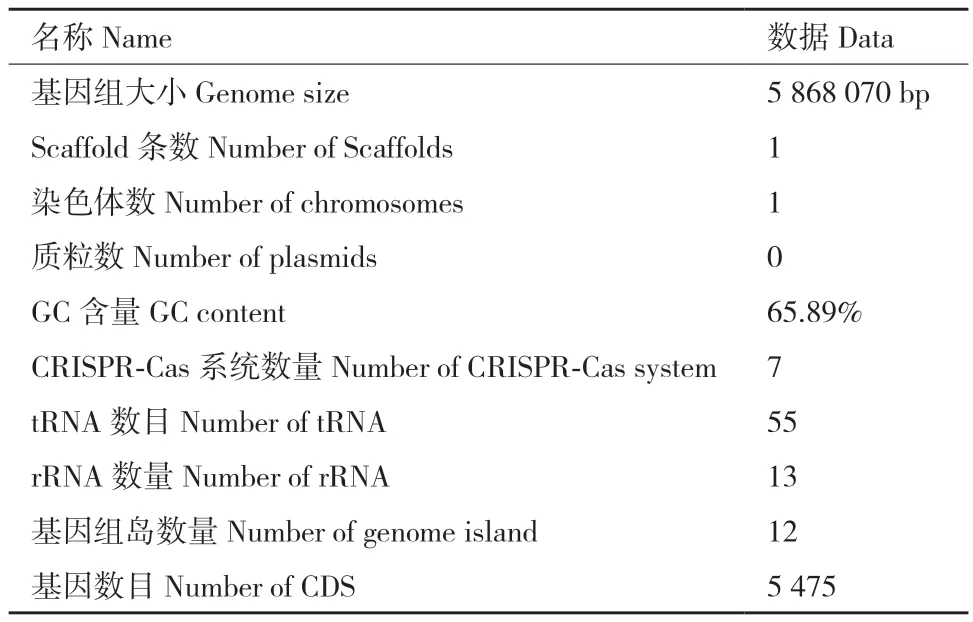
表1 菌株77基因组组装Table 1 Genome assembly of strain 77
2.2 功能注释
将菌株77的全基因组测序结果与6大数据库(NR、Swiss-Prot、Pfam、EggNOG、GO 和 KEGG)分别进行比对,获得数据库中的功能注释信息。对编码的各种基因进行了统计。并对KEGG、COG、GO注释结果进行详细解读。
2.2.1 KEGG注释 菌株77基因组中有2 696个基因在KEGG数据库被注释(图3),被注释的编码基因集中于细胞生物学进程,代谢通路,人类疾病通路,基因复制和转录通路,内分泌系统、细胞老化等生物系统通路,信号转导、膜运输等环境信息处理通路,基因个数分别为391、1 755、140、187、47、466。在新陈代谢途径中,有90个基因与外源物质的降解和代谢有关;有40个基因与抗菌耐药有关,说明菌株77可能对抗生素类物质具有耐受能力。

图3 菌株77基因组的KEGG注释途径Fig. 3 KEGG annotated pathways of strain 77’s genome
2.2.2 COG功能注释 菌株77基因组中有4 862个基因在COG数据库被注释,占细菌77所有基因的88.8%。菌株77的COG功能分为22类,其中预测最多的基因功能涉及能量产生和转换、氨基酸转运和代谢、碳水化合物运输和代谢、转录、无机离子的转运与代谢、信号转导机制等(图4)。

图4 菌株77基因组的COG功能注释分类Fig. 4 Annotated classification of COG functions of strain 77’s genome
2.2.3 GO注释分类统计 菌株77基因组中共有4 212个基因在GO数据库中被注释,占所有基因的76.93%。被注释的编码基因集中于细胞组成(cellular component,CC)、分子功能(molecular function,MF)、生物过程(biological process,BP)三大类(图5)。其中与分子功能相关的基因最多,达3 267个。在细胞组成中,有大量基因与分解代谢和趋化有关,这些基因可能参与了菌株77对根分泌物和真菌代谢物的趋化和分解代谢(表2)。

表2 菌株77基因组的GO注释中分解代谢与趋化相关基因统计Table 2 Statistics of catabolism and chemotaxis related genes in GO annotation of strain 77’s genome

图5 菌株77基因组的GO功能注释分类Fig. 5 Classification of GO functions annotation of strain 77’s genome
2.3 碳水化合物活性酶分析
在细菌77基因编码的六大类蛋白质家族中,糖基转移酶(glycosyl transferases,GTs)、碳水化合物酯酶(carbohydrate esterases,CEs)、辅助氧化还原酶(auxiliary activities,AAs)、糖苷水解酶(glycoside hydrolases,GHs) 占 比 分 别 为 35.71%、28.57%、19.05%和15.08%,多糖裂合酶(polysaccharide lyases,PLs)和碳水化合物结合模块(carbohydratebinding modules,CBMs)各占 0.79%(图 6)。糖基转移酶占比最高,该酶是糖基化过程中糖链合成的关键酶之一,参与多种基础生命活动。
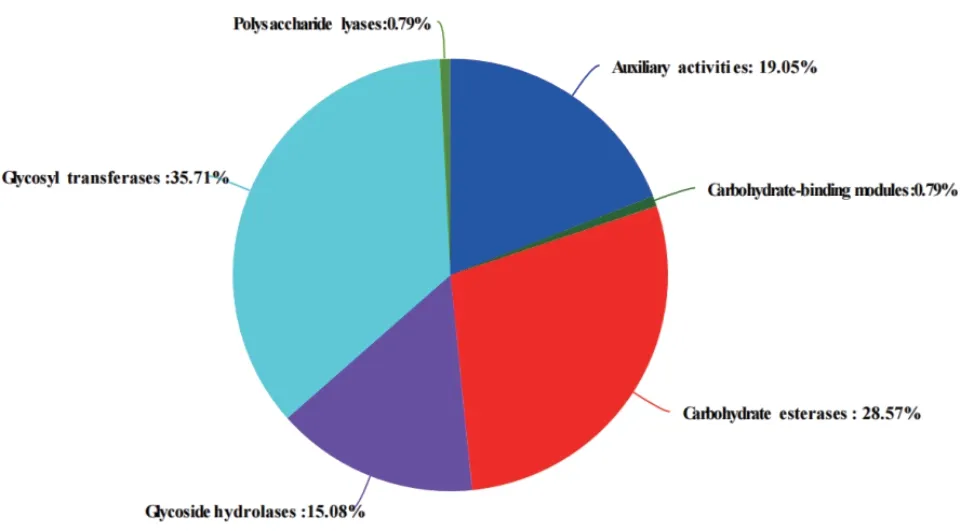
图6 菌株77基因组的碳水化合物活性酶注释统计Fig. 6 Statistics of CAZyme annotation of strain 77’s genome
2.4 趋化基因预测分类
在菌株77基因组中预测到多种类型的趋化基因(表3),可编码组成跨膜受体复合物所必需的多类趋化蛋白,包括:Mcp类、Tar类等甲基趋化受体蛋白、Aer类趋氧性受体蛋白、Che类(CheW、CheA、CheB、CheD、CheR、CheBR)趋化蛋白、Wsp类(WspA、WspB、WspC、WspD、WspF)趋化蛋白、负责调控鞭毛运动的鞭毛马达蛋白MotA以及功能未知的趋化蛋白。因此推测菌株77对某些物质具有趋化作用。
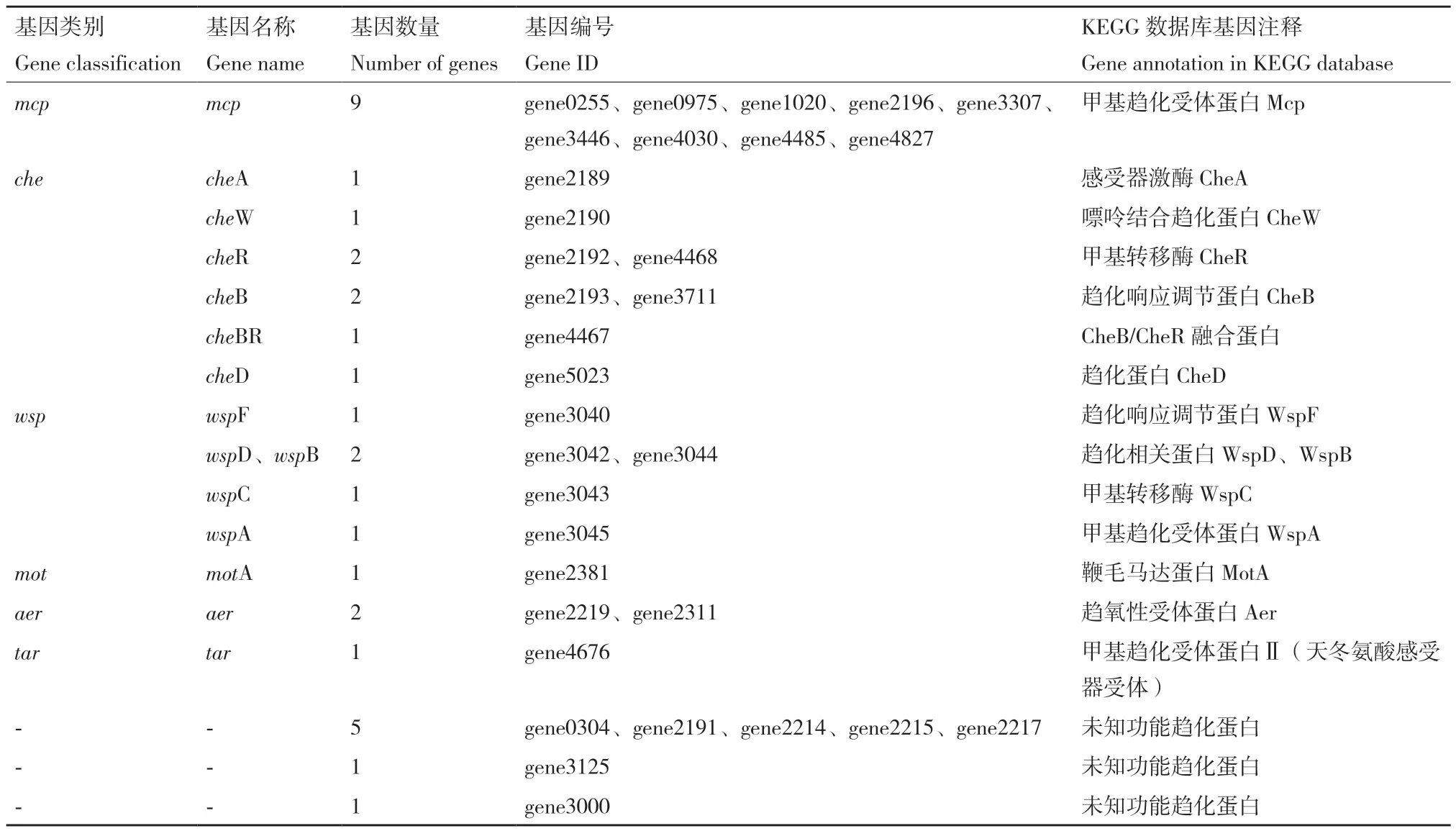
表3 菌株77趋化基因预测分类Table 3 Predictive classification of chemotactic genes of strain 77
2.5 分泌系统及耐药基因
对菌株77的分泌系统进行预测发现,与耐药和趋化相关的Ⅵ 型分泌系统(type Ⅵ secretion system,T6SS)占有较大比例,其次为在革兰氏阴性菌中普遍存在的Ⅱ型分泌系统,不含Ⅲ型和Ⅴ型分泌系统(表4)。对菌株77的耐药基因分析结果表明,有375个基因被预测为耐药基因,多被注释为抗生素耐药性外排泵基因、抗生素耐药基因簇、多种抗生素抗性基因。预测分类统计显示,细菌77对大环内酯类、氟喹诺酮类、青霉素类等十大类药物均有抗性(图7),推测菌株77可能是一株多重耐药菌株。

图7 耐药基因预测分类Fig. 7 Predictive classification of drug resistance genes

表4 菌株77分泌系统分类Table 4 Classification in secretion system of strain 77
2.6 菌株77对真菌分泌物及根分泌物的趋化响应
分别测试了菌株77对1.2.8中真菌分泌物或根分泌物的趋化响应,结果表明,菌株77对浓度为1 mmol/L的真菌分泌物或根分泌物中的α-酮戊二酸、延胡索酸、琥珀酸、苹果酸等及根分泌物对羟基苯乙酸、水杨酸(图8)等都有较明显的趋化响应;对糖类、氨基酸类及醇类则没有明显的趋化响应。

图8 菌株77对真菌分泌物及根分泌物成分的趋化响应Fig.8 Chemotactic responses of stain 77 to fungal and root exudates
2.7 趋化化合物对菌株77生长的影响
共测定了7种化合物对菌株77生长的影响,结果表明,所检测的化合物在低浓度时与77共培养24 h均可促进菌株77的增殖,但各物质促进菌株77增殖的浓度略有差异。水杨酸在浓度为0.5-2 mmol/L、延胡索酸在浓度为0.5-4 mmol/L时可促进菌株77的生长,在高浓度时抑制菌株77的增殖;其他5种化合物仅在0.5-1 mmol/L时促进菌株77的生长(表5)。
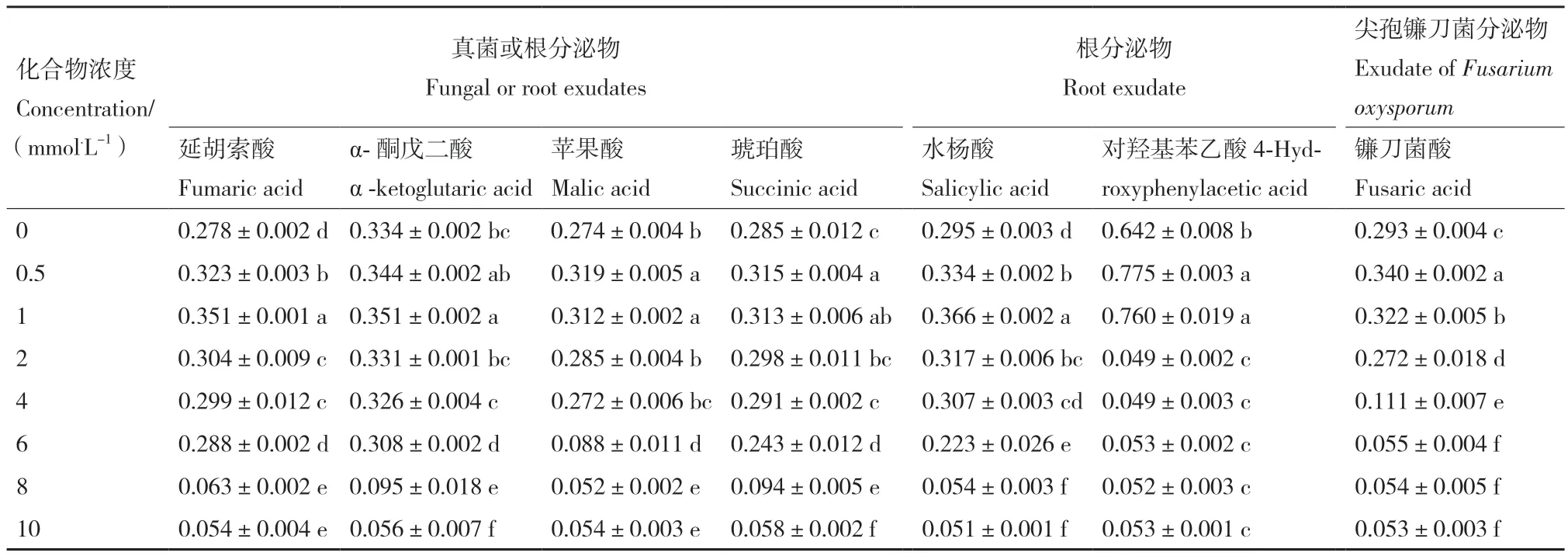
表5 真菌及根分泌物组分对菌株77 OD600的影响Table 5 Effects of fungal and root exudate components on OD600 value of strain 77
2.8 菌株77对常见抗生素的抗性
药敏试验表明,菌株77对卡那霉素、氯霉素和氨苄青霉素(图9-a-c)均有抗性,最高耐受浓度达到300 μg/mL;对浓度高于50 μg/mL的四环素(图9-d)敏感。表明菌株77对多种抗生素有较高的耐受能力。

图9 菌株77对常见抗生素的抗性Fig. 9 Resistances of strain 77 to common antibiotics
3 讨论
菌丝际细菌指存在于真菌菌丝周围的细菌。菌丝际细菌不仅影响真菌的生长,对植物也有一定影响[25-26]。深入揭示菌丝际细菌-真菌-植物之间的相互关系,对通过微生态调控促进植物生长具有重要意义。目前国内外学者主要从生理学和生态学角度研究菌丝际细菌与真菌的关系[27],认为真菌分泌物是影响菌丝际细菌种群构成的重要因素,但影响细菌向真菌趋化或在菌丝际定殖的真菌分泌物因真菌种属不同而异[7,28]。课题组前期研究发现无色杆菌77受到黄瓜连作和枯萎病菌侵染的影响[4],由于菌丝际细菌是采用枯萎病菌菌丝从根际土壤细菌悬浮液中诱集获得,因此推测菌丝际细菌除受到真菌分泌物影响外,也受到植物根分泌物的影响。本研究通过基因组解析和生物学功能研究,初步证明了根分泌物和真菌分泌物是影响菌株77高丰度存在于枯萎病菌菌丝际的重要原因,为深入理解土壤中菌丝际细菌与真菌和植物的关系提供了新的线索。
通过基因组分析预测基因的功能已成为常用的技术手段。对菌株77的基因组分析发现其基因组中含有完整的趋化基因,包括原核生物中重要趋化基因簇mcp、che等[29];趋化作用检测表明菌株77对真菌分泌物中的有机酸类化合物具有趋化作用,但对镰刀菌酸、苯丙氨酸、丝氨酸等氨基酸及鼠李糖、甘露糖、甘露醇等真菌分泌物[30]并无明显趋化响应,而低浓度有机酸和镰刀菌酸可以促进菌株77的增殖。该结果与孙宁康等[9]对菌根真菌菌丝际细菌的趋化作用研究结果部分相同,但与De Weert等[7]、Haq 等[8]、Palmieri等[31]研究结果不同。造成差异的原因可能有两个方面:(1)本研究与他人研究中的研究对象不同,即细菌和真菌不同,不同真菌产生的分泌物不同可能造成趋化作用的差异;(2)所采用的趋化研究方法不同。前人研究中所采用的游动平板法[7-8]、微流体芯片方法[9]、毛细管法[31]等均需要细菌与所检测的真菌分泌物或趋化物接触,而本研究所使用的趋化作用测定方法中细菌与真菌相距1 cm,并未接触,因而可能仅能检测到有机酸等强趋化作用物质,镰刀菌酸和其它真菌分泌物是否在接触后才表现趋化作用尚需进一步研究。
根分泌物是影响细菌在植物根际定殖的重要因素。有关根际细菌对根分泌物的趋化作用研究已有较多研究报道。Yuan等[32]研究发现芽孢杆菌对含有机酸的根系分泌物具有明显的趋化响应,其中对苹果酸的趋化作用最明显,延胡索酸还能促进芽孢杆菌生物膜的形成。Feng 等[20]使用微流控芯片设备检验解淀粉芽孢杆菌SQR9对黄瓜根系分泌物的趋化响应,发现SQR9对包括氨基酸(天冬氨酸、谷氨酸等)、有机酸(苹果酸、柠檬酸、延胡索酸等)和10种其他物质(甘露糖、海藻糖等)在内的44种物质都具有明显趋化作用。De Weert等[7]发现荧光假单胞菌WCS365在番茄根际定殖所需的第一步是该菌对番茄根分泌物的趋化,其中苹果酸和柠檬酸是最重要的趋化物。本研究发现菌丝际细菌77不仅对黄瓜根分泌物中的有机酸具有趋化和利用特性,对水杨酸、对羟基苯乙酸[21]等根分泌物也有明显的趋化和利用特性,低浓度的趋化物还促进菌株77的增殖。该结果说明无色杆菌77对植物根分泌物的趋化和利用是连作后无色杆菌属细菌在枯萎病菌菌丝际丰度上升的原因之一。
土壤中存在着很多细菌、放线菌和真菌,如青霉菌、放线菌可产生多种抗生素类物质拮抗其他微生物,具有耐药特性的微生物则为其自身生存创造了条件[33]。菌株77基因组中存在多个Ⅵ型分泌系统以及多种耐药基因如hcp、mac、pmr等,可能是菌株77抵御土壤中其它细菌和真菌而能存活的另一个重要原因。目前仅发现菌株77可利用低浓度的镰刀菌酸促进其自身增殖,是否通过耐受枯萎病菌产生的其它杀菌物质而增强其在菌丝际存活的几率,尚需要进一步研究。
综上所述,无色杆菌77基因组中存在大量与趋化、耐药等相关的基因,可能与其高丰度存活于枯萎病菌菌丝际有关,未来通过基因敲除和功能验证等技术手段可进一步深入了解无色杆菌77在枯萎病菌菌丝际的定殖机理。
4 结论
本研究对无色杆菌菌株77的基因组测序分析和功能注释发现其基因组中含有多种耐药基因和完整的趋化基因。该菌株对多种抗生素具有抗性,是一株抗生素耐药菌株。菌株77对根分泌物和真菌分泌物中多种有机酸、对根分泌物中的水杨酸和对羟基苯乙酸具有趋化作用;低浓度上述趋化物和镰刀菌酸可促进菌株77增殖。无色杆菌77对菌丝分泌物及植物根分泌物的趋化和利用是连作后无色杆菌属细菌在枯萎病菌菌丝际丰度上升的重要原因。
