氟喹诺酮类抗生素及耐药基因污染控制的研究进展
2022-11-05李柳穆迎春刘璐张洪玉徐锦华杨臻乔璐宋金龙
李柳 穆迎春 刘璐 张洪玉 徐锦华 杨臻 乔璐宋金龙
(1. 上海海洋大学食品学院,上海 200120;2. 中国水产科学研究院,北京 100141;3. 农业农村部水产品质量安全控制重点实验室,北京 100141)
氟喹诺酮类抗生素属于喹诺酮类抗生素,其化学结构中具有喹诺酮的基本结构和氟,故由此命名。该类药通过直接与病原菌DNA的非配对碱基结合,抑制病原菌的DNA螺旋酶,阻碍DNA的超螺旋,使其超螺旋不完全,造成其染色质不可逆受损,抑制其分裂增殖和生存,以此达到抑菌和杀菌作用[1]。常用的氟喹诺酮类抗生素包括环丙沙星、诺氟沙星、氧氟沙星和恩诺沙星。
氟喹诺酮药物是一类人畜通用的抗生素,因其抗菌谱广、杀菌力强、与其他抗菌药物不易出现交叉耐药性、价格低廉等特点,被广泛用于人类和畜牧、水产等养殖业领域中。然而氟喹诺酮类抗生素的大量使用,也引发了许多问题。现如今,氟喹诺酮类抗生素主要通过制药企业废水、医疗行业废弃物、畜牧业粪便及水产养殖用水等排放入自然环境[2],且由于氟喹诺酮类抗生素化学性质稳定,在水中较难降解,故其在环境中保留持久,并不断积累[3],这使得其在环境中的残留量不断增加。该类药物具有较强的生态毒性,其在环境中的富集会影响植物的生长和土壤的肥力[4]。水体环境中富集的氟喹诺酮类抗生素可进入水生动物体内,进而引入食物链,最终影响人体。据实际案例分析,氟喹诺酮类抗生素存在有多方面的不良反应,包括皮肤过敏、消化和呼吸系统损伤、存在神经毒性等,危害人体健康[2]。《中华人民共和国农业部公告第2292号》2015年明确规定,根据《兽药管理条例》第六十九条规定,在食品动物中停止使用洛美沙星、培氟沙星、氧氟沙星、诺氟沙星等4种兽药,撤销相关兽药产品批准文号,但恩诺沙星、环丙沙星等作为批准用药仍广泛用于畜牧、水产等养殖行业。
近年来,氟喹诺酮类抗生素在不同环境中频繁被检出,包括水环境、土壤和水生生物等中均有被检出,且检出率和检出浓度均较高。据报道,氟喹诺酮类抗生素在我国的近海域中均有检出,其中渤海中检测平均浓度高达726 ng/L[5];在我国的河流和湖泊中氟喹诺酮类抗生素残留分布呈北高南低的趋势,其中北方的大清河中氧氟沙星的含量呈现最大值16 952.5 ng/L[4];在我国的饮用水源地中也检测出此类药物,2020年在南京市的饮用水源地中检测出多种氟喹诺酮类药物,其中环丙沙星含量达317.60 ng/L[6];2020年石家庄市地表水和地下水中均检测有该类药物,结果显示,地表水中浓度高于地下水,其中地表水中恩诺沙星的含量最高,达到1 675 ng/L[6];在我国的农田土壤中,氟喹诺酮类抗生素中恩诺沙星、诺氟沙星和环丙沙星的检出浓度最高,平均值分别介于0-99.4、0-141.73、0-126.25 μg/kg,接近或高于引发生态毒性的限值100 μg/kg[7];江苏养殖区内斑点叉尾鮰中检测出恩诺沙星和环丙沙星,且其含量超过最大残余限量200 μg/kg[8]。因此,氟喹诺酮类抗生素在环境中存在大量残留,并对环境和人类健康造成极大安全隐患,而有效地去除该类药物残留显得尤为重要。
与光降解、化学氧化降解、电离辐射降解等物理和化学方法降解去除氟喹诺酮药物残留相比,微生物降解法存在显著优势:成本低、操作简易、对环境无损害、无二次污染等,使得微生物降解法成为一种极具潜力的氟喹诺酮类抗生素去除方式。近年来,有许多专家学者对该领域进行了研究,氟喹诺酮类抗生素的微生物降解逐渐成为关注点。本文详细介绍了近年来氟喹诺酮类抗生素微生物降解单株菌和混合菌系、微生物降解酶、降解途径以及氟喹诺酮类抗生素的微生物处理方法等,以期为后续微生物降解氟喹诺酮类抗生素的研究提供参考。
1 氟喹诺酮类抗生素降解菌
1.1 降解氟喹诺酮类抗生素的单株菌
氟喹诺酮类抗生素的微生物降解,是利用微生物的代谢作用将氟喹诺酮类药物完全矿化为小分子无害物质,或对其结构进行修饰转化为对环境无损伤的物质,而筛选和分离能高效降解氟喹诺酮类抗生素的微生物是其中的重要部分。近年来,科研人员分别分离和鉴定了许多氟喹诺酮类抗生素降解菌株,并对其降解性能进行了研究(表1)。由表1可看出,菌株中包括细菌和真菌,其中具有降解该类药物能力的细菌来自苍白杆菌属(Ochrobactrum)、栖热菌属(Thermus)、慢生根瘤菌属(Bradyrhizobium)、芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、微球菌属(Micrococcus)、葡萄球菌属(Staphylococcus)、分支杆菌属(Mycobacterium)、假单胞菌属(Pseudomonas)、肠杆菌属(Enterobacter)、肠球菌属(Enterococcus)等,具有降解该药物能力的真菌一般为白腐真菌、褐腐真菌、软腐真菌三类。与细菌相比,真菌具有更强的高药物浓度耐受性,并大多可降解多种氟喹诺酮类抗生素。Čvančarová等[19]在研究一组白腐真菌对不同氟喹诺酮类抗生素的生物降解时表明,白腐真菌中Trametes versicolor和Irpex lacteus两株菌在10 mg/L的抗生素初始浓度下,在10-14 d可基本完全降解环丙沙星、诺氟沙星和氧氟沙星。真菌相对于细菌所展现出来的一定优势,主要是由于真菌酶的非特异性,以及其强大的酶系。
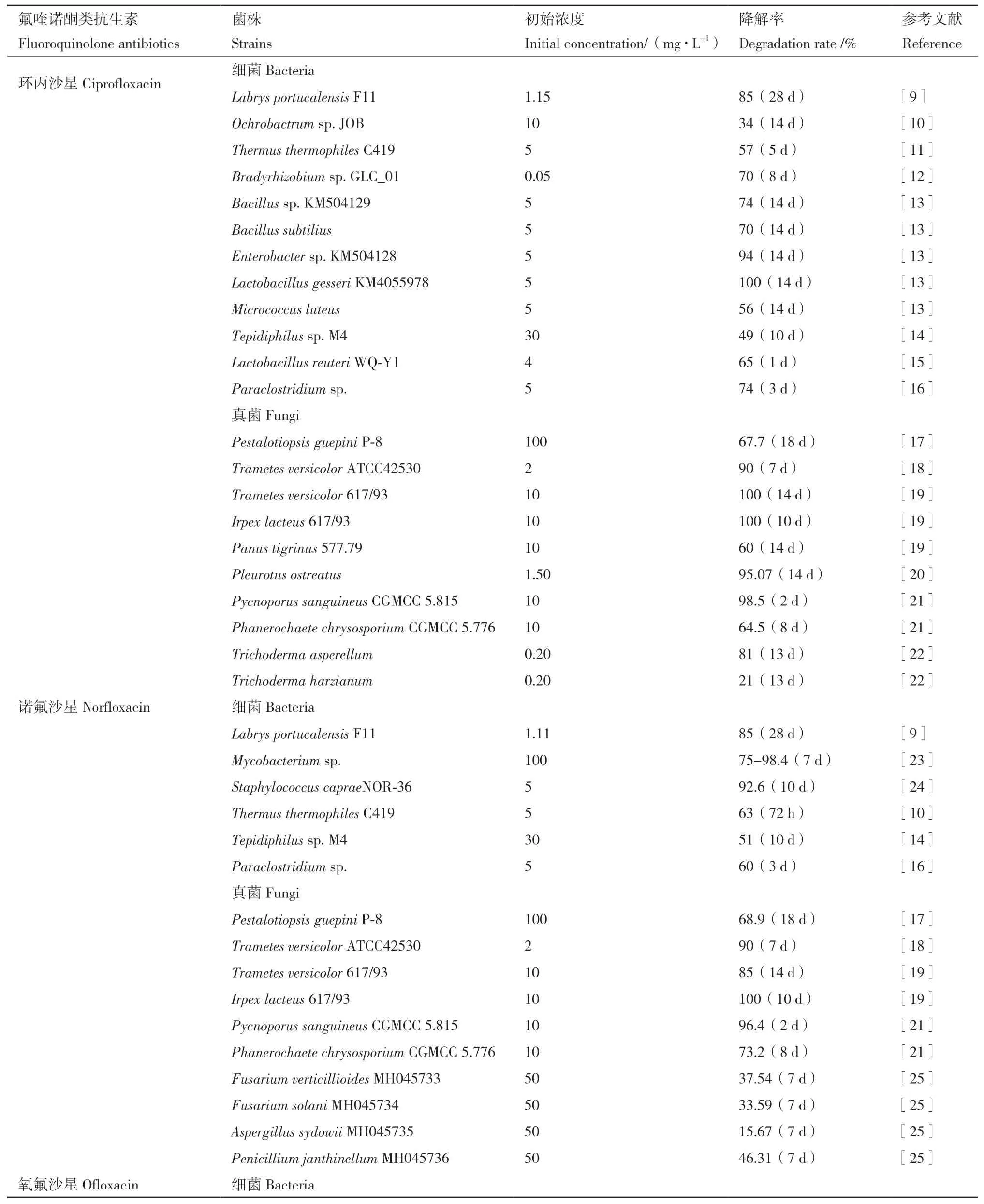
表1 已报道的降解氟喹诺酮类抗生素的菌株Table 1 Reported strains that degrade fluoroquinolone antibiotics

续表(Continued)
此外,除分离得到常温降解菌外,还分离得到了在较高温环境下降解性能也较好的降解菌。Pan等[11]从抗生素制药厂的污泥中分离出了一株嗜热细菌Thermus thermophiles C419,可以在70℃左右的温度下有效的降解环丙沙星,并对诺氟沙星、氧氟沙星和恩诺沙星等均表现出较好的降解效果。氟喹诺酮类抗生素在较高温度下的微生物降解,有利于其在实际应用中发挥优势,辅助热环境和热物质中的氟喹诺酮类抗生素残留降解。
1.2 降解氟喹诺酮类抗生素的菌群
在筛选和分离氟喹诺酮类抗生素高效降解菌株的同时,也有研究者对多株菌组成的混合菌群降解氟喹诺酮类药物进行了研究。Maia等[30]将Labrys portucalensis F11,Rhodococcus sp. FP1和Rhodococcus sp. S2三株菌混合培养,发现该菌群在19 d内可分别将10 mg/L的环丙沙星、诺氟沙星和氧氟沙星降解95.6%,96.1%,98.3%。构建合适的高效降解复合菌群混合培养可通过协调代谢作用提高其对氟喹诺酮类抗生素的降解效率,且可能获得细胞毒性较小的代谢产物。喻娇等[10]通过阶段驯化培养获得了能高效降解环丙沙星的混合菌群HD-1,在14 d内将10 mg/L的环丙沙星降解61%,并且相对于从菌群中分离出来的优势降解单菌Ochrobactrum sp.JOB,其降解效率提高了27%。Feng等[31]通过连续驯化构建的高效降解环丙沙星的稳定复合菌群XG,在14 d内可将5 mg/L的环丙沙星降解61.4%,其相较于从该复合菌群中分离出来具有降解环丙沙星能力的单株菌Ochrobactrum sp. YJ17,在14 d内将5 mg/L的环丙沙星降解34.3%,其降解效率有所提高。Gao等[21]发现诺氟沙星在P. chrysosporium和P. sanguineus混合培养情况下,其降解效果比用P.chrysosporium单独降解效果好,其代谢产物的细胞毒性比用P. chrysosporium和P. sanguineus分别单独降解产生的代谢产物毒性低。现今对于混合培养的协同代谢机制还有待进一步研究。
总的来说,筛选和分离具有高效降解效果的降解菌,是微生物降解氟喹诺酮类抗生素的重要组成部分。现如今分离得到的能够完全降解氟喹诺酮类抗生素的高效降解菌株较少,对于环境高耐受的菌株及高效降解混合菌群也较少,且需进一步研究微生物降解氟喹诺酮类抗生素的基因及酶系。
2 降解氟喹诺酮类抗生素的酶
微生物对于抗生素的降解,主要依赖于其胞内酶和外分泌酶对抗生素的分解和修饰作用。目前,已研究并确定了多种在微生物降解氟喹诺酮类抗生素过程中起主要作用的酶类型(表2)。其中最常见的是胞内细胞色素P450酶和胞外漆酶,这两种酶也是白腐真菌强大酶系中对氟喹诺酮类抗生素起主要作用的酶[18],白腐真菌因为其强大的非特异性酶系统而在污染物的降解方面起显著优势[39]。除此之外,还在一些细菌和真菌中分离和纯化了一些降解氟喹诺酮类抗生素相关酶,如氨基糖苷乙酰化转移酶、锰过氧化物酶、氯过氧化物酶和脱氢酶。每一种酶在降解氟喹诺酮类抗生素的过程中发挥的作用不一样。
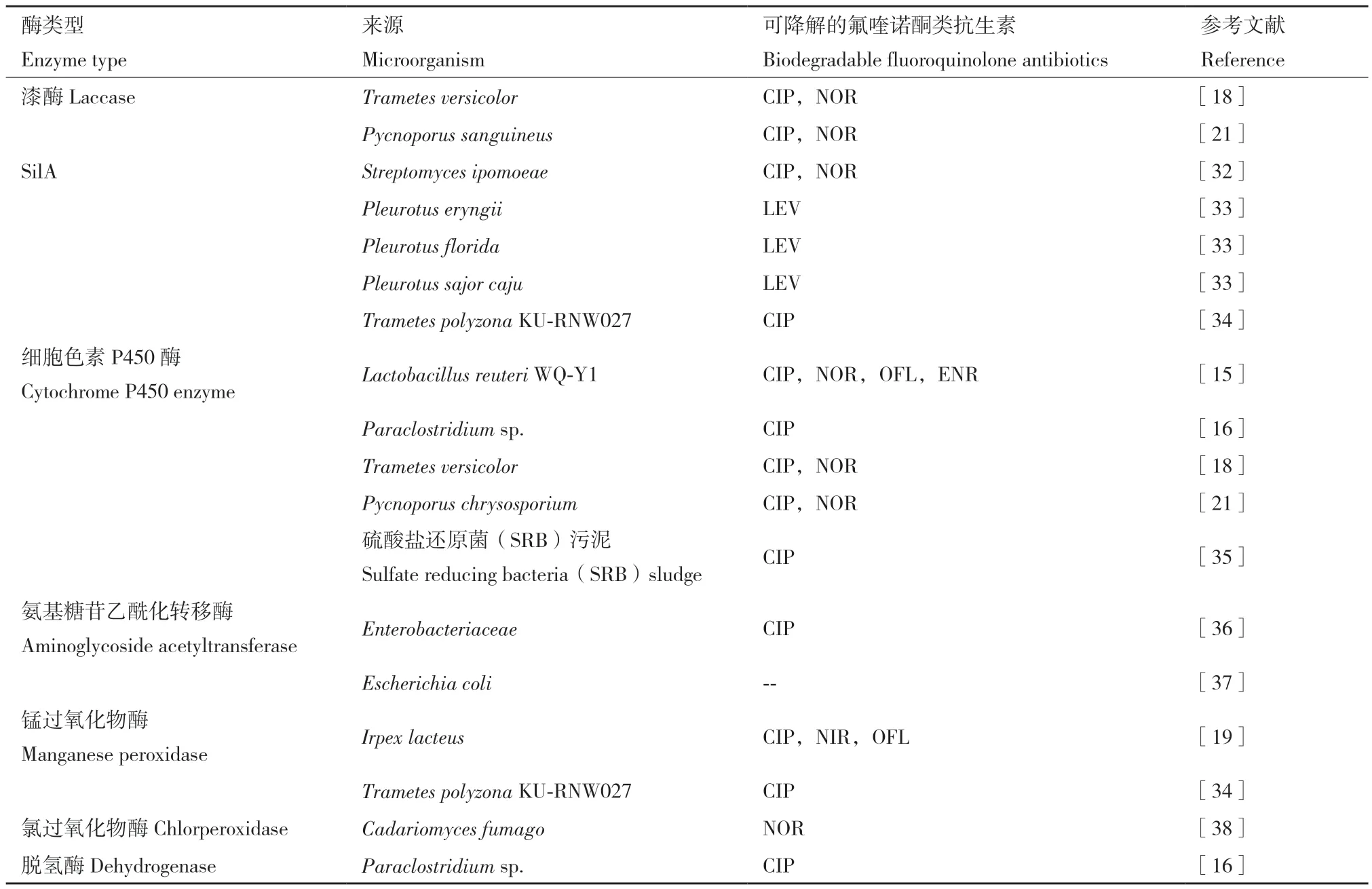
表2 降解氟喹诺酮类抗生素的酶Table 2 Enzymes degrading fluoroquinolone antibiotics
漆酶是一种细胞外蓝色多铜氧化物酶,其主要通过对哌嗪取代基的氧化来降解氟喹诺酮类抗生素,但其需要在与介质联用的情况下才能发挥降解效果。Blánquez等[32]从 Streptomyces ipomoeae中分离出一种新型的碱性漆酶SilA,其在单独使用时对环丙沙星和恩诺沙星没有效果,而在与乙酰丁香酮作为介质联用时,对环丙沙星和恩诺沙星降解效果最高达92.9%和93.2%,并通过对其降解产物的分析,确定漆酶是通过对哌嗪基团的氧化作用发挥作用。Ailette等[18]和Gao等[21]在研究微生物对氟喹诺酮类抗生素的降解机制时,也证实了漆酶在介质存在下对于氟喹诺酮类抗生素的降解作用,但对于其具体作用机制的研究并没有深入。
细胞色素P450酶主要通过哌嗪取代基的氧化、羟基化、脱羧和脱氟作用降解氟喹诺酮类抗生素。Prieto等[18]在研究Trametes versicolor对环丙沙星和诺氟沙星的降解作用时,使用细胞色素P450酶抑制剂抑制其酶活性,结果显示两种氟喹诺酮类抗生素降解受到抑制,说明该酶在这两种氟喹诺酮类抗生素降解中起关键作用,并通过产物鉴定以及联系细胞色素P450的性质,确定该酶可氧化哌嗪取代基和对芳香环羟基化,并可能参与脱羧和脱氟过程。Gao等[21]在研究P. chrysosporium对于环丙沙星和诺氟沙星的降解时也同样用到了细胞色素P450酶抑制剂,得到了相同的结果,并也通过产物鉴定确定了该酶是通过对哌嗪取代基的氧化而发挥作用。Qu等[15]在研究Lactobacillus reuteri WQ-Y1对氟喹诺酮类抗生素降解作用时,也确证了细胞色素P450酶的关键作用。
氨基糖苷乙酰转移酶主要是通过哌嗪环上的N-乙酰化对氟喹诺酮类抗生素进行降解。有研究发现,Escherichia coli对氟喹诺酮类抗生素敏感性下降、出现耐药性新的机制是aac(6')-Ib-cr编码的氨基糖苷乙酰转移酶对氟喹诺酮类抗生素的哌嗪环上的N-乙酰化[37]。锰过氧化物酶并未知道其具体降解机制,仅有研究者证明其在氟喹诺酮类抗生素降解中发挥作用。Lueangjaroenkit等[34]从 Trametes polyzona KURNW027中分离纯化了两种锰过氧化氢酶,其可以在1 U/mL含量下在1 d使25 mg/L环丙沙星失活。Čvančarová等[19]在研究 Irpex lacteus对氟喹诺酮类抗生素降解作用时,通过酶活性分析证实了锰过氧化氢酶参与降解过程。氯过氧化氢酶在氟喹诺酮类抗生素降解过程中表现为过氧化物酶活性,其在对诺氟沙星的降解中通过脱甲基、脱乙基、脱羧、脱氟反应实现诺氟沙星的降解[38]。脱氢酶通过羟基化反应参与降解。Fang等[16]在研究Paraclostridium sp.对环丙沙星的降解时,通过酶活性分析,证实了脱氢酶在降解过程中起主要作用,并通过产物分析,推断了其是通过羟基化反应实现降解环丙沙星。
在研究降解氟喹诺酮类抗生素的酶时,研究者大多仅证实了参与降解过程的酶,而对其酶的具体降解作用的深入研究较少,并且对其酶的研究还不够具体。
3 氟喹诺酮类抗生素的降解途径
现有报道的氟喹诺酮类抗生素的微生物降解途径有多种,不同代表药物的降解途径因其支链基团的不同而存在差异,但总体存在相似性(图1)[40]。氟喹诺酮类抗生素的微生物降解途径主要为:N-乙酰化(代谢为FQ-1)、哌嗪环的裂解(代谢为FQ-2,FQ-6,FQ-1.1,FQ-7.1,FQ-7.2)、脱羧(代谢为FQ-3)、脱氟(代谢为FQ-4)、羟基化(代谢为FQ-5,FQ-4.1)、哌嗪环去乙烯(代谢为FQ-6,FQ-1.1,FQ-7.1,FQ-7.2)、去甲基化(代谢为 FQ-8)。总的来说,氟喹诺酮类抗生素微生物降解以转化和修饰为主,未破坏其氮双并环基本结构,未实现产物的完全矿化,部分代谢产物仍存在抗菌活性[41-43]。
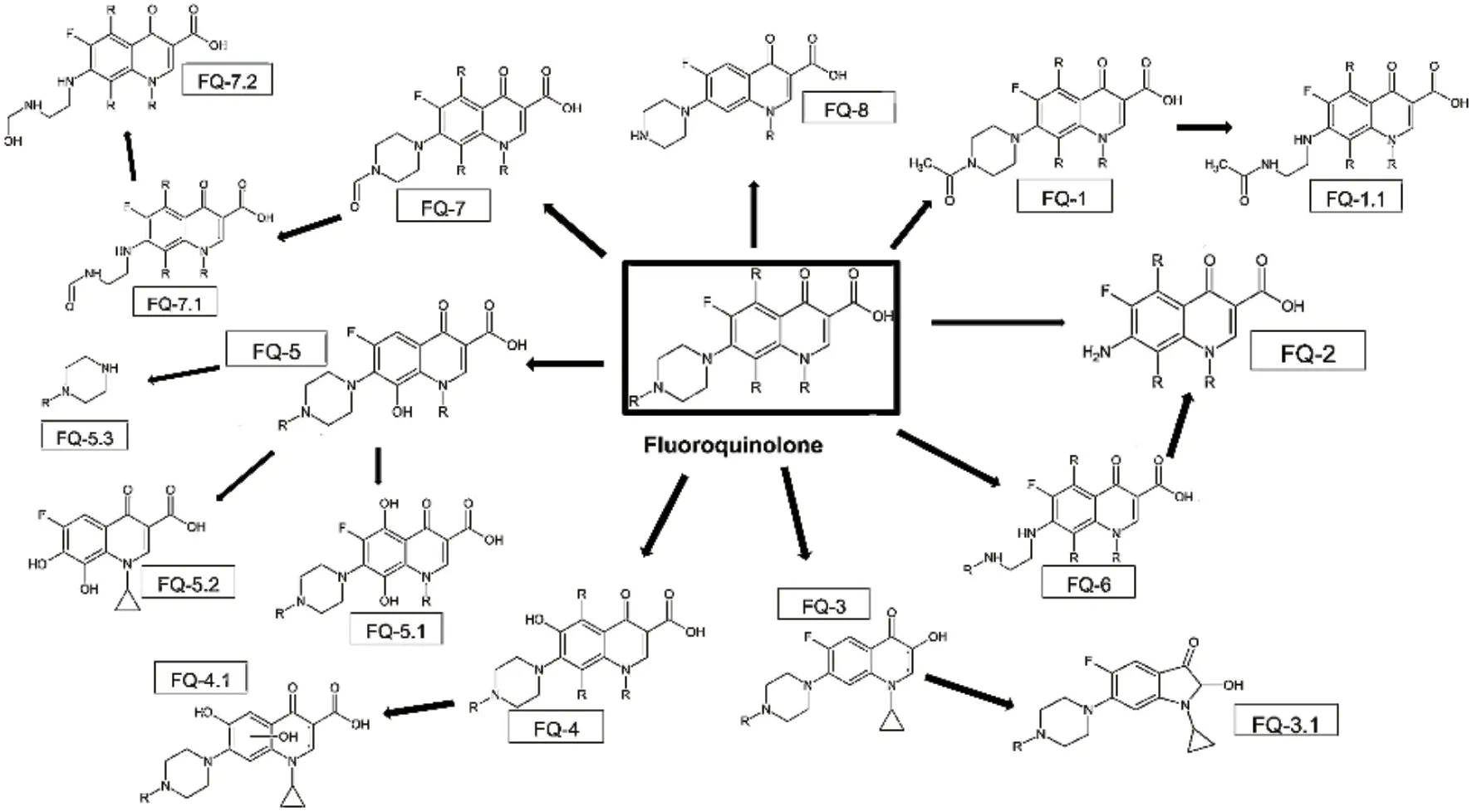
图1 细菌和真菌降解或转化氟喹诺酮类抗生素的主要途径Fig. 1 Main pathways of degrading or transforming fluoroquinolones by bacteria and fungi
氟喹诺酮类抗生素微生物降解途径的差异主要取决于代表药物取代基的不同及参与反应的微生物的不同。不同氟喹诺酮类药物因R基团的差异,展现出不同的降解趋向;参与反应的微生物不同,参与反应的酶系不同,则催化的反应不同,途径也就不同。在研究真菌Xylaria longipes对环丙沙星的微生物转化实验中,在培养基中加入10 mg/L的环丙沙星培养10 d,测得有代谢产物脱乙烯环丙沙星、脱乙烯-N-乙酰环丙沙星、N-甲酰环丙沙星和N-乙酰环丙沙星4种,可判断环丙沙星在Xylaria longipes作用下发生了哌嗪基的裂解、N-乙酰化、N-甲酰化等反应[41]。Liao等[44]发现一个主要由Gammaproteobacteria、Bacteroidia和 Betaproteobacteria组成的微生物群落,在以环丙沙星为唯一的碳源和氮源的情况下培养28 d后,对环丙沙星主要进行4种途径的降解,即哌嗪环的裂解、进一步的喹啉环的破坏、羟基化和脱氟。由3种细菌菌株即Labrys portucalensis F11、Rhodococcus sp. FP1和Rhodococcus sp.组成的菌群,分别在加入10 mg/L的环丙沙星和加入10 mg/L的氧氟沙星的培养基中培养60 d,检测中间代谢产物,表明其对于环丙沙星的降解主要为哌嗪基的裂解、羟基化、脱氟和脱羧,对氧氟沙星的降解主要脱甲基化[30]。Kim等[45]分离出的Microbacterium sp.菌株可降解诺氟沙星,在含30 mg/L诺氟沙星的培养基中培养21 d,其诺氟沙星降解代谢产物鉴定为8-羟基诺氟沙星,6-脱氟-6-羟基诺氟沙星,脱乙烯诺氟沙星和N-乙酰诺氟沙星,可判断诺氟沙星的降解途径为羟基化、脱氟、哌嗪基团的脱乙烯化和N-乙酰化。Zhao等[46]用Lolium perenne L.降解恩诺沙星,其降解途径主要为哌嗪环的裂解、羟基化、脱羧、甲基化以及喹啉环的裂解。总之,不同微生物作用及不同药物,降解途径存在特异性,但又存在总体规律,为后续氟喹诺酮类抗生素降解提供考据。
4 微生物降解氟喹诺酮类抗生素的实际应用
微生物降解氟喹诺酮类抗生素是目前去除氟喹诺酮类抗生素环境残留的一种有效方法,相较于光降解法、化学氧化还原降解法等降解方法具有成本低、原位修复和效率高等特点,已经成功应用于实际的环境修护和废水处理中。
4.1 活性污泥法
活性污泥法是国内外常用于处理抗生素污水的一种微生物处理方法。因其工艺成熟、运行稳定,常用于污水中氟喹诺酮类抗生素的处理。氟喹诺酮类抗生素在活性污泥中的去除以吸附为主微生物降解为辅,而其中水解等作用微乎其微[47]。
活性污泥法对水中微量ng/L级氟喹诺酮类抗生素的去除率最高可达91%[48]。温度、pH、氧化还原条件、氧气含量是影响活性污泥降解效率的主要因素,通常温度对于吸附和降解的作用相反,升高温度,微生物降解过程增强,而吸附作用则减弱[47,49];而氧气含量对于二者的作用则一致,有氧条件均有利于两者作用,缺氧条件则相对较差[47]。活性污泥法去除废水中的氟喹诺酮类抗生素需探索合适的反应条件,以达到最好的降解效果。虽然活性污泥法具有较好的降解效果,也是目前实际应用较多的方法,但其也存在一定的问题和局限性,如占地面积大,对高浓度残留修复时易出现浮渣、泡沫、污泥膨胀等[50]。此外,该法降解过程较为缓慢,且氟喹诺酮类抗生素仍存在污泥沉积物中,无法完全去除,现今常与其他其他技术联用来提高降解效率及进一步处理污泥。
4.2 膜生物反应器法
膜生物反应器是将膜分离技术与微生物降解相结合的一项处理有机物污水的技术。其将膜分离的高效截留作用运用到传统的活性污泥法中,使其在反应器中保持高的污泥浓度,提高其有机负荷,可有效地减少处理技术的占地面积,且膜组件还能有效地保留降解效率较高的微生物,提高其微生物降解效果[51]。这些都有效的改善了活性污泥法中存在的一些问题。
膜生物反应器法对含氟喹诺酮类抗生素的废水的处理,相较于活性污泥法有所提高,其对μg/L级氟喹诺酮类抗生素处理也较好。Dorival-García等[52]研究表明,在实验室条件下,在适宜温度和氧含量及高固体悬浮物含量的情况下,对于μg/L级氟喹诺酮类抗生素几乎可以完全去除,且膜生物反应器中的高固体悬浮物含量不仅促进了污泥对于氟喹诺酮的吸附,还增强了微生物对于氟喹诺酮的降解。近年来,常规的膜生物反应器中氟喹诺酮类抗生素被证实,主要以吸附占主导,微生物降解作用相对较弱[52]。但现今对于膜生物反应器的发展已经改善了这一现象。Xu等[53]研究表明,序批膜生物反应器法对含50 μg/L氟喹诺酮类抗生素的废水的处理,虽该药物在污泥中的积累显著,但其生物去除主要得益于微生物降解,这可能是序批膜生物反应器中的好氧和缺氧条件交替进行有助于氟喹诺酮类抗生素的微生物降解。
膜生物反应器法处理氟喹诺酮类抗生素虽具有一定的优势,但也存在有许多的问题。如膜易受固体颗粒、大分子有机无机物、微生物聚合体堵塞及污染,影响处理效果,需定期更换膜、能耗高、处理后的污泥也需再处理等[54]。
5 总结与展望
本文综述了对氟喹诺酮类抗生素具有降解作用的细菌和真菌,以及混合菌群;并对已报道的氟喹诺酮类抗生素降解酶及其作用机制进行了归纳;对现已研究发现的氟喹诺酮类抗生素的降解途径进行了总结;最后,介绍了微生物实际应用于氟喹诺酮类抗生素污染防治的常规方法。
目前能高效降解氟喹诺酮类药物的单株菌较少,能在短时、高浓药物情况下,对氟喹诺酮类抗生素进行完全降解的单株菌较少,能够同时对多种氟喹诺酮类抗生素进行降解的菌株也较少;且对环境高耐受的菌株开发不足,目前仅分离得到在较高温度(70℃)环境下可有效降解多种氟喹诺酮类抗生素的菌株[10],但对于低温、厌氧、高压等极端环境下可耐受并具有降解能力的菌株开发短缺。可加强对于高效、广谱的降解菌的筛选和分离,结合高通量筛选等新技术快速筛选高效降解菌株[55],并尝试调节环境因素,富集筛选环境高耐受性的菌株。
对于降解氟喹诺酮类抗生素混合菌群的研究现有报道较少,一般为利用氟喹诺酮类药物驯化培养得到高效降解菌群,但对不同的微生物之间的相互作用及其机理并未做深入研究。可运用一些组学技术,如宏基因组学、转录组学、代谢组学和蛋白质组学等[56-57],确定不同微生物之间的互作情况,有目的的优化降解菌群,提高其降解效果。也可根据已知的高效降解单株菌的不同作用机制,利用营养互补、代谢分割等策略[58],人工组合构建合适的稳定的可完全矿化氟喹诺酮药物的高效降解菌群。
迄今为止,氟喹诺酮类抗生素降解酶的研究还有待深入,Qu等[15]在研究一株乳杆菌对环丙沙星的降解时,仅证实了细胞色素P450酶家族起关键作用,但并未明确确定是其家族中的哪一具体酶。且某些酶只能证实其参与降解过程,但未了解其具体作用机制[19,34],对于微生物中编码酶的基因深入研究也较少。可加强探索起作用的具体酶,可提取或体外合成,制成酶制剂等应用于生物修护和医疗等方面;清楚酶的作用机制及其编码基因,可利用基因工程构建可降解多种氟喹诺酮类抗生素的高效降解菌。
目前微生物降解氟喹诺酮类药物的代谢途径还不够明确,且降解未实现完全矿化[40,43],可能产生毒性或抗菌活性更强的代谢产物,Čvančarová等[19]使用了5种不同的真菌研究了环丙沙星的降解,在该研究中虽然环丙沙星可被I. lacteus和T. versicolor完全转化,但在液体介质中仍保留有高的残留抗菌活性。而对于降解所产生的代谢中间体和代谢产物的毒理性和病理性研究较少。可加强对其代谢途径机理的研究,并对中间代谢产物的抗菌活性和毒性进行分析,判断其对环境的风险性;分析代谢产物的结构,结合合适的物理化学生物方法,实现代谢产物的再降解。
微生物降解氟喹诺酮类抗生素的实际应用中存在有很多局限,如无法完全去除废水中的药物残留、能耗高等。可优化现存的方法,开发新型的处理设备,与其他技术联用[59];并探究新型的应用途径,如外源添加对氟喹诺酮类抗生素起降解作用的酶和对含氟喹诺酮类抗生素的废弃物进行预处理等。
最后,抗生素作为抑制微生物生长的化合物,其是否会引起耐药性的传播和扩散问题引起了科研人员的关注。微生物耐药是微生物对抗微生物药物不敏感的现象,但有研究表明[60],从人的肠道菌群中分离出来的4株Klebsiella pneumoniae和1株Escherichia fergusonii,能够在低氯霉素初始浓度下利用氯霉素作为单一碳源生长,并降解氯霉素,但其药敏性测试结果,即在较高氯霉素初始浓度下显示对氯霉素敏感,说明微生物降解抗生素过程与微生物抗生素耐药的途径和机理大相径庭。Barnhill等[61]评估了可利用抗生素生长且抗生素敏感的Salmonella的表型,也证明了可降解抗生素与抗生素耐药是不对等的。所以寻找可降解氟喹诺酮类抗生素且对氟喹诺酮类抗生素敏感的降解菌可作为今后努力的方向。此外,也可以考虑从降解微生物中提取或克隆并重组表达具有降解活性的降解酶,进一步制成酶制剂,从而在修复抗生素残留的同时降低耐药性传播的风险。
