七种聚酰亚胺的合成及光学性能研究*
2022-11-05王甫鹏杨艳华李福敏
王甫鹏,李 先,杨艳华**,李福敏,邵 林
(1.昆明学院 化学化工学院 云南省金属有机分子材料与器件重点实验室(筹),云南 昆明 650214;2.云南省塑料薄膜制品工程技术研究中心,云南 昆明 650214;3.大理州食品检验检测院,云南 大理 67100)
聚酰亚胺(polyimides,简称PI)为特种有机高分子材料,在电介质储能[1]、阻燃隔热[2]、气体分离[3]、光学器件[4]等领域应用广泛。其中,新型耐高温透明光学PI薄膜是柔性电子产业中的热点研究方向之一。通常情况下,通过在PI分子链中进行结构修饰,如引入低共轭或非共轭基团、摩尔体积较大的侧基基团和高电负性基团等[5],可以减弱PI分子链中电荷转移复合物的形成,以获得光学性能优异的PI材料。因此,在前期研究基础上[6],本文通过在PI分子链中引入柔性链接基团(非共轭基团)和不对称侧基基团等措施,以减弱电荷转移复合物的影响,以期获得光学性能更好的PI材料。
1 实验部分
1.1 试剂和仪器
N,N-二甲基乙酰胺(DMAc),加入KOH减压蒸馏后备用;甲苯、K2CO3、芳基硼酸、3,3’,4,4’-联苯四甲酸二酐(PBDA)、吡啶、醋酸酐、正己烷、乙酸乙酯等,均为分析纯;二氯甲烷为光谱纯,购自阿拉丁试剂(上海)有限公司。氘代二甲亚砜试剂(DMSO-d6)(99.9% D,0.03% TMS),购自Sigma-Aldrich公司。
Bruker Avance II-400型核磁共振仪,测试化合物的1H NMR和13C NMR;日本岛津UV-2450/2550型紫外-可见分光光度计测试化合物的光谱图。
根据之前的研究方法[7],合成化合物1、2和3。
1.2 二胺单体的合成
根据之前的研究方法[8],合成3a~3d等化合物,合成路线如图1所示。
在氮气保护下,在 50 mL 三口烧瓶中依次加入化合物3(0.5 g,1.26 mmol)、4-(1-萘基)苯基硼酸(0.313 g,1.26 mmol)、Pd(PPh3)4(0.0146 g,0.0126 mmol)、K2CO3(0.522 g,3.78 mmol)、甲苯(30 mL)和蒸馏水(15 mL),升温至 100 ℃ 下搅拌 8 h。冷却至室温,甲苯萃取(3×10 mL),收集有机层,柱层层析法提纯[使用溶剂比例为V(乙酸乙酯)∶V(正己烷)=1∶3],得到二胺单体3e(C36H29N3O)。1H NMR(400 MHz,DMSO-d6,δ):8.29(s,1H,ArH),8.05(t,2H,J=8.0 Hz,ArH),7.98(t,1H,J=8.0 Hz,ArH),7.92(d,1H,J=8.0 Hz,ArH),7.86(d,2H,J=8.0 Hz,ArH),7.56~7.52(m,3H,ArH),7.42(t,1H,J=8.0 Hz,ArH),7.36(q,3H,J=8.0 Hz,ArH),7.24(d,1H,J=8.0 Hz,ArH),7.00(d,2H,J=4.0 Hz,ArH),6.57(d,2H,J=12.0 Hz,ArH),6.32(t,4H,J=8.0 Hz,ArH),5.40(s,2H,—CH2—),5.03(s,2H,—NH2),4.94(s,2H,—NH2);13C NMR(101 MHz,DMSO-d6,δ):170.15,150.50,147.28,140.90,140.08,139.09,137.54,136.12,133.84,133.19,132.76,130.97,130.15,129.38,129.00,128.71,128.30,128.05,127.99,127.24,126.91,126.64,126.40,125.74,125.51,123.05,114.30,112.54,51.71。
二胺单体3f的合成条件与二胺单体3e完全相同,只是将4-(1-萘基)苯基硼酸换成等物质的量的[1,1′-联萘]-4-基硼酸,此处不再赘述。
二胺单体3f(C40H31N3O)1H NMR(400 MHz,DMSO-d6,δ):8.47(s,1H,ArH),8.07(q,1H,J=4.0 Hz,ArH),7.68(q,1H,J=4.0 Hz,ArH),7.63~7.44(m,5H,ArH),7.41~7.25(m,6H,ArH),7.23~7.16(m,3H,ArH),7.05(d,2H,J=8.0 Hz,ArH),6.72(d,2H,J=8.0 Hz,ArH),6.36(q,4H,J=8.0 Hz,ArH),5.44(s,2H,—CH2—),5.05(s,2H,—NH2),4.94(s,2H,—NH2);13C NMR(101 MHz,DMSO-d6,δ):170.07,150.69,147.44,139.17,138.51,137.35,136.06,133.60,132.96,132.88,132.36,131.81,131.09,129.65,129.52,129.26,128.78,128.32,128.21,127.97,127.23,126.70,126.43,126.09,126.03,122.86,122.66,114.35,112.55,54.34。
1.2.2 聚合物的合成
在氮气保护下,在 50 mL 三口烧瓶中依次加入化合物3(0.5 g,1.26 mmol)、PBDA(0.313 g,1.26 mmol)和除水DMAc(5 mL),25 ℃ 下搅拌 24 h。然后加入除水DMAc(2 mL)、吡啶(0.5 mL)和醋酸酐(0.5 mL),升温至 100 ℃ 下搅拌 9 h。冷却至室温后,将反应液逐滴加入CH3OH(70 mL)中并不断搅拌,抽滤,用CH3OH冲洗滤饼,100 ℃ 真空干燥 24 h,得到聚酰亚胺PI-3g((C36H20BrN3O5)n)。1H NMR(400 MHz,DMSO-d6,δ):7.96~7.53(m,10H,ArH),7.32(d,8H,J=28.0 Hz,ArH),5.14(s,2H,—CH2—)。
将化合物3换成合成等物质的量的二胺单体3a~3d,合成条件完全相同,合成其余六种聚酰亚胺,并进行核磁氢谱表征,此处不再赘述。
聚酰亚胺PI-3a((C42H25N3O5)n)1H NMR(400 MHz,DMSO-d6,δ):8.46(d,4H,J=48.0 Hz,ArH),8.08(d,3H,J=16.0 Hz,ArH),7.71~7.05(m,16H,ArH),5.16(d,2H,J=20.0 Hz,—CH2—)。
聚酰亚胺PI-3b((C43H27N3O5)n)1H NMR(400 MHz,DMSO-d6,δ):8.45~8.00(m,7H,ArH),7.67~7.51(m,3H,ArH),7.51~7.16(m,10H,ArH),7.09~7.06(m,2H,ArH),5.09(s,2H,—CH2—),2.36(s,3H,—CH3)。
聚酰亚胺PI-3c((C43H27N3O5)n)1H NMR(400 MHz,DMSO-d6,δ):8.45~8.03(m,6H,ArH),7.75~7.54(m,4H,ArH),7.46~6.86(m,12H,ArH),4.91(dd,2H,J=16.0 Hz,36.0 Hz,—CH2—),1.88(s,3H,—CH3)。
聚酰亚胺PI-3d((C44H29N3O7)n)1H NMR(400 MHz,DMSO-d6,δ):8.45~8.23(m,4H,ArH),8.08~7.96(m,2H,ArH),7.63~7.22(m,12H,ArH),6.52~6.38(m,3H,ArH),5.20(d,2H,J=20.0 Hz,—CH2—),3.77~3.72(m,6H,—OCH3)。
聚酰亚胺PI-3e((C52H31N3O5)n)1H NMR(400 MHz,DMSO-d6,δ):8.26~8.13(m,1H,ArH),7.95~7.79(m,11H,ArH),7.64~7.38(m,7H,ArH),7.33~6.98(m,10H,ArH),5.08(s,2H,—CH2—)。
聚酰亚胺PI-3f((C56H33N3O5)n)1H NMR(400 MHz,DMSO-d6,δ):8.49~8.45(t,1H,J=8.0 Hz,ArH),8.07~7.84(m,8H,ArH),7.68~7.18(m,22H,ArH),5.13(s,2H,—CH2—)。
2 结果与讨论
2.1 核磁表征
结合核磁氢谱测试结果可知,未经Suzuki偶联反应取代的二胺单体与BPDA合成的聚酰亚胺PI-3g核磁氢谱显示,—CH2—的化学位移(δ)为5.14,取代反应后,—CH2—的δ发生变化。其中,含有苯基和3,5-二甲氧基苯基的聚酰亚胺PI-3a(5.16)和PI-3d(5.20)的-CH2-向低场方向移动,这主要是由于两种取代基增加了π电子环电流产生的感应磁场,—CH2—位于去屏蔽区导致。同时,由于3,5-二甲氧基苯基中的-OCH3电负性较强,使得聚酰亚胺PI-3d的δ向低场移动得更多,如表1所示。聚酰亚胺PI-3b(5.09)和PI-3c(4.19)的—CH2—向高场方向移动,这主要是由于—CH3基团的作用,使—CH2—位于屏蔽区导致,同时,由于PI-3c的 —CH3位于—CH2—的邻位,—CH2—对屏蔽效应较强,导致PI-3c的-CH3向高场移动更多。由于1,1’-联萘基和4-(1-萘基)苯基在受到外磁场的作用时,也产生各向异性效应,导致聚酰亚胺PI-3e(5.08)和PI-3f(5.13)中—CH2—的δ也向高场方向移动。
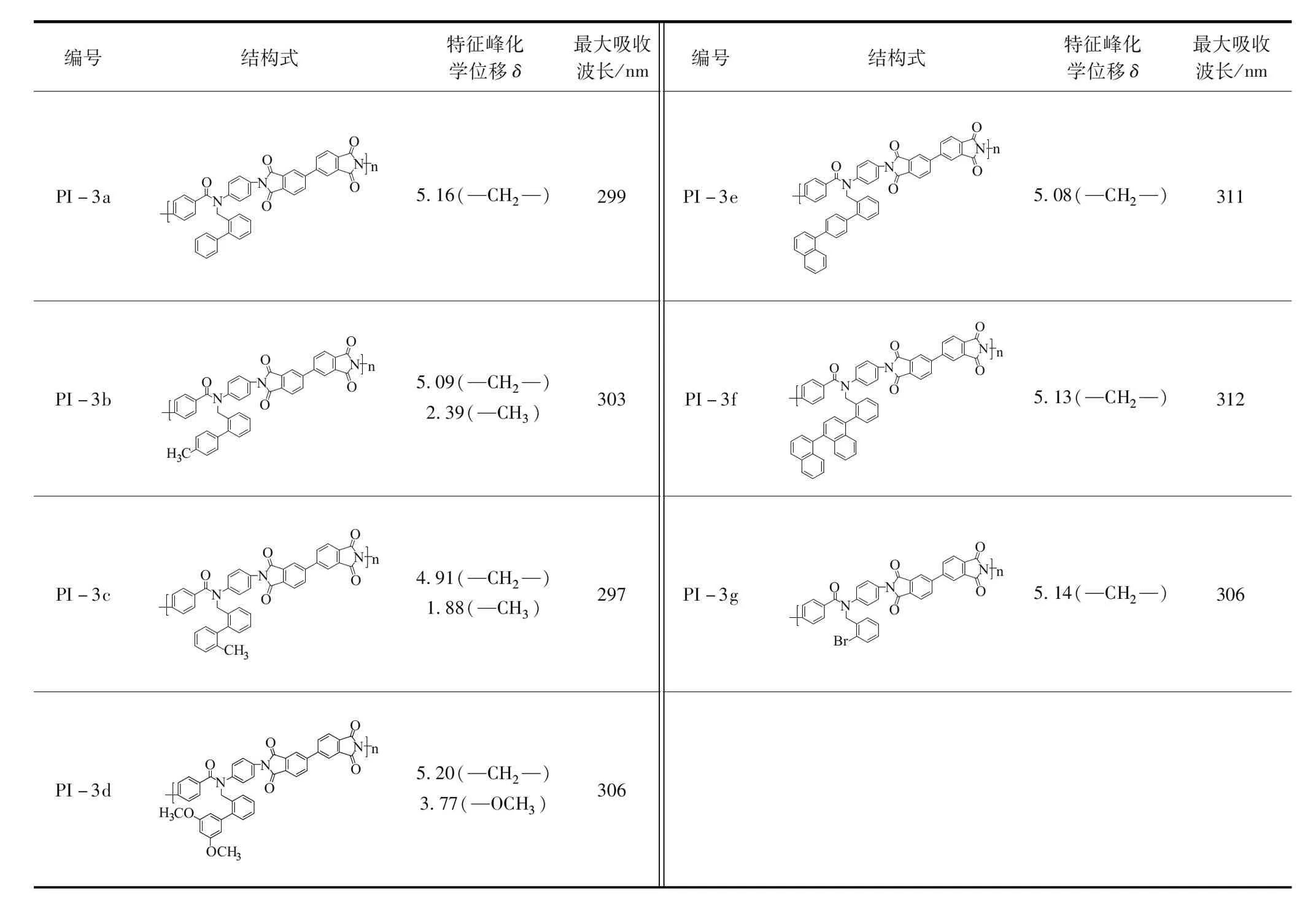
表1 七种聚酰亚胺核磁氢谱特征峰化学位移值与光谱学数据
2.2 聚酰亚胺的紫外-可见光谱测试
将合成的聚酰亚胺配制成浓度为 10-5mol/L 的二氯甲烷溶液,测试其紫外-可见光谱(UV),归一化结果如图2所示,最大吸收波长数据如表1所示。
由测试结果可知,7种聚酰亚胺只有一个最大吸收峰,这主要是分子中的电子供体部分与电子受体部分(BPDA)的电荷转移机理产生的。—CH2—邻位含有苯基的聚酰亚胺PI-3a的最大吸收波长(λmax)为 299 nm,将苯基变为1,1’-联萘基和4-(1-萘基)苯基后,增加了分子体系中的共轭效应,使π电子离域于整个分子平面,同时降低π*轨道能量,导致聚酰亚胺PI-3e和PI-3f的λmax发生红移,分别为311和 312 nm。在苯基中增加—CH3基团后,对位的—CH3基团延伸了共轭体系,导致聚酰亚胺PI-3b的λmax红移至 303 nm,而邻位的—CH3基团扰乱了分子的刚性和平面性,导致聚酰亚胺PI-3c的λmax蓝移至 297 nm。在苯基上增加—OCH3基团后,含有孤对电子的O原子,与芳基体系中的π电子形成p-π共轭,增加π电子流动性,导致聚酰亚胺PI-3d的λmax红移至 306 nm。此外,未经Suzuki偶联反应取代的聚酰亚胺PI-3g中的—Br基团,也具有非键电子对的存在,因此,PI-3g的λmax红移至 306 nm。
3 结语
综上所述,本研究合成了7种具有3,3’,4,4’-联苯四甲酸二酐部分的聚酰亚胺。由于Suzuki取代反应引入基团的电荷效应和空间位阻不同,不仅导致聚酰亚胺分子中特征峰—CH2—的δ发生变化,而且影响了分子的共轭体系,致使聚酰亚胺紫外-可见光谱图谱发生红移。此外,聚酰亚胺取代基电荷效应和空间位阻的不同,会影响其薄膜的透明性,这将在后续的工作中继续深入研究。
