妊娠期小鼠砷暴露对孕中期胎鼠脑组织全基因组mRNA表达的影响
2022-11-05李冬晨邰大鹏
王 汇,李冬晨,张 颖,邰大鹏
(包头医学院公共卫生学院,内蒙古 包头 014040)
砷(arsenic,As)是国际癌症中心公认的人类致癌物。目前,全世界仍有多个地区暴露于富As环境中,暴露形式多样,其中以饮水、燃煤和土壤As暴露为主[1]。As暴露可导致机体衰老、皮肤病变、肝癌、肺癌、膀胱癌和免疫系统病变等[2-4]。中枢神经系统同样是As攻击的重要靶器官。近年来大量研究表明,饮水性As暴露地区青少年学生智力与认知水平明显下降,出现神经系统病变[5-6,19]。同时,动物实验结果也表明,As可穿越胎盘屏障,蓄积于子代中枢神经系统,进而对神经发育造成影响,处于发育早期的神经系统对外界有害物质的毒作用较为敏感,更易引起神经系统损伤[7-8]。
Mo等[9]报道,长期As暴露可导致小鼠小脑和海马组织代谢异常,长期低水平As暴露可导致海马组织中神经突触的异常形成及小脑组织中神经鞘的脱落。Dipp等[10]报道,一定水平As暴露可影响斑马鱼神经系统发育,引发神经性病变。有研究发现,围产期As暴露导致新生大鼠脑内胆碱能和多巴胺能系统代谢异常[11]。Ram 等[12]报道,小鼠孕期及哺乳期As暴露后,其子代海马椎体神经元出现自噬和退化。尽管如此,妊娠期As暴露影响胎儿神经系统发育的分子机制仍不清楚,相关报道较少。
转录组测序(RNA transcriptome sequencing,RNA-seq)技术的出现为此项研究领域带来了新契机和方向,RNA-seq技术可完整检测某组织或细胞系中全基因组的表达。目前该技术已用于研究多种疾病相关差异表达基因[13-15],但As暴露致胎鼠脑组织全基因组差异基因和作用途径报道少见。RNA-seq技术为进一步系统性探索As中毒分子机制提供了新的思路和方法。
为探讨妊娠期As暴露是否影响胎儿神经系统发育,本研究用适当浓度亚砷酸钠(NaAsO2)溶液喂饮新受孕小鼠,并在受孕第12天(D12)对胎鼠脑组织进行RNA-seq,分析胎鼠脑组织中全基因组mRNA表达水平,系统性分析As暴露损害胎鼠神经系统发育的分子机制,以期为慢性As中毒影响神经系统发育分子机制研究及实现地方性As中毒疾病的早期防控提供新思路。
1 材料与方法
1.1 药物、试剂和仪器
NaAsO2,美国Sigma公司;RNA提取试剂盒、核糖体RNA去除试剂盒和逆转录试剂盒,德国Qiagen公司;Trizol溶解液、反转录试剂盒和实时定量检测试剂盒,美国Thermo Fisher公司;Lightcycler 96实时定量PCR(real time-quantitative PCR,RT-qPCR)仪,瑞士Roche公司。
1.2 动物和分组
40只SPF级成年健康ICR小鼠,体重为18~25 g,雌雄各半,购自斯贝福实验动物科技有限公司,生产许可证号SCXK(京)2019-0010。实验前适应性饲养1周后,按雌雄比1∶1进行交配,每天观察阴栓,查到阴栓之日视为妊娠D0。将孕鼠单笼饲养,随机分为正常对照组和As暴露组,每组10只。正常对照组每天自由饮用纯净水,As处理组自由饮用NaAsO275 μg·L-1水溶液。受孕D12处死孕鼠,取出胎鼠脑组织,称重,置液氮中保存备用。
1.3 转录组测序
于孕D12处死孕鼠,分离胎鼠脑组织,将每只孕鼠所有胎鼠脑组织混合为一个样本,从As暴露组和正常对照组各随机挑选3只孕鼠处死,将每只孕鼠的胎鼠脑组织取出并混合成1个混合样,共6组混合样,委托南京派森诺有限责任公司进行RNA-seq。利用组织RNA提取试剂盒提取脑组织总RNA,并用核糖体RNA去除试剂盒去除总RNA中核糖体RNA,再将RNA打断成200~300 bp的片段,并保证接头序列顺利连接。利用逆转录试剂盒将片段RNA逆转录合成cDNA正链,再通过DNA合成生成双链DNA。利用PCR技术富集片段生成文库,对文库进行Agilent2100 Bioanalyzer质量检测,再将DNA打成单链片段,进行illumina HiSeq高通量测序。
1.4 生物信息学分析
对原始数据进行整理、过滤,去除其中的接头及低质量转录文本,获得高质量测序数据。采用DESeq对基因表达进行差异分析,筛选差异表达基因条件为:表达水平差异>1(即|log2fold change|),P<0.05。做热图(heat map)和MA图,寻找差异基因,对差异基因做聚类分析,做GO功能分析确定差异表达基因主要生物学功能,同时也对差异表达基因进行KEGG富集分析,筛选出差异基因富集信号通路。
1.5 RT-qPCR验证测序结果的可靠性
为验证测序结果准确性,在测序结果中选取10个差异表达mRNA(|log2fold change|>1,P<0.05),包括2个上调表达基因fgf17h和cacna1f及8个下调表达基因hcn4,adcy8,cacng3,camk4,grp,gpr83,chrm2和grin10,利用Primer Primier5.0软件设计特异性引物(表1)。使用Trizol法提取脑组织样本中总RNA,逆转录试剂盒逆转录成cDNA,利用qPCR技术检测差异基因表达水平。将RT-qPCR检测的10个差异基因表达水平与RNA-seq结果进行差异变化趋势比较,以验证RNA-seq结果可靠性。

Tab.1 Primer sequences used for real time-quantiative PCR(RT-qPCR)of differential genes
1.6 统计学分析
实验结果数据以±s表示,利用GraghPad8.0进行统计分析与作图,两样本均数比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 测序样本相关性检验
样本间基因表达水平的相关性是检验实验可靠性和样本选择是否合理的重要指标。为确保样本差异表达分析的准确性,在得到测序结果后进一步进行皮尔逊相关系数分析。分析结果(图1)显示,样本间基因表达水平相关性均>0.8,表明本实验样本采集可靠有效。同时,As暴露组和正常对照组之间可见明显差异。
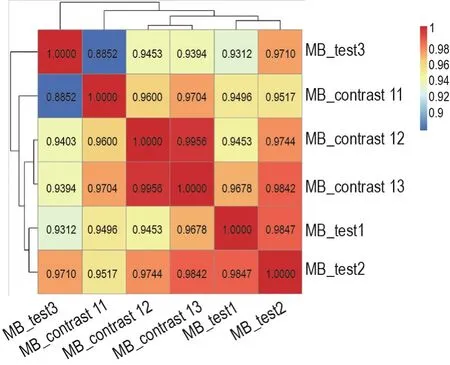
Fig.1 Sample correlation test.The pregnant mice drank sodium arsenite (NaAsO2)aqueous solution 75 μg · L-1(in As treatment group,MB-test)or purified water(in normal control group,MB-contrast) freely from the first day of pregnancy(D0),and were killed at D12.The mixed samples of fetal brain tissue of 3 pregnant mice were collected in each group.The fetal brain tissues were taken for RNA transcriptome sequencing(RNA-seq).The Pearson correlation coefficient was further analyzed.Red indicates high correlation coefficient and blue indicates low correlation coefficient.
2.2 差异表达基因可靠性验证
RT-qPCR验证结果(图2)发现,测序数据中10个差异基因的上调或下调表达趋势与RT-qPCR结果一致,差异倍数也与RT-qPCR结果相近,证明RNA-seq结果可靠。

Fig.2 Verification of differentially expressed genes by RT-qPCR.The ten differentially expressed genes were selected from the RNA-seq data for RT-qPCR detection to reveal their expression change and expression multiples to verify the accuracy and reliability of RNA-seq results.±s,n=3.*P<0.05,compared with RNA-seq data.
2.3 差异表达基因的筛选分析
利用RNA-seq技术检测分析发现,与正常对照组相比,As暴露组胎鼠脑组织中165个基因mRNA表达上调,998个表达下调,差异表达基因共计1163个(图3)。随后筛选出部分与神经系统发育、氧化应激和细胞凋亡密切相关差异基因绘制柱状图进行分析(图4)。

Fig.3 Analysis of differentially expressed genes.A:heat map analysis of differentially expressed genes.The red indicates up-to-tune expression,the green indicates down-tuned expression,the black indicates unchanged.B:MA plot map analysis of differentially expressed genes.M:logarithmic ratio;A:average value.The red dot indicates the up-regulated genes in this group,the blue dot indicates the down-regulated genes in this group,and the grey dot indicates the non significant differentially expressed genes.MB-test is the brain tissue of fetal mice in arsenic treatment group,MB-contrast is normal control group.
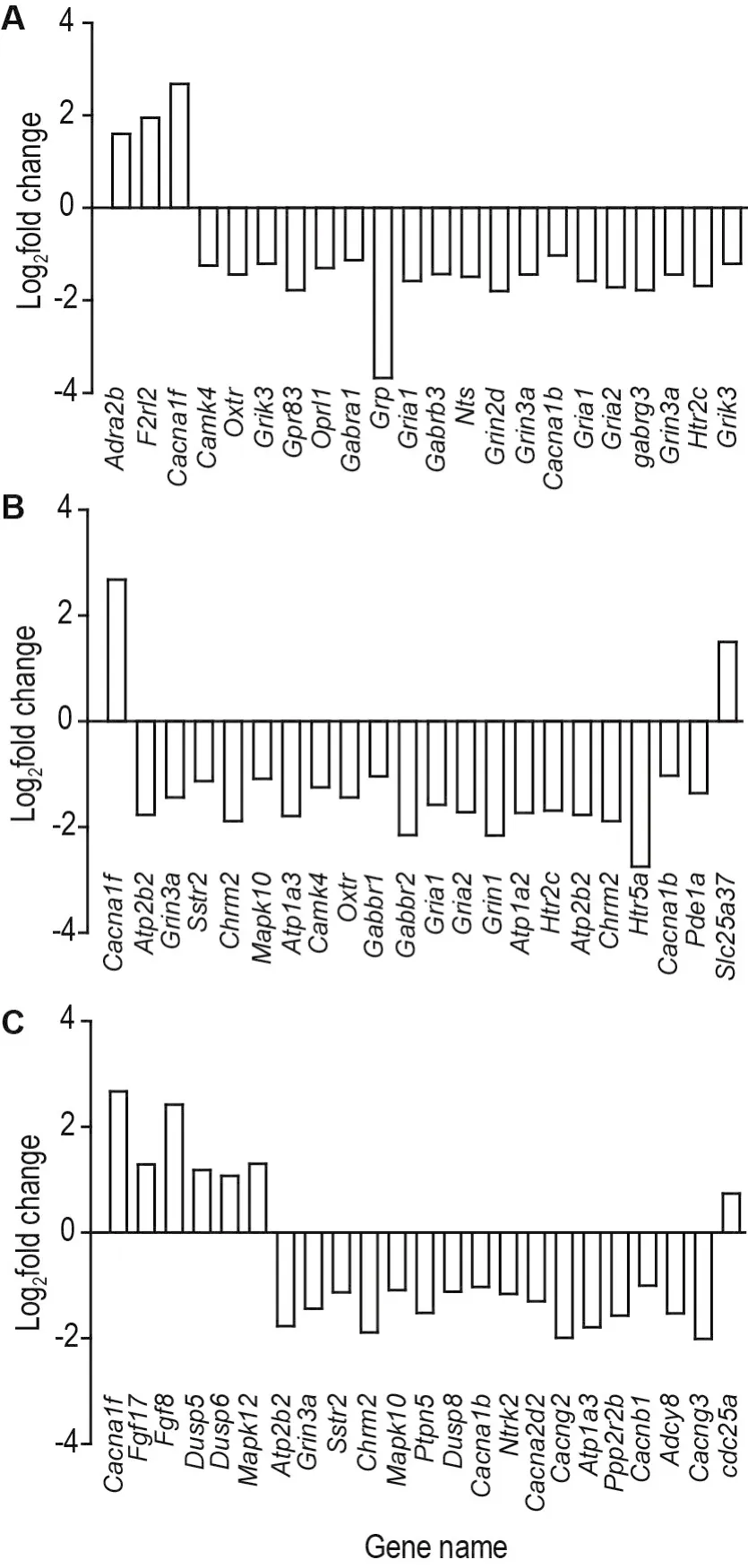
Fig.4 Classificational analysis of differentially expressed genes related to nervous system development(A),oxidative stress(B)and apoptosis(C).The differential genes closely related to nervous system development,oxidative stress and apoptosis were screened from total differentially expressed genes seen in Fig.3B,and the histogram was drawn.The screening condition was|log2fold change|>1,P<0.05.Adra2b:adrenergic receptor alpha 2b;f2rl2:coagulation factor Ⅱ receptor-like 2;oxtr:oxytocin receptor;grik3:glutamate receptor ionotropic kainate 3;oprl1:opioid receptor-like 1;gabra1:gamma-aminobutyric acid(GABA)A receptor subunit alpha 1;nts:neurotensin;gria1:glutamate receptor ionotropic AMPA1;htr2c:5-hydroxytryptamine(serotonin) receptor 2C;atp2b2:ATPase Ca2+transporting plasma membrane 2;sstr2:somatostatin receptor 2;mapk10:mitogen-activated protein kinase 10;atp1a3:ATPase Na+/K+transporting alpha 3 polypeptide;gabbr1:gamma-aminobutyricacid (GABA) B receptor1;pde1a:phosphodiesterase 1A calmodulin-dependent;slc25a37:solute carrier family 25 member 37;dusp5:dual specificity phosphatase 5;ptpn5:protein tyrosine phosphatase,non-receptor type 5;ntrk2:neurotrophic tyrosine kinase receptor type 2;ppp2r2b:protein phosphatase 2 regulatory subunit B beta;adcy8:adenylate cyclase 8;cdc25A:cell division cycle 25A.
2.4 差异表达基因的GO富集分析
对As暴露组和正常对照组差异表达基因进行GO富集分析,将差异基因富集到相应功能区域,结果表明(图5A),在生物学过程方面,差异基因主要富集在神经系统和行为发育、多组织发育和定位及信号传递和神经刺激反应等方面;在细胞组成分类中,差异基因主要集中在神经突触形成、细胞器和胞内膜组成及细胞外基质组成方面;在分子功能方面差异基因主要富集在信号传递、分子结合和转运活性方面。
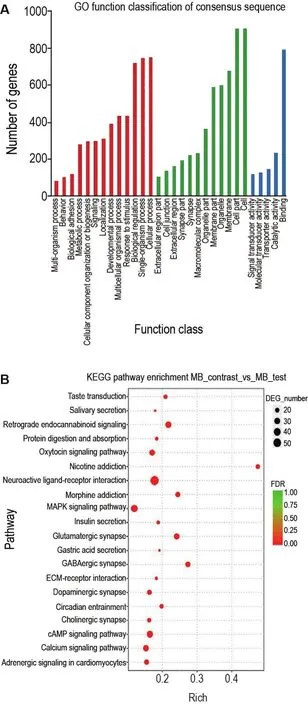
Fig.5 Enrichment analysis of differentially expressed genes by GO(A)and KEGG(B)analysis.The red indicates the biological process module,the green indicates the cellular component module and the blue indicates the molecular funtion module in Fig A.The size of the dot in Fig B represents the ratio of the number of differential genes enriched in the pathway to the number of all genes annotated in the pathway,and the color represents the significant difference value of the pathway.
2.5 差异表达基因的KEGG富集分析
进一步对差异基因进行KEGG富集分析,统计各个信号通路不同层级上包含差异表达基因的数目,进而确定其主要参与代谢途径和信号通路,进行信号通路归类分析。结果(图5)发现,差异基因显著富集于20个信号通路,其中包括与神经发育相关催产素信号转导、尼古丁成瘾、神经活性配体受体相互作用及吗啡成瘾4个信号通路;神经突触传递相关谷氨酸突触传递、唾液腺分泌、GABA突触传递、多巴胺突触传递、胆碱突触传递、逆行性内源性大麻素信号传导、味觉传导、心肌细胞中肾上腺素信号传导和胃酸分泌9个信号通路;与细胞凋亡有关蛋白质消化及吸收、细胞外基质受体相互作用和昼夜节律调节3个信号通路及与氧化应激相关丝裂原活化蛋白激酶信号传递、环磷酸腺苷信号传递、钙调节信号转导和胰岛素分泌4个信号通路。
3 讨论
本研究采用构建妊娠期As暴露胎鼠模型,收集特定胚胎发育期As暴露胎鼠脑组织进行RNA-seq,探讨As暴露对小鼠胚胎神经毒性作用的分子机制。而后对RNA-seq数据进行过滤及皮尔逊相关系数分析。结果表明,As暴露组与正常对照组胎鼠脑组织样本间基因表达水平相关性很高(均>0.8),证明本实验样本可靠性强,数据准确。
为进一步探索妊娠期As暴露对胎鼠神经系统发育影响,本课题组分析As暴露组与正常对照组胎鼠脑组织RNA-seq结果,采用DESeq对基因表达进行差异分析发现,2组样本基因表达差异明显,且主要富集在神经系统发育、神经突触传递、细胞凋亡和氧化应激等方面。由此,本课题组预测,妊娠期As暴露很可能通过提高氧化应激和细胞凋亡水平影响胎鼠神经系统发育。这与文献[9-10]报道研究结果相似。Nandita等[16]报道,细胞分裂周期 25A(cell division cycle 25A,cdc25A)基因为体内细胞周期主要调控因子,As暴露会下调cdc25AmRNA水平,从而诱导细胞周期阻滞而致使A498肾细胞癌细胞凋亡。本研究中,使用RNA-seq技术对全基因组测序结果显示,As暴露组和阴性对照组胎鼠脑组织中cdc25A基因表达有显著差异,与上述结果一致。
对差异表达基因进行GO富集分析发现,差异基因主要富集在神经系统和行为发育、多组织发育和定位、信号传递和神经刺激反应、神经突触形成、细胞器和胞内膜组成、细胞外基质组成及信号传递、分子结合和转运活性等方面。研究发现,小鼠经口As染毒后,与正常对照组相比,As暴露组小鼠水迷宫学习记忆能力下降;电镜观察发现,突触后致密体厚度变薄和突触间隙变宽[17]。Ram等[12]发现,孕期As暴露可诱导小鼠大脑皮质神经元轴突消失、细胞萎缩、细胞浆空泡变性、核溶解和固缩。当溶质载体家族25成员21(solute carrier family 25 member 21,SLC25A21)蛋白基因表达异常时,会导致线粒体呼吸链缺失,代谢异常,引起以脊髓运动神经元和骨骼肌运动障碍为主的中枢神经系统病变[18]。RNA-seq结果同样显示,As暴露组与正常对照组胎鼠脑组织SLC25A21mRNA表达差异明显,且GO富集分析显示,包括SLC25A21在内大量差异表达基因富集于线粒体组成方面,证实As暴露影响了SLC25A21的差异表达,从而引起线粒体功能障碍,进而引起中枢神经系统病变。N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)蛋白是中枢神经系统内离子型门控通道谷氨酸受体,在学习与记忆中发挥关键作用,当As暴露后会引起NMDAR重要内源性激动剂D-丝氨酸含量减少,从而影响NMDAR偶联离子通道开放,进而影响学习记忆功能[19]。本研究通过GO分析发现,在生物过程方面,差异基因明显富集于细胞跨膜转运等功能区域,尤其是离子跨膜通道区,同样确证了以上结论。
本研究通过KEGG富集分析发现,As暴露诱导胎鼠脑组织差异基因明显富集于与氧化应激和细胞凋亡相关丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路上。有研究报道,MAPK信号通路与神经损伤密切相关[20-22],本研究中,RNA-seq结果同样显示大量差异基因富集于MAPK信号通路,进一步证实As暴露后诱导神经损伤。唐强虎等[23]证实,慢性As暴露后引起神经元丢失,线粒体功能破坏,同时激活MAPK信号通路,也与本次测序结果相一致。
本研究提示,妊娠期As暴露引起胚胎脑组织毒性作用可能是通过提高氧化应激水平、促进神经元凋亡和影响神经突触而实现,其具体分子机制有待深入研究。
