氧化应激介导多柔比星导致的大鼠主动脉血管平滑肌细胞损伤
2022-11-05张成瑞邱会琴范彦英杨彩红
张成瑞,谢 童,邱会琴,王 婵,范彦英,杨彩红
(山西医科大学基础医学院药理学教研室,山西 太原 030001)
多柔比星(doxorubicin,Dox)是目前最有效的抗肿瘤蒽环类抗生素之一,广泛应用于白血病、生殖细胞肿瘤和乳腺癌等多种肿瘤的治疗。虽然其单独使用或联合其他方法使用时可有效杀死癌细胞,但其心脏毒性作用是其限制给药的主要原因[1-2]。Dox抗肿瘤治疗可诱发心衰、心律失常、冠心病、动脉高血压和动脉栓塞等多种心血管疾病的发生,以往认为心脏为其毒性作用靶点,目前研究表明,其心血管毒性作用与血管结构性损伤或功能性异常密切相关。Zamorano等[3]研究结果表明,抗肿瘤治疗诱发的心血管损伤主要由血管损伤所致,而非心肌细胞损伤。目前对Dox心血管毒性的研究主要集中在Dox诱导的心脏毒性,而对其诱导血管毒性研究较少。
血管平滑肌细胞为血管中膜主要成分,有助于心血管系统功能和稳态的维持[4]。研究表明,蛋白激酶C(protein kinase C,PKC)信号通路参与动脉粥样硬化、高血压、心肌缺血/再灌注损伤等多种心血管系统疾病的发生发展[5]。本课题组前期研究结果表明,Dox可导致大鼠主动脉功能损伤[6],血管平滑肌细胞是其主要损伤部位,且其损伤作用与PKC密切相关,然而氧化应激是否参与这一过程尚未报道。本研究通过建立Dox诱导的A7r5细胞损伤模型,探讨在Dox诱导心血管毒性中与氧化应激相关的作用机制,旨在为抗肿瘤药物心血管损伤的发病机制研究和临床防治寻求新的靶点。
1 材料与方法
1.1 药物、试剂和主要仪器
Dox、噻唑蓝(methyl thiazolyl tetrazolium,MTT)和BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司);优级胎牛血清(美国Cellmax公司);0.25%胰蛋白酶(不含EDTA)、DMEM高糖培养基、青霉素-链霉素溶液、兔抗大鼠β肌动蛋白单克隆抗体和辣根过氧化物酶标记的山羊抗兔IgG抗体(二抗)(武汉博士德生物工程有限公司);磷酸盐缓冲溶液(phosphate buffer solution,PBS)(武汉赛维尔生物科技有限公司);一氧化氮(nitric oxide,NO)检测试剂盒、2′,7′-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针和过氧化氢酶(catalase,CAT)检测试剂盒(上海碧云天生物技术研究所);ECL超敏发光液(美国Bio-RAD公司);兔抗大鼠硫氧还蛋白互作蛋白(thioredoxin-interaction protein,TXNIP)单克隆抗体、兔抗大鼠还原型烟酰胺腺嘌呤二核苷磷酸氧化酶2(nicotinamide adenine dinucleotide phosphate,NOX2)蛋白单克隆抗体、兔抗大鼠PKCα蛋白单克隆抗体、兔抗大鼠PKCβ1蛋白单克隆抗体和兔抗大鼠PKCβ2蛋白单克隆抗体(英国Abcam公司);兔抗大鼠NADPH氧化酶的胞膜催化亚基p22phox蛋白单克隆抗体、兔抗大鼠内皮型NOS(endothelial nitric oxide synthase,eNOS)蛋白多克隆抗体和兔抗大鼠诱导型NO合酶(inducible NO synthase,iNOS)蛋白多克隆抗体(万类生物科技有限公司)。CO2培养箱(美国Thermo Fisher Scientific公司);倒置荧光显微镜(德国Leica公司);多功能酶标仪(美国伯腾公司);凝胶电泳及成像设备(美国Bio-Rad公司)。
1.2 细胞和细胞培养
A7r5细胞(广州吉尼欧生物科技有限公司),接种于含10%FBS和1%双抗的DMEM高糖培养基中,5%CO2,37℃ 恒定环境下培养,换液频率为1~2 d 1次,筛选具有良好生长状态的细胞,进行后续实验。
1.3 细胞分组和显微镜下观察细胞形态
按预实验结果,将处于生长期的A7r5细胞100 μL按每孔4×103密度接种于96孔板,空白组加入100 μL不含细胞的完全培养基(DMEM高糖培养基∶胎牛血清∶双抗溶液=89%∶10%∶1%),5%CO2,37℃恒定环境下培养24 h待细胞贴壁,而后加入Dox 0(细胞对照组),0.33,1.00和1.33 μmol·L-1孵育A7r5细胞24 h后,分别在显微镜下观察细胞形态变化。
1.4 MTT法检测细胞存活率
按1.3分组处理细胞,24 h后更换培养基,每孔避光加入20 μL MTT(5 g·L-1)溶液,培养箱中孵育3 h。清空孔内液体,加150 μL DMSO溶解结晶,酶标仪于570 nm波长处检测吸光度(A570nm)值。细胞存活率(%)=(Dox组A570nm-空白组A570nm)/(细胞对照组A570nm-空白组A570nm)×100%。
1.5 DCFH-DA法检测细胞内ROS水平
按1.3分组处理细胞,胰蛋白酶消化收集细胞,加入DCFH-DA特异性荧光探针(10 μmol·L-1)孵育20 min,负载DCFH-DA。在488 nm激发波长,532 nm发射波长下测定荧光强度,然后用荧光显微镜拍摄A7r5细胞并使用酶标仪分析A7r5细胞荧光强度,定量ROS水平。
1.6 比色法测定细胞内CAT含量
按1.3分组处理细胞,弃孔内液体,加入RIPA裂解液4℃,13 000×g离心20 min,留取上清。按检测试剂盒说明书测定CAT含量(mmol·min-1·g-1蛋白)。
1.7 硝酸盐法测定细胞内NO含量
按1.3分组处理细胞,参考实验方法1.6细胞内CAT含量测定中细胞裂解方法,严格按照说明书测定NO含量。
1.8 Western印迹法检测细胞内TXNlP,NOX2,p22phox,eNOS,iNOS,PKC α,PKC β1和PKC β2蛋白表达水平
按1.3分组处理细胞,提细胞蛋白,通过BCA试剂盒定量蛋白浓度。40 μg样品经10%或15%SDS-PAGE电泳分离,并转移至NC膜上,5%脱脂奶粉摇床封闭2 h,TBST洗膜,与一抗TXNIP(1∶5000),NOX2(1∶5000),p22phox(1∶500),eNOS(1∶500),iNOS(1∶500),PKCα(1∶5000),PKCβ1(1∶5000),PKCβ2(1∶5000)和β肌动蛋白(1∶5000)在4℃条件下孵育过夜。TBST洗膜,将膜与二抗(1∶5000)在37℃孵箱培养1 h,ECL显影成像,用Image Lab软件定量分析归一化蛋白条带。以目标蛋白与内参蛋白积分吸光度值比值表示蛋白表达水平。
1.9 统计学分析
实验结果数据以±s表示,均通过GraphPad Prism 7.0处理,两组间比较采用t检验,多组间检验选用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 Dox对A7r5细胞形态变化的影响
显微镜下观察发现,细胞对照组A7r5细胞呈梭形,在其中央为圆形细胞核,细胞整体呈现出良好的生长状态;Dox 0.33 μmol·L-1组细胞形态未见明显改变;Dox 1.00和1.33 μmol·L-1组细胞呈不规则型,细胞核呈碎片状(图1)。

Fig.1 Effect of doxorubicin(Dox)on morphology of A7r5 cells.A7r5 cells were treated with Dox 0.33,1.00 and 1.33 μmol·L-1for 24 h.Arrows show the nucleus in fragments.
2.2 Dox对A7r5细胞存活率的影响
MTT法检测结果显示,与细胞对照组相比,Dox 0.33,1.00 和 1.33 μmol·L-1组细胞存活率显著降低(P<0.05,P<0.01),表明Dox对A7r5细胞有毒性作用(表1)。
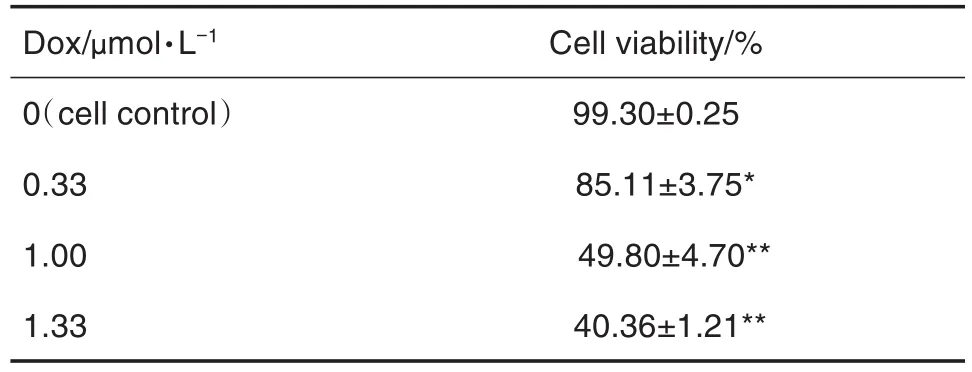
Tab.1 Effect of DOX on cell viability of A7r5 cells
2.3 Dox对A7r5细胞内ROS水平的影响
DCFH-DA荧光探针检测结果(表2)显示,与细胞对照组相比,Dox 0.33,1.00和1.33 μmol·L-1组A7r5细胞内ROS产生水平显著增加(P<0.01),表明Dox可诱导氧化产物增加,引起氧化应激损伤。

Tab.2 Effect of Dox on reactive oxygen species(ROS)content of A7r5 cells
2.4 Dox对A7r5细胞内CAT活性的影响
如表3所示,与细胞对照组相比,Dox 0.33,1.00和1.33 μmol·L-1组A7r5细胞内CAT活性显著降低(P<0.01),提示Dox可减少抗氧化产物产生。

Tab.3 Effect of Dox on catalase(CAT)activity of A7r5 cells
2.5 Dox对A7r5细胞内NO含量的影响
如表4所示,与细胞对照组相比,Dox 0.33,1.00和1.33 μmol·L-1组A7r5细胞内NO含量均显著升高(P<0.01)。

Tab.4 Effect of Dox on nitric oxide(NO)content of A7r5 cells
2.6 Dox对A7r5细胞TXNlP,NOX2,p22phox,eNOS,iNOS,PKC α,PKC β1和 PKC β2 蛋白表达水平的影响
Western印迹法结果显示,与细胞对照组相比,Dox 1.00 和 1.33 μmol·L-1组 A7r5 细胞内 TXNIP,p22phox,eNOS和iNOS蛋白表达水平显著升高(P<0.01,图2A、C、D和E),Dox 1.33 μmol·L-1组细胞内PKCα和PKCβ1蛋白表达水平显著升高(P<0.05,图2F、G),细胞内PKCβ2蛋白表达水平在Dox 0.33,1.00和1.33 μmol·L-1组均显著升高(P<0.05,图2H),而细胞内NOX2蛋白表达水平呈上升趋势(图2B),但无统计学差异。

Fig.2 Effect of DOX on protein expression levels of thioredoxin interaction protein(TXNlP,A),oxidase 2(NOX2,B),p22phox(C),endothelial nitric oxide synthase(eNOS,D),inducible NO synthase(iNOS,E),protein kinase C α(PKC α,F),PKC β1,(G)and PKC β2,(H)in A7r5 cells by Western blotting.See Fig.1 for the cell treatment.A2-H2 were the semi-quantitative results of A1-H1,respectively.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
3 讨论
本研究结果显示,Dox可引起A7r5细胞死亡和细胞形态改变,降低细胞存活率,同时诱导细胞内ROS和NO过度产生,抗氧化酶CAT活性降低,提示细胞发生氧化应激损伤。氧化应激是指机体氧化与抗氧化防御系统之间的一种严重失衡状态,TXNIP是机体关键的氧化应激调节蛋白,可通过与硫氧还蛋白结合参与调控糖尿病、平滑肌细胞功能障碍、缺血再灌注损伤和癌症等多种疾病的发生发展[7-8]。本研究结果显示,Dox可诱导A7r5细胞中TXNIP蛋白表达增多,提示这可能是Dox诱导细胞发生氧化损伤的主要原因之一。
研究表明,氧化应激在心血管疾病的病理生理过程中发挥关键作用,其中抗ROS物质对Dox诱导的心血管毒性具有保护作用[9]。机体内多种酶类可催化ROS的产生,其中血管组织中ROS主要由NADPH氧化酶(NOX)系统产生[10],而PKC的亚型如PKCα和PKCβ在NOX系统激活过程中发挥至关重要的作用[11]。本研究结果显示,Dox诱导A7r5细胞中PKCα,PKCβ1,PKCβ2和NOX的胞膜催化亚基p22phox蛋白表达增多,提示Dox诱导的A7r5细胞氧化损伤可能与激活PKC/NOX通路有关。这一结果与Qin等[12]研究氟非尼酮可通过抑制PKCα、PKCβ和NOX4的活性来减少高糖诱导的原代人肾小球细胞ROS的生成和改善线粒体功能障碍作用相一致。同时,有研究报道,NO在体内由内皮型NO合酶(endothelial nitric oxide synthase,eNOS)和诱导型NO合酶(inducible nitric oxide synthase,iNOS)催化左旋精氨酸转化而来,参与维持血管稳态的调节,NO本身作为一种氧自由基,当其产生过多时可与反应生成具有强氧化性的,从而进一步加重机体组织氧化损伤[13]。Kalivendi等[14]研究发现,抗氧化剂可通过抑制eNOS上调减轻Dox诱导的牛主动脉内皮细胞氧化损伤;在高糖条件下,VEGF/PKC/NO途径参与血管舒张功能障碍的发生发展[15],表明NOS活性与PKC的活化有关,且受其调节。本研究结果显示,Dox诱导A7r5细胞内NO含量增多,eNOS和iNOS蛋白表达显著上调,提示Dox诱导的A7r5细胞氧化损伤可能与PKC激活NOS有关。
综上所述,本研究结果表明,Dox对A7r5细胞具有显著毒性作用,其损伤作用可能是通过靶向氧化应激介导的,且该作用机制可能与PKC激活NADPH氧化酶和NOS,从而调节体内ROS的产生有关。不足的是,本研究仅在体外实验证实了氧化应激与Dox诱导A7r5细胞损伤有关,而Dox所诱导A7r5细胞损伤的性质以及抗氧化物质是否对Dox诱导的心血管损伤具有保护作用还有待进一步研究。
