稳定敲降多腺苷二磷酸核糖聚合酶1的HaCaT细胞的建立
2022-11-05肖智勇程军平周文霞张永祥
刘 峰,肖智勇,程军平,蒋 宁,周文霞,张永祥
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
皮肤癌是临床上最常见的癌症之一,根据发生部位分为鳞状细胞癌、基底细胞癌、恶性黑色素瘤和皮肤淋巴细胞瘤等[1-2]。经常性曝晒和紫外线照射是皮肤癌最常见的诱因[3]。流行病学研究表明,其他类型的辐射(如电离辐射)、农药和石化燃料燃烧产生的多环芳香烃及水和某些食物中的毒素等造成的DNA损伤也是导致皮肤癌的重要因素[4]。
皮肤细胞基因组损伤后可激活多种DNA损伤修复酶[5],其中最重要的一种是多腺苷二磷酸核糖腺苷二磷酸核糖〔poly(ADP-ribose),PAR〕聚合酶 1(PAR polymerase-1,PARP-1)6]。PARP-1 可结合到DNA单链或双链损伤处,通过催化底物烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)合成长≥200个ADP核糖单位的PAR,发挥PAR化作用[7]。PAR化作用是指PAR通过共价或非共价方式结合到靶蛋白对靶蛋白进行修饰的过程,是一种可在生理和病理条件下发生的翻译后修饰,主要参与遗传毒性的应激反应。通过这种修饰,PAR可调节靶蛋白的理化性质,进而影响染色质重塑、DNA损伤修复和转录、细胞内信号转导、细胞周期和死亡及表观遗传学调控等多种细胞功能[8]。目前,PAR化与DNA损伤修复相关的研究较多。PARP家族共有17个亚型,其中PARP-1作为含量最多的亚型,贡献了机体90%的PAR化作用。PARP-1作为重要的DNA损伤修复酶被广泛关注[9]。
目前用于皮肤癌防治药物筛选的细胞模型主要为基于A431和SCL-1等皮肤癌细胞系的筛选模型,而辐射和环境污染物主要损伤的是正常皮肤细胞的DNA。为研究PARP-1在正常皮肤细胞DNA损伤中的作用,本研究构建含PARP-1短发夹RNA(short hairpin RNA,shRNA)慢病毒载体质粒(pLVX-shRNA2-puro-PARP-1),转染至人永生化表皮角化形成细胞HaCaT细胞,获得单克隆稳定敲降PARP-1蛋白的HaCaT细胞(PARP-1 KD HaCaT细胞),为进一步筛选抗DNA损伤致皮肤癌药物及机制研究奠定基础。
1 材料与方法
1.1 细胞、试剂、引物和仪器
HEK293T人胚肾细胞(本实验室保存);人永生化表皮角化形成细胞HaCaT细胞(中国典型培养物保藏中心)。
质粒抽提试剂盒(美国Promega公司);限制性内切酶EcoRⅠ,BamHⅠ和XhoⅠ及T4 DNA连接酶M0202L(美国NEB公司);JM109感受态细胞、慢病毒载体质粒pLVX-shRNA2-puro、阴性对照慢病毒载体质粒pLVX-shRNA2-puro-hScramble和HET高效转染试剂盒BW11002(深圳百恩维生物科技有限公司);DMEM培养基(美国Cyclone公司);胎牛血清(fetal bovine serum,FBS)(美国Gibco公司);胰蛋白酶(上海索莱宝生物科技有限公司);TRIzol RNA提取试剂(美国Invitrogen公司);cDNA逆转录试剂盒和SYBR Premix qPCR试剂盒(日本TaKaRa公司);兔抗人PARP-1单克隆抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IgG抗体(美国CST公司);小鼠抗人GAPDH单克隆抗体(北京中杉金桥公司);Western印迹法SuperSignal HRP化学发光底物(美国Thermo公司);Cocktail蛋白酶抑制剂(瑞士Roche公司);Luminex多因子检测试剂盒(德国Merck公司);DNA损伤剂硫芥(sulfur mustard,SM)(军事医学研究院毒物药物研究所)。
引物为美国Invitrogen公司合成,分别为质粒测序引物U6-F:5′-TACGATACAAGGCTGTTAGAGAG-3′;PARP-1 RT-qPCR正向引物:GAGCATCCCCAAGGACTCG,反向引物:CCGCTGTCTTCTTGACTTTC;GAPDH RT-qPCR正向引物:AGGTGAAGGTCGGAGTCAAC,反向引物:CGCTCCTGGAAGATGGTGAT。
CountessTM细胞计数仪(美国Invitrogen公司);F-11 PH计(北京屹源电子仪器科技公司);DM4000B型荧光显微镜(美国Leica公司);3K15型台式高速冷冻离心机(美国Sigma公司);ND2000C型微量紫外分光光度计(美国Thermo公司);Milei-Q Biocel型纯水机及 0.22和 0.45 μm PVDF针头过滤器(美国Millipore公司)。
1.2 慢病毒载体质粒的构建
针对PARP-1mRNA进行RNA干扰的目标序列为 5′-CGACCTGATCTGGAACATCAA-3′[10],以此为基础合成PARP-1 shRNA片段,序列为5′-GATCCCGACCTGATCTGGAACATCAATTCAAGAGATTGATGTTCCAGATCAGGTCGTTTTTTCTCGAGG-3′。将慢病毒载体质粒pLVX-shRNA2-puro与PARP-1 shRNA分别经EcoRⅠ和BamHⅠ双酶切,酶切反应在37℃水浴反应2 h;酶切产物利用T4 DNA连接酶于22℃水浴过夜进行连接反应,将连接产物转化到JM109感受态细胞。
转化过程[11]如下:将连接产物与JM109感受态细胞混匀后冰浴30 min,42℃热激45 s;立即置冰上2 min,加入预热至室温的LB培养基400 μL,37℃恒温摇床(200 r·min-1)培养1 h;2000×g离心1 min,弃去培养上清400 μL,剩余100 μL用移液器混匀后均匀涂布于含氨苄西林100 mg·L-1抗性的LB平板上,倒置,37℃恒温培养箱培养过夜。分别挑取单菌落接种于含5 mL氨苄西林100 mg·L-1的抗性LB培养液中,37℃恒温摇床(250 r·min-1)培养过夜。用质粒抽提试剂盒抽提pLVX-shRNA2-puro-PARP-1质粒,并用XhoⅠ限制性内切酶37℃恒温水浴酶切2 h,在pLVX-shRNA2-puro质粒上含有1个XhoⅠ酶切位点,结合PARP-1 shRNA片段上XhoⅠ位点可切出1320 bp条带。挑取酶切鉴定连接成功的阳性菌落以引物U6-F进行DNA测序。测序结果包含PARP-1 shRNA序列则表明连接成功。
1.3 慢病毒包装和制备
将HEK293T细胞培养至对数生长期,用胰酶消化,取6×106细胞接种到10 cm细胞培养皿中,37℃,5%CO2培养箱培养24 h。用含10%FBS、无青霉素和链霉素的DMEM完全培养基5 mL在转染前2 h换液。转染使用基于脂质体转染方法的HET高效转染试剂盒,按说明书方法进行。首先在A管中加入HET缓冲液 A 500 μL,在B管中加入pLVX-shRNA2-puro-PARP-1或阴性对照慢病毒载体质粒 pLVX-shRNA2-puro-hScramble 10 μL、慢病毒包装混合物(含慢病毒包装质粒)15 μL、HET缓冲液 B 50 μL和双蒸水425 μL并混匀。将B管中的液体缓缓逐滴加入到A管,用移液器轻轻混匀并静置30 min,将液体加入到HEK293T培养皿中,轻轻倾斜混匀,于培养箱中培养16 h。荧光显微镜观察转染后HEK293T细胞中绿色荧光蛋白(green fluorescent protein,GFP)的表达。GFP表达阳性表示质粒转染成功。
弃培养基后换液为完全培养基,继续培养过夜后收集上清保存于4℃冰箱;重新加入完全培养基10 mL,过夜后再次收集上清。将2次收集的上清混合后200×g离心5 min;上清液以0.45 μm PVDF滤器过滤至50 mL圆底离心管中;4℃,20 000×g离心4 h,弃上清后按每皿(10 cm)加入DMEM 200 μL重悬病毒颗粒,室温静置2 h;然后用移液器轻轻吹匀,继续室温放置30 min,将提取的病毒颗粒分装至洁净的1.5 mL EP管中,-80℃冰箱保存待用。
1.4 慢病毒转染HaCaT细胞感染复数的测定
HaCaT细胞接种于96孔培养板,每孔1×104细胞。按1,10和100的感染复数(multiplicity of infection,MOI)分别将 1×104,1×105和 1×106含PARP-1 shRNA的慢病毒颗粒加入细胞,CO2培养箱(37℃,5%CO2)孵育24 h。同时设未转染慢病毒的HaCaT细胞对照组。孵育后吸弃培养液,加入不含病毒的培养液过夜。慢病毒中带有GFP核酸序列,荧光显微镜观察GFP表达阳性细胞即为成功感染的细胞。转染效率(%)=镜下GFP表达阳性细胞数/镜下细胞总数×100%。每组观察3个视野,据平均感染效率判断加入病毒最适MOI值。
1.5 嘌呤霉素浓度的确定
将HaCaT细胞以每孔5×104接种24孔板,孵育过夜后加入含嘌呤霉素(终浓度0,1,3和6 mg·L-1)和10%FBS的DMEM培养基,每组设3复孔。48 h后显微镜下拍照,计数活细胞。活细胞数为0时的最低嘌呤霉素浓度为后续实验用浓度。
1.6 HaCaT细胞慢病毒转染和单克隆PARP-1 KD HaCaT细胞的筛选
将HaCaT细胞以每孔5×104接种24孔板,孵育6 h贴壁后,每孔加入5×106带有阴性对照hScramble shRNA或PARP-1 shRNA的病毒颗粒,24 h后加入嘌呤霉素(终浓度为3 mg·L-1)筛选。筛选过程中可见细胞大量死亡,4~7 d后适时胰酶消化转移至六孔板。待细胞长满后转移到培养瓶中扩大培养,分别得到阴性对照(negative control,NC)HaCaT细胞和PARP-1 KD HaCaT细胞。将PARP-1 KD HaCaT细胞稀释至1.0×104L-1,96孔板中每孔接种100 μL,待细胞贴壁生长后倒置显微镜下观察。将只含有1个细胞的培养孔编号,记录只有单个克隆的孔,约15 d后即可挑选单克隆稳定敲降PARP-1细胞,即PARP-1 KD HaCaT细胞。
1.7 RT-qPCR法检测PARP-1 KD HaCaT细胞PARP-1 mRNA表达
用TRIzol试剂提取NC HaCaT细胞和PARP-1 KD HaCaT细胞总RNA,并用cDNA逆转录试剂盒合成cDNA。以PARP-1为目的基因,GAPDH为内参基因,qPCR 反应体系为:模板 cDNA 6 μL,SYBR qPCR Mix 10 μL,上下游引物各1 μL,无RNA酶水2 μL。RT-qPCR实验参照SYBR Premix qPCR试剂盒说明书进行。反应条件为:95℃ 预变性 1 min;95℃ 15 s,60℃ 30 s,72℃1 min,共40 个循环。以 2-ΔΔCt计算PARP-1mRNA相对表达水平。
1.8 Western印迹法检测PARP-1 KD HaCaT细胞PARP-1蛋白表达
用含Cocktail蛋白酶抑制剂的RIPA细胞裂解液分别提取NC HaCaT细胞和PARP-1 KD HaCaT细胞总蛋白,并用BSA蛋白质含量检测试剂盒进行蛋白质定量。均取蛋白质25 μg进行SDS-PAGE凝胶电泳。湿法电转到PVDF膜上。5%BSA封闭1 h后,分别加入兔抗人PARP-1单克隆抗体(1∶2000)和小鼠抗人GAPDH单抗(1∶10 000),4℃孵育过夜。加入HRP标记山羊抗兔IgG抗体或山羊抗小鼠IgG抗体(1∶10 000)室温孵育1 h,ECL显色后于化学发光仪中曝光并扫描分析各条带积分吸光度(integrated absorbance,IA)。以目标蛋白PARP-1与内参蛋白GAPDH的IA比值表示PARP-1蛋白相对表达水平。
1.9 Luminex法检测PARP-1 KD HaCaT细胞磷酸化组蛋白H2AX( γ-H2AX)表达水平
将NC HaCaT细胞和PARP-1 KD HaCaT细胞分别接种于6孔板中,每孔接种3×105细胞,采用10%FBS+DMEM/F12培养基培养。细胞贴壁后给予SM 100和1000 μmol·L-1,孵育6 和24 h后吸弃培养液,用冷PBS清洗1次。每孔加入Luminex多因子检测试剂盒中的专用裂解液300 μL,4℃孵育10 min,20 000×g离心10 min后取上清得细胞裂解液,分装冻存于-70℃冰箱。将冻存的上清样品按Luminex多因子检测试剂盒说明书步骤上机检测γ-H2AX表达水平。γ-H2AX表达水平用平均荧光强度表示。
1.10 统计学分析
实验结果数据以±s表示,用GraphPad Prism 8.0统计学软件,one-way ANOVA分析进行多组比较,两组比较使用LSD-t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 pLVX-shRNA2-puro-PARP-1慢病毒载体质粒鉴定
将pLVX-shRNA2-puro-PARP-1重组质粒提取浓缩后,用XhoⅠ进行酶切鉴定。挑取的3个克隆经XhoⅠ酶切后均获得约1320 bp条带,表明为阳性克隆(图1)。挑取其中1个阳性克隆进行核酸测序,结果表明序列与所设计的PARP-1 shRNA一致(图2)。综合酶切和核酸测序结果,表明LVX-shRNA2-puro-PARP-1慢病毒载体质粒构建成功。
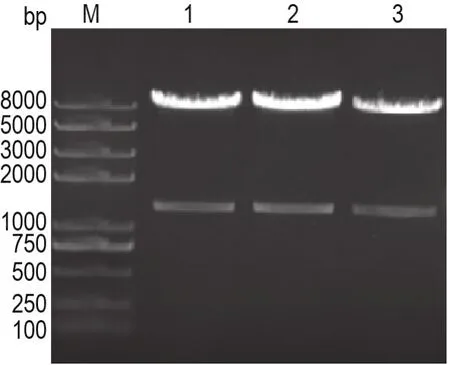
Fig.1 ldentification of recombinant positive cloning vectors containing poly(ADP-ribose)polymerase-1(PARP-1)short hairpin RNA(shRNA)(pLVX-shRNA2-puro-PARP-1).Recombinant plasmids pLVX-shRNA2-puro-PARP-1 were digested by XhoⅠ.M:DNA marker;lanes 1-3:positive clone.
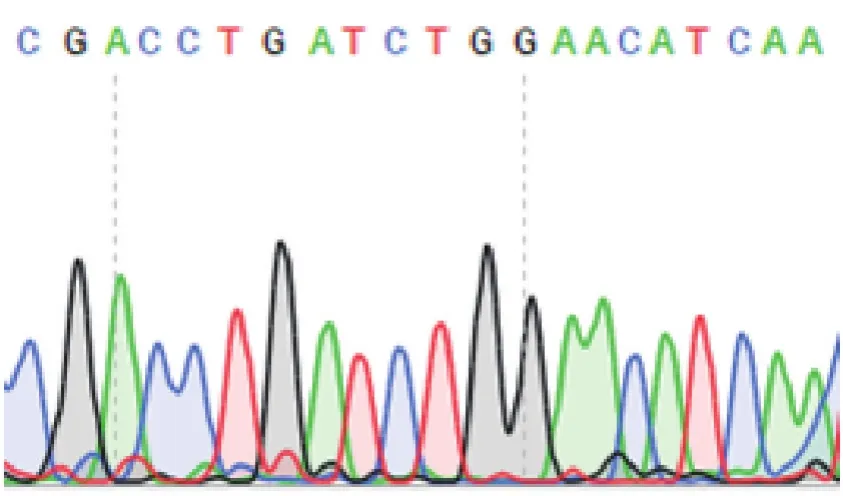
Fig.2 Sequence identification of pLVX-shRNA2-puro-PARP-1 plasmids.PARP-1 targeting sequence"CGACCTGATCTGGAACATCAA"was identified using Sanger sequencing method.
2.2 慢病毒包装和鉴定
将慢病毒载体质粒pLVX-shRNA2-purohScramble和pLVX-shRNA2-puro-PARP-1分别与慢病毒包装质粒转染至HEK293T细胞,培养箱孵育16 h,换液前采用荧光显微镜拍照,观察GFP表达。结果显示,转染pLVX-shRNA2-puro-hScramble或pLVX-shRNA2-puro-PARP-1的HEK293T细胞中均可见GFP表达(图3),表明质粒转染成功。
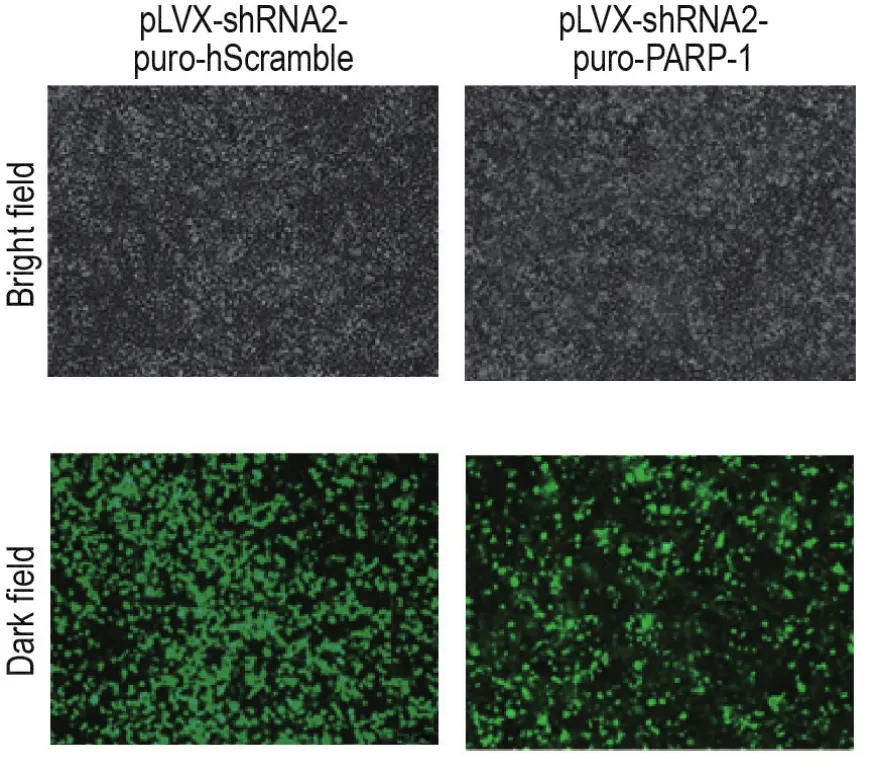
Fig.3 Transfection efficiency of lentiviral vector plasmids(×10).Vector pLVX-shRNA2-puro-hScramble or pLVX-shRNA2-puro-PARP-1 and packaging plasmids were co-transfected with high efficiency transfection kit(HET)into HEK293T cells.Green fluorescent protein(GFP)expression was detected under a fluorescence microscope 16 h after transfection to identify the transfection efficiency of plasmids.
2.3 慢病毒转染HaCaT细胞MOl值的确定
将含PARP-1 shRNA的慢病毒颗粒转染至HaCaT细胞,荧光显微镜下观察HaCaT细胞GFP表达。结果显示,MOI值为100时,转染效率最高,为(9.60±0.80)%(n=3);MOI值为10时,转染效率为(3.60±1.74)%(n=3);MOI为1时,几乎未见GFP表达,转染效率为(0.20±0.20)%(n=3)。未转染慢病毒的HaCaT细胞对照组无GFP表达(图 4)。因此,确定转染时MOI值为100。
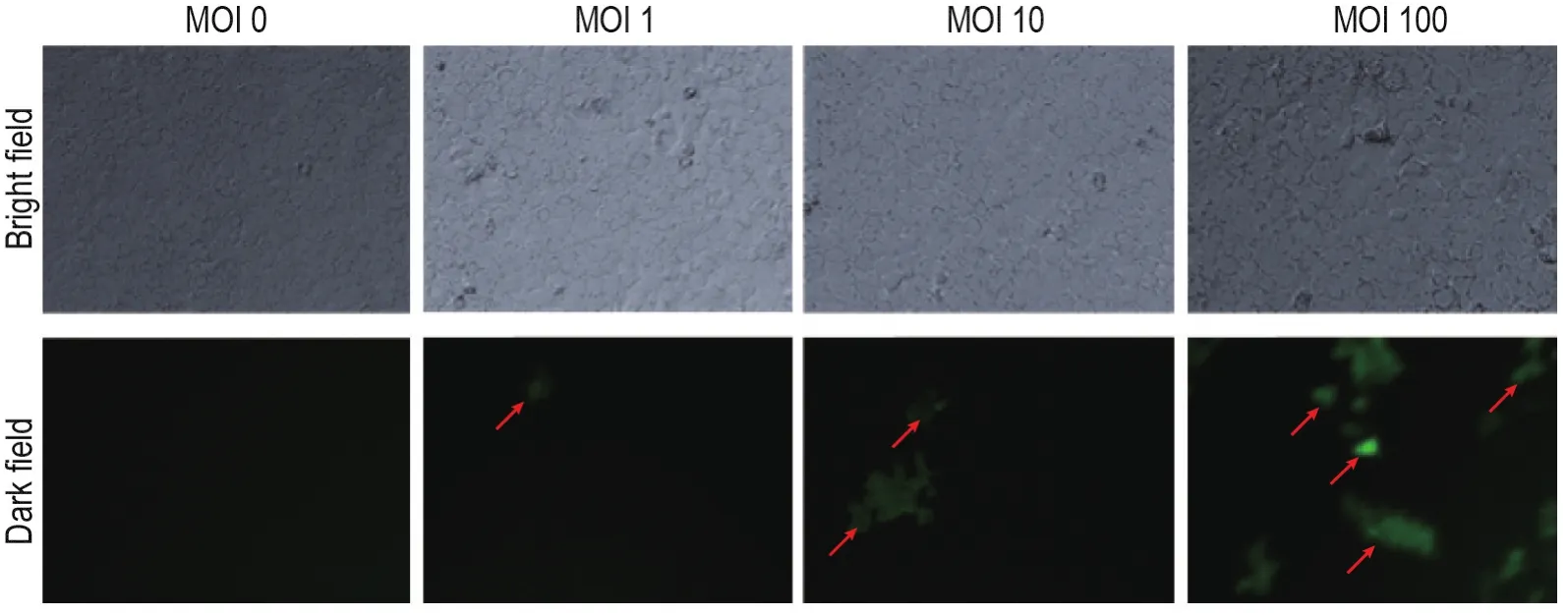
Fig.4 Transfection efficiency of PARP-1 lentivirus on HaCaT cells(×20).HaCaT cells were transfected with PARP-1 lentivirus.GFP expression in HaCaT cells was detected under a fluorescence microscope.MOI:multiplicity of infection;↑:GFP expression.
2.4 筛选单克隆PARP-1 KD HaCaT细胞时嘌呤霉素浓度的确定
图5结果表明,HaCaT加入嘌呤霉素48 h后,细胞对照组每视野活细胞数为95±36(n=3),嘌呤霉素1 mg·L-1组有少数细胞存活,仅为15±5(n=3),3和6 mg·L-1组HaCaT细胞全部死亡。为此确定筛选单克隆PARP-1 KD HaCaT细胞时嘌呤霉素的浓度为3 mg·L-1。

Fig.5 Determination of puromycin concentration in screening monoclonal PARP-1 KD HaCaT cells(×20).HaCaT cells were treated with puromycin for 48 h and pictures were taken under a microscope.↑:surviving cells.
2.5 PARP-1 KD HaCaT细胞PARP-1 mRNA和蛋白表达水平
HaCaT细胞经含有PARP-1 shRNA的慢病毒颗粒转染并用嘌呤霉素(终浓度为3 mg·L-1)筛选15 d,得到单克隆PARP-1 KD HaCaT细胞。RT-qPCR结果(表1)显示,PARP-1 KD HaCaT 细胞PARP-1mRNA降低为NC HaCaT细胞的约14%。Western印迹法结果(图6)显示,PARP-1 KD HaCaT细胞PARP-1蛋白表达水平降低为NC HaCaT细胞的约10%。

Tab.1 Expression of PARP-1 mRNA in negative control(NC) HaCaT cells and PARP-1 knockdown HaCaT(PARP-1 KD HaCaT)cells by RT-qPCR

Fig.6 Expression of PARP-1 protein in NC HaCaT cells and PARP-1 KD HaCaT cells by Western blotting.See Tab.1 for the cell treatment.B was the semi-quantitative result of A.IA:integrated absorbance.±s,n=3.**P<0.01,compared with NC HaCaT cell group.
2.6 硫芥对PARP-1 KD HaCaT细胞 γ-H2AX表达水平的影响
DNA 损伤剂 SM 100 和 1000 μmol·L-1与 NC HaCaT细胞和PARP-1 KD HaCaT细胞作用6 h,与相应的细胞对照组相比,γ-H2AX表达水平均明显增加(P<0.01)(图7 A),但两种细胞之间无明显差异;作用24 h,与相应的细胞对照组相比,NC HaCaT细胞γ-H2AX表达无明显变化,PARP-1 KD HaCaT细胞γ-H2AX表达明显增加(P<0.01),且在1000 μmol·L-1时,PARP-1 KD HaCaT细胞γ-H2AX表达较NC HaCaT细胞明显增加(P<0.01)(图7 B)。提示PARP-1敲降可明显增加SM作用后HaCaT细胞DNA损伤。

Fig.7 Effect of sulfur mustard(SM)on phosphorylated histone H2AX( γ -H2AX)expression level in PARP-1 KD HaCaT cells.PARP-1 KD HaCaT cells and NC HaCaT cells were treated with SM 100 and 1000 μmol·L-1for 6(A)and 24 h(B),respectively.The expression level of γ-H2AX was detected by Luminex assay.MFI:mean fluorescence intensity.±s,n=3.**P<0.01,compared with corresponding cell control group;##P<0.01,compared with NC HaCaT cells+SM 1000 μmol·L-1 group.
3 讨论
目前认为,PARP-1在DNA损伤修复、基因转录和细胞死亡等过程中具有重要作用。PARP-1抑制剂对多种疾病治疗具有潜在的应用价值,尤其对DNA修复功能缺陷的肿瘤细胞具有高度敏感性,可有效增加肿瘤患者的生存率。目前已有多种PARP-1抑制剂获批上市用于肿瘤治疗,如维利帕尼(veliparib)、他拉唑帕尼(talazoparib)、尼拉帕尼(niraparib)、芦卡帕尼(rucaparib)和奥拉帕尼(olaparib)等[12]。由于PARP-1修复DNA损伤时需消耗NAD+和ATP等能量物质,所以严重的DNA损伤可导致PARP-1过度激活,进而因能量耗竭导致细胞死亡和周围组织炎症。因此,PARP-1抑制剂在缺血再灌注损伤、烷化剂导致的皮肤损伤及炎症等疾病治疗中表现出一定的药效。
本研究以慢病毒(pLVX-shRNA2-puro)为载体,针对PARP-1mRNA设计干扰序列shRNA,化学合成后采用酶切法插入慢病毒载体质粒。测序和酶切结果显示,包含PARP-1 shRNA的慢病毒载体质粒构建成功。将该慢病毒载体质粒及包装质粒共转染至HEK293T细胞,包装并提取含有PARP-1 shRNA的慢病毒颗粒。用HaCaT细胞测定最适慢病毒MOI值为100,随后将该慢病毒转染至HaCaT细胞,用嘌呤霉素3 mg·L-1筛选出单克隆PARP-1 KD HaCaT细胞。用Western印迹法及RT-qPCR法检测该细胞PARP-1敲降效率。结果表明,PARP-1 mRNA和蛋白表达水平明显降低。
γ-H2AX为DNA损伤的指示蛋白。Luminex法检测结果表明,SM 1000 μmol·L-1作用 24 h,PARP-1 KD HaCaT细胞γ-H2AX表达水平高于NC HaCaT细胞,提示PARP-1敲降可显著增加γ-H2AX表达,PARP-1在正常皮肤细胞HaCaT的DNA损伤修复中发挥重要作用。
与siRNA介导的瞬时转染敲降基因的方式不同,本研究采用慢病毒载体转染HaCaT细胞,PARP-1 shRNA序列可通过慢病毒整合到细胞基因组中,得到稳定敲降PARP-1的PARP-1 KD HaCaT。上述结果表明,本研究所构建的PARP-1 KD HaCaT细胞可用于抗DNA损伤药物筛选及其机制研究,可为后续研究提供可靠的细胞模型[13]。
目前,皮肤癌研究中常用的细胞模型多为癌细胞,本研究中选用的HaCaT细胞是人永生化的表皮角化形成细胞,是皮肤相关实验中常用的正常细胞模型,对比皮肤癌细胞更适用于正常皮肤损伤的相关研究[14-15]。因此,本研究成功构建的含PARP-1 shRNA的慢病毒载体质粒和PARP-1 KD HaCaT细胞,可为进一步研究PARP-1在正常皮肤细胞DNA损伤中的作用机制奠定基础。
