微小RNA-16 对急性心肌梗死大鼠心肌细胞凋亡和炎症反应的影响及其机制研究
2022-11-04赖震宇赵展庆余秉昌蔡秋燕林奇栋
赖震宇,赵展庆,余秉昌,蔡秋燕,林奇栋
急性心肌梗死(AMI)是一种以冠状动脉闭塞导致心肌细胞缺氧和死亡为特征的疾病[1]。微小RNA(miR)是治疗心血管疾病的新靶点[2-3]。已经在缺血、缺氧的心脏和心肌细胞中发现了miR 的异常表达[4]。miR-16 可诱导心肌细胞凋亡来加重心肌缺血损伤[5]。在AMI中,抑制miR-16 可保护大鼠心脏免受缺血性损伤[6],表明miR-16 可能是挽救缺血性心肌的治疗靶点。然而,miR-16 在AMI 中的作用机制尚不明确。miRNA 和信使RNA(mRNA)之间的相互作用在AMI 后的转录调控中发挥着关键作用,已经在AMI患者中发现了竞争性内源性RNA 网络[7]。维甲酸受体相关孤核受体A(RORA)是维持心脏功能的关键保护剂,上调RORA 可抑制心肌细胞的缺氧损伤[8]。此外,RORA 可抑制肿瘤坏死因子-α(TNF-α)介导的核因子κB(NF-κB)通路激活[9]。另有研究显示,miR-16 是一种潜在的NF-κB 相关miRNA,在心肌梗死大鼠中NF-κB 的激活可上调miR-16 表达[10-11]。然而,在AMI中,RORA 是否介导miR-16与NF-κB 的激活还是未知。使用生物信息学数据库(TargetScan、starBase、PicTar)搜索了miR-16 下游靶标,预测显示RORA 与miR-16 具有特定的结合位点,是miR-16 的潜在靶基因。我们推测miR-16的过表达可能是AMI 中RORA 低表达的原因,抑制miR-16 可能通过上调RORA 来预防AMI。
1 材料与方法
1.1 实验动物
SPF 级雄性SD 大鼠80只,体质量(200±20)g,购自济南朋悦实验动物繁殖有限公司,合格证号为SCXK(鲁)20190003。大鼠在标准条件下饲养:温度(21±1)℃,湿度55%~60%,可自由获取食物和水。
1.2 主要试剂与仪器
重组腺相关病毒血清型9(rAAV9)载体携带miR-16 抑制剂(rAAV9-anti-miR-16)基因和用于RORA沉默的短发夹RNA(shRNA)(rAAV9-sh-RORA)及相应的阴性对照(rAAV9-anti-NC、rAAV9-sh-NC)、miR-16 模拟物(miR-16 mimic)及其阴性对照(miR-NC)购自上海GenePharm 公司;2,3,5-三苯基氯化四氮唑(TTC)溶液、核蛋白提取试剂盒购自北京Solarbio 公司;大鼠N 末端B 型利钠肽原(NT-proBNP)酶联免疫吸附(ELISA)检测试剂盒、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)ELISA 试剂盒购自上海酶联生物科技有限公司;苏木素-伊红(HE)染色试剂盒和TUNEL 细胞凋亡检测试剂盒(绿色荧光)购自上海碧云天生物技术研究所;兔源一抗B 细胞淋巴瘤因子2(Bcl-2)、Bcl-2 相关X 蛋白(Bax)、NF-κB p65、RORA、TNF-α 和甘油醛-3-磷酸脱氢酶(GAPDH)、组蛋白H3(Histone H3)购自英国Abcam 公司;兔源一抗半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、裂解的Caspase-3(cleaved-Caspase-3)购自美国Cell Signaling Technology 公司。动物心电图系统(Nasiff Associates 公司,美国);Vevo 2100超高分辨率小动物彩色多普勒超声实时影像系统(VisualSonics 公司,加拿大);iMark680 多功能酶标仪(Bio-Rad 公司,美国);BX51 电动显微镜(Olympus公司,日本);ABI Prism®7500 型荧光定量PCR 仪(应用生物系统公司,美国)。
1.3 AMI 大鼠模型的建立
将大鼠随机分为假手术组(sham组,n=12)和造模组(n=68)。造模组大鼠采用左前降支(LAD)永久结扎法[12]建立AMI 模型。通过腹腔注射戊巴比妥钠(60 mg/kg)来麻醉大鼠。在第四肋间打开胸腔,露出心脏。用6-0 尼龙缝线在距左耳尖2~3 mm 处结扎LAD。三导联心电图用于监测心肌缺血开始时的心率以及典型的心电图变化。结扎30 min 后观察到心电图ST 段明显抬高和心肌紫绀,AMI 模型即成功建立[12]。为了降低大鼠的死亡率,在结扎后即可在心脏表面滴注(1~2 滴)和腹腔注射(0.1~0.2 ml)利多卡因以预防室性心律失常,并腹腔注射呋塞米(0.1~0.2 ml)以减轻心脏负荷[13]。然后,逐层缝合。sham 组大鼠不结扎冠状动脉,其余操作同上。
1.4 分组与干预
取60 只造模成功大鼠随机分为AMI 组、rAAV9-miR-16 抑制剂阴性对照组(rAAV9-anti-NC 组)、rAAV9-miR-16 抑制剂组(rAAV9-anti-miR-16 组)、rAAV9-miR-16抑制剂+RORA短发夹RNA的阴性对照组(rAAV9-anti-miR-16+sh-NC组)、rAAV9-miR-16抑制剂+RORA沉默组(rAAV9-anti-miR-16+sh-RORA 组),每组12 只。rAAV9-anti-NC 组和rAAV9-anti-miR-16 组大鼠分别通过单次尾静脉注 射200 μl 的rAAV9-anti-NC 和rAAV9-anti-miR-16(含1×1011个载体基因拷贝)[14];rAAV9-anti-miR-16+sh-NC 组大鼠以相同的方法将rAAV9-anti-miR-16和rAAV9-sh-NC 共同注射到大鼠体内,rAAV9-antimiR-16+sh-RORA 组大鼠以相同的方法和剂量注射rAAV9-anti-miR-16 和rAAV9-sh-RORA,sham组和AMI 组尾静脉注射等体积的生理盐水。单次尾静脉注射,注射2 周后,进行取材和相关指标的检测。
1.5 取材及指标检测
1.5.1 超声心动图检测大鼠心功能
将所有大鼠麻醉并仰卧位固定以进行经胸超声心动图检测,评估左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室射血分数(LVEF)和左心室短轴缩短分数(LVFS)。所有测量值均取自5 个连续心动周期的平均值。
1.5.2 ELISA 法检测血清NT-proBNP 水平、CK-MB和LDH 活性
心功能检测完成后,大鼠经腹主动脉取血,静置后以2 000×g 离心10 min,取血清。ELISA 法检测血清NT-proBNP 水平、CK-MB 和LDH 活性。
1.5.3 TTC 染色检测心肌梗死面积
每组随机选取6 只大鼠,采集血样后,迅速收集心脏组织。然后,将心脏组织冠状面切成五片,用0.2% TTC 溶液快速染色。用数码相机拍摄图像并使用Image J 软件进行分析。心肌梗死面积百分比计算为白色面积(梗死区域)/总面积×100%。
1.5.4 HE 染色检测心肌组织病理学变化
每组剩余6 只大鼠,取结扎线下方的左心室组织。将左心室组织冠状切分为两部分,一部分于-80℃保存;另一部分用4%多聚甲醛固定,石蜡包埋,切片厚5 μm,进行常规HE 染色。于光学显微镜下观察心肌组织病理变化。
1.5.5 TUNEL 染色检测心肌组织中细胞凋亡
取心肌组织石蜡切片,经脱蜡、水化后,添加TUNEL 染色溶液并在37℃下避光孵育60 min,4',6-二脒基-2-苯基吲哚(DAPI)染核10 min。封片,在荧光显微镜下观察切片,并使用Image J 软件计数TUNEL 阳性(TUNEL+,绿色荧光)细胞,计算细胞凋亡率(TUNEL+细胞/总细胞数×100%)。每张切片随机选取3 个视野进行统计分析。
1.5.6 逆转录定量PCR(RT-qPCR)检测心肌组织miR-16、RORA mRNA 和TNF-α mRNA、IL-6 mRNA 表达水平
使用Trizol 试剂从心脏组织中分离总RNA 样品。通过逆转录试剂盒将总RNA 逆转录为互补DNA(cDNA)。然后,在ABI Prism®7500 型荧光定量PCR 系统中扩增cDNA。热循环条件如下:95℃10 min,94℃ 15 s,60℃ 30 s 和72℃ 60 s,40 个循环。2-ΔΔCt方法计算靶基因的相对表达量,U6 和GAPDH 用于标准化。引物序列见表1。

表1 引物序列
1.5.7 免疫蛋白印迹(Western blot)法检测心肌组织中蛋白表达
用放射免疫沉淀法(RIPA)裂解液提取心肌组织总蛋白,并用核蛋白提取试剂盒提取核蛋白质(用于检测NF-κB p65 水平)。BCA 法测定蛋白质浓度后,将蛋白质(30 μg)变性并通过10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移到聚偏二氟乙烯(PVDF)膜上。用5%脱脂牛奶在室温下封闭膜1 h。洗涤3 次后,将膜与一抗Bcl-2、Caspase-3、cleaved-Caspase-3、Bax,均以1: 500 稀释;NF-κB p65、RORA、TNF-α、Histone H3,均以1: 1 000 稀释;GAPDH,1: 2 000 稀释在4℃下孵育过夜。然后将山羊抗兔IgG 二抗(HRP,1: 2 000)与膜在室温下孵育1 h。使用电化学发光(ECL)系统检测免疫反应,并用Image J 软件计算条带灰度值。GAPDH、Histone H3 为内参蛋白。
1.5.8 双荧光素酶报告基因实验
miR-16 和RORA 的结合位点由StarBase(http://starbase.sysu.edu.cn/)预测。构建重组荧光素酶报告载体psiCHECK-2,分别携带野生型(WT)或突变型(MUT)RORA 的3'-非翻译区(3'UTR),命名为WT-RORA、MUT-RORA。使 用Lipofectamine 3 000 试剂将24 孔板中的HEK-293 细胞与荧光素酶报告载体(WT-RORA、MUT-RORA)和miR-16 mimic 或miR-NC共转染。转染48h后,用双荧光素酶报告基因检测系统(Dual-Glo®)测量psiCHECK-2 载体的荧光素酶活性。海肾荧光素酶活性用作内部对照,计算萤火虫萤光素酶活性与海肾荧光素酶活性的比率。
1.6 统计学方法
使用GraphPad Prism 8.0 软件进行统计分析。计量数据以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠心功能指标比较(表2)
表2 各组大鼠的心功能指标比较(n=12,)
注:LVEDD:左心室舒张末期内径;LVESD:左心室收缩末期内径;LVEF:左心室射血分数;LVFS:左心室短轴缩短分数;rAAV9:重组腺相关病毒血清型9;RORA:维甲酸受体相关孤核受体A;miR:微小RNA。sham 组:假手术组;AMI 组:急性心肌梗死组;rAAV9-anti-NC 组:rAAV9-miR-16 抑制剂阴性对照组;rAAV9-anti-miR-16 组:rAAV9-miR-16 抑制剂组;rAAV9-anti-miR-16+sh-NC 组:rAAV9-miR-16 抑制剂+RORA短发夹RNA 的阴性对照组;rAAV9-anti-miR-16+sh-RORA 组:rAAV9-miR-16 抑制剂+RORA 沉默的短发夹RNA 组。与sham 组相比*P<0.05,与AMI 组、rAAV9-anti-NC 组相比△P<0.05,与rAAV9-anti-miR-16 组、rAAV9-anti-miR-16+sh-NC 组相比▲P<0.05
与sham 组相比,AMI 组大鼠LVEDD、LVESD 均显著增大,LVEF、LVFS 均显著下降(P均<0.05);与AMI组、rAAV9-anti-NC组相比,rAAV9-antimiR-16组大鼠LVEDD、LVESD均显著减小,LVEF、LVFS均显著升高(P均<0.05);与rAAV9-anti-miR-16组、rAAV9-anti-miR-16+sh-NC 组相比,rAAV9-antimiR-16+sh-RORA 组大鼠LVEDD、LVESD 显著增大,LVEF、LVFS 均显著下降(P均<0.05)。
2.2 各组大鼠血清NT-proBNP水 平、CK-MB和LDH活性比较(图1)

图1 各组大鼠血清NT-proBNP 水平(1A)、CK-MB(1B)和LDH 活性(1C)比较(n=12)
与sham 组相比,AMI 组大鼠血清NT-proBNP 水平、CK-MB 和LDH 活性均显著升高(P均<0.05);与AMI 组、rAAV9-anti-NC组相比,rAAV9-antimiR-16 组上述指标水平均显著降低(P均<0.05);与rAAV9-anti-miR-16组、rAAV9-anti-miR-16+sh-NC组相比,rAAV9-anti-miR-16+sh-RORA组上述指标水平均显著升高(P均<0.05)。
2.3 各组大鼠心肌梗死面积比较(图2)
与sham 组相比,AMI 组大鼠心肌梗死面积百分比显著升高(P<0.05);与AMI 组、rAAV9-anti-NC 组相比,rAAV9-anti-miR-16 组心肌梗死面积百分比均显著降低(P均<0.05);与rAAV9-antimiR-16 组、rAAV9-anti-miR-16+sh-NC组相比,rAAV9-anti-miR-16+sh-RORA 组心肌梗死面积百分比均显著升高(P均<0.05)。
2.4 各组大鼠心肌组织损伤比较(图3)
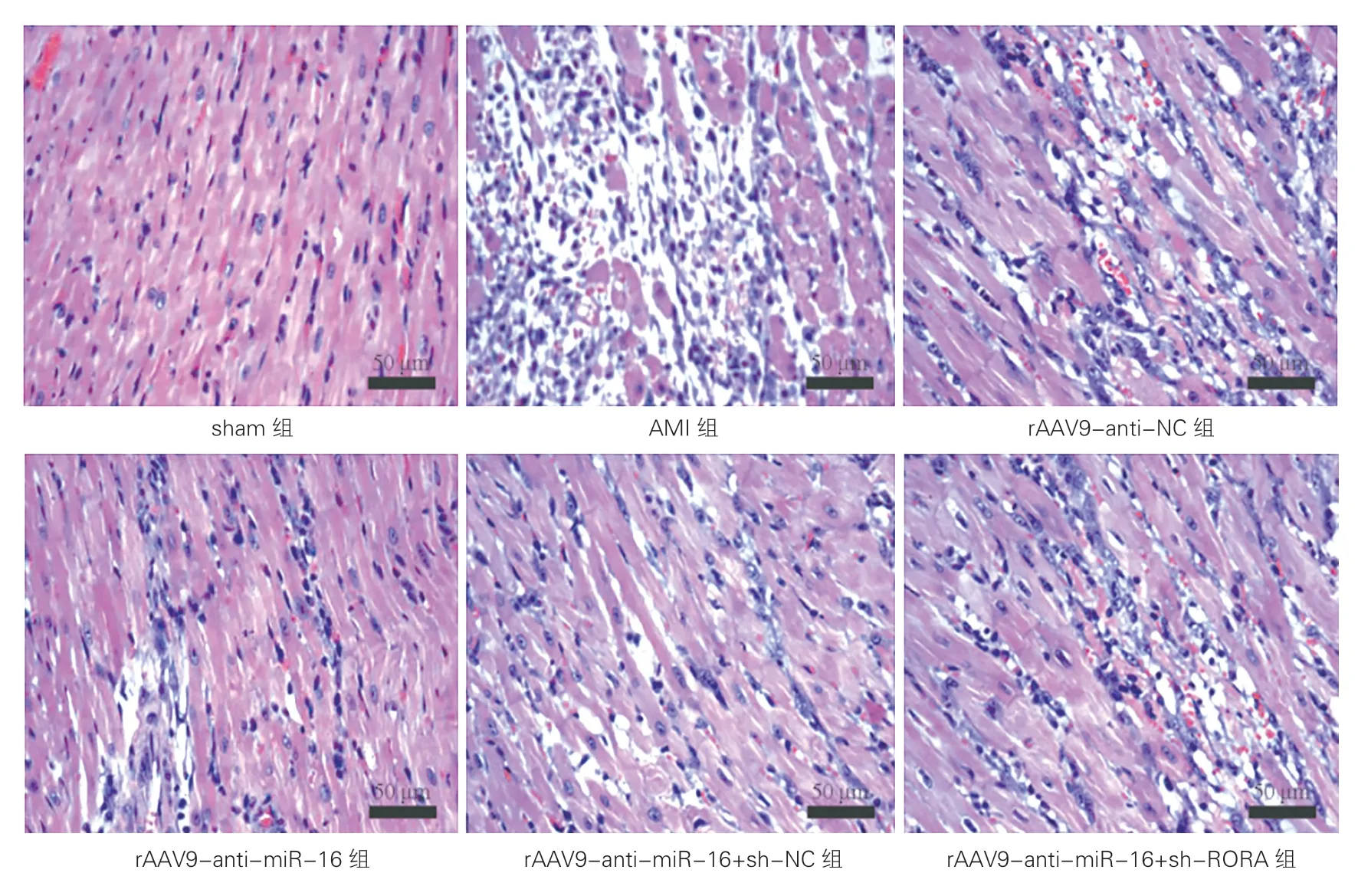
图3 HE 染色检测各组大鼠心肌组织形态学改变(n=6,比例尺:50μm)
HE 染色结果显示,sham 组心肌细胞形态规则,心肌纤维排列整齐,无明显水肿和炎性细胞浸润;与sham 组相比,AMI 组和rAAV9-anti-NC 组大鼠可见心肌细胞排列紊乱、肿胀、数量减少,心肌纤维出现断裂,炎性细胞浸润明显;与AMI 组和rAAV9-anti-NC 组相比,rAAV9-anti-miR-16组和rAAV9-anti-miR-16+sh-NC 组大鼠可见轻度心肌细胞水肿,少量心肌纤维断裂,炎性细胞浸润减少;与rAAV9-anti-miR-16 组和rAAV9-anti-miR-16+sh-NC 组相比,rAAV9-anti-miR-16+sh-RORA 组大鼠心肌细胞排列紊乱,炎性细胞浸润增加,心肌损伤加重。
2.5 各组大鼠心肌细胞凋亡率比较(图4)
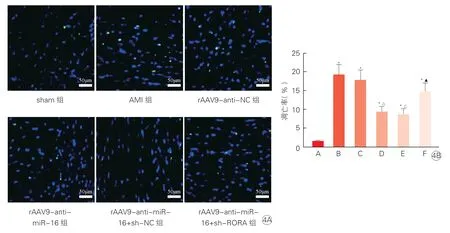
图4 TUNEL 染色检测大鼠心肌细胞凋亡(n=6)
TUNEL 染色结果显示,与sham 组相比,AMI组大鼠心肌组织中绿色荧光标记的TUNEL+细胞明显增多,细胞凋亡率显著升高(P<0.05);与AMI组、rAAV9-anti-NC 组相比,rAAV9-anti-miR-16组细胞凋亡率显著降低(P<0.05);与rAAV9-antimiR-16 组、rAAV9-anti-miR-16+sh-NC 组相比,rAAV9-anti-miR-16+sh-RORA 组细胞凋亡率显著升高(P<0.05)。
2.6 各组大鼠心肌组织miR-16、RORA mRNA 和TNF-α mRNA、IL-6 mRNA 水平比较(图5)
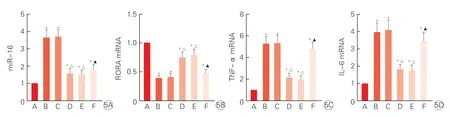
图5 各组大鼠心肌组织miR-16(5A)、RORA mRNA(5B)、TNF-α mRNA(5C)、IL-6 mRNA(5D)水平比较(n=6)
与sham 组相比,AMI 组miR-16、TNF-α mRNA、IL-6 mRNA 水平均显著升高,RORA mRNA水平显著降低(P均<0.05);与AMI 组、rAAV9-anti-NC 组 相 比,rAAV9-anti-miR-16 组miR-16、TNF-α mRNA、IL-6 mRNA 水平均显著降低,RORA mRNA 水平显著升高(P均<0.05);与rAAV9-anti-miR-16 组、rAAV9-anti-miR-16+sh-NC 组相比,rAAV9-anti-miR-16+sh-RORA 组TNF-α mRNA、IL-6 mRNA 水平均显著升高,RORA mRNA 水平显著降低(P均<0.05)。
2.7 各组大鼠心肌组织Caspase-3、cleaved-Caspase-3、Bcl-2、Bax 蛋白水平比较(图6)
与sham 组相比,AMI 组cleaved-Caspase-3/Caspase-3 比值、Bax 蛋白水平均显著升高,Bcl-2 蛋白水平显著降低(P均<0.05);与AMI 组、rAAV9-anti-NC 组相比,rAAV9-anti-miR-16 组cleaved-Caspase-3/Caspase-3 比值、Bax 蛋白水平显著降低,Bcl-2 蛋白水平均显著升高(P均<0.05);与rAAV9-anti-miR-16 组、rAAV9-anti-miR-16+sh-NC 组相比,rAAV9-anti-miR-16+sh-RORA 组cleaved-Caspase-3/Caspase-3 比值、Bax 蛋白水平显著升高,Bcl-2 蛋白水平均显著降低(P均<0.05)。
2.8 各组大鼠心肌组织RORA、TNF-α、NF-κB p65 蛋白表达水平比较(图7)
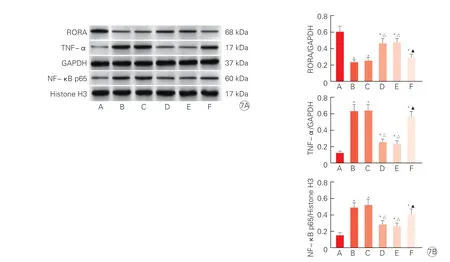
图7 各组大鼠心肌组织RORA、TNF-α、NF-κB p65 蛋白表达水平(n=6)
与sham 组相比,AMI 组RORA 蛋白水平显著降低,TNF-α 和NF-κB p65 蛋白水平均显著升高(P均<0.05);与AMI 组、rAAV9-anti-NC 组相比,rAAV9-anti-miR-16 组RORA 蛋白水平显著升高,TNF-α 和NF-κB p65 蛋白水平均显著降低(P均<0.05);与rAAV9-anti-miR-16 组、rAAV9-antimiR-16+sh-NC 组相比,rAAV9-anti-miR-16+sh-RORA组RORA蛋白水平显著降低,TNF-α 和NF-κB p65 蛋白水平均显著升高(P均<0.05),差异均有统计学意义。
2)采集套管气的技术路线。对于正在生产的抽油井,回油干线的压力称为回压。一般情况下,回压取决于原油集输系统的流动阻力。一旦建设完成原油集输系统,回压波动将是一个稳定值Ph。
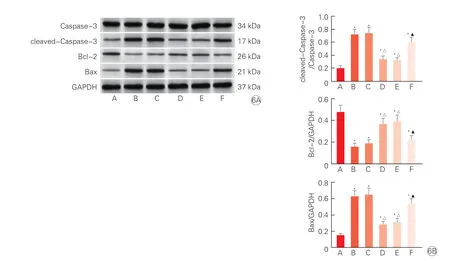
注:6A:蛋白电泳图;6B:各组Caspase-3、cleaved-Caspase-3、Bcl-2、Bax 蛋白表达量比较。A:假手术组(sham 组);B:急性心肌梗死组(AMI组);C:rAAV9-miR-16 抑制剂阴性对照组(rAAV9-anti-NC 组);D:rAAV9-miR-16 抑制剂组(rAAV9-anti-miR-16 组);E:rAAV9-miR-16 抑制剂+RORA短发夹RNA的阴性对照组(rAAV9-anti-miR-16+sh-NC 组);F:rAAV9-miR-16 抑制剂+RORA 沉默的短发夹RNA 组(rAAV9-anti-miR-16+sh-RORA组)。Caspase-3:半胱氨酸天冬氨酸蛋白酶-3;cleaved-Caspase-3:裂解的Caspase-3;Bcl-2:B 细胞淋巴瘤/因子2;Bax:Bcl-2 相关X 蛋白;GAPDH:甘油醛-3-磷酸脱氢酶;miR-16:微小RNA-16;rAAV9:重组腺相关病毒血清型9;RORA:维甲酸受体相关孤核受体A。与sham 组相比*P<0.05;与AMI 组、rAAV9-anti-NC 组相比 △P<0.05;与rAAV9-anti-miR-16 组、rAAV9-antimiR-16+sh-NC 组相比▲P<0.05
2.9 miR-16 靶向调控RORA 表达(图8)

图8 靶基因预测和细胞荧光素酶活性结果
通过StarBase 数据库预测编码RORA 的3'UTR mRNA 含有miR-16 的结合位点。
双荧光素酶报告基因实验检测结果显示,与转染miR-NC 相比,转染miR-16 抑制剂后,含有WT-RORA 质粒的细胞荧光素酶活性显著降低(P<0.05),含MUT-RORA 质粒的细胞荧光素酶活性未受显著影响(P>0.05)。
3 讨论
TNF-α 是一种促炎细胞因子,其介导炎症反应的下游靶标是NF-κB。心脏组织中TNF-α/NF-κB 激活被认为是心肌梗死的标志[15]。有研究发现,病情严重且预后不良的AMI 患者NF-κB p65表达水平显著增加,与AMI 发展和预后相关[16]。RORA 为心肌梗死的关键基因[8]。RORA 的缺乏会加剧高脂饮食引起的心肌肥大、纤维化和功能障碍[17]。重要的是,RORA 是一种炎症调节剂,RORA 的缺失会导致IL-6 表达增强和NF-κB 核转位[18]。相反,RORA 的过表达可以通过阻断NF-κB p65 核转位和调节沉默调节蛋白1(SIRT1)表达限制NF-κB p65在赖氨酸310 处的乙酰化来缓解体内和体外脂多糖(LPS)诱导的炎症和器官损伤[19]。这些研究表明,RORA 在维持心肌细胞存活中发挥关键作用。
本研究结果显示,缺血性心脏中RORA 表达降低,而miR-16 和NF-κB p65 核转位均增加。在敲低miR-16后,RORA 上调,TNF-α 表达、NFκB p65 核转位和心肌细胞凋亡均受到抑制。通过生物信息学预测发现,miR-16 包含RORA 的结合序列。由此猜想miR-16 和RORA 可能存在调控网络。随后的双荧光素酶实验显示,miR-16 的过表达可降低WT-RORA 细胞的荧光素酶活性,证实miR-16 可靶向调控RORA。为了进一步验证miR-16 和RORA 的调控关系,本研究在敲低miR-16 的基础上,采用小分子干扰技术下调RORA 表达,结果显示下调RORA 可部分阻断miR-16 敲低对AMI 大鼠心肌损伤的保护作用,证实了miR-16 可靶向负调控RORA。提示,miR-16 对心肌细胞的有害作用可能是由RORA 的下调赋予的。
miRNA 的生物学功能之一是一个miRNA 可以调节多个基因表达。除RORA外,许多凋亡相关基因已被证实是miR-16 的靶基因。例如,Cao 等[20]表明miR-16 可靶向调节蛋白酪氨酸磷酸酶非受体4型(PTPN4)影响缺氧/复氧诱导的心肌细胞凋亡和自噬;在阿尔茨海默病模型中,miR-16 的高表达可直接靶向和抑制Bcl-2 诱导神经元细胞凋亡[21]。在本研究中,我们确定了RORA 作为miR-16 的直接靶基因,未研究其他潜在靶点,但不能排除所有已验证的靶基因和miR-16 的其他潜在靶点可能参与其对心肌细胞的影响,这是本研究的局限性之一,在未来的研究中将结合体外细胞实验对其作用机制进行深入分析。
利益冲突:所有作者均声明不存在利益冲突
