HPV多重混合感染的女性病人宫颈病变特征分析
2022-11-04木朝宇张晓梅姚慧琳范德胜刘培明
木朝宇,张晓梅,徐 珍,姚慧琳,范德胜,刘培明
宫颈癌(cervical cancer,CC)是女性中最常见的癌症之一,由于宫颈筛查在中国尚未广泛实施,2012年CC的发病率为每10万人62例,其中约50%导致CC相关死亡(每10万人30例)[1]。在全球范围内,中国占新CC病例的11.9%,每年死亡率为11.1%[2]。流行病学评估在无干预的情况下,中国新发CC的发生率从2010年至2050年可能会增加40%~50%[3]。
人乳头瘤病毒(HPV)属于高度异质性的DNA病毒,可引起皮肤和黏膜上皮内细胞内瘤变。HPV可根据其与癌前病变的关联性分为高危型(high-risk,HR)和低危型(low-risk,LR),而依据病毒不同的感染状态又可分为单一亚型的感染和多重亚型的混合感染(包括二重感染、三重感染以及更多亚型感染),其中临床上多重感染以二重感染最为常见。临床上不同HPV亚型的致病性不同,有报道[4]指出HPV高危型持续或反复感染是CC以及癌前病变进展的重要危险因素。此外,HPV亚型之间外壳蛋白差异性较大,产生的抗体基本不具备交叉保护作用,因此易出现多种亚型混合感染以及反复感染[4]。而对于HPV多重亚型混合感染是否促进宫颈病变的发生、发展,目前尚且存在争议。LEE等[5]报道HPV单一亚型感染可提高CC的患病风险至19.9倍,而HPV多重亚型混合感染可使该风险上升到31.8倍。此外,也有报道[6]显示在CC的高危年轻群体中,HPV多亚型混合感染率明显高于单一亚型的感染,HPV持续感染的病人感染其他亚型的可能性亦较大。但也有文献[7]报道,随着宫颈病变程度的提高,多亚型混合感染率趋于降低,且宫颈鳞癌倾向于HR-HPV单一感染。
本研究通过分析HPV多重亚型混合感染的不同年龄段女性病人中不同级别宫颈病变的分布,探讨HPV多重亚型混合感染在CC和癌前病变发生的影响,为临床宫颈癌的防治提供风险预测和指导。
1 对象与方法
1.1 研究对象及分组 2017年3月至2019年5月淮北矿工总医院妇科就诊、筛查和体检并接受HPV分型检测的女性6 382例,年龄19~90岁,中位年龄46.01岁。根据HPV检测结果,仅有1种亚型感染者定义为单一感染,而2种及以上亚型混合感染者定义为多重混合感染。HPV多重混合感染包括高危混合型、高低危混合型以及低危混合型3种类型,并根据液基细胞学(TCT)和阴道镜下病理组织活检结果进行分组。
1.2 主要试剂及仪器 HPV核酸扩增分型检测试剂盒、核酸分子快速杂交仪,均为中山大学达安基因股份有限公司配套仪器和试剂;核酸扩增仪为美国ABI7500 PCR仪。
1.3 方法
1.3.1 样本采集 宫颈样本由妇科医生通过细胞刷获得,并将采集的宫颈上皮脱落细胞标本置于样本保存液中,4 ℃冰箱储存备用。
1.3.2 核酸抽提 将样品混合加入带有1 mL细胞保存溶液的1.5 mL离心管中,以12 000 r/min离心3 min,除去上清液,向沉淀物加入1 mL 0.9%氯化钠溶液后涡旋混匀,以12 000 r/min离心3 min,再次除去上清液,并将100 μL变性试剂(中山大学达安基因股份有限公司)加入到沉淀中并涡旋混匀。然后,将样品在100 ℃温育10 min,并以12 000 r/min离心3 min,收集上清液并使用NanoDrop 2000分光光度计测量DNA浓度,所得核酸用于实验或于-20 ℃中保存待用。
1.3.3 PCR-DNA反向点杂交技术 PCR循环条件反应条件为95 ℃、15 min,95 ℃、40 s,55 ℃、40 s,72 ℃、40 s,40个循环;72 ℃、7 min,4 ℃维持,即可得到扩增的 PCR产物。然后,将扩增的产物纯化,变性并杂交。核酸分子杂交及HPV基因分型的显色结果判定分析等过程均参考试剂盒说明书。试剂盒检测的亚型中包括15种高危亚型(16、18、31、33、35、39、45、51、52、56、58、59、68、73和82)、三种可能高危亚型(26、53和66)以及10种低危亚型(6、11、40、42、43、44、54、61、81和83)。
1.3.4 TCT和宫颈组织病理检查 TCT包括未见上皮内病变或恶性细胞(NILM)、无确定诊断意义的非典型鳞状细胞(ASCUS)和不能排除高级别上皮内病变的非典型鳞状细胞(ASC-H)、 低级别上皮内病变(LSIL)、高级别上皮内病变(HSIL)、鳞状癌(SCC)、不典型腺上皮细胞(AGC)、腺原位癌(AIS)。宫颈组织病理活检包括宫颈慢性炎症、LSIL、 HSI和浸润性癌(ICC)等。本研究中TCT和宫颈组织病理检查数据由本院病理科提供。
1.4 统计学方法 采用χ2检验。
2 结果
2.1 HPV多重感染的流行病学表现 本研究中6 382例样本基因分型检测显示HPV感染率为16.4%(1 044/6 382),其中HPV单一感染阳性占比67.0%(700/1 044),感染率为11.0%(700/6 382);而多重混合感染阳性占比33.0%(344/1 044),感染率为5.4%(344/6 382)。此外,344例多重混合感染样本中,HR-HPV和LR-HPV基因型的频数分别为310和222。多重混合感染以二重感染为主(220例,63.9%),其次是三重感染(68例,19.8%)、四重感染(28例,8.1%)、五重感染(20例,5.8%)等,最高多达八重感染。多亚型混合感染随着混合种类的增加,感染的占比逐渐降低。在多亚型混合感染病例中,高低危混合型感染占比最高54.65%(188/344),其次为高危亚型混合感染35.47%(122/344),而低危混合型最低9.88%(34/344),三者感染差异有统计学意义(χ2=156.17,P<0.01)。
2.2 HPV多重感染亚型分布 本研究中,HPV 28种亚型均被检出,排前5位的亚型依次为HPV52 11.7%、HPV40 8.4%、HPV44 7.7%、HPV16 6.8%、HPV58和HPV53 5.9%。其中高危亚型流行的前3名依次为HPV52、HPV16、HPV58型,低危亚型流行的前3名依次为HPV40、HPV44、HPV54型。HPV52感染频次与其他各型相比,差异有统计学意义(P<0.01);HPV16感染频次与其他各型相比,差异有统计学意义(P<0.05)(见表1)。

表1 HPV多重感染亚型频数分布(n=909)
2.3 HPV多重感染及宫颈病变的年龄分布情况 不同年龄段妇女人群HPV多重感染构成比位次前3的年龄段依次为41~50岁年龄段占35.8%、51~60岁年龄段占28.2%和31~40岁年龄段占15.4%。随着年龄的增加,感染频次波动上升(χ2=18.34,P<0.01)(见表2)。41~50岁是HPV多重感染例数和HR亚型频数分布最多的年龄段,位次前3的亚型依次是HPV52占18.2%、HPV16占10.6%、HPV58占9.2%;不同于HPV52、16亚型(41~50岁),HPV58亚型分布最多的是51~60岁的年龄组;HPV多重感染病人中宫颈病变的分布也主要集中在41~50岁年龄段,其次是51~60岁年龄段。但不同年龄组中宫颈病变的分布差异无统计学意义(χ2=2.97,P>0.05)(见表3)。多重混合感染中,除31~40岁年龄组外,其余年龄段均以高低危混合型感染为主,高危混合型次之,而低危混合型最少。除≥61岁年龄组外,其余年龄组3种混合感染差异无统计学意义(χ2=9.20,P>0.05)(见表4)。LSIL与HSIL分布随年龄段增大而增加,在41~50岁达到最高,随后降低;而CC分布则在51~60岁年龄段达到最高,随后呈下降趋势,41~50岁与51~60岁年龄段低级别宫颈病变(LSIL)与严重宫颈病变(HSIL+CC)的分布差异无统计学意义(χ2=2.20,P>0.05)(见表5)。
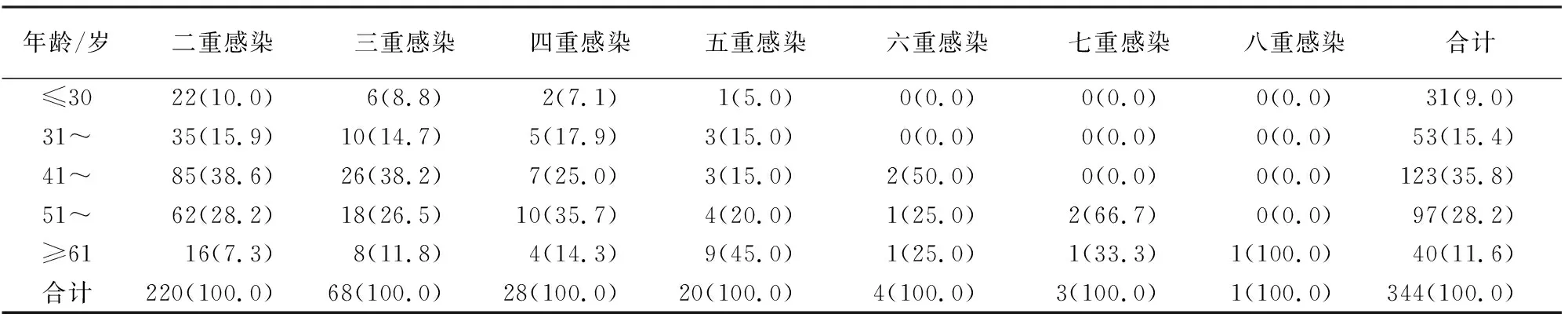
表2 不同年龄段HPV多重感染分布情况[n;构成比(%)]

表3 不同年龄段HPV多重感染的高危亚型及宫颈病变分布情况[n;构成比(%)]
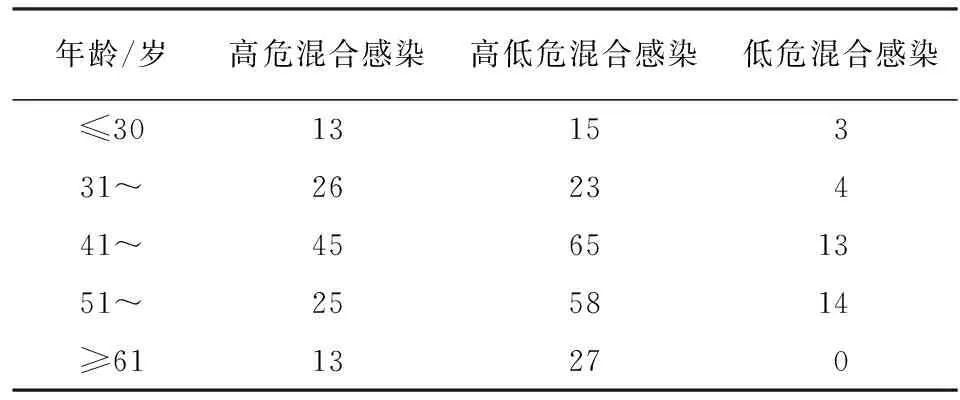
表4 不同年龄段HPV多重混合感染类型分布情况(n)
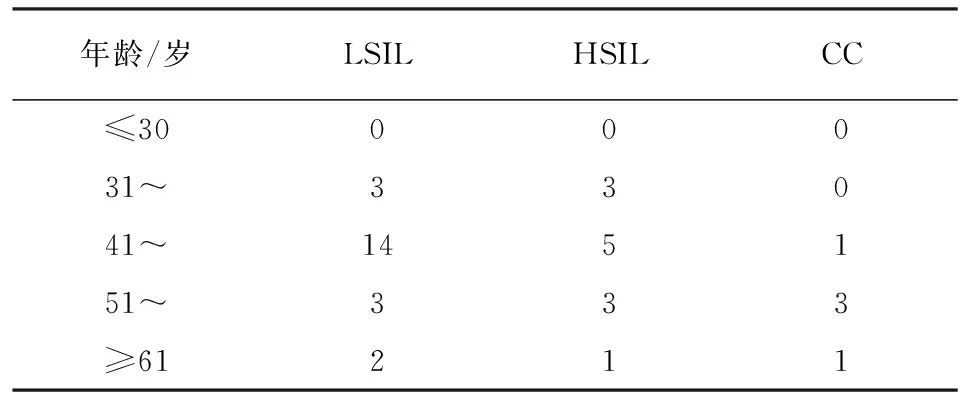
表5 不同年龄组HPV多重感染LSIL、HSIL及CC分布情况(n)
2.4 HPV多重混合感染中宫颈病变的分布情况 344例HPV多重混合感染行TCT和阴道镜下病理组织活检结果显示,正常组305例,LISL组22例,HSIL组12例以及CC组5例(见表6)。344例多重混合感染中高危混合型122例、高低危混合型188例、低危混合型34例。高危混合型宫颈病变率为21.31%高于低危混合型的2.94%和高低危混合型的6.39%(P<0.01),低危混合型与高低危混合型严重宫颈病变率差异无统计学意义(P>0.05)(见表7)。此外,39例宫颈病变病人HPV多重感染的高危亚型分布结果:LSIL组分布有13种高危亚型,感染频次较高的亚型依次为HPV52、HPV31、HPV56、HPV33;HSIL组分布有11种高危亚型,感染频次较高的亚型依次为HPV33、HPV16及HPV82;CC组分布有10种亚型,感染频次较高的亚型依次为HPV58、HPV16、HPV39、HPV52、HPV53和HPV66。
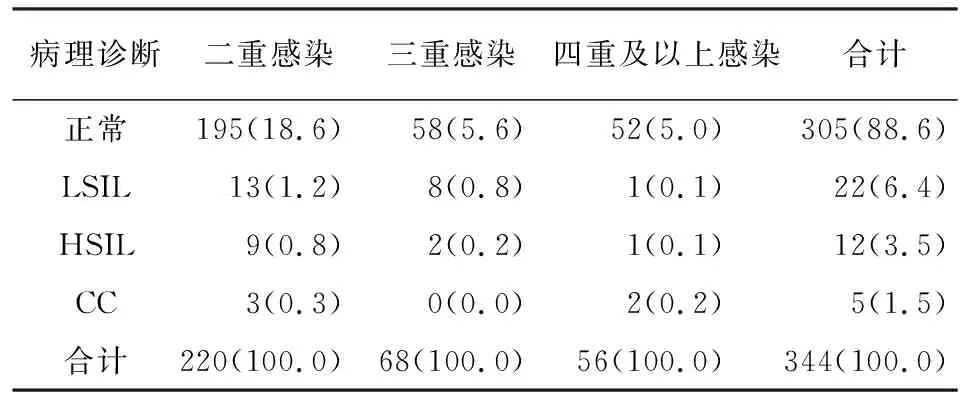
表6 HPV多重感染中的宫颈病变分布[n;构成比(%)]
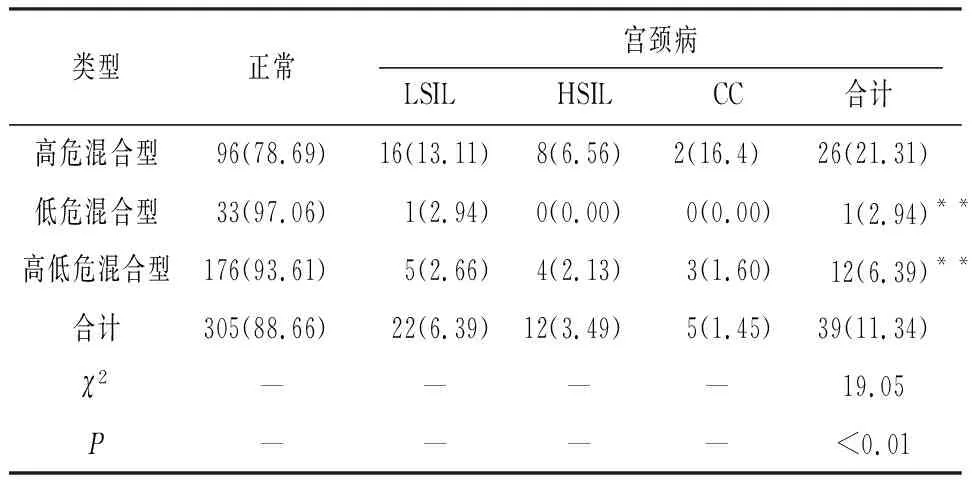
表7 HPV 3种混合感染中的宫颈病变分布[n;构成比(%)]
3 讨论
HPV多重感染表明机体免疫机制清除病毒不力,预示病情进展,而HPV绝大部分会在半年时间内通过自身免疫清除感染,大部分宫颈病变会在2年的时间内消退[8]。近年来,有研究[9]报道HPV多亚型混合感染与不同程度的宫颈病变具有明显的相关性,随着宫颈病变程度的严重性升高,多亚型混合感染率呈上升现象(宫颈癌除外)。亦有文献[7]表明随宫颈病变程度的加重,多亚型混合感染率趋于下降,且SCC的倾向于单一HR-HPV感染。此外,卢洪胜等[10]认为HPV多亚型感染可能会对病毒的致病力产生影响,并最终影响到CC病程的进展和严重性。而赵红霞等[11]认为HPV多亚型感染与CC的发生没有显著相关性,HPV亚型数目与宫颈病变是否发生无显著关联性,可能存在与病变后的病情进展和癌病程度相关性。同样,也有研究[12]提示HPV亚型数目与宫颈病变是否发生以及宫颈病变的严重程度没有显著关联性,而HPV基因型的致病能力与宫颈病变、宫颈病变后进展以及癌病程度密切相关。本研究结果亦显示,344例HPV多亚型感染阳性病人中,随着宫颈病变程度加重,多亚型混合感染占比呈下降趋势,且随着HPV多重感染亚型数增加,LSIL、HSIL及CC组的多重感染占比也呈下降趋势。研究结果说明,HPV多重感染与不同程度的宫颈病变无明显的相关性,与上述文献[12]研究结果相似。
CC的发病年龄各国报道不一。在多数国家的女性人群中,宫颈浸润癌发病率在20岁以前很低,20~29 岁开始增长。我国女性CC发病率<25岁处于较低水平,25~40岁呈持续大幅度上升。据统计,我国城市妇女宫颈癌发病率在45岁达到顶峰后缓慢下降,农村妇女宫颈癌发病在55岁左右出现峰值[12]。本研究结果亦显示,41~50岁是HPV多重感染例数、HR亚型频数以及宫颈病变的分布最多的年龄段。LSIL与HSIL分布随年龄段增大而增加,在41~50岁达到最高,随后降低;而CC分布则在51~60岁年龄段达到最高,随后呈下降趋势。 提示41~50岁是宫颈病变的高风险年龄段,而51~60岁是宫颈癌发病的危险年龄段。
HR-HPV持续感染是诱发子宫颈上皮内瘤变的重要因素,HR-HPV持续性感染会进展为CC[4]。有研究[13]表明HR-HPV与HR-HPV混合感染引起高级别内瘤变的危险性比高危单一亚型感染要高3倍;另有报道[14]显示HR-HPV混合型感染时致癌风险增加,高低危混合型以及低危型混合感染时,增加宫颈LSIL的发病风险。本研究中HPV多重混合感染包括高危混合型122例(正常组96例、宫颈病变组26例)、高低危混合型188例(正常组176例、宫颈病变组12例)以及低危混合型34例(正常组33例、宫颈病变组1例)。高危混合型与高低危混合型宫颈病变(LSIL、HSIL)差异具有统计学意义(P<0.01),高危混合型与高低危混合型严重宫颈病变(HSIL+CC)差异无统计学意义(P>0.05)。此外,本研究中39例宫颈病变病人HPV多重感染的高危亚型在不同宫颈病变组中的分布显示感染频次HPV52亚型在LSIL中最高,HPV33、HPV16在HSIL中分布较高,而HPV58在CC中分布最高,但各高危亚型在不同等级宫颈病组分布差异无统计学意义。
综上,HPV多亚型混合感染与宫颈病变无明显的相关性,随着宫颈病变严重程度升高,多亚型混合感染率趋于下降。HPV感染亚型数目与宫颈病变是否发生以及宫颈病变的严重程度也无显著关联性,而HPV基因型的致病能力与宫颈病变、宫颈病变后病情进展密切相关。此外,年龄因素如41~50岁是宫颈病变的高风险年龄段,而51~60岁是CC发病的危险年龄段。考虑到本研究对象范围的有限性,地域性差异以及HPV检测方法学等因素的影响,有待进一步加大研究范围及样本量,进行更深入的研究。
