甘加藏羊发情周期血浆Kisspeptin动态变化和PHPT轴中Kiss1/GPR54 的表达与分布
2022-11-03杨亚文高何璇刘莉莉包莹莹何玉琴杨志杰陈卫刚葛闻博
杨亚文,高何璇,刘莉莉,包莹莹,何玉琴,杨志杰,陈卫刚,葛闻博
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2.兰州银行网络金融部,甘肃 兰州 730070;3.伊犁师范大学 生物与地理科学学院,新疆 伊犁 835000;4.中国农业科学院 兰州畜牧与兽药研究所,甘肃 兰州 730070)
甘加藏羊(Ovisarise)是甘南草地型藏羊的优良地方类型之一,常年生活在2 800 m以上的高海拔地区,季节性发情(每年7—9月),发情周期平均为(16 ± 2)d,每年产羔一次,一次一胎[1-2]。作为典型的季节性单次发情动物,较低水平的自然繁殖率与单次产羔是影响甘加藏羊群体数量的主要原因之一,严重影响了藏区畜牧业的良性发展。
研究发现,动物的季节性繁殖除了受到随季节变化的光周期、气温、食物供应等[3]原因的影响,繁殖相关基因的表达调控[4]也对发情起到重要作用。20世纪90年代,Lee等[5]在人黑色素瘤细胞株中首次发现了Kiss1基因,它能编码产生转移抑制素(Kisspeptin)。有研究表明,下丘脑中的Kisspeptin在与膜受体GPR54结合后,会刺激下游促性腺激素释放激素(Gonadotropin-releasing hormone, GnRH)的分泌[6-9],从而间接调控动物的季节性繁殖。也有研究报道Kiss1/GPR54系统是动物青春期启动和发展的关键[10]。在非繁殖季节给绵羊注射Kisspeptin可以使90%的绵羊反季节排卵,证实Kiss1/GPR54系统是启动母羊季节性繁殖的关键因子[11];Kiss1基因及其受体分布于多种组织器官,主要表达于下丘脑、垂体、胰腺、性腺、甲状腺等组织当中。下丘脑-垂体-甲状腺轴在调节生殖功能上起着重要作用,无论是甲状腺功能异常或是自身免疫性甲状腺疾病,均会对生殖产生不利影响[12-14]。陈卫刚[15]已对甘加藏羊发情周期下丘脑、垂体和卵巢组织中Kiss1/GPR54系统进行了详细研究,但对于有调节动物季节性繁殖的视神经、松果体和甲状腺组织中、Kiss1/GPR54系统的表达及其生理调控等未见研究报道。
因此,本试验以视神经为切入点,从“松果体-下丘脑-垂体-甲状腺轴”(Pineal-hypothalamus-pituitary-thyroid axis,PHPTA)着手,首次从基因和蛋白水平对甘加藏羊繁殖季节和非繁殖季节视神经、PHPTA组织中Kiss1、GPR54mRNA及其蛋白的表达分布以及血浆Kisspeptin含量的动态变化规律进行了研究,以期为进一步阐明Kiss1/GPR54系统对藏羊生殖活动的调控及其机理研究提供科学依据。
1 材料和方法
1.1 试验材料
1.1.1 试验动物 2019年7—9月(繁殖季节)在甘肃省甘南州夏河县甘加乡羊场随机选取24只2.5~3.5岁健康未孕的雌性甘加藏羊作试验组,其中发情前期、发情期、发情后期、间情期各6只;5月(非繁殖季节)随机选取6只乏情期甘加藏羊作对照组。
1.1.2 颈静脉采血 以公羊爬跨记为0 h,根据四期分法及母羊阴道涂片法跟踪观察2个发情周期,分别在发情期(第0~36小时)、发情后期(第39~72小时)、间情期(第4 ~13天)及发情前期(第14~16天)进行采样。第一个周期采集血浆:颈静脉采血,发情期每2 h采集1次,发情后期每3 h采集1次,其他时期7:00,19:00各采血1次,采血后迅速离心,吸取上清,置于-20 ℃保存。
1.1.3 组织采样 第2个周期采集组织样:将甘加藏羊颈动脉放血处死后,迅速打开颅腔及颈部取出完整的视神经、松果体、下丘脑、垂体和甲状腺,所得样品平均分为2份,分别置于4%多聚甲醛溶液和液氮中,待返回实验室后移至-80 ℃冰箱保存。
1.2 试验方法
1.2.1 血浆Kisspeptin检测 根据绵羊吻素(Kisspeptin)ELISA 检测试剂盒(北京,奇松)说明书并设置3次重复,测定血浆Kisspeptin的OD值。根据标准品的OD值以及相对应的浓度绘制标准曲线,得到Kisspeptin的回归方程y=0.001x+0.132 9(R2=0.996 8),其中y表示OD值,x表示浓度。根据回归方程计算得到不同时期Kisspeptin的浓度。用SPSS 22.0软件统计血浆中Kisspeptin不同时期的浓度,并分析显著性。
1.2.2 视神经、PHPT轴中Kiss1、GPR54mRNA检测 NCBI 网站查找Kiss1、GPR54相对应CDS序列,利用 Premier 5.0设计引物,由擎科生物合成(表1)。

表1 qRT-PCR引物Tab.1 Primer of qRT-PCR
TransZol UP RNA 提取试剂盒(北京,全式金)提取视神经、松果体、下丘脑、垂体、甲状腺中的总RNA,迅速检测RNA浓度,使用反转录预混型试剂盒(湖南,艾克瑞生物)在20 μL的体系中进行反转录,所得cDNA保存在-20 ℃备用。以反转录的cDNA为模板,设置温度梯度测定退火温度。然后进行qRT-PCR,总体系为 20 μL ,每个样品设3个重复。扩增条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环次数40次。所得相关数据用2-ΔΔCt方法进行计算,每个基因相对表达量均以内参基因为基准进行校正。所有数据用SPSS 22.0软件进行显著性分析。
1.2.3 视神经、PHPT轴中Kisspeptin、GPR54 蛋白检测 液氮中充分研磨组织,加RIPA裂解液(北京,索莱宝)和蛋白酶抑制剂(北京,索莱宝),反复冻融使其充分裂解,振荡离心,取上清,提取组织总蛋白。PCR仪(上海,普迪)进行蛋白变性(98 ℃,10 min),保存于-20 ℃备用。制备12%分离胶和5%浓缩胶后,以8 μL上样量进行SDS-PAGE电泳,电泳完毕对照Marker预染条带,裁剪对应条带:Kisspeptin(16 ku)、GPR54(44 ku)、β-actin(42 ku),湿转法转膜至0.45 μm的PVDF膜(北京,索莱宝)上,PBST(PBS+Tween 20)(北京,索莱宝)洗膜10 min后5%脱脂奶粉室温封闭1 h。孵育一抗Kisspeptin、GPR54(1∶ 1 000),β-actin(1∶4 500),4 ℃过夜。PBST洗膜2 h,37 ℃二抗孵育(1∶4 500)1 h,PBST洗膜2 h,暗室曝光显影。Image J图像分析系统进行灰度值分析,SPSS 22.0软件进行差异性分析。
1.2.4 视神经、PHPT轴Kisspeptin、GPR54免疫组织化学染色 将提前用4%多聚甲醛固定好的组织进行石蜡包埋、切片、脱蜡处理后,H2O2封闭内源性过氧化物酶,用SP免疫组化检测试剂盒(北京,博奥森)进行试验。Kisspeptin和GPR54抗体(北京,博奥森)以1∶350稀释,用磷酸缓冲盐溶液(PBS) 代替一抗作阴性对照,4 ℃ 孵育过夜,然后与二抗(北京,博奥森)37 ℃反应15 min,二氨基联苯胺(DAB)(北京,博奥森)显色,脱水透明后中性树胶封片。利用正置光学显微镜BX51-DP71(日本,麦克奥迪)观察并拍照,Kisspeptin和 GPR54 阳性部位呈现棕色。
2 结果与分析
2.1 甘加藏羊血浆Kisspeptin含量动态变化
由图1可知,甘加藏羊血浆Kisspeptin在整个发情周期呈波动式和脉冲式交替分泌,乏情期整体激素水平低于发情周期;Kisspeptin在发情开始第12 小时达到第一个峰值(172.53±1.91)pg/mL,发情后期开始激素水平急剧上升,在第36,39小时达到第2和第3个峰值;发情周期内,Kisspeptin在发情后期的平均激素水平最高(122.13±2.18)pg/mL,间情期最低(114.38±25.31)pg/mL;乏情期激素水平大幅下降,平均含量仅达到(92.71±16.10)pg/mL。

A.发情期(0~36 h)和发情后期(39~72 h);B.间情期(4 dM~13 dN)、发情前期(14 dM~16 dN)和乏情期(F);N.晚;M.早。A.Estrus(0—36 h)and metestrus(39—72 h);B.Diestrus(4 dM—13 dN),proestrus(14 dM—16 dN)and anestrus(F) ;N.Night ;M.Morning.
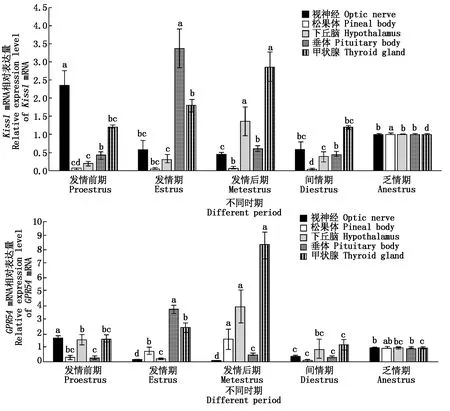
2.2 甘加藏羊视神经、PHPT轴中Kiss1 、GPR54 mRNA的表达分析
由图2可知,视神经Kiss1mRNA的相对表达量整体呈下降趋势,并在发情后期降到谷底。松果体Kiss1mRNA的相对表达量在发情后期最高,间情期最低,其余各时期基本无太大波动。下丘脑、甲状腺中的Kiss1mRNA在发情周期内逐步升高,均在发情后期达到顶峰,显著高于其他时期(P<0.05)。垂体Kiss1mRNA相对表达量在发情期就达到峰值。
同一组织不同时期间进行显著性分析,不同小写字母表示不同时期间差异显著(P<0.05)。图4同。Significance analysis was conducted in different periods of the same organization, and different lowercase letters indicated significant differences in different periods(P<0.05).The same asFig.4.
视神经GPR54mRNA相对表达量在发情前期最高,显著高于其他时期(P<0.05);垂体组织Kiss1、GPR54mRNA相对表达量在发情期显著高于其他时期(P<0.05);松果体、下丘脑和甲状腺三者GPR54mRNA表达模式相同,均在发情后期达到峰值,显著高于其余时期(P<0.05)。
2.3 甘加藏羊视神经、PHPT轴中Kisspeptin、GPR54 蛋白含量分析
由图3,4可知,视神经组织Kisspeptin蛋白含量在发情后期达到峰值;在乏情期,松果体Kisspeptin高于发情周期各时期,其中间情期显著高于发情期和发情后期(P<0.05);下丘脑Kisspeptin蛋白含量在乏情期最高,发情前期表达量显著高于其他3个时期(P<0.05);垂体Kisspeptin蛋白含量在间情期达到峰值,显著高于其他时期(P<0.05);甲状腺Kisspeptin蛋白含量在发情前期和发情期差异不显著(P<0.05),发情后期和间情期差异不显著(P<0.05),但均显著高于乏情期(P<0.05)。

A.视神经;B.松果体;C.下丘脑;D.垂体;E.甲状腺。A.Optic nerve;B.Pineal body;C.Hypothalamus;D.Pituitary body;E.Thyroid gland.

图4 甘加藏羊发情周期和乏情期视神经、PHPT轴组织中Kisspeptin、GPR54蛋白相对表达量Fig.4 Optic nerve and PHPT axis tissues in estrus cycle and anestrus of Ganjia Tibetan sheep relative expression levels of Kisspeptin and GPR54 proteins
视神经GPR54蛋白含量总体呈下降趋势,在整个发情期内变化不大,其中间情期降到谷底;松果体、下丘脑GPR54均在间情期蛋白含量最高,显著高于其他时期(P<0.05);垂体组织GPR54蛋白含量在发情前期最高,并随发情周期逐渐减少;甲状腺GPR54蛋白含量在发情前期最高,显著高于其余时期(P<0.05)。
2.4 甘加藏羊视神经、PHPT轴中Kisspeptin、GPR54免疫阳性产物分布表达
甘加藏羊发情周期视神经、松果体、下丘脑、垂体、甲状腺中均有Kisspeptin和GPR54蛋白表达。视神经中,Kisspeptin阳性着色主要在神经胶质细胞胞核中(图5-A),GPR54主要在神经胶质细胞胞质中(图5-B);松果体中,Kisspeptin和GPR54主要表达在松果体细胞胞质中(图5-C、D),呈棕黄色强阳性表达,胞核中也有少量表达;下丘脑组织中,Kisspeptin在促垂体区的神经内分泌小细胞和神经胶质细胞中呈强阳性表达(图5-E),GPR54主要在神经内分泌小细胞的胞质中表达(图5-F);垂体组织中,Kisspeptin和GPR54主要表达在嗜碱性细胞的胞质中(图5-G、H);甲状腺组织中,Kisspeptin和GPR54主要表达在甲状腺滤泡细胞胞质中(图5-I、J)。
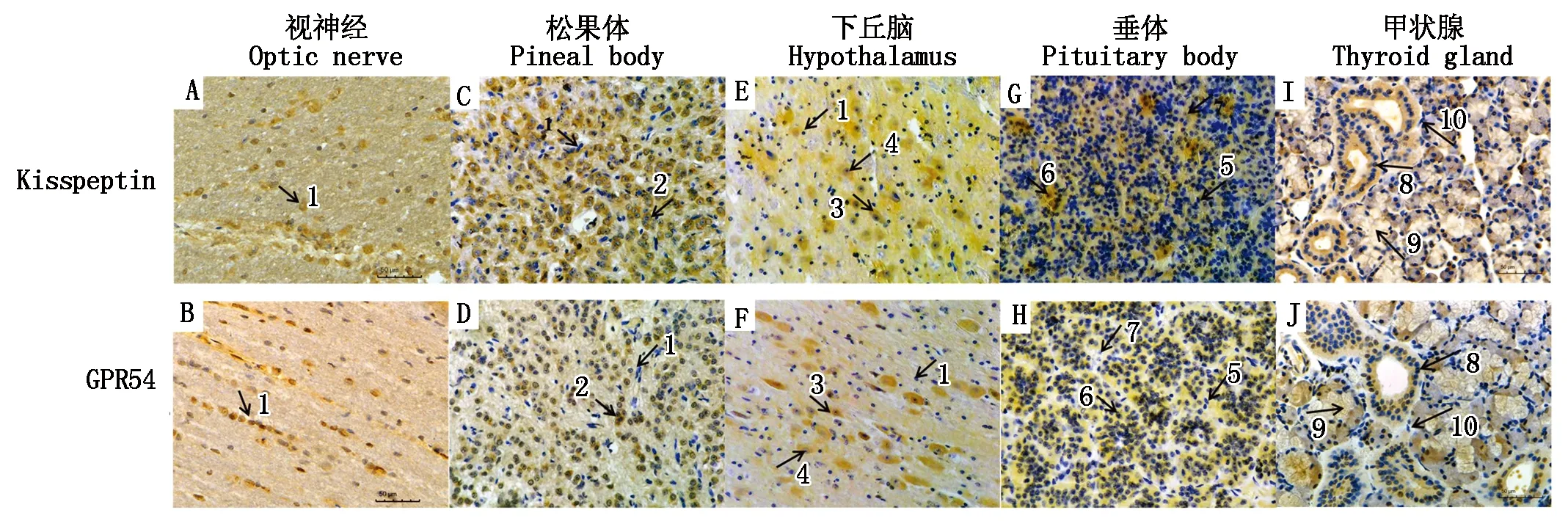
1.神经胶质细胞;2.松果体细胞;3.神经细胞;4.神经细胞核;5.嗜酸性细胞;6.嗜碱性细胞;7.嫌色细胞;8.滤泡上皮细胞;9.滤泡胶质;10.滤泡旁细胞。1.Glial cell;2.Pineal body cell;3.Neuron;4.Nerve nucleus;5.Eosinophilic cell;6.Basophilic cell ;7.Chromophobe;8.Follicular epithelial cell;9.Follicular glial cell;10.Parafollicular cell.
3 结论与讨论
3.1 甘加藏羊血浆Kisspeptin动态变化和发情周期的关系
动物的季节性发情不仅受到光照、温度和营养等因素的影响,基因调控也是非常重要的原因之一[4]。研究表明,Kiss1及其受体GPR54广泛参与到动物的季节性发情调控中。作为Kiss1基因的水解产物之一,Kisspeptin会在神经内分泌细胞末梢调控GnRH的分泌。有研究报道[11],Kisspeptin在母羊非繁殖季节的含量远低于繁殖季节,这与本研究结果相符。本研究结果显示,甘加藏羊发情周期各时期血浆Kisspeptin含量呈现脉冲式和波动式交替变化,出现多个波峰和波谷,且在发情周期内血浆Kisspeptin含量远高于乏情期含量,表明发情周期内高浓度的Kisspeptin是参与甘加藏羊季节繁殖生殖活动调控的因子之一。
研究发现,Kisspeptin与GnRH的分泌改变具有同步性,在与其神经元表面的GPR54结合后,可对后者形成正向反馈作用[16]。葛闻博等[17]在研究甘加藏羊发情周期GnRH分泌规律时发现,甘加藏羊血浆GnRH从发情前期开始升高,在发情后期达到峰值后开始下降,间情期最低。史军红等[18]认为,哺乳动物的发情周期内每个卵泡波的出现都伴随着1个促卵泡素(Follicle-stimulating hormone,FSH)和促黄体素(Luteinizing hormone,LH)分泌峰,而血浆GnRH会正向促进FSH和LH的分泌。Jayasena等[19]也证实了这一点。在本试验结果中,Kisspeptin分泌量在间情期最低,从发情前期开始,呈上升趋势,至发情后期达最高值,在第16 天达到一个明显峰值,后在发情期(第12 小时)、发情后期(第36,39 小时)、间情期(第4,6,9 天)也出现明显峰值。这与葛闻博等[17]关于GnRH的分泌趋势研究结果相一致,但二者出现峰值的时间点不同,后者存在一定时间延迟,表明Kisspeptin可能通过促进GnRH的分泌参与到甘加藏羊的季节性繁殖中。
3.2 甘加藏羊视神经、PHPT轴中Kiss1、GPR54 表达变化及其对繁殖的影响
Kiss1、GPR54作为繁殖相关调控基因在人、绵羊、大鼠、小鼠、母猪等[20-25]哺乳动物体内广泛表达,Tena-Sempere[26]在研究Kiss1/GPR54对人生殖系统的影响时发现,Kiss1、GPR54均会在人下丘脑中离散分布,且GPR54还在甲状腺、脑垂体中特异表达,其中脑垂体含量最高。Um等[27]在研究鱼类和哺乳动物Kiss1和GPR54基因的表达时发现,Kiss1主要分布在大鼠、小鼠、羊的下丘脑中,母猪的下丘脑、垂体、卵巢中也有Kiss1和GPR54mRNA的表达。本研究结果发现,甘加藏羊的视神经、松果体、下丘脑、垂体、甲状腺组织中均检测到Kiss1、GPR54mRNA及其蛋白的表达,且不同组织在不同时期有显著差异。陈卫刚[15]通过免疫组化试验发现甘加藏羊Kisspeptin、GPR54的阳性产物主要存在于下丘脑的促垂体区和垂体中的嗜碱性细胞中,这与本研究结果一致。本试验Kisspeptin主要表达在神经胶质细胞、松果体细胞胞质、下丘脑神经内分泌小细胞、垂体嗜碱性细胞胞质以及甲状腺滤泡细胞胞质中,GPR54主要表达在神经胶质细胞胞质、松果体细胞、下丘脑神经内分泌小细胞胞质以及甲状腺滤泡细胞胞质中。发情周期Kiss1、GPR54在不同组织的分布及差异性表达表明,Kiss1/GPR54系统可能参与调控甘加藏羊的季节性发情。
哺乳动物视网膜在接收到不同季节的光信号后经视神经传导,会刺激松果体发生节律性释放褪黑素,直接或间接影响Kiss1的表达,继而调控GnRH的表达[28]。本研究结果与之一致,当甘加藏羊处在发情周期内时,视神经Kiss1、GPR54mRNA相对表达量在发情前期就显著高于其他时期,这可能是短日照致使藏羊褪黑素分泌增多,Kiss1形成的正反馈调节。进入繁殖季节或发情期后下丘脑会大幅合成GnRH,并释放进入垂体门脉,被血液运送到腺垂体后使垂体细胞合成释放FSH和LH,FSH和LH在到达卵巢后加快了卵泡的发育、排卵,同时刺激类固醇激素的合成释放,进而引起动物发情症状逐渐明显[29]。王军等[30]在研究Kiss1、GPR54基因对绵羊的繁殖调控中发现,在发情状态下绵羊下丘脑ARC中Kiss1基因表达量明显上升;而在乏情期时,不管是正常绵羊还是切除了卵巢的绵羊,ARC内Kiss1mRNA表达水平都显著降低。结合本研究,甘加藏羊下丘脑Kiss1、GPR54mRNA相对表达量均在发情后期达到峰值,整个发情周期总体呈上升趋势,这也与金慧慧等[31]的结果相似,进一步证实了Kiss1/GPR54系统会通过干涉靶基因GnRH从而参与调控藏羊的季节性繁殖。但郭若婷[32]却指出,阿勒泰绵羊下丘脑Kiss1在发情期表达最高,与本研究结果不一致,这可能是品种、生长环境及气候不同所导致的。
褪黑素参与的光周期与类固醇激素的季节性反馈作用会共同调节Kiss1基因在不同繁殖季节的表达[33]。松果体、下丘脑、甲状腺组织中Kiss1、GPR54基因表达从发情前期开始呈现上升趋势,在发情后期达到最高,显著高于非繁殖季节。有研究发现,甲状腺中有合成褪黑素的2种关键酶[34],提示甲状腺可自主合成褪黑素。褪黑素会通过光周期的变化来介导甲状腺中Kiss1的表达,甲状腺中Kiss1/GPR54在不同时期内的表达变化表明,其可能作为重要的调控因子参与到季节性调控中,这种调控作用而后又会集中表现在调控下游GnRH的表达来影响藏羊季节性发情中。垂体组织中Kiss1mRNA在发情期达到峰值,并显著高于各个时期。Kisspeptin、GPR54蛋白含量与mRNA检测结果略有差异,可能是基因在转录和翻译水平存在时空间隔造成的。Kiss1/GPR54系统广泛参与到甘加藏羊的季节性繁殖调控中,但该系统影响藏羊繁殖的分子机制有待进一步研究。
本研究结果显示,甘加藏羊血浆Kisspeptin含量在发情周期内呈现动态变化规律,且Kisspeptin水平明显高于乏情期,表明Kisspeptin参与了藏羊的季节性发情调控。发情周期Kiss1、GPR54mRNA及其蛋白在视神经和PHPT轴中均有表达及分布,且其相对表达量随发情周期的变化存在一定的差异和动态变化规律,证实Kiss1/GPR54系统是调控藏羊季节性发情周期生理活动的主要调控因子。
