TLR4基因在绵羊不同生理状态下子宫内膜组织中的mRNA表达
2019-08-13孔维欢熊燊源代蓉
孔维欢 熊燊源 代蓉
摘要:为了研究Toll样受体4(Toll-like receptor 4,TLR4)在绵羊胚胎附植期和发情周期子宫内膜中mRNA的表达模式。采用半定量RT-PCR和实时荧光定量RT-PCR分别检测妊娠21 d母羊全身组织和妊娠9、13、17、21、25 d 的母羊子宫内膜组织TLR4基因的表达以及绵羊卵泡期与黄体期母羊子宫内膜组织TLR4基因的表达。结果表明,TLR4基因在肝脏、脾脏、卵巢、输卵管、子宫、小肠、膀胱、肌肉及松果体等组织出现表达,其中在输卵管、卵巢、子宫、膀胱、脾脏及松果体中表达量较高,在肝脏、小肠、肌肉中表达较弱,而在心脏、垂体、脂肪等组织中不表达。从妊娠9 d开始,绵羊胚胎TLR4基因表达量呈逐渐下降趋势;至胚胎附植点17 d,TLR4基因表达量最低,之后又呈现上升趋势,到25 d达到峰值。不管是在细毛羊还是在湖羊子宫内膜组织中检测,TLR4基因黄体期的表达水平均显著高于卵泡期(P<0.05)。说明TLR4的mRNA表达具有组织特异性,在胚胎附植期绵羊子宫内膜中呈现先低后高的趋势,以及其在绵羊发情周期中表达出现黄体期显著高于卵泡期现象,也初步说明了TLR4可能在胚胎附植早期和发情周期中均发挥一定作用。
关键词:TLR4基因;绵羊;胚胎附植期;发情周期;子宫内膜
中图分类号: S826.1 文献标志码: A 文章编号:1002-1302(2019)01-0035-05
Toll样受体(Toll-like receptor,TLR) 是一类典型的Ⅰ型模式识别受体(pattern recognition receptors,PRR)[1-3]。据调查,近些年来对动物繁殖相关的疾病(流产、子宫内膜炎、乳腺炎等)与天然免疫受体TLRs的关联性分析研究逐年增多。而其中TLR4受体基因是当前医学领域研究最为广泛的,随着国内经济的发展、人们生活水平的提高、人均寿命的增长,内分泌性疾病发病率的不断上升,子宫内膜样癌的发病呈现逐渐年轻化的趋势,子宫内膜样癌的发病与体内外多种因素有了密切的关联[4],其中长期受到雌激素刺激和缺乏孕激素拮抗作用就是子宫内膜发生癌变的主要外界因素。因而母-胎界面中的免疫调节机制也成了许多免疫学家一直的研究热点,并证实了TLR4在生殖免疫系统中发挥着重要的作用。比如,Romero等认为早产主要就是因为生殖道的感染进而引发了炎症所导致的[5]。母-胎界面作为妊娠时联系母体和胎儿的重要屏障保护组织,其上各类促炎症因子的表达情况被证明是与正常的妊娠和分娩相关的[6]。而哺乳动物妊娠建立的标识则是胚胎的附植,它是胚胎与母体复杂的多基因双向调控作用的结果。有研究表明,雌性动物生殖道内有大量表达TLR1-6等免疫受體,在2004年,Pioli等的相关研究中,TLR4受体基因在人类的输卵管、子宫内膜、子宫颈等生殖器中呈现出差异性表达[7]。2007年,Nishimura等在人类的卵巢、输卵管以及子宫中同样检测到了TLR1-10等受体基因的表达[8]。所以,推测TLR4与雌性动物生殖免疫的关联性可能表现为其在雌性动物不同生理阶段所发挥出的作用。
鉴于TLR4基因在绵羊胚胎附植期及发情周期对子宫和孕体分子调控模式的研究鲜有报道,本试验选择该受体作为绵羊不同生理阶段表达调控的目的基因,试图通过组织表达谱检测分析、半定量RT-PCR和实时荧光定量RT-PCR技术,探究其在胚胎附植期和发情周期的不同阶段子宫内膜中的差异表达,初步揭示TLR4受体在哺乳动物繁殖免疫调节过程中发挥的重要作用,也为了解该受体的免疫功能机制提供了一定的理论数据。
1 材料与方法
1.1 试验材料
试验动物:来自新疆农垦科学院畜牧研究所的试验种羊场。其中中国美利奴细毛羊30只、湖羊10只。选择的首要标准是3胎以内的成年羊,体质量为35~45 kg,个头适中、体型良好、膘情中上、哺乳性好,无生殖免疫系统等方面的疾病。其次是饲养环境及各品种绵羊个体之间等无明显差异。
试验药剂:孕酮海绵栓(澳大利亚 Intervet Pty.Ltd.,500 mg/支),孕马血清促性腺激素(PMSG)(浙江宁波第二激素厂,1 000 IU/支),Trizol 试剂(Invitrogen公司),琼脂糖(Biowest公司),三氯甲烷、异丙醇(北京化工厂),反转录试剂盒、ddH2O(北京全式金公司),dNTP、Taq 酶、10×Buffer、DNA Marker(TaKaRa公司),480 SYBR GreenⅠMaster(Roche公司)。
试验仪器:高速冷冻离心机、可调式微量移液枪、-80 ℃冰箱(Thermo公司),4 ℃冰箱、微波炉(美的公司),电热恒温水浴锅(上海精宏实验设备有限公司),制冰机(Grant公司),电子分析天平(美国丹佛公司),超净工作台(上海博讯公司),电泳仪、紫外分光光度计(Bio-Rad公司),UV凝胶成像系统(Uvitec Cambridge公司),PCR扩增仪(Heraeus 公司),圆周振荡器(IKA公司),高压灭菌锅(Sanyo公司),LightCycler 480实时荧光定量PCR系统(Roche公司)。
1.2 试验方案
首先随机把细毛羊分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ 5 组(每组3只),利用孕酮海绵栓与PMSG结合的方法将绵羊进行同期发情处理,发情母羊间隔12 h左右采用人工授精,重复2~3次。其次,再把细毛羊和湖羊2种绵羊各自随机分为 A、B 2组,3只/组,同样的方法经过同期发情处理。
人工授精后9、13、17、21、25 d,采集细毛羊妊娠母羊的子宫内膜组织以及细毛羊、湖羊卵泡期和黄体期的子宫内膜组织,迅速置于液氮保存备用;并对妊娠21 d 的3只细毛羊进行屠宰,采集其心脏、肝脏、脾脏、卵巢、输卵管、子宫、小肠、膀胱、松果体、垂体以及肌肉、脂肪等12 种组织,迅速置于液氮中保存备用。
1.3 试验设计
试验于2017年5—7月在新疆农垦科学院新疆兵团绵羊繁育生物技术重点实验室进行。
1.3.1 总RNA的提取和单链cDNA的转录合成 各组织样品均取100 mg,放入液氮中进行研磨处理,然后按照Trizol试剂说明书的步骤分别提取所需绵羊组织的总RNA。利用紫外分光光度计测定出RNA的D值(D260 nm/D280 nm)和浓度,用1%琼脂糖凝胶电泳检测总RNA的完整性。所提总RNA的D值在1.8~2.0之间,且没有蛋白和基因组污染,符合试验要求。单链cDNA的转录合成按照TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒说明书结合试验所需进行适当调整。
1.3.2 引物设计及合成 根据GenBank中绵羊TLR4基因mRNA序列(XM_012111214.1),应用软件Primer 5.0进行引物设计(表1),引物跨内含子并处在基因的高保守区域,由生工生物工程(上海)股份有限公司合成。
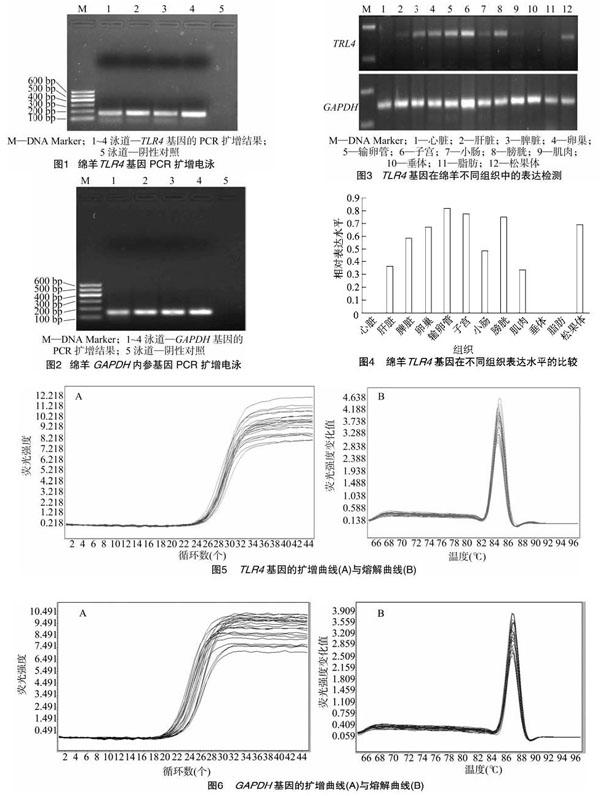
1.3.3 TLR4基因克隆 以反转录合成的单链cDNA为模板进行PCR扩增。反应总体积为25 μL,反应体系:10× buffer 2.5 μL,dNTP 2.0 μL,TLR4上下游引物F/R各 0.5 μL,Taq酶0.5 μL,ddH2O 16.0 μL,cDNA模板3.0 μL。PCR 反应优化条件:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,共35个循环;最后72 ℃延伸7 min。得到的PCR产物经1.5%琼脂糖凝胶电泳检测,DNA测序由英潍捷基(上海)贸易有限公司完成,经鉴定所得序列正确。
1.3.4 组织表达谱分析 按照上述方法分别提取妊娠 21 d 母羊心脏、肝脏、脾脏、卵巢、输卵管、子宫、小肠、膀胱、松果体、垂体、肌肉、脂肪等12种组织的总RNA,并反转录合成cDNA单链。再根据所设计的TLR4上下游引物F/R对其单链进行PCR扩增。以绵羊GAPDH基因作为内参基因,根据该持家基因指数扩增期PCR产物的灰度调整各组织初始模板的浓度,并与TLR4目的基因指数扩增期PCR产物的灰度进行比值,进而利用半定量法分析出TLR4基因在所选的12种组织中的相对表达水平。
1.3.5 实时荧光定量RT-PCR检测 采集2种不同生理状态下的细毛羊和湖羊的各个不同时期不同阶段的子宫内膜组织,分别提取它们的总RNA,同样反转录合成 cDNA单链,然后进行实时荧光定量PCR检测。根据所设计的TLR4上下游引物F/R进行PCR扩增,同样以绵羊GAPDH基因作为内参基因,进行同樣条件下的定量扩增和检测。反应体系 20.0 μL,包括2×SYBR premix EX Taq TM 10.0 μL,上下游引物F/R各0.4 μL,ddH2O 7.2μL,模板cDNA 2.0 μL。PCR反应扩增程序:94 ℃预变性30 s;94 ℃变性5 s,60 ℃ 复性 15 s,72 ℃延伸20 s,共45 个循环。扩增完成后,进行熔解曲线的分析,并判断扩增过程及产物的特异性。每个检测样品设置3个重复,定量分析结果由LightCyeler 480分析软件自动分析。
1.4 统计分析
通过实时荧光定量PCR获得目的基因和持家基因的CT值,采用2-ΔΔCT法计算TLR4基因的相对表达量。利用SPSS 21.0软件进行单因素方差分析,结果以柱状图显示各时期不同阶段的基因差异表达。
2 结果与分析
2.1 绵羊TLR4基因的克隆
利用GenBank中绵羊TLR4基因mRNA序列(XM_012111214.1),以绵羊子宫内膜组织cDNA 第一链为模板,经扩增和测序,获得一条长度为165 bp的目的片段(图1)及长度为149 bp的GAPDH内参基因片段(图2)。PCR产物送测序公司测序,是所设计的目的基因片段。
2.2 绵羊TLR4基因的组织表达谱分析
运用半定量RT-PCR检测方法,以绵羊GAPDH作为内参基因,检测了TLR4目的基因在妊娠21 d母羊不同组织中的差异表达情况。由图3、图4可知,TLR4基因在输卵管、卵巢、子宫、膀胱、脾脏及松果体中出现高表达,在肝脏、小肠、肌肉中出现低表达,而在心脏、垂体、脂肪等组织中不表达。
2.3 绵羊TLR4目的基因和GAPDH内参基因扩增曲线和熔解曲线分析
由图5、图6可知,实时荧光定量RT-PCR扩增曲线显示,扩增产物的“S”形曲线都很清晰,检测到的荧光信号峰值较高,TLR4目的基因和GAPDH内参基因的指数扩增期和平台期也很明显,线性范围也很广。TLR4基因从22~34个循环可检测出,GAPDH从19~31个循环可检测出,表现出较为完整的扩增曲线。熔解曲线分析表明,熔解曲线呈现单峰,说明扩增产物单一,其荧光强度均来源于特异性的扩增产物,而没有产生非特异性扩增和引物二聚体,说明扩增产物特异性良好,结果具有很好的代表性。
2.4 绵羊TLR4基因在不同品种绵羊卵泡期和黄体期母羊子宫内膜的表达分析
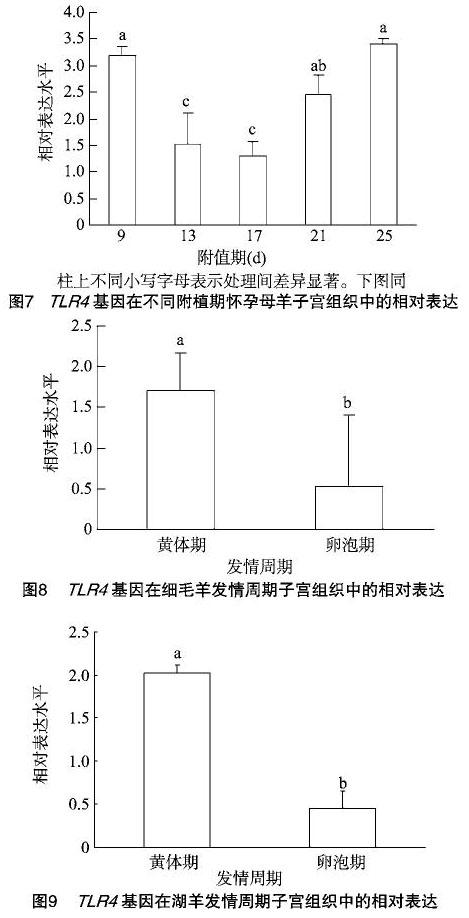
本试验旨在研究TLR4基因在绵羊胚胎附植期和发情周期子宫内膜中mRNA表达情况,采用了实时荧光定量 RT-PCR 方法,以绵羊GAPDH作为内参基因对胚胎附植期和发情周期各不同阶段的子宫内膜TLR4基因表达水平进行了跟踪检测。由图7可知,TLR4基因在附植期不同阶段怀孕母羊子宫内膜组织中,17 d表达水平最低,25 d表达水平最高;9~25 d TLR4基因表达呈现出先降低后升高的趋势,胚胎附植期不同阶段的表达水平差异显著(P<0.05)。
由图8、图9可知,无论是细毛羊还是湖羊,TLR4基因在其子宫组织中的表达水平均是黄体期>卵泡期,且差异显著(P<0.05),但不同品种绵羊之间的表达差异并不明显。
3 讨论
关于人和小鼠的TLR4的研究报道比较多,表明了其在免疫、疾病和感染等方面发挥着重要的作用[9-11],但在有关绵羊繁殖方面的研究较少,而且对TLR4免疫分子机制研究也相对较少。
本试验首次采用半定量RT-PCR方法对妊娠21 d母羊全身组织进行表达谱分析研究,结果显示TLR4基因在输卵管、卵巢、子宫、膀胱、脾脏及松果体等与繁殖和免疫相关的组织器官中呈现高表达,在肝脏、小肠、肌肉中呈现低表达,而在心脏、垂体、脂肪等组织中不表达。2011年聶奎等在文献报道中称在兔的胸腺、骨髓、淋巴结、脾脏等组织中均检测到TLR4 mRNA的表达[12]。周作勇等研究发现,TLR4 mRNA在雏鸡胸腺、肠道、肌肉和脾脏中的转录水平没有显著性的差异[13]。而2006年Higgs等在文章中报道,TLR4主要在鸡的骨髓中表达,而在脾脏、肝脏、小肠、法氏囊和盲肠等组织中表达水平低或者不表达[14]。同样,Alvarez等在猪的组织器官中研究发现,TLR4 mRNA在其胸腺和淋巴结中表达量较高,在其他组织中表达量较低[15]。Nishimura等针对胎儿和成人的组织以及细胞样品进行了采集研究,结果表明TLR4 mRNA在脾脏表达量最高[16]。综上结果,不仅说明了TLR4 mRNA表达具有组织特异性,而且在繁殖和免疫器官中TLR4的高表达也暗示了该受体可能与繁殖及免疫机制存在某种关联。
胚胎和子宫内膜在时空上互相辨认、容受并产生黏附性关联,是哺乳动物胚胎附植成功与否的重要环节,在此过程当中涉及到了相互之间的复杂分子调控进程。在反刍动物的胚胎附植过程当中,囊胚在附植期会出现显著性的形态学转变。通常情况下,绵羊囊胚在配种发育8 d后从透明带中孵出,呈直径约200 μm球形,11 d起由球形变成管形;发育14 d时变成纤丝状,到17 d时达到25 cm以上[17]。同时,囊胚的伸长也是附植开始的显著性标志,滋养层细胞的快速伸长对维持妊娠非常重要,它可以使孕体尽快与子宫内膜产生黏附且抑制前列腺素的分泌。绵羊妊娠14 d胚胎滋养层绒毛与子宫内膜上皮细胞开始接触,并在妊娠16~18 d产生黏附,绒毛不停伸长而呈现出血管,妊娠30 d时与子宫阜的组织构成“母包子型”胎盘[18]。
本试验针对细毛羊胚胎附植期5 个不同阶段的母羊子宫内膜进行了荧光定量RT-PCR检测,结果发现妊娠9~17 d母羊子宫内膜TLR4基因的表达水平逐渐下降,且在17 d胚胎附植点的表达量最低。在此过程中,雌激素的致敏和孕激素的生理作用是子宫产生生理变化的主要因素。孕激素促进子宫内膜腺体的分泌;雌激素除促使子宫内膜增生外,还促进了子宫释放蛋白水解酶,继而促使透明带溶解和滋养层细胞增生,滋养层渐渐浸入子宫上皮和基质层,进而引起胚胎的附植。TLR4信号通路中的重要调节因子NF-κB被证实可调节妊娠相关组织中促炎症因子(IL-1β、TNF-α等)以及前列腺素的产量,继而通过IL-1β来促进子宫颈的成熟与扩张,通过前列腺素、E2来刺激分娩[19]。所以,TLR4受体mRNA表达在附植点17 d降低之后,至25 d mRNA的表达量又逐渐升高,且表现出显著性差异。
在动物发情周期中,随着动物生殖器官(如卵巢和子宫内膜)的生理变化以及损伤再修复过程,TLR4的表达量会有显著变化[20]。因为性激素不仅可以调节子宫内膜的结构和组织形态,而且还可以调节免疫细胞在子宫内膜的汇集和分布。例如,人类子宫中发现大量的NK细胞,并且随着发情周期变化NK细胞以不断增加的趋势分布于子宫内膜[21-22]。已证实在发情周期TLR2、TLR3、TLR4、TLR5、TLR6、TLR9和TLR10基因在子宫内膜中的表达变化[23]。雌激素水平在生殖期相对于分泌期较高,同时孕酮水平在分泌期相对于生殖期要高。这表明,在雌性哺乳动物生殖系统特别是在子宫内膜中,雌激素对TLRs的表达起抑制作用,而孕酮对TLRs表达起促进作用,Jorgenson等发现了TLR3在子宫内膜组织中的表达有周期依赖性[24]。
本试验对细毛羊和湖羊的卵泡期和黄体期研究发现,TLR4基因在其子宫内膜组织中的表达水平均出现黄体期>卵泡期。这与Jorgenson等的研究结果[24]一致。在卵泡期雌激素水平逐渐升高至最大,促进子宫内膜增厚,子宫颈上皮生长、增高呈高柱状,增强深层腺体分泌活动,黏液分泌量也逐渐增多,子宫肌收缩活动也逐渐增强,卵泡逐渐发育增大。而在黄体期,大量的孕激素分泌,作用于子宫,内膜血管增生,子宫变粗,腺体分泌活动性加强,子宫肌收缩受到抑制。所以,这一研究结果也得到了理论知识的支撑。
综上试验,本研究得出TLR4基因在输卵管、卵巢、子宫、膀胱、脾脏及松果体等免疫组织器官中呈现出高表达水平,说明了该受体基因在组织中的表达特异性。其mRNA在绵羊不同生理状态下子宫内膜组织中的表达呈现动态时空特征,初步揭示TLR4受体在哺乳动物繁殖免疫调节过程中发挥着重要作用。
参考文献:
[1]Palm E,Demirel I,Bengtsson T,et al. The role of toll-like and protease-activated receptors in the expression of cytokines by gingival fibroblasts stimulated with the periodontal pathogen Porphyromonas gingivalis[J]. Cytokine,2015,76(2):424-432.
[2]Johnston D G,Corr S C. Toll-Like receptor signalling and the control of intestinal barrier function[J]. Methods in Molecular Biology,2016,1390:287-300.
[3]Liew F Y,Xu D,Brint E K,et al. Negative regulation of toll-like receptor-mediated immune responses[J]. Nature Reviews Immunology,2005,5(6):446-458.
[4]王玉华. 子宫内膜癌发病相关因素及治疗进展[J]. 医学理论与实践,2013,26(5):593-594,596.
[5]Romero R,Espinoza J,Gonalves L F,et al. Inflammation in preterm and term labour and delivery[J]. Seminars in Fetal & Neonatal Medicine,2006,11(5):317-326.
[6]Croy B A,Chantakru S,Esadeg S,et al. Decidual natural killer cells:key regulators of placental development (a review)[J]. Journal of Reproductive Immunology,2002,57(1/2):151-168.
[7]Pioli P A,Amiel E,Schaefer T M,et al. Differential expression of toll-like receptors (TLR)-2 and (TLR)-4 in tissues of the human female reproductive tract[J]. Infection and Immunity,2004,72(10):5799-5806.
[8]Nishimura M,Naito S. Tissue-specific mRNA expression profiles of human toll-like receptors and related genes[J]. Biological & Pharmaceutical Bulletin,2005,28(5):886-892.
[9]Zacharowski K,Zacharowski P A,Koch A,et al. Toll-like receptor 4 plays a crucial role in the immune-adrenal response to systemic inflammatory response syndrome[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(16):6392-6397.
[10]Takeda K,Akira S. Toll-like receptors in innate immunity[J]. International Immunology,2005,17:1-14.
[11]Pan H,Wu X. Hypoxia attenuates inflammatory mediators production induced by Acanthamoeba via Toll-like receptor 4 signaling in human corneal epithelial cells[J]. Biochemical and Biophysical Research Communications,2012,420(3):685-691.
[12]聶 奎,曾兴艳,王裕文,等. 兔TLR2、TLR4部分cDNA 克隆及其在组织中的分布[J]. 中国兽医杂志,2011,47(3):12-14.
[13]周作勇,聂 奎,宋振辉,等. 雏鸡不同组织TLR1、TLR2、TLR4、TLR5和TLR15 mRNA转录水平相对定量研究[J]. 畜牧兽医学报,2010,41(11):1453-1459.
[14]Higgs R,Cormican P,Cahalane S,et al. Induction of a novel chicken Toll-like receptor follwing Salmonella enterica serovar typhimurium infection[J]. Infection and Immunity,2006,74:1692-1698.
[15]Alvarez B,Revilla C,Chamorro S,et al. Molecular cloning,characterization and tissue expression of porcine Toll-like receptor 4[J]. Developmental and Comparative Immunology,2006,30(4):345-355.
[16]Nishimura M,Naito S. Tissue-specific mRNA expression profiles of human toll-like receptors and related genes[J]. Biological & Pharmaceutical Bulletin,2005,28(5):886-892.
[17]Spencer T E,Johnson G A,Bazer F W,et al. Implantation mechanisms:insights from the sheep[J]. Reproduction,2004,128(6):657-668.
[18]熊燊源,万鹏程,石文艳,等. 绵羊胚胎附植分子调控研究进展[J]. 生命科学,2012,24(10):1105-1113.
[19]Kannaki T R S M,Verma P. C. Toll-like receptors and their role in animal reproduction[J]. Animal Reproduction Science,2011,125(1/2/3/4):1-12.
[20]Zhang Z,Schluesener H J. Mammalian toll-like receptors:from endogenous ligands to tissue regeneration[J]. Cellular and Molecular Life Sciences,2006,63(24):2901-2907.
[21]Givan A L,White H D,Stern J E,et al. Flow cytometric analysis of leukocytes in the human female reproductive tract:comparison of fallopian tube,uterus,cervix,and vagina[J]. American Journal of Reproductive Immunology,1997,38(5):350-359.
[22]Hunt J S. Immunologically relevant cells in the uterus[J]. Biology of Reproduction,1994,50(3):461-466.
[23]Aflatoonian R,Tuckerman E,Elliott S L,et al. Menstrual cycle-dependent changes of toll-like receptors in endometrium[J]. Human Reproduction,2007,22(2):586-593.
[24]Jorgenson R L,Young S L,Lange M J,et al. Human endometrial epithelial cells cyclically express toll-like receptor 3 and exhibit TLR3-dependent responses to dsRNA[J]. Human Immunology,2005,66(5):469-482. 程鴻燕,郭 昱,马芳芳,等. 谷子NCED基因家族鉴定及其干旱胁迫响应表达模式分析[J]. 江苏农业科学,2019,47(1):40-44.
