双黄连冻干粉成分分析及其与头孢拉定合用对人肝细胞功能的影响
2022-11-02徐大志温如燕李相玲余浚龙
徐大志,温如燕,李相玲*,余浚龙*
(1.大庆市人民医院,黑龙江 大庆 163316;2.广西中医药大学,广西 南宁 530200)
双黄连具有清热解毒功效,临床上常用来与其他药物合用。 如双黄连口服液联合雷尼替丁治疗口腔溃疡,其临床疗效和安全性优于单独使用雷尼替丁,且疗效持久、复发率低[1]。 临床上,双黄连冻干粉联合头孢替安治疗儿童上呼吸道感染的效果亦优于头孢替安单独使用[2]。 双黄连注射剂是中医医院治疗上呼吸道感染性疾病的首选药之一,其疗效已被肯定[3]。然而,2016 年国家食品药品监督管理总局通报的中药不良反应报告中,中药注射剂占比53.7%[4],不良反应发生比例较高[5]。 肝脏是药物代谢的主要器官,谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)是常用的肝功能检测指标[6]。 二磷酸腺苷(adenosine diphosphate, ADP)和三磷酸腺苷(adenosine triphosphate,ATP)的含量检测可以反映细胞的生长状态,同时也能部分地反映组织细胞内能量代谢状态和药物的作用[7]。环氧化酶(cyclooxygenase, COX)是花生四烯酸合成前列腺素(prostagalnadina, PGs)过程中一个重要的限速酶。 在肝癌组织中COX-2 呈高表达,可以促进肿瘤细胞增殖及肿瘤转移,抵抗细胞凋亡,参与血管形成,在包括肝癌的多种肿瘤发生中起重要作用[8]。 血红素加氧酶-1(heme oxygenase-1, HO-1)是一种诱导酶,以其抗炎、抗氧化和神经保护作用而闻名[9]。 HO-1 也是肝脏应急后诱生型一氧化氮合酶(inducible nitric oxide synthase, iNOS)介导保护的另一种有效介体[10]。由此推测,双黄连冻干粉与头孢类抗生素合用对肝脏有影响。前期研究认为,高浓度的双黄连注射液对体外培养的肝细胞有一定损伤,且与头孢拉定联合应用可增加肝细胞毒性[11]。为了进一步探讨双黄连注射液的不良反应,以及与头孢类抗生素联合用药之后对肝脏的影响,本研究选择双黄连冻干粉中各成分与头孢拉定合用,检测人肝细胞(HL-7702)中ALT、AST、ADP、ATP、COX-2 及HO-1 的表达量,进一步研究双黄连冻干粉单独或者与头孢拉定合用对肝细胞的影响,为临床上双黄连注射液的应用以及与其他抗生素合用提供理论支持。
1 材料
1.1 主要仪器
高效液相色谱仪(high performance liquid chromatography, HPLC)(型号:Dionex Summit, 美国Dionex 公司);分析天平(型号:AUM220D,日本Shimadzu 公司);低速大容量离心机(型号:LXJ-IIB,上海安亭科学仪器厂);高速低温离心机(型号:5810 型,美国Eppendorf centrifuge 公司);细胞培养箱(型号:MCO175,日本SANYO 公司);倒置显微镜(型号:IMT-2,日本奥林巴斯公司);PCR 仪(型号:PCR System2400,美国PerkinElmer 公司);凝胶成像仪(型号:GDS7600,英国Ultra-violet products公司)。
1.2 试药
绿原酸对照品(批号:110753-200413,纯度>97%)、连翘苷对照品(批号:110821-200711,纯度>98%)、黄芩苷对照品(批号:110715-201016,纯度为99%)、汉黄芩素对照品(批号:110821-200711,纯度>98%)均购自中国药品生物制品检定所;双黄连冻干粉(哈药集团有限公司,批号:1005006);ADP 对照品(美国Sigma 公司,批号:75431-54-8,纯度≥98%);ATP 对照品(美国Amersco 公司,批号:Amersco-220,纯度≥98%)。
1.3 细胞株来源
HL-7702 细胞(批号:BFN608006124),来自中国科学院上海细胞生物学研究所。
2 方法
2.1 HPLC 检测双黄连冻干粉含量[12]
根据文献中HPLC 条件[13],应用HPLC 波长转换法同时检测双黄连冻干粉中绿原酸、连翘苷、黄芩苷及汉黄芩素4 种成分的含量。
2.2 分组与给药
取对数生长期的HL-7702 细胞,胰酶消化后用新鲜培养基制成细胞悬液,按5×104cells/mL 接种于6 孔板中,每孔3 mL,实验分为对照组(只加细胞液)、头孢拉定组、DMSO 组、双黄连组、绿原酸组、连翘苷组、黄芩苷组、汉黄芩素组、绿原酸+头孢拉定组(0.046 mg/mL)、连翘苷+头孢拉定组(0.046 mg/mL)、黄芩苷+头孢拉定组(0.046 mg/mL)以及汉黄芩素+头孢拉定组(0.046 mg/mL)。 静置培养48 h 后,对照组加入空白溶剂RPMI 1640,头孢拉定组加入头孢拉定0.046 mg/mL,DMSO 组加入0.2%的DMSO。其余分为高剂量组和低剂量组,其中低剂量组中各组分浓度相当于双黄连组浓度为0.5 mg/mL,高剂量组中各组分浓度相当于2 mg/mL 的双黄连冻干粉培养液,具体为:绿原酸组低剂量浓度为0.009 84 μg/μL、高剂量浓度为0.039 34 μg/μL,连翘苷组低浓度为0.001 388 μg/μL、高浓度为0.005 549 μg/μL,黄芩苷组低剂量浓度为0.129 5 μg/μL、高剂量浓度为0.517 7 μg/μL, 汉黄芩素组低剂量浓度为0.000 223 μg/μL、高剂量浓度为0.000 89 μg/μL。其余各组为绿原酸+头孢拉定组(0.046 mg/mL)、连翘苷+头孢拉定组(0.046 mg/mL)、黄芩苷+头孢拉定组(0.046 mg/mL)、汉黄芩素+头孢拉定组(0.046 mg/mL)。 每个剂量组重复6 孔,培养箱中培养后进行观察、处理和取样。
2.3 培养液中ALT、AST 的含量测定
将细胞每孔3 mL 接种于6 孔板,按照“2.2”项下方法给药细胞,培养箱培养24 h,收集细胞悬液,离心(800 r/min,5 min,半径8.9 cm),吸取上清液,试剂盒检测ALT、AST 的含量。
2.4 肝细胞中的ATP、ADP 的含量测定
将细胞接种于6 孔板,每孔3 mL,按照“2.2”项下方法给药细胞,培养箱孵育48 h 后收集细胞悬液,用无菌PBS 洗3 次,0.5 mL 胰蛋白酶消化,离心(800 r/min,5 min,半径8.9 cm),弃上清液,向离心管中加入100 ℃的磷酸缓冲盐(50 mmol/L)1 mL,摇匀,沸水浴中放置10 min,在冰浴中冷却,离心(800 r/min,5 min,半径8.9 cm),取上清液,0.45 μm滤膜过滤,取滤液,流动相:甲醇-磷酸盐缓冲液溶液(pH 5.8),流速1.0 mL/min,柱温30 ℃,进样器温度4 ℃,检测波长260 nm,进样10 μL,HPLC 方法检测肝细胞中的ATP、ADP 的含量。
2.5 RT-PCR、琼脂糖凝胶电泳检测COX-2、HO-1的表达
取对数生长期的HL-7702 细胞悬液,以5×104个/孔接种于6 孔板,每孔3 mL。 培养48 h 待细胞贴壁后,对照组加入10%的胎牛血清的RPMI1640培养液;头孢拉定组加入含有0.046 mg/mL 的头孢拉定和含有10%胎牛血清的RPMI1640 培养液;其余各组加入不同浓度的双黄连冻干粉和不同浓度的双黄连粉针剂与0.046 mg/mL 头孢拉定的培养液,每组3 个复孔。 药物作用1 d 后,弃上清液,用无菌PBS 洗3 次,按照Total RNA 提取试剂盒的说明提取总RNA。 参照文献[14]设计引物(见表1),经BLAST 确认引物特性,由生工生物工程(上海)有限公司合成。
将各引物管瞬时离心,慢慢打开管盖,加入适量的无RNA 水稀释成10 mmol/L 的引物储备液,盖上管盖,充分混匀,瞬时离心于-20 ℃储存备用。 RTPCR 反转录,PCR 扩增。 其中,HO-1、β-actin PCR条件为94 ℃预变性2 min,94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸60 s,30 个循环后于72 ℃再延伸10 min。COX-2 的PCR 条件为95℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,30个循环,72 ℃最终延伸10 min。 RT-PCR 法检测HO-1、COX-2 基因的表达。 取上述PCR 产物每管5 μL,Marker 1 μL 充分混匀上样。 电泳电压100 V、60 min。 凝胶成像分析,以HO-1、COX-2 与β-actin的灰度之比判断mRNA 的相对表达水平。

表1 引物序列
2.6 统计学分析
各实验组数据使用SPSS 20.0 统计软件进行分析,各组数据以“±s”表示,两组样本均数间比较采用t 检验进行统计分析,多组之间比较用单因素方差分析,以P<0.05 为差异有统计学意义。
3 结果
3.1 双黄连冻干粉含量测定
HPLC 检测,按照各组分标准品的标准曲线计算双黄连冻干粉中各组分含量,从结果可知在双黄连冻干粉中,黄芩苷含量最高,其次为绿原酸、连翘苷,汉黄芩素含量最低。 详见表2。

表2 双黄连冻干粉主要成分含量(n=6,μg)
3.2 培养液中ALT、AST 的含量
与对照组相比,高剂量组中黄芩苷组、连翘苷组、汉黄芩素组人肝细胞(HL-7702)中ALT、AST 表达均下降(P<0.05,P<0.01);绿原酸+头孢拉定组(0.046 mg/mL)与连翘苷+头孢拉定组(0.046 mg/mL)中ALT 表达增加(P<0.05,P<0.01),AST 差异无统计学意义(P>0.05)。 详见表3。
表3 高剂量组各组分对HL-7702 细胞ALT、AST 的作用(n=6,±s,IU/L)
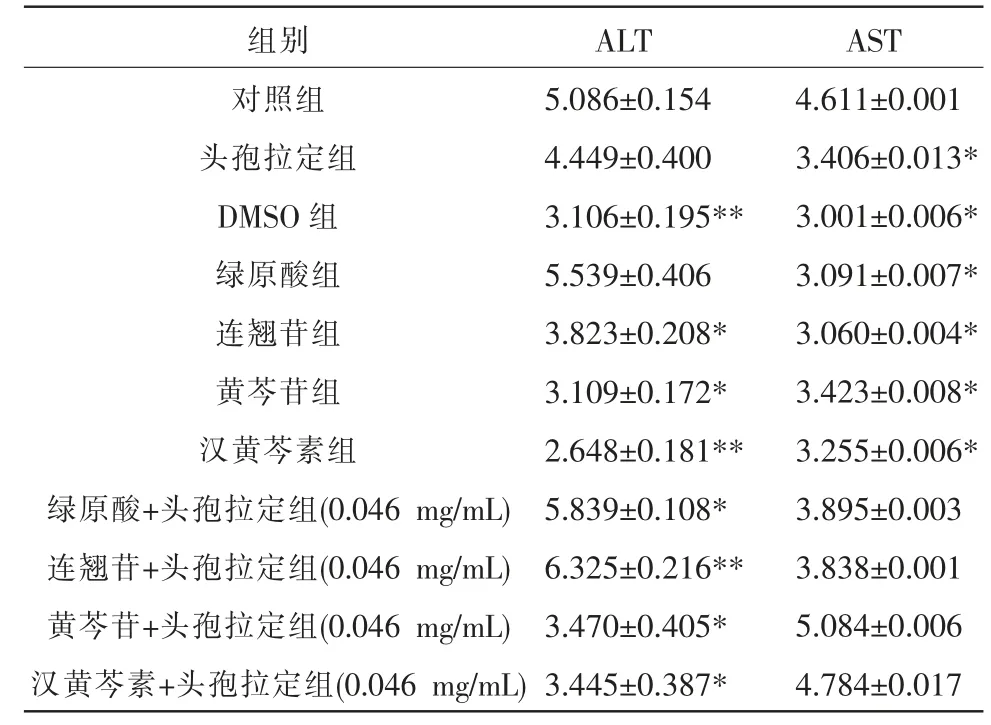
表3 高剂量组各组分对HL-7702 细胞ALT、AST 的作用(n=6,±s,IU/L)
注:与对照组比较,*P<0.05,**P<0.01。
组别对照组头孢拉定组DMSO 组绿原酸组连翘苷组黄芩苷组汉黄芩素组绿原酸+头孢拉定组(0.046 mg/mL)连翘苷+头孢拉定组(0.046 mg/mL)黄芩苷+头孢拉定组(0.046 mg/mL)汉黄芩素+头孢拉定组(0.046 mg/mL)ALT 5.086±0.154 4.449±0.400 3.106±0.195**5.539±0.406 3.823±0.208*3.109±0.172*2.648±0.181**5.839±0.108*6.325±0.216**3.470±0.405*3.445±0.387*AST 4.611±0.001 3.406±0.013*3.001±0.006*3.091±0.007*3.060±0.004*3.423±0.008*3.255±0.006*3.895±0.003 3.838±0.001 5.084±0.006 4.784±0.017
与对照组相比,低剂量组中黄芩苷组、连翘苷组、汉黄芩素组人肝细胞(HL-7702)中ALT 表达下降(P<0.05),AST 表达差异无统计学意义(P>0.05);汉黄芩素+头孢拉定组(0.046 mg/mL)与连翘苷+头孢拉定组(0.046 mg/mL)中ALT 表达增加(P<0.05),AST 差异无统计学意义(P>0.05)。 详见表4。
表4 低剂量组各组分对HL-7702 细胞ALT、AST 的作用(n=6,±s,IU/L)
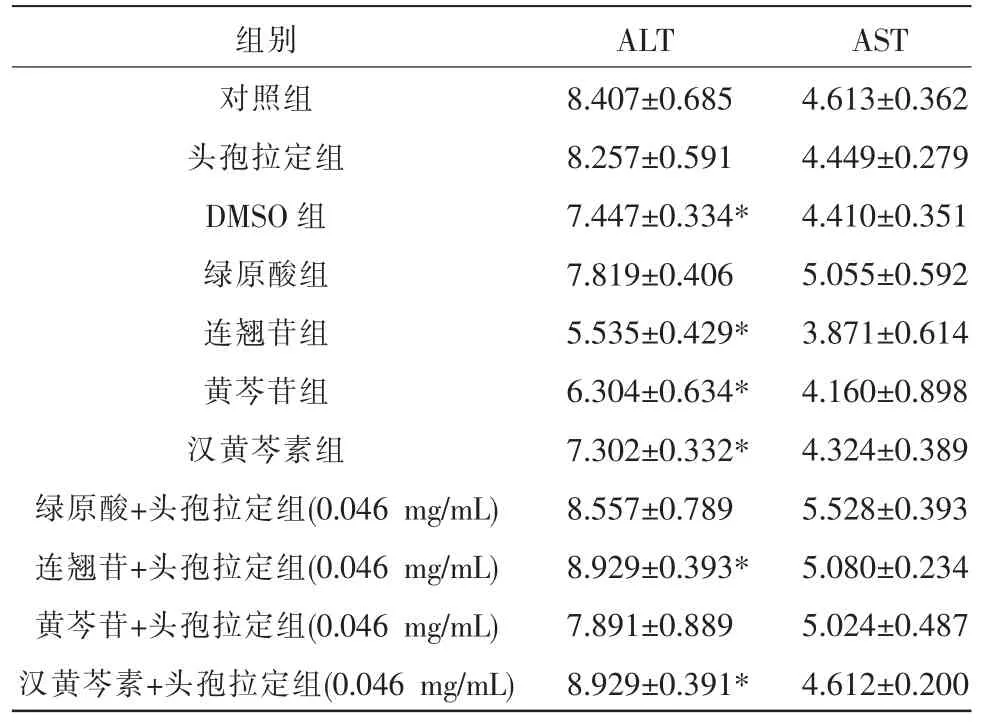
表4 低剂量组各组分对HL-7702 细胞ALT、AST 的作用(n=6,±s,IU/L)
注:与对照组比较,*P<0.05。
组别对照组头孢拉定组DMSO 组绿原酸组连翘苷组黄芩苷组汉黄芩素组绿原酸+头孢拉定组(0.046 mg/mL)连翘苷+头孢拉定组(0.046 mg/mL)黄芩苷+头孢拉定组(0.046 mg/mL)汉黄芩素+头孢拉定组(0.046 mg/mL)ALT 8.407±0.685 8.257±0.591 7.447±0.334*7.819±0.406 5.535±0.429*6.304±0.634*7.302±0.332*8.557±0.789 8.929±0.393*7.891±0.889 8.929±0.391*AST 4.613±0.362 4.449±0.279 4.410±0.351 5.055±0.592 3.871±0.614 4.160±0.898 4.324±0.389 5.528±0.393 5.080±0.234 5.024±0.487 4.612±0.200
3.3 肝细胞中ATP、ADP 的含量
与对照组比较,高剂量组中绿原酸组、绿原酸+头孢拉定组(0.046 mg/mL)以及连翘苷+头孢拉定组(0.046 mg/mL)中ATP 表达显著降低(P<0.05,P<0.01);各组对ADP 表达影响差异均无统计学意义(P>0.05)。详见表5。
与对照组比较,低剂量组中黄芩苷组ATP 与ADP表达明显增加(P<0.05),汉黄芩素组ATP 与ADP 表达明显降低(P<0.05,P<0.01);黄芩苷、汉黄芩素与头孢拉定合用后细胞中ATP、ADP 的含量显著降低(P<0.01)。 详见表6。
表5 高剂量组中各组分对HL-7702 细胞ATP、ADP 的作用(n=6,±s,μg)
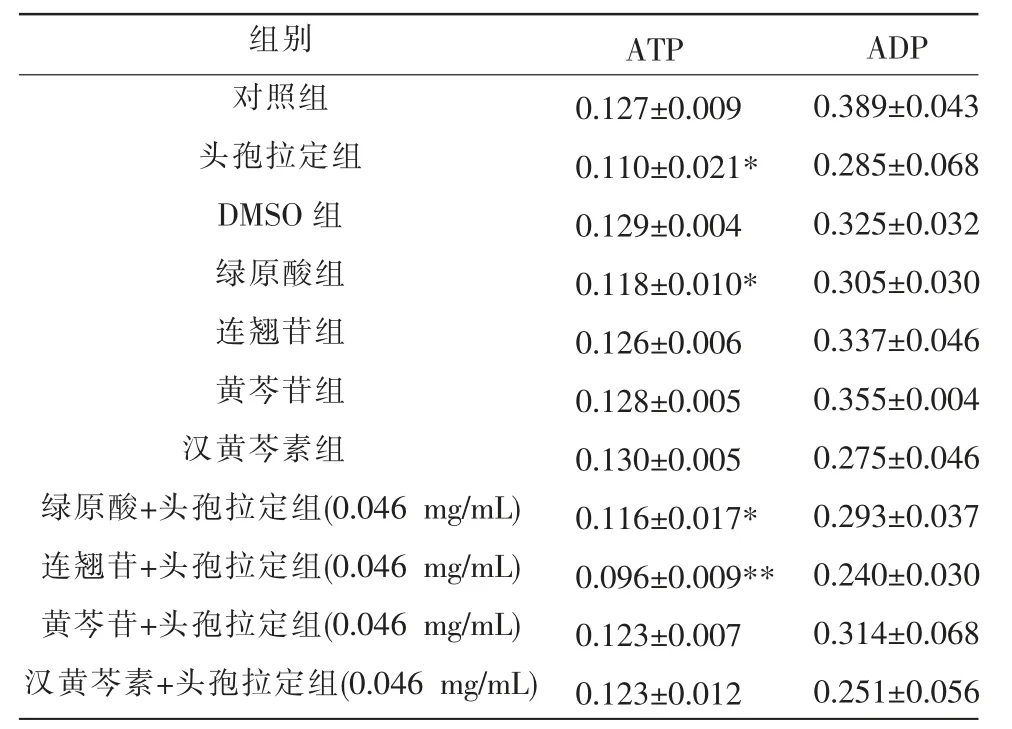
表5 高剂量组中各组分对HL-7702 细胞ATP、ADP 的作用(n=6,±s,μg)
注:与对照组比较,*P<0.05,**P<0.01。
组别对照组头孢拉定组DMSO 组绿原酸组连翘苷组黄芩苷组汉黄芩素组绿原酸+头孢拉定组(0.046 mg/mL)连翘苷+头孢拉定组(0.046 mg/mL)黄芩苷+头孢拉定组(0.046 mg/mL)汉黄芩素+头孢拉定组(0.046 mg/mL)ATP 0.127±0.009 0.110±0.021*0.129±0.004 0.118±0.010*0.126±0.006 0.128±0.005 0.130±0.005 0.116±0.017*0.096±0.009**0.123±0.007 0.123±0.012 ADP 0.389±0.043 0.285±0.068 0.325±0.032 0.305±0.030 0.337±0.046 0.355±0.004 0.275±0.046 0.293±0.037 0.240±0.030 0.314±0.068 0.251±0.056
表6 低剂量组各组分对HL-7702 细胞ATP、ADP 的作用(n=6,±s,μg)
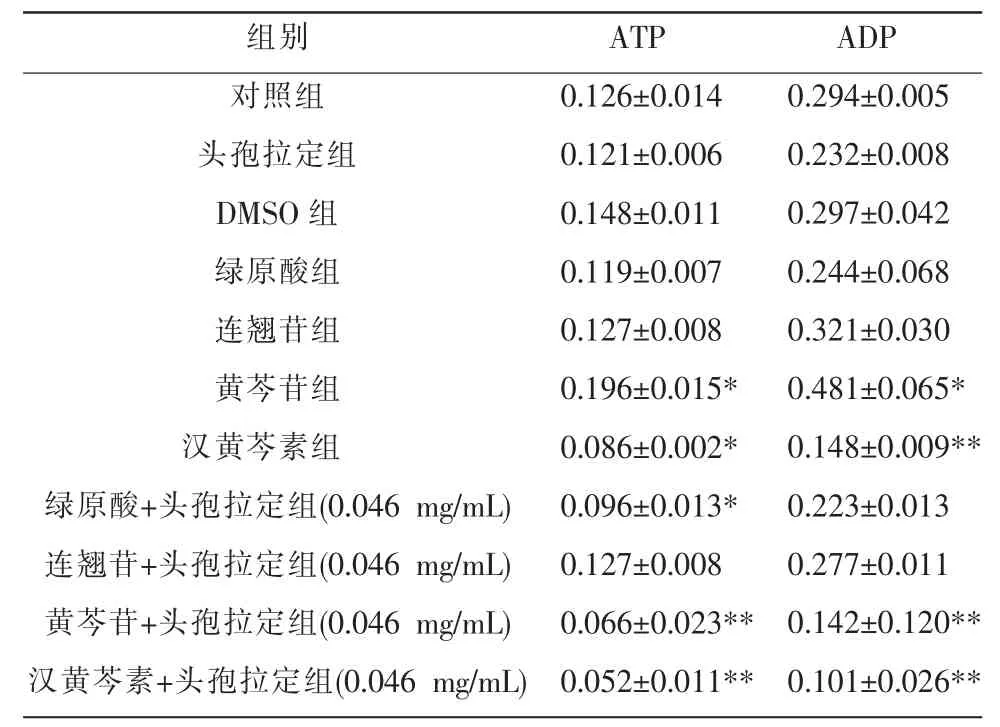
表6 低剂量组各组分对HL-7702 细胞ATP、ADP 的作用(n=6,±s,μg)
注:与对照组比较,*P<0.05,**P<0.01。
组别对照组头孢拉定组DMSO 组绿原酸组连翘苷组黄芩苷组汉黄芩素组绿原酸+头孢拉定组(0.046 mg/mL)连翘苷+头孢拉定组(0.046 mg/mL)黄芩苷+头孢拉定组(0.046 mg/mL)汉黄芩素+头孢拉定组(0.046 mg/mL)ATP 0.126±0.014 0.121±0.006 0.148±0.011 0.119±0.007 0.127±0.008 0.196±0.015*0.086±0.002*0.096±0.013*0.127±0.008 0.066±0.023**0.052±0.011**ADP 0.294±0.005 0.232±0.008 0.297±0.042 0.244±0.068 0.321±0.030 0.481±0.065*0.148±0.009**0.223±0.013 0.277±0.011 0.142±0.120**0.101±0.026**
3.4 HO-1、COX-2 琼脂糖电泳及相对表达量
与对照组比较, 头孢拉定组HO-1、COX-2 相对表达量增加,但差异无统计学意义(P>0.05);双黄连不同剂量组均能增加HO-1、COX-2 的表达,差异有统计学意义(P<0.05,P<0.01);双黄连各剂量组与头孢拉定0.046 mg/mL 合用组均能显著促进HO-1、COX-2 的表达,差异有统计学意义(P<0.05,P<0.01)。 详见图1-2。
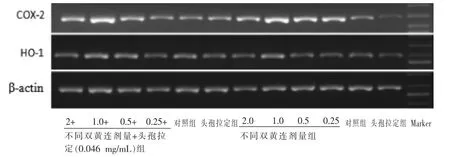
图1 不同浓度双黄连单独以及与头孢拉定合用对HL-7702 肝细胞HO-1、COX-2 的RT-PCR 产物电泳图(n=3,±s,mg/mL)
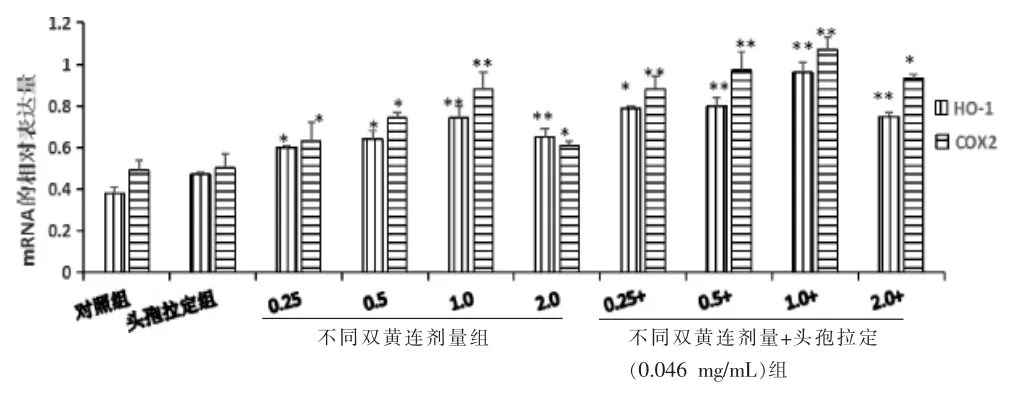
图2 不同浓度双黄连单独以及与头孢拉定合用对HL-7702肝细胞HO-1、COX-2 的mRNA 表达的影响(n=3,±s,mg/mL)
4 讨论
双黄连冻干粉中含有绿原酸、咖啡酸、芦丁、金丝桃苷、连翘酯苷、野黄芩苷、黄芩苷、连翘苷、木犀草素、黄芩素和汉黄芩素等多种成分[15]。 2020 版《中华人民共和国药典》中规定,注射用双黄连(冻干)质量检测的指标成分就是:绿原酸8.5~11.5 mg/支、黄芩苷128~173 mg/支、连翘苷1.4~2.1 mg/支。本研究中,选择应用HPLC 波长转换法同时检测以上3 种成分,并增加了汉黄芩素的含量测定。 检测结果显示,注射用双黄连冻干粉中黄芩苷含量最高,其次为绿原酸、连翘苷,汉黄芩素含量最低。
前期研究发现,双黄连冻干粉单用以及与头孢拉定合用,对人肝细胞生长、增殖、细胞形态都有比较明显的抑制作用,且高浓度双黄连冻干粉(2 mg/mL)体外对人肝细胞有一定的损伤[11],说明随着注射用双黄连给药量的加大,其对肝细胞的毒性相应加大,进一步说明双黄连主要有效成分合用后可能发生相互作用,产生不良反应。本研究低剂量组中,与对照组相比,连翘苷组、黄芩苷组、汉黄芩素组的实验结果显示此3 种成分单独使用能显著降低HL-7702 细胞ALT 表达,而绿原酸单独应用对ALT的表达无影响;高剂量组中绿原酸、连翘苷、汉黄芩素对HL-7702细胞AST、ALT 含量影响与对照组相比差异显著,这与文献报道[16-18]的其均有保肝作用相一致。 在ATP、ADP 检测结果中,与对照组相比,高剂量组中各组对ADP 表达无影响,绿原酸组、绿原酸与头孢拉定合用组以及连翘苷与头孢拉定合用组能显著抑制ATP 表达;而低剂量组中黄芩苷、汉黄芩素单独以及与头孢拉定合用对ATP、ADP 表达均有显著影响。
COX-2 被认为是一种炎症反应基因,主要分布在核膜,在炎症组织中高表达[19]。 研究发现,在高分化的肝细胞癌中COX-2 表达增强,参与肝癌的早期形成阶段,在进展期中表达呈现降低[20]。本实验结果表明,单独给予不同浓度的双黄连注射液的细胞,COX-2 mRNA 的表达量与给药浓度呈正相关,但是当双黄连浓度达到2.0 mg/mL 时,其表达量有所下降。 这可能与注射液中含有脂多糖类物质有关,当低剂量给药时,双黄连注射剂中含有的脂多糖类物质具有内毒素活性,随着给药浓度的增加,对细胞的刺激性增加,所以药物作用后COX-2 表达上调。本实验结果发现,HO-1 mRNA 与COX-2 mRNA的表达趋势相一致,说明HO-1 mRNA 与COX-2 mRNA的表达具有相关性。这可能与给药后,药物刺激肝细胞产生应激反应,消耗细胞内的抗氧化剂,造成细胞损伤,并调节细胞内的信号转导途径[21]。
本研究发现,双黄连冻干粉及其组分与头孢拉定合用对肝细胞功能以及能量代谢有一定的影响,对环氧化物酶和血红素加氧酶的表达存在影响。 其中,对剂量的探索为后续动物实验的研究奠定基础。其合用之后,所造成的肝细胞损害的作用机制还有待进一步研究,尤其是动物在体实验的研究。
