蓝金口服液治疗上呼吸道感染(风热表证)的作用研究
2022-11-02刘学武张乐佳邹振兴徐康平张宗利
刘学武,张乐佳,宋 军,吴 颖,邹振兴,徐康平,陈 静*,张宗利*
(1.新药药效与安全性评价湖南省重点实验室,湖南 长沙410331;2. 湖南普瑞玛药物研究中心有限公司,湖南 长沙 410331;3.湖南中嘉生物医药有限公司,湖南 长沙 410336;4.中南大学湘雅药学院,湖南 长沙 410013)
上呼吸道感染俗称普通感冒,是指自鼻腔至喉部之间的急性炎症的总称,是最常见的呼吸系统疾病[1-2],该病四季、任何年龄均可发病,其病原体多以病毒为主,并在疾病后期常伴有细菌和真菌的继发性感染。 临床上对于上呼吸道感染主要采用抗感染和改善症状(如发热、咳嗽、头痛及全身酸痛等)相结合[3-4],西药能获得直接抗感染的作用或降温、镇痛作用,但单一用药往往不能同时获得上述效果,中药则可能达到两者兼顾的治疗效果,但在用药时需遵循中医证候特异性[5-6]。 因此,快速而有效的中医辨证用药治疗成为研究热点。 上呼吸道感染按中医证候分型可分为风热表证、风寒表证、外寒里热证、暑湿证等[7-9],其中以风热表证和风寒表证居多[8-10]。目前,市售的上呼吸道感染中成药多选用清热解毒为主[11],但清热解毒药多适用于上呼吸道感染热毒壅盛证[12-15],为满足更广泛的临床需求,开发疏散风热,以透邪外出解表的中成药可能更具有临床适用性。 蓝金口服液是由板蓝根、金银花、连翘、射干、柴胡等配伍组成,兼具有清热解毒、疏风透表之功效,主治外感温邪疫毒,邪在卫表,证见发热较甚,微恶风寒,头身痛而无汗,或有微汗,咽痛口干,或颐肿,舌苔薄白或薄黄,脉浮数等,适用于风热表证型上呼吸道感染的治疗,同时可用于流行性感冒、流行性腮腺炎、急性咽炎、扁桃体炎等上述见症者。 本研究通过观察蓝金口服液对体内外的抗菌、抗病毒作用以及解热、发汗、镇痛作用,考察蓝金口服液的直接抗感染作用和改善风热表证所伴有的高热、无汗而头身痛等症状的药效功能。
1 材料
1.1 实验动物
SPF 级ICR 小鼠370 只,雌性225 只,雄性145 只,动 物 合 格 证 号:43004700024175、4300470005721、43004700026564、43004700014322、43004700019800;SPF 级BALB/C 小鼠90 只,雌雄各半,动物合格证号:430047000035323;SPF 级SD 大鼠100 只,雌雄各半,动物合格证号:43004700019800、43004700019800。以上动物均购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2011-0003、SCXK(湘)2016-0002;在湖南省药物安全评价研究中心屏障环境实验室饲养,实验动物使用许可证号:SYXK(湘)2015-0016。
1.2 菌种、病毒与细胞株
标准菌种:金黄色葡萄球菌Staphylococcus aureus(ATCC25923)、大肠埃希菌Escherichiacoli(ATCC25922)、肺炎链球菌Strptococous pneumoniae(ATCC49619)、乙型溶血性链球菌Strptococoushemolyticus(ATCC32210)、白假丝酵母菌Monilia albicans(ATCC10231),均购于南京便诊生物科技有限公司。临床分离菌:金黄色葡萄球菌(18 株)、肺炎链球菌(19 株)、乙型溶血性链球菌(15 株)、大肠埃希杆菌(19 株)、肺炎克雷伯菌(20 株)、白假丝酵母菌(6 株),均系湖南中医药大学第一附属医院细菌室、湖南中医药大学第三附属医院检验科、湖南省儿童医院检验科分离细菌,所有细菌均经过西门子细菌鉴定系统鉴定。
病毒株:甲型流感病毒亚甲型鼠肺适应株H1N1(A/PR/8/34),由湖南师范大学生命科学院病毒研究室赠送,在湖南中医药大学微生物教研室进行培养和传代。 呼吸道合胞病毒株(RSV Lon 株)购自中国预防医学科学院病毒研究所及儿科研究所。
细胞株:人喉癌细胞株(Hep-2)、犬肾细胞株(DMCK),均购自中南大学湘雅医学院细胞供应中心。
1.3 试剂与试药
蓝金口服液(浓缩液),2.703 g 生药/mL,批号:20150127,由湖南中嘉药物开发有限公司提供。诺氟沙星片,批号:15032332,由湖南新汇制药股份有限公司生产。氨苄西林胶囊,批号:14022366,由珠海联邦制药股份有限公司中山分公司生产。 氟康唑片,批号:20140201,由海南中化联合制药工业股份有限公司生产。阿莫西林胶囊,批号:151121,由安徽安科恒益药业有限公司生产。 双黄连口服液, 批号:20150127, 河南福森药液有限公司生产。 利巴韦林片,批号:1605016,由江西汇仁药业有限公司提供。板蓝根颗粒,批号:WXMB16109,由广州云南白药集团股份有限公司提供。 硝酸毛果芸香碱滴眼液,批号:14120401,由武汉五景药业有限公司生产。 罗通定片,批号:A140701,由山西云鹏制药有限公司生产;阿司匹林片,批号:ZKA1407,由云南白药集团股份有限公司生产。 上述受试物或阳性对照药用于体内实验时,于使用前加蒸馏水稀释至所需浓度药液,进行给药;体外抗菌、抗病毒实验用灭菌注射用水稀释至相应浓度后,用0.22 μm 的滤膜过滤,然后添加至体外培养体系中。 RPMI-1640 培养基,购自美国Sigma 公司。活性干酵母粉,批号:12000222,安琪酵母股份有限公司产品。 小牛血清,购自杭州四季青生物有限公司。
1.4 主要仪器
移液器(德国Eppendorf 公司);CJ-1F 型医用净化工作台(苏州冯氏实验动物设备有限公司);BSC1300-Ⅱ-B2 型生物安全柜(山东新华医疗器械股份有限公司);DMIL 倒置显微镜(德国Leica 公司);SpectraMaxi3x 型多功能酶标仪[美谷分子仪器(上海)有限公司];艾科浦超纯水仪(重庆颐洋企业发展有限公司);ME1002E 型电子天平[梅特勒-托利多仪器(上海)有限公司]。
2 方法
2.1 体外抗菌作用
2.1.1 琼脂扩散法测定药物抗菌作用 取对数生长期菌液0.1 mL(菌液浓度1×108CFU/mL),加入制备好的含无菌培养基的平皿中,均匀铺开菌液后,取直径6 mm 金属灭菌打孔器于平皿中均匀且垂直打孔,每孔用移液器移取受试药液200 μL,每个菌重复2 次,每次做3 个平行复孔。于37 ℃培养箱中培养24 h,测量每个抑菌圈两个垂直方向的直径,以抑菌圈的直径大小表示药物的抗菌作用强弱。
2.1.2 试管稀释法测定药物的最低抑菌浓度 取10 支无菌试管,每管加入1.0 mL 液体培养基,第一管加入200 mg/mL 受试药与液体培养基混匀后,采用连续2 倍稀释法,用液体培养基对药物进行稀释,使各管实验药物终浓度分别为200、100、50、25、12.5、6.25、3.13、1.57 mg/mL(各管最终总容量为1 mL),各实验管分别加入浓度1×108CFU 的各菌株对数生长期培养物0.1 mL。另设置加等量不含任何药物与细菌或真菌的培养基对照、含细菌或真菌不含药培养基的空白对照。细菌于37 ℃培养24 h,真菌于28 ℃培养48 h,肉眼观察不同菌株生长情况,以未见细菌或真菌生长的药物最高稀释度为药物的最低抑菌浓度(minimum inhibitory concentration, MIC)。
2.2 体内抗菌保护作用
ICR 小鼠240 只,雌雄各半,随机分为8 组,每组30 只(每种细菌10 只/组),分别为模型对照组、阿莫西林胶囊组(0.26 g/kg)、双黄连口服液组(7.8 mL/kg)、蓝 金 口 服 液 剂 量1、2、3、4、5 组(1.6、3.1、6.2、12.5、25.0 g 生药/kg)。各组小鼠每天给药1 次,连续7 d,模型对照组每天灌胃给予等体积蒸馏水。 于第4 天给药前,各组小鼠分别腹腔注射引起小鼠90%以上死亡的金黄色葡萄球菌、肺炎链球菌、溶血性链球菌(用5%活性酵母溶液配制,其中金黄色葡萄球菌为7.5×107CFU/只,肺炎链球菌为1.9×105CFU/只,溶血性链球菌为2.5×108CFU/只),菌液体积每只0.6 mL,阿莫西林胶囊组小鼠自注射细菌当日起,连续灌胃给药3 d。 各组小鼠自注射细菌后连续观察7 d,记录动物的死亡情况。
2.3 体外抗病毒作用
2.3.1 药物的细胞毒性作用 用细胞维持液将1.2 g/mL的蓝金口服液、双黄连口服液分别用细胞维生长持 液 按 连 续 对 倍 稀 释 成1200、600、300、150、75、37.5 mg/mL;将100 mg/mL 利巴韦林按用细胞生长维持液连续对倍稀释为5、2.5、1.25、0.63、0.32、0.16 mg/mL,分别加入96 孔板已长成单层的Hep-2 或DMCK 细胞中,每个稀释度接种8 个复孔,每孔加入100 μL,置于37 ℃CO2培养箱中培养48 h 后, 弃培养液上清液,每孔加入100 μL 细胞维持液(含5 mg/mL 的MTT,但不含血清的1640 液),继续培养2~3 h 后,弃上清液,PBS 洗3 次,每孔加DMSO 溶解液150 μL,振荡5~10 min,待结晶完全溶解,酶标仪测得细胞在570 nm处OD 值。计算各稀释度的药物对细胞存活的影响,并计算细胞死亡率/%=(1-实验孔OD 均值/对照孔OD 测定值均值)×100%,根据细胞死亡率计算细胞毒性半数中毒浓度(CC50)。
2.3.2 药物对病毒的抑制作用 分别取已长成单层Hep-2 细胞或DMCK 细胞的培养板,倒掉培养液,每孔分别接种100TCID50 的不同病毒液50 μL,置37 ℃含5% CO2的培养箱中吸附1 h 后,吸去未吸附的病毒液,用PBS 洗细胞2 次后,每孔加入相应稀释度的药物(蓝金口服液、双黄连口服液分别用细胞维持液按连续对倍稀释成10、5、2.5、1.25、0.63、0.31 mg/mL;利巴韦林用细胞维持液按连续对倍稀释成25、12.5、6.3、3.2、1.6、0.8 μg/mL)100 μL,每个稀释度接种8 个复孔,观察药物对病毒感染细胞后的抑制作用。 同时,设病毒对照、阳性对照药物及正常细胞对照。 置于37 ℃、5% CO2培养箱中培养,每日倒置微镜下观察细胞病变,并记录空斑数,根据病变情况及空白数计算药物对病毒感染细胞的半数有效抑制浓度(IC50),并根据CC50计算安全指数SI=CC50/IC50。
2.4 体内抗病毒保护作用
BALB/C 小鼠90 只,雌雄各半,体质量19.0~24.3 g,先按性别、体质量随机分为9 组,每组10只,分别为正常对照组、模型对照组、利巴韦林片组(117 mg/kg)、板蓝根颗粒组(2.6 g/kg)、蓝金口服液1、2、3、4、5 组(1.6、3.1、6.2、12.5、25.0 g 生药/kg)。除正常对照组外,每只小鼠经鼻滴入10LD50 (10-5.5)的甲型流感病毒鼠肺适应株,各组小鼠于感染前一天开始灌胃给药,每天1 次,连续7 d,正常对照组和模型对照组每天灌服等体积蒸馏水。 从病毒感染即日起,逐日观察动物发病症状,死亡数,共14 d,计算各组小鼠的死亡率、平均存活天数以及肺指数。 肺指数指机体肺质量与体质量的百分比,以肺指数值的大小表示肺部炎性病变的严重程度。
2.5 解热作用
试验大鼠于检疫结束后测肛温2 次,选取体温波动小于0.5 ℃的健康SD 大鼠50 只,雌雄各半,体质量160.1~199.4 g,按性别、体质量随机分为5组,每组10 只,分别为模型对照组、双黄连口服液组(5.4 mL/kg)以及蓝金口服液低、中、高剂量组(2.16、4.32、8.64 g 生药/kg)。各组大鼠按10 mL/kg 灌胃给予相应浓度药液,1 次/d,连续7 d,空白对照组灌胃给予等体积蒸馏水。各组大鼠于给药第5、第6 天分别测定肛温一次使之适应。 于末次给药前动物禁食不禁水12 h,造模前测定基础肛温值,测定后各鼠背部皮下注射20%干酵母-生理盐水悬液10 mL/kg,于造模后4 h 按组别灌胃给予对应药物或蒸馏水,于造模后1、2、4、5、6、8、10 h 分别检测各组大鼠肛温,并计算体温波动值△T =T基础体温-T造模后体温。
2.6 发汗作用
SD 大鼠50 只,雌雄各半,体质量190.4~217.5 g,按性别、体质量随机分为5 组,分别为空白对照组、毛果芸香碱组(40 mg/kg)以及蓝金口服液组低、中、高剂量组(2.16、4.32、8.64 g 生药/kg)。 各组大鼠按10 mL/kg 灌胃给予相应浓度药液,1 次/d,连续7 d,空白对照组灌胃给予等体积蒸馏水。 于末次给药后30 min,各组大鼠用75%乙醇擦拭干净右足跖,然后涂上和田-高垣氏A 液,待充分干燥后,再薄薄涂上和田-高垣氏B 液,20 min 后,用40 倍放大镜计数足跖部的深紫色着色点(汗点)。
2.7 镇痛作用
2.7.1 对小鼠醋酸扭体反应的影响 ICR 小鼠50只,体质量18.0~24.8 g,雌雄各半,按性别体重随机分为5 组,每组10 只,分别为模型对照组、阿司匹林片组(287 mg/kg)以及蓝金口服液低、中、高剂量组(3.1、6.2、12.5 g 生药/kg)。 各组小鼠按20 mL/kg 灌胃给予相应浓度药液,每天1 次,连续7 d,模型对照组灌胃给予等体积蒸馏水。 末次给药后30 min,各组小鼠按0.2 mL/只腹腔注射0.7%冰乙酸,记录15 min 内各组小鼠扭体反应次数和首次出现扭体反应的潜伏期。
2.7.2 对小鼠热板痛阈值的影响 ICR 小鼠80 只,雌性。 将智能热板测痛仪温度调节到(55±0.5) ℃作为热刺激源,记录小鼠自投入热板至出现舔后足的潜伏期时间,作为该鼠的痛阈值。给药前先测定每只小鼠的痛阈,把痛阈值小于5 s 或大于30 s 的小鼠剔除。 筛选合格小鼠50 只,按痛阈值兼顾体质量随机分为5 组,每组10 只,分别为模型对照组、罗通定组(20 mg/kg)及蓝金口服液低、中、高剂量组(3.1、6.2、12.5 g 生药/kg)。 每日给药前将罗通定片(碾磨成粉末)及蓝金口服液用蒸馏水按剂量配制成相应浓度,现配现用。 各组小鼠按20 mL/kg 灌胃给予相应浓度药液,1 次/d,连续7 d,模型对照组灌胃给予等体积蒸馏水。于末次给药前及末次给药后30、60、120 min 测定各组小鼠痛阈值。
2.8 统计方法
3 结果
3.1 体外抗菌作用
3.1.1 琼脂扩散法测定药物抗菌作用 蓝金口服液具有较强的抑菌作用,蓝金口服液对革兰氏阳性菌的抑菌作用强于革兰氏阴性菌。 蓝金口服液对金黄色葡萄球菌、肺炎链球菌、乙型溶血链球菌的抑菌圈明显大于阳性对照药(氨苄西林)(P<0.05)。蓝金口服液对大肠埃希氏菌的抑菌圈明显大于阳性对照药(诺氟沙星)(P<0.05)。 蓝金口服液对白假丝酵母菌的抑菌圈明显大于阳性对照药(氟康唑)(P<0.05)。详见表1。
3.1.2 试管稀释法测定药物的最低抑菌浓度 根据各个细菌的MIC 可知,蓝金口服液对临床分离金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌、大肠埃希菌、肺炎克雷伯菌均具有一定的抑制作用,且蓝金口服液对革兰氏阳性菌(金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌)的抑制作用明显优于革兰氏阴性菌(大肠埃希菌、肺炎克雷伯菌)以及白假丝酵母菌。 详见表2。
表1 蓝金口服液对细菌的抑制作用(±s,n=6)
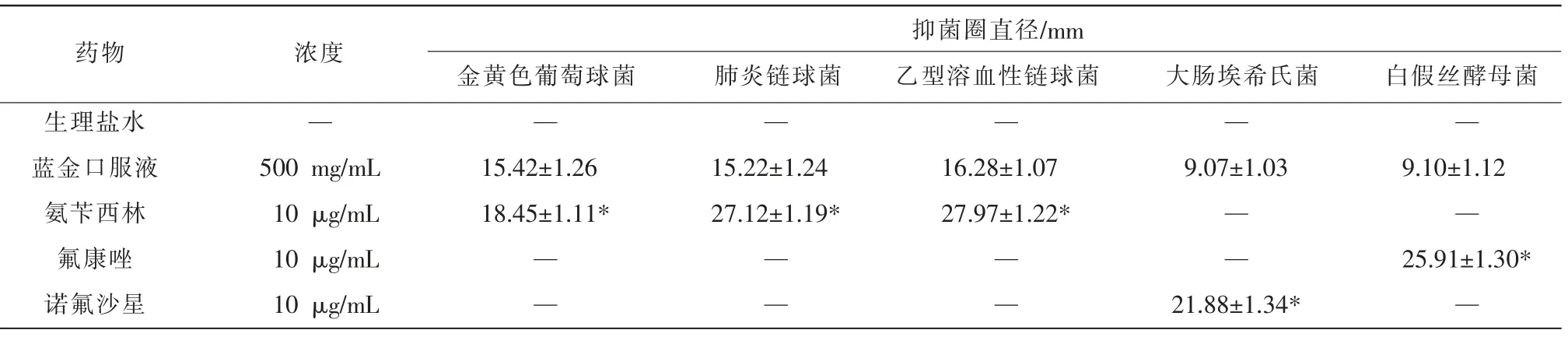
表1 蓝金口服液对细菌的抑制作用(±s,n=6)
注:同菌种内与阳性对照药物比较,*P<0.05。
药物 浓度 抑菌圈直径/mm金黄色葡萄球菌 肺炎链球菌 乙型溶血性链球菌 大肠埃希氏菌 白假丝酵母菌生理盐水蓝金口服液氨苄西林氟康唑诺氟沙星——————500 mg/mL 10 μg/mL 10 μg/mL 10 μg/mL 15.42±1.26 18.45±1.11*15.22±1.24 27.12±1.19*16.28±1.07 27.97±1.22*9.07±1.03— —— —— —— —21.88±1.34*9.10±1.12—25.91±1.30*—
3.2 体内抗菌保护作用
如图1A 所示,模型对照组小鼠注射金黄色葡萄球菌后,存活率为0%;与模型对照组比较,蓝金口服液4、5 组小鼠存活率分别达50%、40%,且存活天数均显著延长(P<0.05 或P<0.01);与模型对照组比较,阿莫西林组和双黄连口服液组小鼠存活率分别为90%、50%,且两组小鼠的存活天数均显著延长(P<0.05 或P<0.01)。 如图1B 所示,模型对照组小鼠注射肺炎链球菌后,存活率为10%;与模型对照组比较,蓝金口服液剂量4、5 组小鼠存活率分别达60%、70%,存活天数显著延长(P<0.05 或P<0.01);与模型对照组比较,阿莫西林组和双黄连口服液组小鼠存活率分别为80%、40%,且阿莫西林组小鼠存活天数显著延长(P<0.01)。 如图1C 所示,模型对照组小鼠注射溶血性链球菌后,存活率为0%;与模型对照组比较,蓝金口服液剂量4、5 组小鼠存活率分别达30%、50%,且存活天数均显著延长(P<0.05 或P<0.01);与模型对照组比较,阿莫西林组和双黄连口服液组小鼠存活率分别达100%、50%,且两组小鼠的存活天数均显著延长(P<0.05 或P<0.01)。
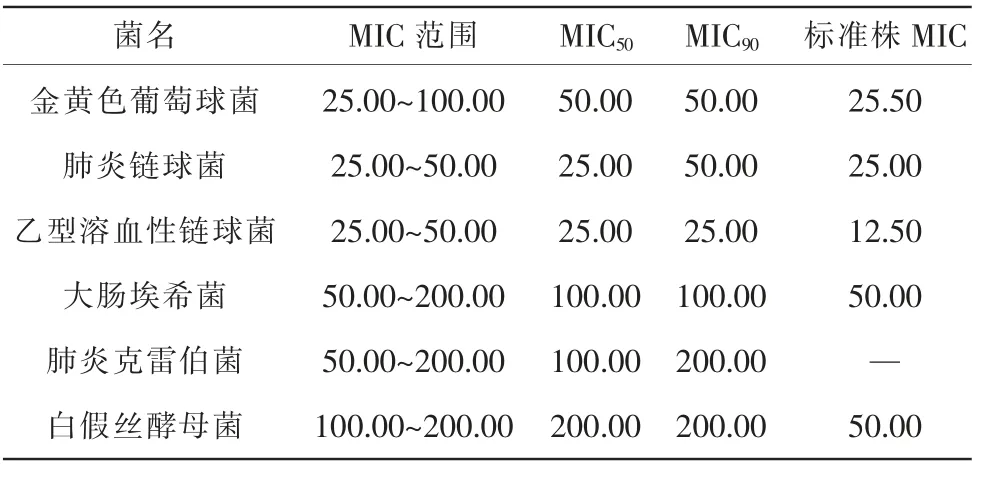
表2 蓝金口服液对97 株临床分离菌的MIC测定结果(mg/mL)
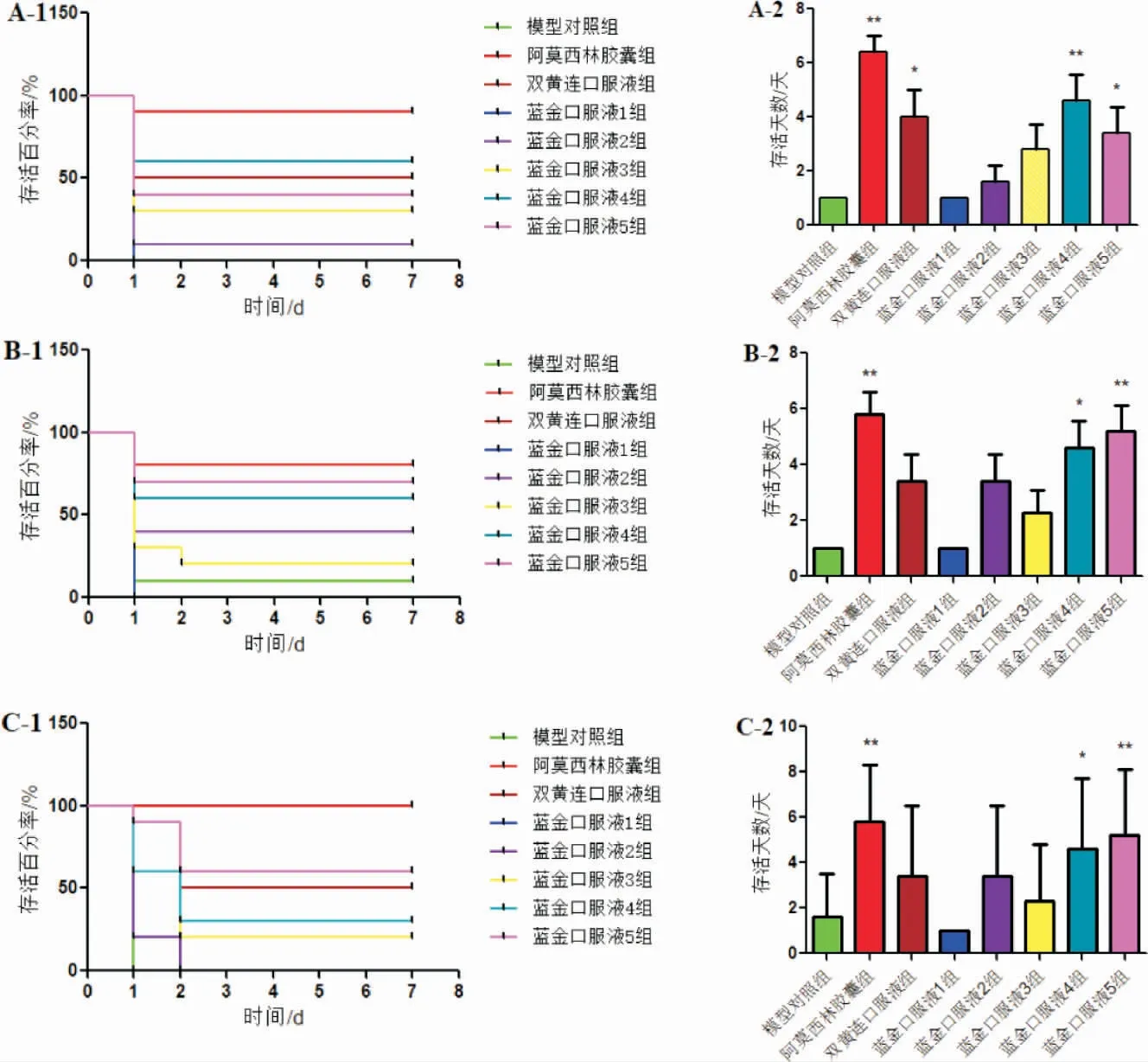
图1 蓝金口服液对小鼠感染细菌后的体内保护作用(n=10)
3.3 体外抗病毒作用
3.3.1 蓝金口服液对呼吸道合胞病毒的抑制作用 蓝金口服液、双黄连口服液和利巴韦林片对Hep-2 细胞的细胞毒性CC50分别为679 mg/mL、5211 mg/mL、1581 μg/mL;蓝金口服液、双黄连口服液和奥司他韦胶囊对甲型流感病毒体外空斑形成的抑制作用IC50分别为3.5 mg/mL、4.89 mg/mL、6.3 μg/mL;根据CC50和IC50计算安全指数SI 分别为194、104、251。 详见图2。
3.3.2 蓝金口服液对甲型流感病毒的抑制作用 蓝金口服液、双黄连口服液和利巴韦林对MDCK 细胞的细胞毒性CC50分别为967 mg/mL、891 mg/mL、1132 μg/mL;蓝金口服液、双黄连口服液和利巴韦林片对甲型流感病毒体外空斑形成的抑制作用IC50分别为6.58 mg/mL、8.33 mg/mL、3.5 μg/mL;根据CC50和IC50计算安全指数SI 分别为147、107、323。详见图3。
3.4 蓝金口服液体内抗病毒保护作用
与正常对照组比较,模型组小鼠死亡率、肺指数显著升高(P<0.01),存活天数降低(P<0.01)。 与模型对照组比较,蓝金口服液各剂量组小鼠死亡率、肺指数显著减小(P<0.01),蓝金口服液2、3、4、5 组小鼠存活天数显著延长(P<0.01)。 详见图4。
3.5 蓝金口服液解热作用
与模型对照组比较,蓝金口服液中剂量组大鼠造模后6 h 的体温波动值△T 显著减小(P<0.05),蓝金口服液高剂量组大鼠6、8、10 h 体温波动值△t显著减小(P<0.05);与模型对照组比较,双黄连口服液组大鼠造模后6 h 的体温波动值△T 显著减小(P<0.05)。 详见图5。
3.6 蓝金口服液发汗作用
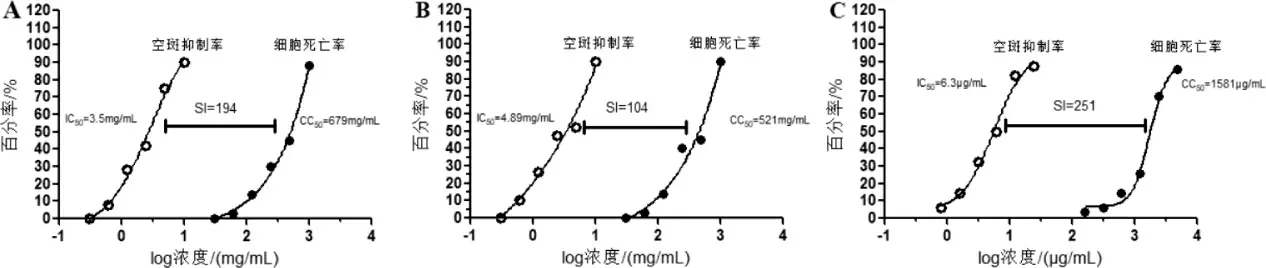
图2 蓝金口服液对呼吸道合胞病毒感染细胞的抑制作用
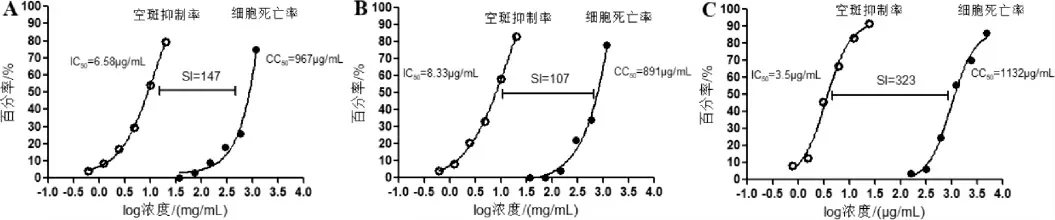
图3 蓝金口服液对甲型流感病毒感染细胞病变的抑制作用(n=8)
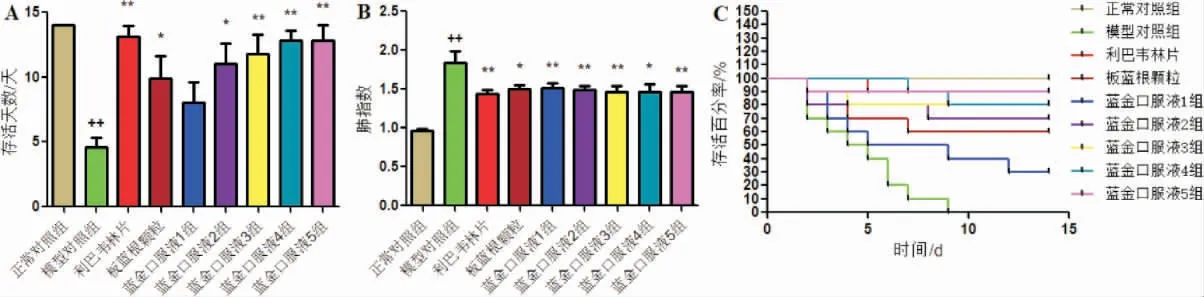
图4 蓝金口服液剂量1、2、3、4、5 组对流感病毒感染小鼠存活天数、肺指数及死亡率的影响(n=10)
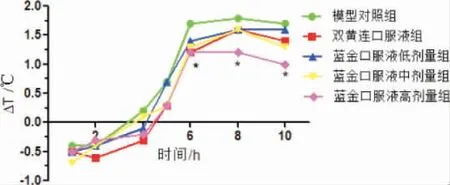
图5 蓝金口服液对干酵母所致大鼠体温升高的影响(n=10)
与空白对照组比较,蓝金口服液中、高剂量组大鼠汗点数显著增加(P<0.05);与空白对照组比较,毛果芸香碱组大鼠足趾汗点数显著增加(P<0.01)。详见图6。
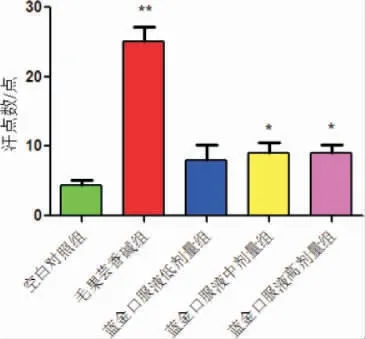
图6 蓝金口服液对大鼠足趾汗液分泌的影响(n=10)
3.7 蓝金口服液镇痛作用
3.7.1 外周镇痛作用研究——乙酸扭体法 与模型对照组比较,蓝金口服液高剂量组小鼠扭体潜伏期显著缩短(P<0.05),中、高剂量组小鼠扭体次数显著减少(P<0.05);与模型对照组比较,阿司匹林组小鼠扭体潜伏期显著缩短(P<0.01),扭体次数显著减少(P<0.01)。 详见图7。
3.7.2 中枢镇痛作用研究——热板法 与模型对照组比较,蓝金口服液高剂量组动物给药后30 min痛阈值显著增加(P<0.05);与模型对照组比较,罗通定组小鼠给药后30、60、120 min 痛阈值显著增加(P<0.05 或P<0.01)。 详见图8。
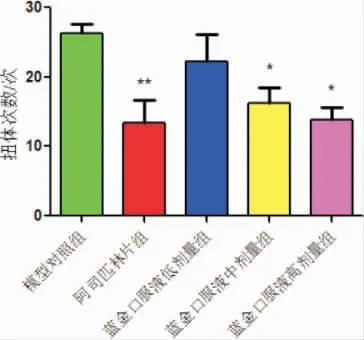
图7 蓝金口服液对乙酸致小鼠扭体反应的影响(n=10)
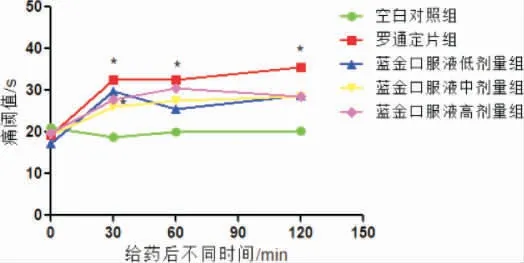
图8 蓝金口服液对热板法小鼠的镇痛作用(n=10)
4 讨论
上呼吸道感染属于中医学“外感发热”“伤风感冒”范畴[16],按中医证候分型以风热、风寒、暑湿较为多见,其中以风热犯表证尤为常见[8-11]。 目前,中医药治疗上呼吸道感染多以清热解毒药为主[11],但清热解毒药较适用于上呼吸道感染热毒壅盛证[12-15]。 蓝金口服液由板蓝根、金银花、连翘、柴胡、荆芥、射干、甘草组成,根据其处方组成可知,本方兼具有清热解毒、疏风透表之功效,可主治外感温邪疫毒,邪在卫表,适用于风热表证型上呼吸道感染的治疗。 流行病学调查显示,风热犯表证占上呼吸道感染的30%~50%[7-10,17-18],属于上呼吸道感染的主要证候类型,且风热感冒的感染病原体多以病毒为主[18],包括流感病毒、鼻病毒、呼吸道合胞病毒等[16-18],故本研究选用甲型流感病毒和呼吸道合胞病毒作为代表性病毒株,通过体外抗病毒和体内保护实验考察蓝金口服液的抗病毒作用。结果显示,蓝金口服液32.51 mg/mL 对甲型流感病毒引起的MDCK 细胞病变及血凝现象有明显的抑制作用,且能显著减少呼吸道合胞病毒引起的Hep-2 细胞病变空斑数,同时蓝金口服液1.6、3.1、6.2、12.5、25.0 g 生药/kg 还能显著降低小鼠感染甲型流感病毒后的死亡率,显著延长存活时间,显著减小肺指数,提示蓝金口服液具有显著的抗感冒病毒作用。感冒后期通常伴有细菌和真菌的继发性感染,其病原体包括金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌、大肠埃希菌、白假丝酵母菌等[16]。 故本次研究选用金黄色葡萄球菌、肺炎链球菌、乙型溶血链球菌、大肠埃希菌、白假丝酵母菌作为代表性菌株,通过体外抗菌和体内保护实验考察蓝金口服液的抗菌作用。结果显示,蓝金口服液具有较强的体外抑菌作用,且对革兰氏阳性菌的抑制作用明显优于革兰氏阴性菌以及白假丝酵母菌。 同时,蓝金口服液能够显著延长小鼠感染金黄色葡萄球菌、肺炎链球菌及溶血性链球菌后的存活时间,提高其存活率,提示蓝金口服液具有体内抗菌作用。
风热表证的症状主要包括发热、咽痛、微恶风寒、头身痛等[16],本次研究通过小鼠乙酸扭体实验和热板痛阈实验考察蓝金口服液的镇痛作用,以体现其对咽痛、头身痛症状的缓解作用,结果显示,蓝金口服液6.2、12.5 g 生药/kg 能显著抑制醋酸诱导的小鼠扭体次数,蓝金口服液12.5 g 生药/kg 能显著减少热板所致的小鼠舔足痛阈值,提示蓝金口服液具有明显的外周和中枢镇痛作用。发热是风热表证型感冒主要的临床症状之一,主要表现为内热,故本次实验通过活性酵母诱导大鼠体温升高,结果显示,4.32、8.64 g 生药/kg 的蓝金口服液能显著降低大鼠高热模型的体温,同时还能增加大鼠汗液分泌,提示蓝金口服液具有显著的清热、发汗解表作用,能通过退里热、祛除外邪、解除表证,以达到改善无汗、微恶风寒等症状。通过上述实验结果可知,蓝金口服液对上呼吸道感染(风热表证)具有显著治疗效果,但其作用机制仍需通过进一步实验探索进行证实。
