温阳振衰颗粒对TGF-β1 诱导肾小管上皮细胞转分化状态下ERK/STAT3 信号转导通路的影响
2022-11-02林湘东陈新宇
林湘东,向 茗,陈新宇*
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学中医诊断学教研室,湖南 长沙 410208)
慢性肾衰竭是各种慢性肾脏疾病持续进展的共同结局,以代谢产物潴留,水、电解质及酸碱代谢失衡和全身各系统症状为临床表现,死亡率高,是全世界主要的公共卫生问题,严重危害人类健康及生命[1]。肾间质纤维化(renal interstitial fibrosis, RIF)是终末期肾脏病最具特征性的表现,是慢性肾脏疾病肾小管间质损伤中许多独立和重叠的细胞和分子途径的最终常见病理改变,与肾衰竭的进展密切相关。 研究证实,肾小管上皮细胞转分化(epithelial mesenchymal transition, EMT) 是RIF 发展过程的第一阶段,是RIF 形成的关键环节[2]。肾小管EMT受不同生长因子、细胞因子、激素和细胞外信号的调节,细胞因子在RIF 的形成中起重要作用[3]。转化生长因子-β1(transforming growth factor-β1, TGFβ1)是促进肾纤维化的关键细胞因子,目前用于建立EMT 细胞模型,其有调节细胞的增殖、分泌和迁移等多种生物学功能[4]。 研究表明,细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)与肾小管EMT 密切相关,活化的ERK 可激活信号转导及转录激活因子3(signal transduction and activator of transcription 3, STAT3),参与TGF-β1介导的肾小管EMT 发生[5-6]。 温阳振衰颗粒是陈新宇教授创制的经典方,临床用于治疗慢性肾衰竭疗效显著[7]。 据此,本实验通过体外培养观察TGF-β1介导的肾小管EMT 状态下ERK/STAT3 信号转导通路的表达及温阳振衰颗粒对其的干预作用,以期探讨温阳振衰颗粒治疗慢性肾衰竭的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 药物 温阳振衰颗粒(湖南中医药大学第一附属医院制剂室,批号:201709,8 g/包),用蒸馏水将温阳振衰颗粒1.44 g·(kg·d)-1配成6 mL 溶液给大鼠灌胃,每日灌胃2 次,每次3 mL,连续给药7 d;安博维[厄贝沙坦片,赛诺菲(杭州)制药有限公司,批号:BHG0990,规格150 mg/片],用蒸馏水将厄贝沙坦150 mg·(kg·d)-1配成6 mL 溶液给大鼠灌胃,每日灌胃2 次,每次3 mL,连续给药7 d。
1.1.2 实验动物 健康雄性SD 大鼠30 只,体质量(200±20) g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号:SCXK(湘)2016-0002。
1.1.3 实验细胞 HK-2 细胞(批号:CRL-1070)购于中南大学湘雅中心实验室细胞库。
1.1.4 主要试剂 TGF-β1(英国Abcam 公司,批号:9016);U0126(美国APExBio 公司,批号:U120);E-cadherin 抗 体(批 号:00018701)、Vimentin 抗 体(批 号:00090339)、ERK 抗 体(批 号:00096552)、STAT3 抗体(批号:10000862)均购自美国Protein tech 公司;α-SMA(武汉博士德生物工程有限公司,批号:186841);p-ERK 抗体(北京博奥森生物技术公司,批号:192581);p-STAT3 抗体(美国CST公司,批号:20)。
1.1.5 主要仪器 超净工作台(北京亚泰科隆仪器技术有限公司,型号:YT-CJ-2NB);摇床(江苏海门其林贝尔仪器制造有限公司,型号:TS-92);台式冷冻离心机(珠海黑马医学仪器有限公司,型号:TGL-18R);电泳仪(美国Bio-rad 公司,型号:164-5050);电泳槽(型号:DYCZ-24EN)、转膜仪(型号:DYCZ-40A)均购自北京六一生物科技有限公司;精密pH计(上海雷磁仪器厂,型号:E-201-C);电子天平(上海民桥精密科学仪器有限公司,型号:FA-N);普通冰箱(合肥荣事达电子电器集团有限公司,型号:BCD-245F)。
1.2 实验方法
1.2.1 含药血清制备 分别用蒸馏水将温阳振衰颗粒1.44 g·(kg·d)-1、厄贝沙坦150 mg·(kg·d)-1配成6 mL溶液。 取SD 大鼠30 只,随机分成温阳振衰颗粒组、厄贝沙坦片组、正常血清组,各10 只。 正常血清组每日予以蒸馏水6 mL/只,温阳振衰颗粒组每日予以温阳振衰颗粒溶液6 mL/只,厄贝沙坦片组予以厄贝沙坦片溶液6 mL/只,每日灌胃2 次,每次3 mL,连续给药7 d,第7 天给药后2 h 进行麻醉,腹主动脉取血。室温静置1 h,离心、过滤、分装。-20 ℃保存备用[8]。
1.2.2 细胞培养及实验分组 将HK-2 细胞培养于含10%胎牛血清的DMEM/F12 培养基中,待细胞融合率达80%左右,进行消化传代;待细胞培养到6瓶时,消化铺板,铺2 个6 孔板,共12 个孔,每孔约5×104个细胞。药物处理前一天晚上,换无血清DMEM/F12 培养基,饥饿处理12 h。 然后将细胞随机分为空白对照组、TGF-β1 组、TGF-β1+空白血清组、TGF-β1+温阳振衰颗粒组(10%含药血清)、TGF-β1+U0126 组(MEK1/2 抑制剂)、TGF-β1+厄贝沙坦组。 空白对照组为无血清DMEM/F12 培养液;TGF-β1 组在无血清DMEM/F12 培养液中加入10 μL TGF-β1(浓度为10 ng/mL);TGF-β1+空白血清组在无血清DMEM/F12 培养液中加入10 μL TGF-β1(浓度为10 ng/mL)及10%空白血清;TGF-β1+温阳振衰颗粒组在无血清DMEM/F12 培养液中加入10 μL TGF-β1(浓度为10 ng/mL)及10%温阳振衰颗粒含药血清;TGF-β1+U0126 组在无血清DMEM/F12 培养液中使用1 μM(母液1∶10 000用)U0126处理1 h,换液去除U0126 后再加入10 μL TGF-β1(浓度为10 ng/mL);TGF-β1+厄贝沙坦组在10%厄贝沙坦血清DMEM/F12 培养液中加入10 μL TGFβ1(浓度为10 ng/mL)。 各组处理时间均为24 h。
1.2.3 各组细胞形态学观察 上述各组细胞处理时间结束后于倒置显微镜下观察HK-2 细胞的形态改变。
1.2.4 各组细胞E-cadherin、Vimentin、α-SMA、ERK1/2、p-ERK1/2、STAT3、p-STAT3 蛋 白 表 达 的 检 测采用Western blot 法检测,准备电泳样品,取每个样品总蛋白50~100 μg,计算各个样品所需取样量,并与5×loading buffer 混匀,沸水煮5 min,放入冰盒中速冷。上样变性蛋白,开始电泳。电泳结束后转膜,接通电源,转膜300 mA,Vimentin 约75 min,E-cadherin 约2.5 h,α-SMA、ERK1/2、p-ERK1/2 约1 h,p-STAT3、STAT3 约110 min。 转膜完毕后,加入一抗,4 ℃过夜。加入二抗孵育90 min。TBST 冲洗15 min×3次。 ECL 显色曝光,分析结果。
1.2.5 各组细胞E-cadherin、Vimentin、α-SMA、ERK1、ERK2、STAT3 mRNA 表达的检测 采用RT-qPCR法检测,TRIZOL 提取细胞总RNA,逆转录cDNA,SYBR 法进行PCR 扩增,反应体系为30 μL[Template(反转录产物)2 μL,Primer F(10 μM)0.5 μL,Primer R(10 μM)0.5 μL,PCR H2O 12 μL,2X SYBGREEN PCR Master Mix 15 μL]。 反应条件为:95 ℃10 min,95 ℃15 s,60 ℃30 s,40 个循环。 扩增反应结束后读取Ct 值,以β-actin 为内参,用2-ΔΔCt法计算各目的基因相对含量,重复3 次实验。 引物设计见表1。
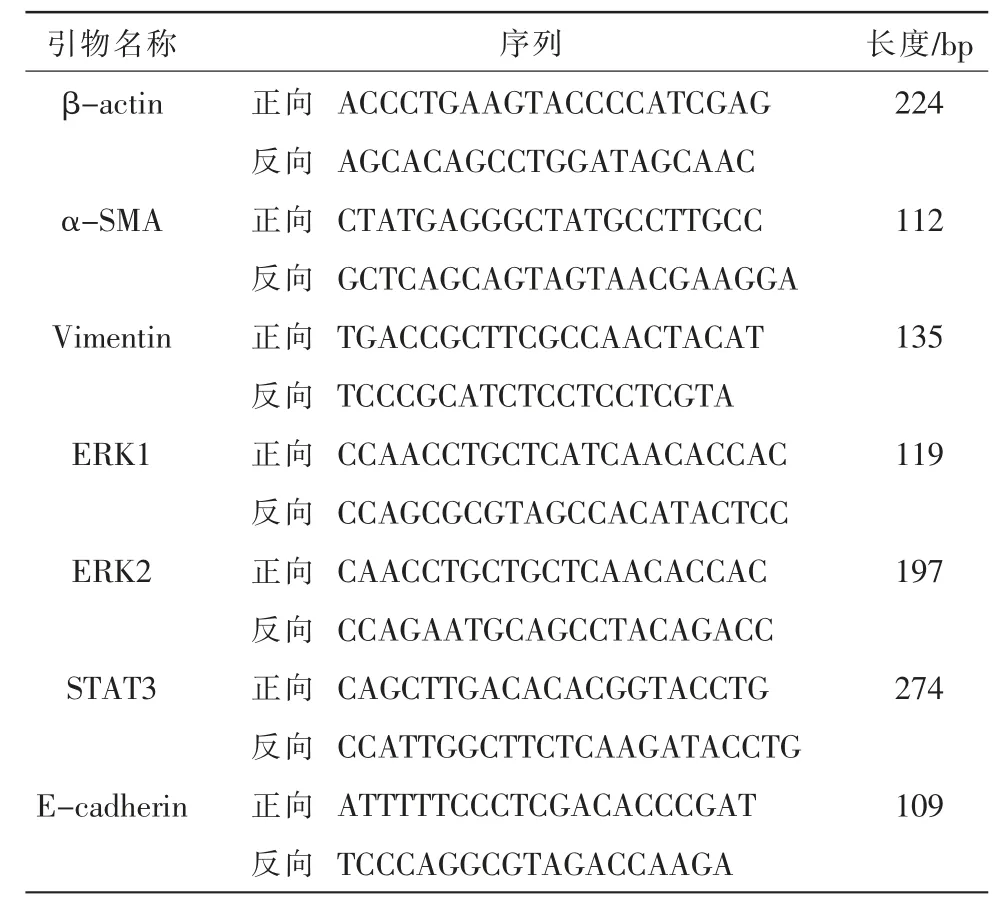
表1 RT-qPCR 法引物设计
1.2.6 统计学分析 使用SPSS 21.0 软件进行数据统计,计量资料表示为“±s”;首先进行方差齐性检验,当方差齐时,使用Independent-samples T 检验比较两组之间的平均值,方差不齐时,采取秩和检验;多组均数比较,采用Q 检验进行方差分析,并使用One-Way ANOVA ISD 方法比较平均值,以P<0.05 为差异有统计学意义。
2 结果
2.1 HK-2 细胞形态学观察
空白对照组中HK-2 细胞形态清楚,呈鹅卵石样,细胞衔接紧密,贴壁良好,少见漂浮细胞。 而在给予TGF-β1 和TGF-β1+空白血清刺激24 h 后,细胞形态发生明显改变,呈长梭形或形态多样无规则,细胞排列稀疏,类似成纤维细胞形态,生长缓慢,贴壁差,多见漂浮细胞。 与TGF-β1 组和TGF-β1+空白血清组比较,TGF-β1+温阳振衰颗粒组、TGFβ1+U0126 组和TGF-β1+厄贝沙坦组细胞形态显著改善,大部分仍保持鹅卵石样,贴壁尚可,漂浮细胞明显减少。 详见图1。
2.2 各组E-cadherin、Vimentin、α-SMA 蛋白表达水平比较
与空白对照组比较,TGF-β1 组和TGF-β1+空白血清组E-cadherin 蛋白表达下调,Vimentin、α-SMA 蛋白表达上调(P<0.05);TGF-β1 组与TGF-β1+空白血清组E-cadherin、Vimentin、α-SMA 蛋白表达比较,差异无统计学意义(P>0.05);与TGF-β1 组和TGF-β1+空白血清组比较,TGF-β1+温阳振衰颗粒组、TGF-β1+U0126 组和TGF-β1+厄贝沙坦组Ecadherin 蛋白表达上调,Vimentin、α-SMA 蛋白表达下调(P<0.05);TGF-β1+温阳振衰颗粒组、TGF-β1+U0126 组和TGF-β1+厄贝沙坦组E-cadherin、Vimentin、α-SMA 蛋白表达比较,差异无统计学意义(P>0.05)。 详见图2、表2。
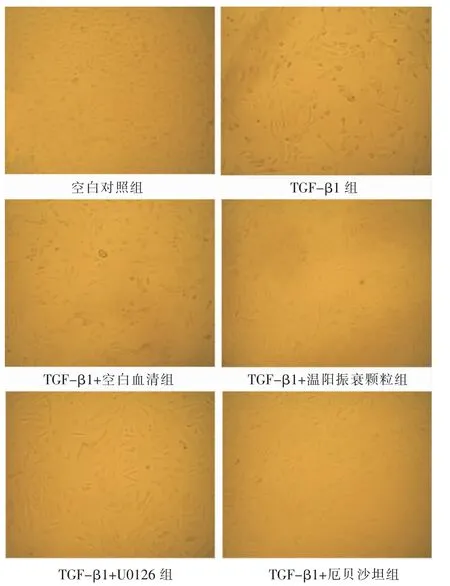
图1 各组HK-2 细胞形态学(光镜,×100)
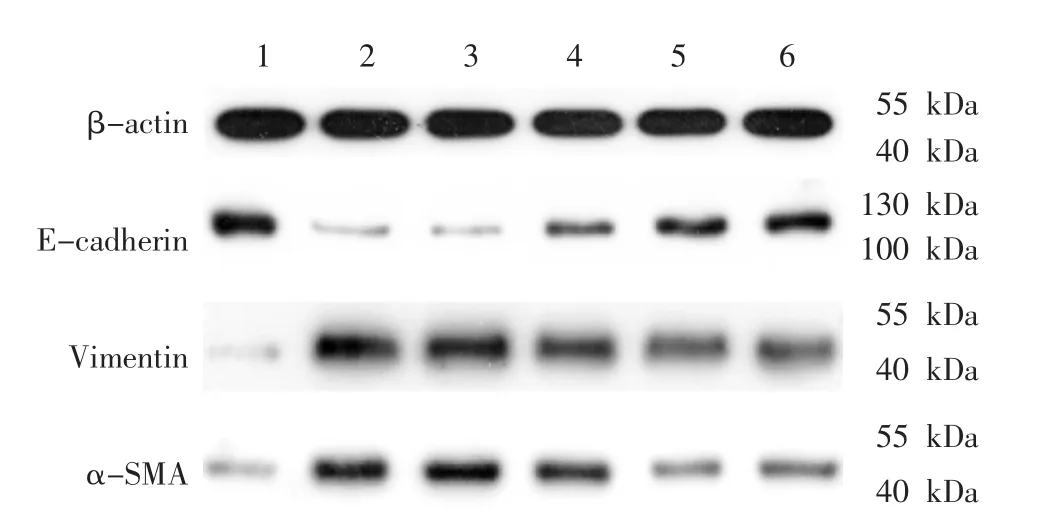
图2 各组E-cadherin、Vimentin、α-SMA 蛋白电泳图
2.3 各组E-cadherin、Vimentin、α-SMA mRNA 表达水平比较
与空白对照组比较,TGF-β1 组和TGF-β1+空白血清组E-cadherin mRNA 表达下调,Vimentin、α-SMA mRNA 表达上调(P<0.05);TGF-β1 组与TGFβ1+空白血清组比较,E-cadherin、Vimentin、α-SMA mRNA 表达差异无统计学意义(P>0.05);与TGF-β1组和TGF-β1+空白血清组比较,TGF-β1+温阳振衰颗粒组、TGF-β1+U0126 组和TGF-β1+厄贝沙坦组E-cadherin mRNA 表达上调,Vimentin、α-SMA mRNA 表达下调(P<0.05);TGF-β1+温阳振衰颗粒组、TGF-β1+U0126 组和TGF-β1+厄贝沙坦组E-cadherin、Vimentin、α-SMA mRNA 表达比较,差异无统计学意义(P>0.05)。 详见表3。
表2 各组E-cadherin、Vimentin、α-SMA 蛋白水平的表达(±s,n=5)
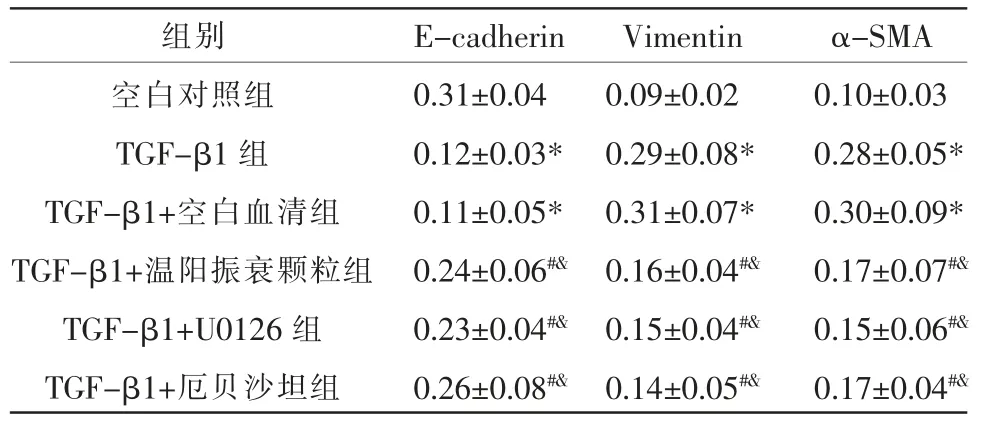
表2 各组E-cadherin、Vimentin、α-SMA 蛋白水平的表达(±s,n=5)
注:与空白对照组比较,*P<0.05;与TGF-β1 组比较,#P<0.05;与TGFβ1+空白血清组比较,&P<0.05。
组别空白对照组TGF-β1 组TGF-β1+空白血清组TGF-β1+温阳振衰颗粒组TGF-β1+U0126 组TGF-β1+厄贝沙坦组E-cadherin 0.31±0.04 0.12±0.03*0.11±0.05*0.24±0.06#&0.23±0.04#&0.26±0.08#&Vimentin 0.09±0.02 0.29±0.08*0.31±0.07*0.16±0.04#&0.15±0.04#&0.14±0.05#&α-SMA 0.10±0.03 0.28±0.05*0.30±0.09*0.17±0.07#&0.15±0.06#&0.17±0.04#&
表3 各组E-cadherin、Vimentin、α-SMA mRNA 的表达(±s,n=5)
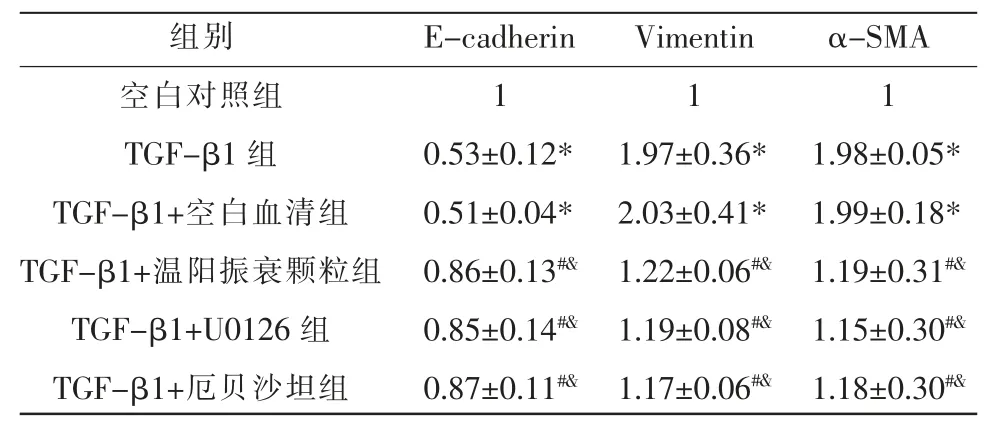
表3 各组E-cadherin、Vimentin、α-SMA mRNA 的表达(±s,n=5)
注:与空白对照组比较,*P<0.05;与TGF-β1 组比较,#P<0.05;与TGF-β1+空白血清组比较,&P<0.05。
组别空白对照组TGF-β1 组TGF-β1+空白血清组TGF-β1+温阳振衰颗粒组TGF-β1+U0126 组TGF-β1+厄贝沙坦组E-cadherin 1 0.53±0.12*0.51±0.04*0.86±0.13#&0.85±0.14#&0.87±0.11#&Vimentin 1 1.97±0.36*2.03±0.41*1.22±0.06#&1.19±0.08#&1.17±0.06#&α-SMA 1 1.98±0.05*1.99±0.18*1.19±0.31#&1.15±0.30#&1.18±0.30#&
2.4 各组ERK1/2、p-ERK1/2、STAT3、p-STAT3 蛋白表达水平比较
与空白对照组比较,其余各组ERK1/2、STAT3蛋白表达差异无统计学意义(P>0.05),TGF-β1 组和TGF-β1+空白血清组p-ERK1/2、p-STAT3 表达明显上调(P<0.05);TGF-β1 组与TGF-β1+空白血清组比较,ERK1/2、p-ERK1/2、STAT3、p-STAT3 蛋白表达差异无统计学意义(P>0.05);与TGF-β1 组和TGF-β1+空白血清组比较,TGF-β1+温阳振衰颗粒组、TGF-β1+U0126 组和TGF-β1+厄贝沙坦组p-ERK1/2、p-STAT3 蛋白表达下调(P<0.05);TGF-β1+温阳振衰颗粒组、TGF-β1+U0126 组和TGF-β1+厄贝 沙 坦 组ERK1/2、p-ERK1/2、STAT3、p-STAT3 蛋白表达比较,差异无统计学意义(P>0.05)。 详见图3、表4。
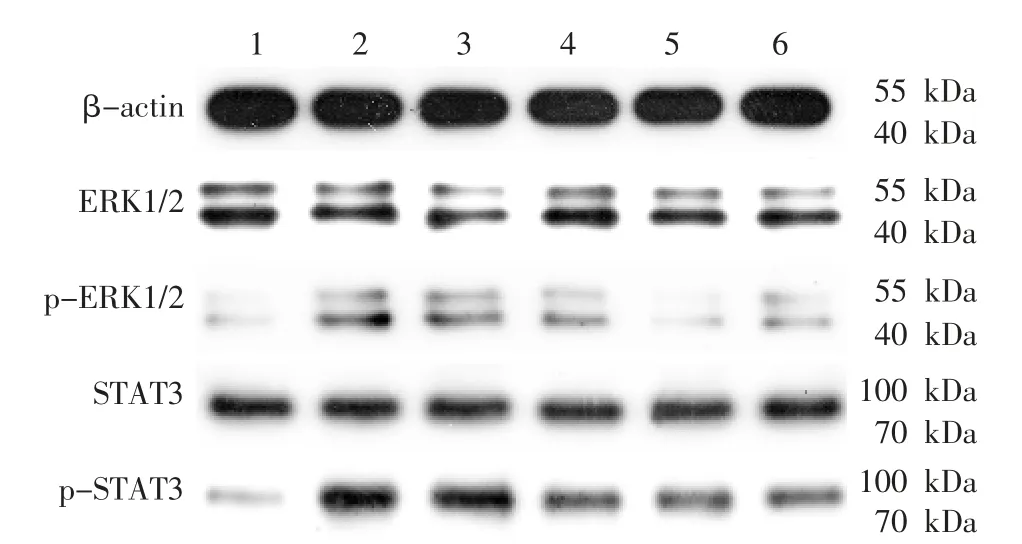
图3 各组ERK1/2、p-ERK1/2、STAT3、p-STAT3蛋白电泳图
表4 各组ERK1/2、p-ERK1/2、STAT3、p-STAT3蛋白的表达(±s,n=5)
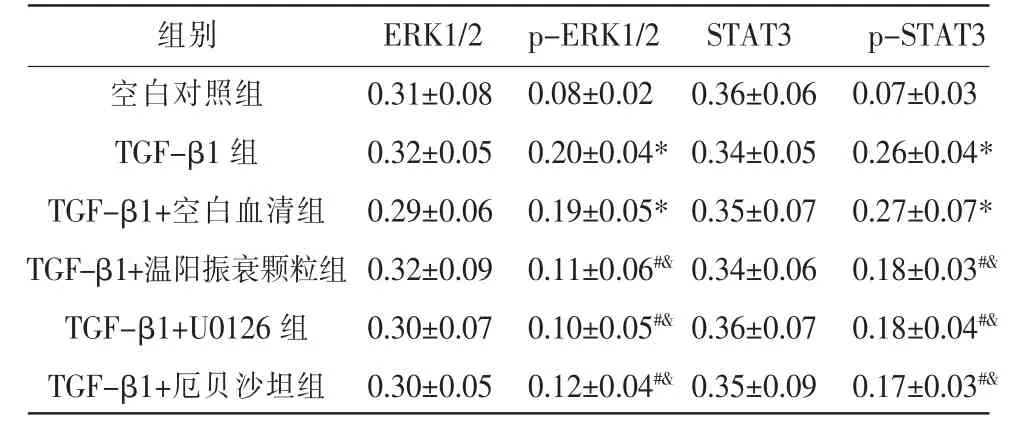
表4 各组ERK1/2、p-ERK1/2、STAT3、p-STAT3蛋白的表达(±s,n=5)
注:与空白对照组比较,*P<0.05;与TGF-β1 组比较,#P<0.05;与TGFβ1+空白血清组比较,&P<0.05。
组别空白对照组TGF-β1 组TGF-β1+空白血清组TGF-β1+温阳振衰颗粒组TGF-β1+U0126 组TGF-β1+厄贝沙坦组ERK1/2 0.31±0.08 0.32±0.05 0.29±0.06 0.32±0.09 0.30±0.07 0.30±0.05 p-ERK1/2 0.08±0.02 0.20±0.04*0.19±0.05*0.11±0.06#&0.10±0.05#&0.12±0.04#&STAT3 0.36±0.06 0.34±0.05 0.35±0.07 0.34±0.06 0.36±0.07 0.35±0.09 p-STAT3 0.07±0.03 0.26±0.04*0.27±0.07*0.18±0.03#&0.18±0.04#&0.17±0.03#&
2.5 各组ERK1/2、STAT3 mRNA 表达水平比较
与空白对照组比较,其余各组ERK1/2、STAT3 mRNA 表达差异无统计学意义(P>0.05)。 详见表5。
表5 各组ERK1/2、STAT3 mRNA 表达水平(±s,n=5)
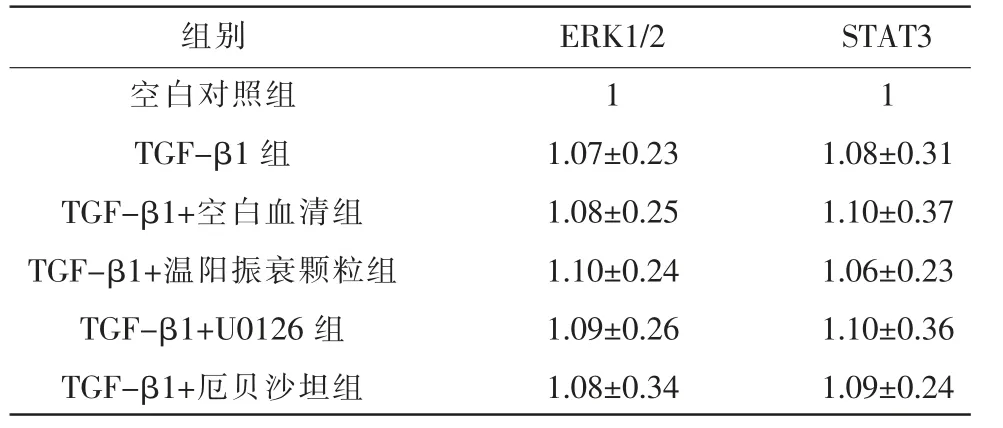
表5 各组ERK1/2、STAT3 mRNA 表达水平(±s,n=5)
组别空白对照组TGF-β1 组TGF-β1+空白血清组TGF-β1+温阳振衰颗粒组TGF-β1+U0126 组TGF-β1+厄贝沙坦组ERK1/2 1 1.07±0.23 1.08±0.25 1.10±0.24 1.09±0.26 1.08±0.34 STAT3 1 1.08±0.31 1.10±0.37 1.06±0.23 1.10±0.36 1.09±0.24
3 讨论
肾间质纤维化与肾脏损伤后发生持续炎症反应密切相关。在炎症环境中,肾小管间质细胞被促纤维化细胞因子激活,转化或转分化为肌成纤维细胞。肌成纤维细胞具有活跃的增殖和分泌胶原的能力,也是产生细胞外基质的主要来源。 当肾脏损伤因素不能及时消除时,肌成纤维细胞不断增殖,细胞外基质持续产生和堆积,最终导致肾小管萎缩、微血管退化,形成持久性瘢痕,取代正常的肾组织,最终发展为肾衰竭[9]。肾小管EMT 是肌成纤维细胞的主要来源,是肾间质纤维化形成的重要途径。 TGF-β1是公认的EMT 诱导剂,TGF-β1 结合相关受体活化Smad蛋白,进而调节EMT 相关基因的转录,促进肾间质纤维化的发生[10]。 TGF-β1 诱导的人HK-2 细胞EMT模型是比较广泛、易操作和易观察的细胞模型[11-12]。正常HK-2 细胞形态清楚,呈鹅卵石样,细胞衔接紧密,贴壁良好,少见漂浮细胞。 本实验研究显示TGFβ1 组和TGF-β1+空白血清组细胞形态发生明显改变,呈长梭形或形态多样无规则,细胞排列稀疏,类似成纤维细胞形态,生长缓慢,贴壁差,多见漂浮细胞;TGF-β1+温阳振衰颗粒组细胞大部分仍保持鹅卵石样,贴壁尚可,漂浮细胞明显减少,提示HK-2细胞EMT 模型建模成功,温阳振衰颗粒可有效延缓HK-2 细胞EMT 的形态学变化。
E-cadherin 是黏蛋白家族中的重要成员,属于跨膜细胞-细胞黏附分子,参与黏附连接的形成,以及其他上皮细胞连接。 它能建立和维持上皮细胞的极性,参与跨膜信号转导,具有防止肾纤维化的作用[13]。 Vimentin 主要在内皮细胞等间叶组织中表达,与维持细胞和细胞器形态、促进细胞黏附及移行、信号传导、细胞凋亡及肿瘤浸润转移等有关。 Vimentin被认为是肾小管上皮细胞在向肌成纤维细胞转化过程中的中间产物[14]。 α-SMA 是平滑肌细胞的标志物,并且被认为是肌成纤维细胞的标志物。肌成纤维细胞的数量和α-SMA 的表达与肾间质纤维化的程度和肾病的进展呈正相关。 α-SMA 表达越多,肾功能下降越快,预后越差[15]。 发生EMT 后,肾小管上皮细胞将出现E-cadherin 表达缺失,获得间质细胞如α-SMA、Vimentin 的特征,并增强细胞迁移和侵袭能力[16]。 因此,E-cadherin、Vimentin、α-SMA 可作为肾小管发生EMT 的标志物。本实验研究显示TGFβ1 组和TGF-β1+空白血清组细胞中E-cadherin 蛋白和mRNA 表达下调,Vimentin、α-SMA 蛋白和mRNA 表达上调;TGF-β1+温阳振衰颗粒组细胞中Ecadherin 蛋白和mRNA 表达上调,Vimentin、α-SMA蛋白和mRNA 表达下调,提示温阳振衰颗粒能增加E-cadherin 和降低Vimentin、α-SMA,从而延缓HK-2 细胞EMT。
ERK1/2 是MAPK 家族的重要成员之一,常存在于胞质中,可由多种细胞外刺激物,如生长因子、细胞因子和G 蛋白偶联受体等激活,活化后迅速进入细胞核内,进一步激活C-Jun、NF-κB、C-Fos 和CREB 等转录因子,影响某些基因的转录和表达,发挥生物学效应。 ERK 信号通路是多种促增殖信号转导途径的共同通路。目前,研究表明TGF-β1 通过活化ERK 信号通路介导肾小管EMT,增加ECM 的分泌,抑制ECM 的降解,促进肾纤维化[17]。 例如,在小鼠肾系膜细胞中,TGF-β1 诱导的CTGF 过表达可被ERK1/2 抑制剂PD98059 部分抑制,从而发挥抗肾脏纤维化作用;抑制ERK 的活化可降低α-SMA 和Collagen Ⅲ的表达,改善肾脏纤维化;在肾小管上皮细胞中,TGF-β1 诱导的EMT 被Erbin 通过ERK 依赖途径抑制,证实了ERK 信号通路的激活与EMT密切相关[18-19]。 STAT3 是位于ERK 级联反应下游的一类重要的调控元件,ERK 能特异性磷酸化STAT3 上的727 位色氨酸(serine 727, Ser727),增强STAT3 的转录活性。现有研究表明STAT3 是对炎症反应发挥重要调控作用的STAT 分子,参与调节细胞呼吸、代谢、自噬等病理生理过程[20]。 更重要的是,STAT3 还在肾脏固有细胞中参与多个肾脏损伤和修复的过程[21-22]。在多种模型肾组织中都可观察到STAT3 途径活化,例如糖尿病肾病、梗阻性肾病等[23-24]。 有临床学者对糖尿病肾病、IgA 肾病等肾病患者的肾脏进行活检取材检测,也发现STAT3 通路发生了显著的磷酸化[25]。 因此,推测ERK 通过调控下游元件STAT3参与肾小管EMT 的发生和进展。 本实验研究显示TGF-β1 组和TGF-β1+空白血清组细胞中p-ERK1/2、p-STAT3 蛋白表达明显上调;TGF-β1+温阳振衰颗粒组细胞中p-ERK1/2、p-STAT3 蛋白表达下调,提示温阳振衰颗粒能部分抑制ERK1/2 和STAT3的磷酸化,部分阻断ERK/STAT3 信号转导通路的激活,进而延缓HK-2 细胞EMT。
陈新宇教授临床实践三十余年,喜用经方治疗疑难杂症,认为人体以阳气为本,治疗疾病当遵从“阳主阴从”,针对慢性肾衰竭,考虑其病位在肾,可累及其他诸多脏腑,其发病机制主要是肾阳虚损,元气亏损,生化无源,浊毒内蕴,久病则累积其他脏腑而发生变证,但其本质仍是阳虚,所以温阳法是陈教授治疗慢性肾衰竭的基本法则,其研制的温阳振衰颗粒来源于仲景经方,功能扶阳、通阳、固阳,获得了良好的临床疗效。 温阳振衰颗粒基本功效为温阳益气、利水消肿,药物组成主要有红参、干姜、甘草、五味子、附片等。 其中,红参为人参蒸制后晒干,味甘、性温,既有人参补气添精之用,又添回阳扶正之功。干姜、附片均有回阳救逆之效,一守中焦,培补脾胃阳气,一固下元,暖肾阳,温经络。 二者与甘草相合,恰有四逆汤之意,扶周身元气,固护根本。 此外,组方需考虑阴阳调和,故有五味子,酸收内敛、固护五脏精气,同时下滋肾阴。 以上各中药各司其职、相互配合,另有甘草从中斡旋,温补一身阳气、调和阴阳,可达补元阳、通经络、消水肿、活瘀血之功。本实验结果显示,温阳振衰颗粒能有效延缓HK-2 细胞EMT的形态学变化,能升高E-cadherin,降低Vimentin、α-SMA,部分抑制ERK1/2 和STAT3 的磷酸化。 据此推测,温阳振衰颗粒可能通过下调ERK1/2 和STAT3蛋白的磷酸化,从而部分阻断ERK/STAT3 信号转导通路的激活,对肾小管EMT 起到延缓作用。
