葛根醇提工艺优化及醇提物体外降脂研究
2022-11-01董红影庞会娜肖凤琴严铭铭
董红影 庞会娜 肖凤琴 邵 帅 严铭铭
高脂血症主要是由于脂质代谢异常所引起。在机体内脂类物质甘油三酯(TG)和总胆固醇(TC)偏高则会导致高血脂症[1]。目前的降血脂药物通过与胆固醇结合为胆酸盐排出体外,起到降血脂作用[2]。
葛根为豆科植物野葛[Puerarialobata(Willd.)Ohwi]的干燥根,含有黄酮类、三萜类、生物碱类等多种化合物[3],其中葛根黄酮是其主要有效活性成分之一[4]。研究[5-6]表明,黄酮类化合物能够清除人类血液中的胆固醇与脂肪。目前黄酮类化合物的制备方法较多,包括水提法、有机溶剂萃取法、酸碱水解法等[7],而乙醇提取法可克服水提物易霉变、其他有机溶剂毒性大等缺点,提取率高,后续的干燥及过滤等操作也比较容易进行,且有关葛根醇提物的降脂活性尚未见报道。
研究拟以胆固醇、油脂吸附量及胆酸盐结合量为评价指标优化葛根醇提工艺,并用棕榈酸诱导HepG2细胞构建脂肪肝细胞模型进一步验证,探究葛根醇提物体外降脂功效,以期为其进一步体内研究提供依据。
1 材料与方法
1.1 材料与试剂
葛根药材:长春市某药房;
无水乙醇:分析纯,无锡市晶科化工有限公司;
DMEM高糖培养基(含双抗):美国Gibco公司;
油红O染色液:上海源叶生物科技有限公司;
棕榈酸(PA):美国Solarbio公司;
总胆固醇(TC)试剂盒以及甘油三酯(TG)检测试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
紫外分光光度计:UV-1700型,日本岛津(中国)有限公司;
恒温水浴锅:HH-6数显型,金坛市佳美仪器有限公司;
离心机:Sigma微型,德国Sigma公司;
电子天平:ME204E型,梅特勒—托利多仪器(上海)有限公司;
酶标仪:Bio-red 550型,上海领成生物科技有限公司。
1.3 试验方法
1.3.1 体外降脂指标测定
(1) 油脂吸附作用:根据文献[8]。按式(1)计算葛根醇提物结合油脂量。
(1)
式中:
OA——油脂吸附量,g/g;
W1——称取葛根醇提物质量,g;
W2——葛根醇提物吸油后质量,g。
(2) 胆固醇吸附作用:
① 胆固醇吸附标准曲线绘制:根据文献[9]并修改。按0.05的梯度分别精确吸取0.1 mg/mL胆固醇标准工作液(0.00~0.40 mL)于比色管中,加入冰醋酸至0.40 mL,然后向各管中依次加入0.2 mL邻苯二甲醛(1 mg/mL)试剂及4.0 mL混合酸(V浓硫酸∶V冰醋酸=1∶1),混匀后37 ℃水浴10 min,于550 nm处测定各管的吸光度值,重复3次,将平均值进行线性回归,以胆固醇质量浓度为横坐标,吸光值为纵坐标,绘制标准曲线。
② 胆固醇吸附作用测定:根据文献[10]并修改。取50 mL 10 mg/mL样品与100 mL 1 mg/mL胆固醇溶液混合,pH值调至7,80 r/min、37 ℃恒温振荡2 h,取0.4 mL 待测溶液加入0.2 mL邻苯二甲醛溶液和混酸4 mL,37 ℃水浴10 min,在4 000 r/min离心20 min,取上清液于550 nm处测定其吸光度。按式(2)计算胆固醇吸附率。
(2)
式中:
CA——胆固醇吸附率,%;
C1——胆固醇加入量,mg/g;
C2——胆固醇剩余量,mg/g。
(3) 胆酸盐结合能力:
① 绘制胆酸盐标准曲线:根据文献[11]并修改。配制甘氨胆酸钠与牛磺胆酸钠标准溶液0.12 mmol/L(pH 6.3的磷酸缓冲溶液),取7个10 mL的具塞试管,分别加入0.0,0.1,0.5,1.0,1.5,2.0,2.5 mL上述标准液,加入磷酸缓冲液补充至2.5 mL,再加入7.5 mL 60% H2SO4,70 ℃水浴20 min,冰浴5 min,在387 nm处测定吸光度。分别以甘氨胆酸钠和牛磺胆酸钠浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
② 胆酸盐结合试验:根据文献[12]。分别按(3)和式(4) 计算剩余甘胺胆酸钠和牛磺胆酸钠含量。
(3)
式中:
SG——甘胺胆酸钠吸附率,%;
c0——加入甘胺胆酸钠的量,mmol;
c1——剩余甘胺胆酸钠的量,mmol。
(4)
式中:
ST——牛磺胆酸钠吸附率,%;
c2——加入牛磺胆酸钠的量,mmol;
c3——剩余牛磺胆酸钠的量,mmol。
1.3.2 葛根醇提物的提取工艺 将葛根饮片粉碎,过100目筛,称取干燥粉末,乙醇回流提取,合并滤液,浓缩,得葛根醇提物浸膏,将所得提取物干燥,粉碎,过200目筛,备用。
1.3.3 单因素试验
(1) 提取时间对体外降脂活性影响:固定乙醇体积分数为70%,提取次数为3次,考察提取时间(0.5,1.0,1.5,2.0 h)对体外降脂指标的影响。
(2) 提取次数对体外降脂活性影响:固定乙醇体积分数为70%,提取时间为1 h,考察提取次数(1,2,3,4次)对体外降脂指标的影响。
(3) 乙醇体积分数对体外降脂活性影响:固定提取次数3次,提取时间为1 h,考察乙醇体积分数(30%,50%,70%,90%)对体外降脂指标的影响。
1.3.4 Box-Behnken响应面法优化提取工艺 根据单因素试验的结果,分别选择提取时间、提取次数和乙醇体积分数为自变量,以多个降脂指标作为响应值,采用多指标综合评分法优化葛根的醇提工艺。
综合评分:为使试验结果全面反映葛根醇提工艺,研究赋予4种降脂指标权重均为0.25,根据式(5)计算综合评分。
W=(OA×0.25+CA×0.25+SG×0.25+ST×0.25)×100%,
(5)
式中:
W——综合评分,%;
OA——油脂吸附量,g/g;
CA——胆固醇吸附率,%;
SG——甘胺胆酸钠吸附率,%;
ST——牛磺胆酸钠吸附率,%。
1.3.5 葛根醇提物棕榈酸诱导的人肝癌细胞(HepG2)脂肪肝模型影响
(1) 细胞培养:用DMEM高糖(10%胎牛血清,1%青霉素与链霉素双抗)培养基培养HepG2细胞,置于含5% CO2,37 ℃的细胞培养箱生长,待细胞处于对数生长期时进行传代试验[13]。
(2) 细胞毒性测定:采用MTT法对葛根醇提物(AL)和棕榈酸(PA)进行细胞毒性试验。通过细胞计数使96孔板中每孔细胞密度为1.5×104个/100 μL,放入37 ℃,5% CO2培养箱中培养。利用显微镜观察,待细胞长满96孔板板底后,加入不同浓度的药物,PA以50的梯度设置(50~550 μmol/L)共11个浓度,AL设置0.5,1.0,10,20,50,80,100,200,500,800,1 000 μg/mL共11个浓度,继续培养20 h后,加5 mg/mL MTT溶液20 μL 后继续培养4 h,吸去溶液后加入150 μL二甲基亚砜,充分反应10 min,使用酶联免疫检测仪在490 nm处测量各孔的吸光值。按式(6)计算细胞存活率。
(6)
式中:
CV——细胞存活率,%;
A0——调零组吸光度;
A1——空白组吸光度;
A2——样品组吸光度。
(3) 细胞内TC、TG水平测定:通过细胞计数调整细胞密度大约为1.5×105个/mL,待细胞80%融合后加药,共设5个试验组,每个试验组设置3个复孔。空白组加DMEM完全培养基,PA组加200 μmol/L PA,3个药物组分别加质量浓度为100,200,300 μg/mL的AL,继续培养24 h。细胞培养24 h后,参照文献[14]方法制备细胞匀浆上清,将其按照检测试剂盒的说明检测细胞中TC和TG含量。
(4) HepG2细胞油红O染色:根据文献[15]并修改。将HepG2细胞均匀接种在6孔板上,在恒温培养箱培养至细胞贴壁,吸去上清液,并用PBS洗涤孔板2次,加入ORO Fixative固定液固定30 min,弃去固定液,用蒸馏水洗涤2次,加入60%异丙醇浸洗5 min,弃去异丙醇后加入新配置好的ORO Stain,浸染10~20 min,弃去染色液,水洗2~5次,直到无多余染液,加入Mayer苏木素染色液,复染1~2 min,弃去染色液后水洗2~5次,加入ORO Bufffer 1 min,弃去,加入蒸馏水覆盖细胞并在显微镜下观察。
1.4 数据处理
使用SPSS 21.0软件对试验数据进行统计学分析,试验图表均采用Origin 2019软件进行绘制,响应面试验使用Design-Expert.V8.0.6.1进行试验设计和数据分析,每组试验均重复3次,试验结果以平均值±标准差表示。
2 结果与分析
2.1 单因素试验结果
由图1和图2可知,随提取时间、提取次数增加,降脂活性先增加后减小,可能由于长时间的提取破坏了葛根中异黄酮类物质转化[16];当提取时间为1 h、提取次数为3次时降脂活性指标均达最高值;因此,最佳提取时间应选择1 h,最佳提取次数应选择3次。由图3可知,当乙醇体积分数达70%时降脂活性最强,可能由于此时溶液极性与葛根中活性物质极性相似[17];因此,最佳乙醇体积分数选取70%。
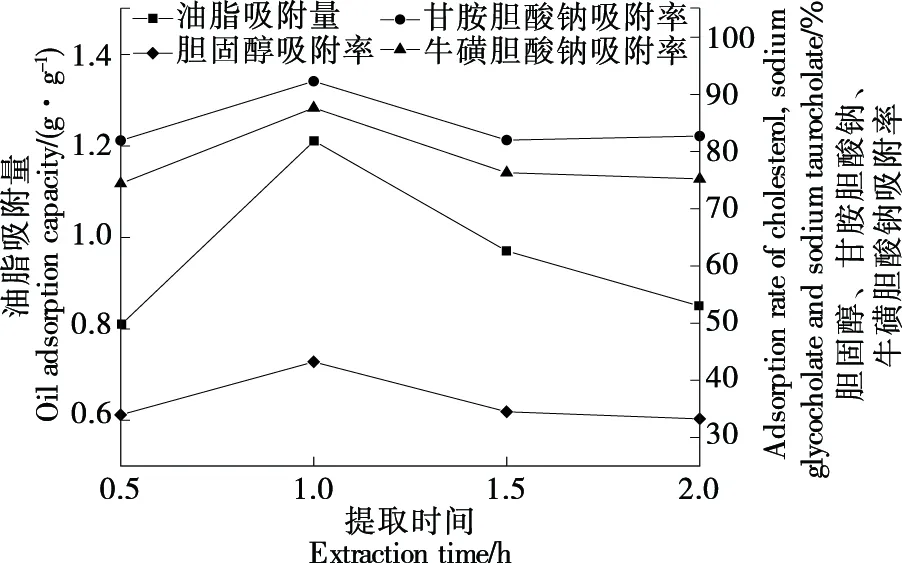
图1 提取时间对降脂活性影响Figure 1 Effects of extraction time on lipid-lowering activity

图2 提取次数对降脂活性的影响Figure 2 Effects of extraction times on lipid-lowering activity
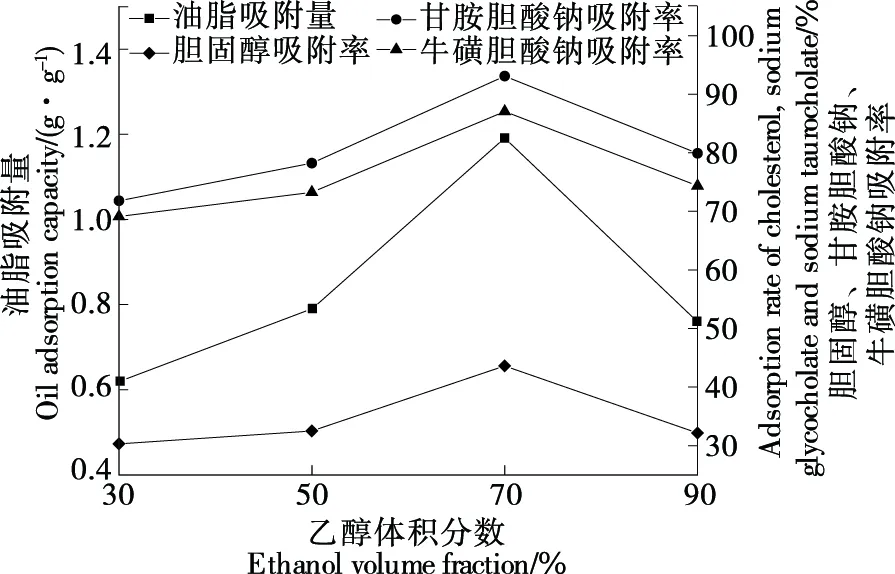
图3 乙醇体积分数对降脂活性的影响Figure 3 Effects of ethanol volume fraction on lipid-lowering activity
2.2 响应面分析结果
2.2.1 Box-Behnken响应面法优化结果 根据单因素试验结果,以油脂吸附量、胆固醇吸附率、甘胺胆酸钠吸附率及牛磺胆酸钠吸附率的综合评分为评价指标,对提取时间、提取次数、乙醇体积分数3个因素进行三因素三水平响应面优化设计。试验因素水平取值见表1,试验设计与结果见表2。
2.2.2 回归模型的建立与数据分析 应用Design-Expert.V8.0.6.1软件对表2中17个试验点的响应值进行多元回归拟合,得到二次回归方程:
Y=97.91+2.39A+1.76B-0.60C-0.28AB-1.40AC+1.95BC-9.80A2-6.99B2-13.87C2。
(7)
由表3可知,模型P<0.000 1,表明模型极显著,说明二次回归模型的选用有意义;失拟项P>0.05,表明失拟不显著,即模型与试验的差异较小,可以说明其他因素对试验结果的干扰较小;模型的相关系数R2=0.989 6,说明该回归方程的拟合程度较高,可用于葛根醇提物工艺的优化与分析。通过P值可以看出,A、A2、B2、C2差异极显著,B、BC差异显著。通过方差分析表可知影响综合评分的主次因素顺序为提取时间>提取次数>乙醇体积分数。
2.2.3 响应面分析 通过Design-Expert.V8.0.6.1软件得到提取时间、提取次数、乙醇体积分数的交互作用对葛根醇提物工艺综合评分影响的3D响应面图和等高线图,试验结果见图4。3D图倾斜度越大,等高线的形状越扁平说明二者交互作用越强[18],由图4可以看出,AB交互作用不显著,AC、BC交互作用较显著,与上述方差分析表结论一致。
2.2.4 工艺优选及验证 通过对回归模型方程求解,得出葛根最佳醇提工艺为提取时间1.06 h,提取次数3.13次,乙醇体积分数72.10%,在此条件下综合评分预计为98.28%。为了便于试验,将提取工艺参数进行调整:提取时间1 h,提取次数3次,乙醇体积分数70%。
为了进一步验证所选工艺为最优且稳定性良好,重复进行3组验证实验,结果见表4。由表4可知,各指标效果较好且RSD值均较小,综合评分较预测值高,说明响应面法优化后的工艺为最佳提取工艺,且工艺稳定性较好。
2.3 葛根醇提物体外降脂细胞试验
2.3.1 PA及AL对细胞的毒性测定 如图5所示,用0~550 μmol/L PA处理细胞24 h,MTT结果显示,当PA浓度达到200 μmol/L时,细胞出现明显的损伤,存活率明显下降,故在建立脂肪堆积模型时,选用100 μmol/L的PA诱导细胞并培养24 h。
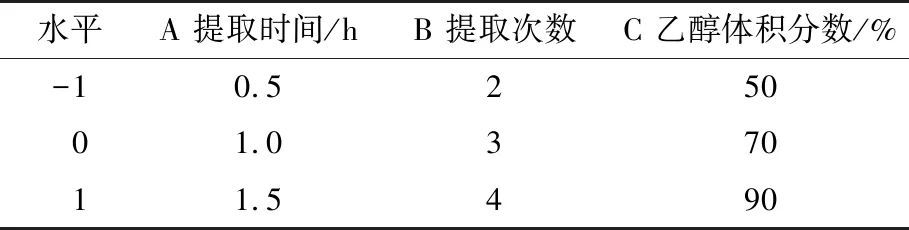
表1 Box-Behnken响应面试验因素水平表Table 1 Box-Behnken response surface test factor level table
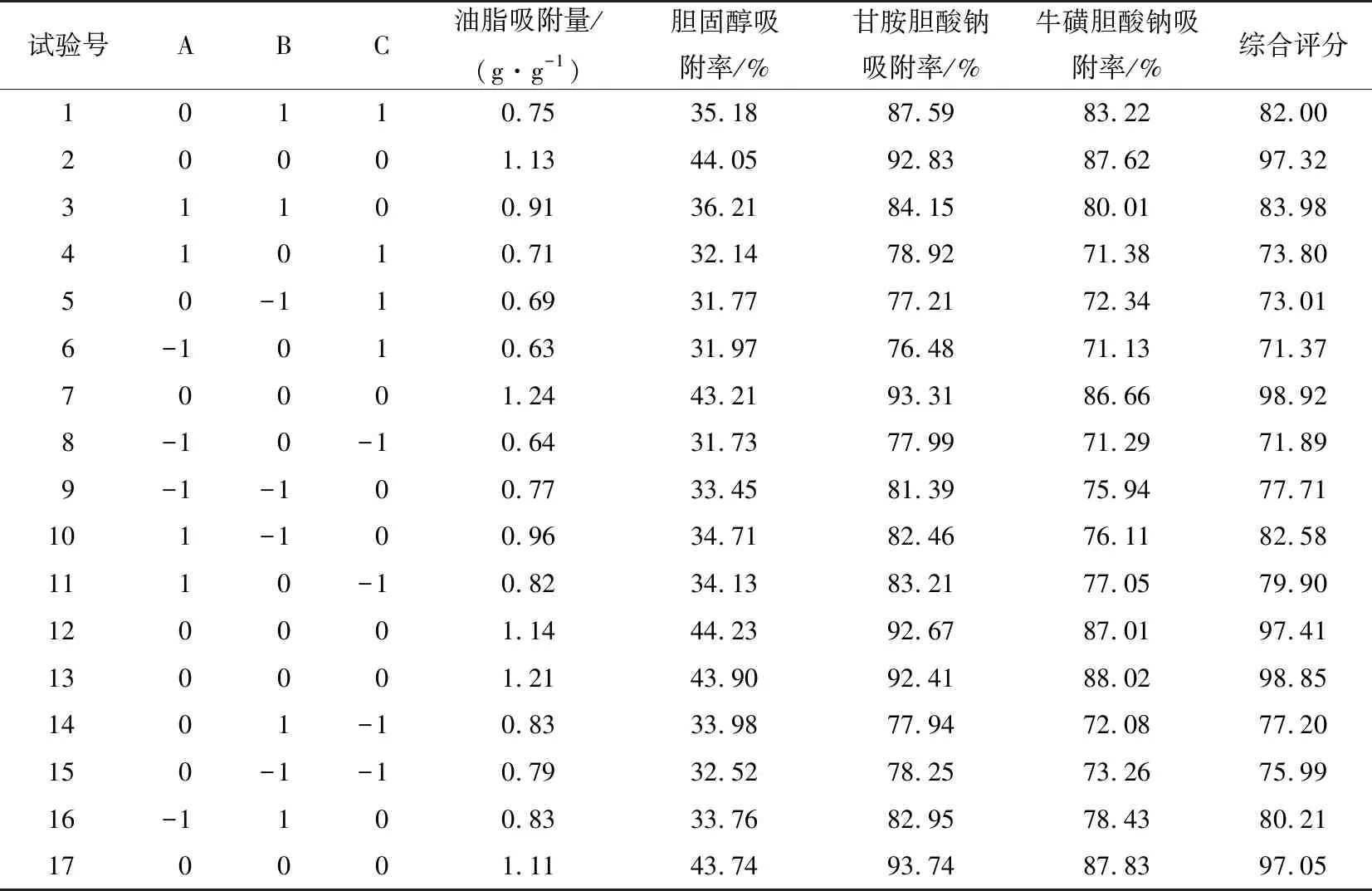
表2 响应面试验设计与结果Table 2 Response surface test design and results
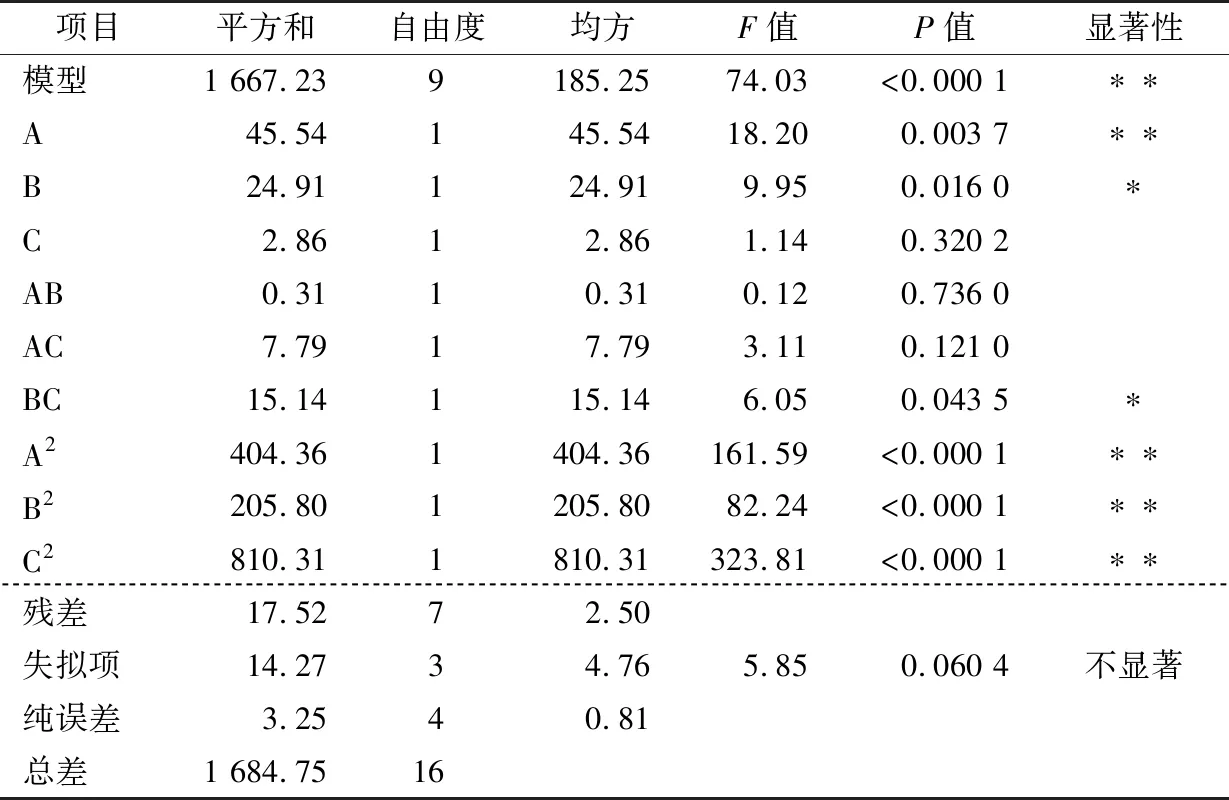
表3 响应面二次回归方程模型方差分析结果†Table 3 Response surface quadratic regression equation model variance analysis results

图4 响应面分析图Figure 4 Response surface analysis diagram
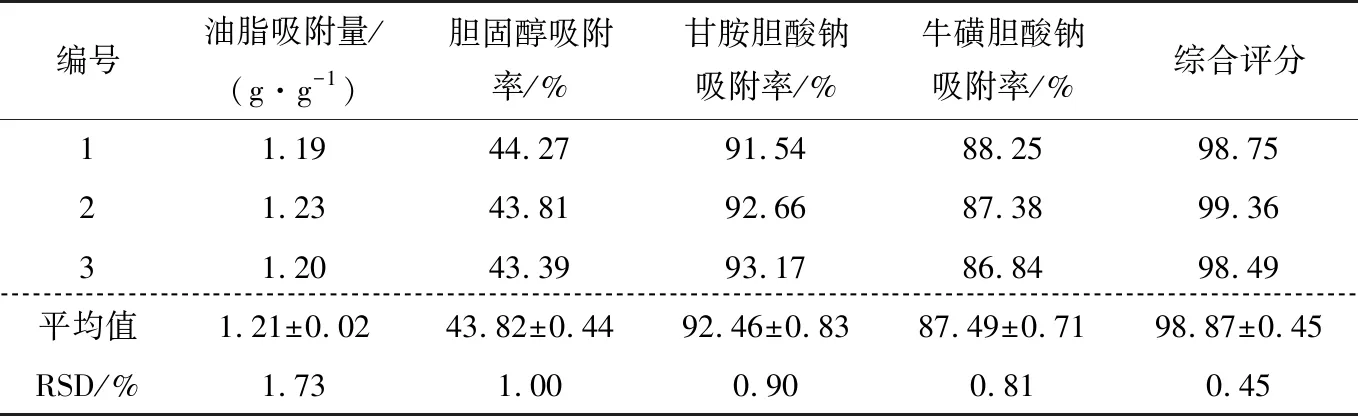
表4 提取工艺验证实验结果Table 4 Extraction process validation test results
如图6所示,用0~1 000 μg/mL AL处理细胞24 h,MTT结果显示,在0~500 μg/mL浓度范围内的AL对细胞生长无显著影响,当样品质量浓度达到800 μg/mL时,表现出明显的细胞毒性,细胞活力降至69.91%,故在给药时,选取的样品最高质量浓度为500 μg/mL。
2.3.2 葛根醇提物对棕榈酸诱导HepG2细胞内TG、TC含量的影响 PA能够诱导胞内的TC含量提升,胆固醇代谢和脂质代谢的关系密不可分,Fungwe等[19-20]研究发现摄入胆固醇的同时TG含量也会随之升高,胆固醇还可以通过抑制脂肪酸的氧化分解从而增加TG水平。由图7可知,PA处理HepG2细胞后,使得细胞内TG、TC含量明显升高,在给予AL干预后能够降低细胞内TG、TC含量,且呈剂量依赖,AL高剂量组TG和TC含量分别降至1.24,0.89 mmol/L,几乎与空白组的含量持平。说明AL可能是通过胆固醇代谢进而影响脂质代谢,降低TG和TC的含量,进一步验证了葛根醇提物有较好的体外降脂活性。
2.3.3 HepG2细胞油红O染色 如图8所示,未经PA处理的空白对照组的细胞形态正常,细胞轮廓清晰可见,未见明显脂滴聚集。经过24 h PA处理后的细胞,黄色脂滴量明显增加,而与PA组相比,AL和PA共同作用组随着AL浓度的增加其细胞内脂滴量逐渐减少,细胞周围脂质积累也有所降低。由此表明,AL可抑制HepG2细胞周围脂滴聚集。
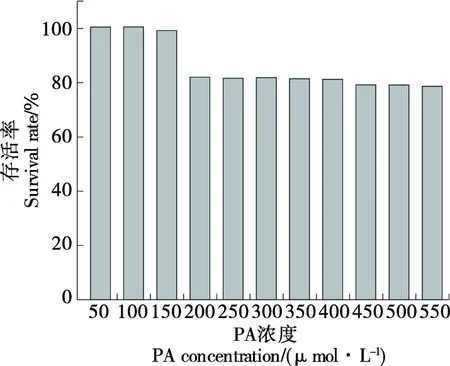
图5 PA对HepG2细胞活力影响Figure 5 Effects of PA on the viability of HepG2 cells
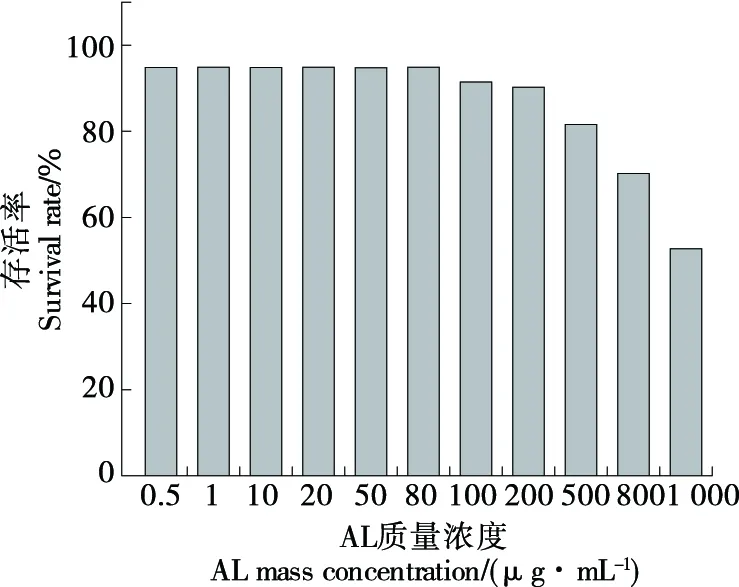
图6 AL对HepG2细胞活力影响Figure 6 Effects of AL on the viability of HepG2 cells

图7 HepG2细胞内TC、TG含量Figure 7 Contents of TC and TG in HepG2 cells

图8 对HepG2细胞脂质积累的影响Figure 8 Effects of lipid accumulation in hepatoma cells
3 结论
以油脂吸附量、胆固醇及胆酸盐吸附率进行综合评分,在前期单因素试验的基础上,确定试验水平后通过响应面法并结合回归模型方程,得出葛根醇提物最佳提取工艺为提取时间1 h,提取次数3次,乙醇体积分数70%。随后测定了棕榈酸诱导的人肝癌细胞细胞内甘油三酯、总胆固醇含量并对其进行油红O染色,结果显示,人肝癌细胞中的甘油三酯、总胆固醇含量明显下降及胞内脂滴聚集逐渐减少,葛根醇提物体外降脂作用较好。
