游离SO2、溶解氧浓度对葡萄酒颜色及花色苷含量的影响
2022-11-01杨兴元艾赛提阿合旦李泽涵李函伦
彭 昕 杨兴元 艾赛提·阿合旦 杨 凡 李泽涵 李函伦
葡萄酒是营养价值很高的酒精饮料[1],特别是红葡萄酒,含有丰富的酚类物质,有很强的抗氧化性,能有效清除体内的活性氧自由基,有预防心血管疾病、抗菌、抗病毒、抗癌等功效[2-4]。
葡萄酒适度接触氧气有利于其酒质的提升,但过量的氧又会导致其风味物质减少,颜色不稳定,口感变差[5-6]。Maurizio等[7]研究发现经过连续2个月的微氧处理(2 mL/L)后,可保持葡萄酒的总酚和总花色苷的含量,而对于颜色稳定性尚缺乏研究。中国的酿酒工程师会兼顾游离SO2含量来进行葡萄酒陈酿管理,但关于游离SO2对葡萄酒颜色稳定性的研究仍十分缺乏。
由于SO2具有强还原性,因此氧化脱色的能力也随之而来[8]。同时氧的存在会促进游离花色素苷与其他酚类物质结合,形成性质更稳定、呈色强度更高的物质[9]。研究拟考察不同浓度的游离SO2、溶解氧(DO)含量对葡萄酒色度、色调、总花色苷含量的影响,以期为企业改进赤霞珠干红葡萄酒的陈酿工艺提供基础试验数据。
1 材料与方法
1.1 材料与试剂
2019年份赤霞珠干红葡萄酒(A)、2015年份赤霞珠干红葡萄酒(B):陈酿于100 t不锈钢大罐(高10 m,直径3.6 m),新疆维吾尔自治区鄯善县新葡王酒庄;
2020年份赤霞珠干红葡萄酒(C):陈酿于0.25 t不锈钢发酵罐(直径0.6 m 高0.9 m),新疆维吾尔自治区鄯善县新葡王酒庄;
氢氧化钠、无水碳酸钠、磷酸、过氧化氢溶液:分析纯,天津市致远化学试剂有限公司;
硫代硫酸钠、淀粉:分析纯,天津市鑫铂特化工有限公司。
1.2 仪器与设备
紫外分光光度计:TU-1900型,北京普析通用仪器责任有限公司;
电子天平:JJ200型,常熟市双杰测试仪器厂;
多功能葡萄酒分析仪:Foss WineScan型,福斯华(北京)科贸有限公司;
充氧仪:SDSCY10微型,济南金君电子科技有限公司。
1.3 方法
1.3.1 游离SO2溶液处理 将样品C混匀后,分装于5 L储酒罐,分别按游离SO2质量浓度为15,20,25,30,35,40,45 mg/L的量加入偏重亚硫酸钾,所得样品依次编号为C1、C2、C3、C4、C5、C6、C7。以未作处理的样品为对照(CK)。各样品置于20 ℃控温箱中贮存备用。
1.3.2 溶解氧处理 将样品C混匀后,分装于5 L储酒罐,分别按1,2,3,4 mg/(L·30 d)的充氧量微氧处理90 d,所得样品依次编号为DC1、DC2、DC3、DC4以未进行充氧处理的样品为对照(DCK)。
1.3.3 总花色苷的测定 采用pH示差法[10]。取待测样品0.2 mL分别用pH 4.5 (0.2 mol/L NaCO3缓冲液)和pH 1.0 (0.2 mol/L KCl缓冲液)稀释,静置100 min,在510 nm和700 nm处测定两种样品的吸光度。根据式(1)计算样品总花色苷含量。
ρ=(ΔApH 1.0-ΔApH 4.5)×449.2×10×100/26 900,
(1)
式中:
ρ——样品总花色苷的质量浓度,mg/L;
ΔApH 1.0——样品处于pH 1.0缓冲溶液时分别在510 nm和700 nm处的吸光值之差;
ΔApH 4.5——样品处于pH 4.5缓冲溶液时分别在510 nm和700 nm处的吸光值之差;
449.2——矢车菊素-3-O-葡萄糖苷的摩尔质量,g/mol;
10——稀释倍数;
26 900——矢车菊素-3-O-葡萄糖苷的摩尔消光系数,L/(mol·cm)。
100 t罐中不同液位总花色苷含量的变化检测:以导管和500 mL注射器,通过抽空气法在不同液位采取3个点位的样品,每4个月进行1次检测分析其总花色苷含量。
1.3.4 色度及色调的计算 样品静止24 h后,经0.45 μm 孔径的滤纸过滤,以水做空白对比(测定前经0.45 μm孔径的滤纸过滤),用pH 3的磷酸氢二钠—柠檬酸缓冲液稀释10倍,装入比色杯中使用分光光度计分别在420 nm和520 nm处比色。
色度:将稀释样品倒入1 cm比色皿中,在420,520,620 nm下分别测定其吸光值,三者之和即为该样品的色度。色调:420 nm与520 nm吸光值之比。
1.3.5 总多酚含量的测定
(1) 没食子酸对照品溶液的制备:精密称取没食子酸0.01 g于100 mL容量瓶中,用蒸馏水定容,即为0.1 mg/mL 的没食子酸对照品溶液备用。
(2) 没食子酸标准曲线的绘制:精密吸取1.0,2.0,3.0,4.0,5.0 mL 没食子酸对照品溶液,用蒸馏水定容至10 mL。从各溶液中吸取1 mL于10 mL量瓶内,加5 mL 蒸馏水,摇匀,加入福林酚试剂0.5 mL,充分摇匀,加10%碳酸钠溶液1.5 mL,混匀,加水定容,混匀后于30 ℃下避光反应2 h,于765 nm处测得吸光度。其标准曲线如图1所示。
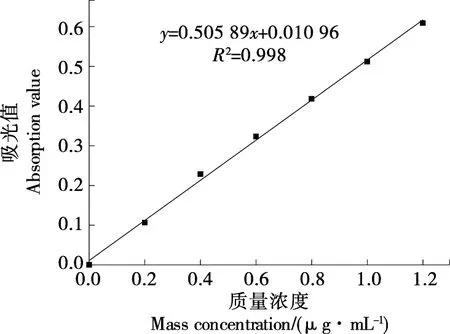
图1 没食子酸标准曲线Figure 1 The standard curve of gallic acid
(3) 葡萄酒溶液总酚的测定:每个深度酒样各取1 mL,用蒸馏水补充至10 mL。从各溶液中吸取1 mL于10 mL量瓶内,加5 mL蒸馏水,摇匀,加入福林酚试剂0.5 mL,充分摇匀,加10%碳酸钠溶液1.5 mL,混匀,加水定容,混匀后于30 ℃下避光反应2 h,于765 nm处测得吸光度并代入回归方程计算含量。
1.3.6 颜色分析 在试验过程中,记录各阶段葡萄酒颜色的变化。
1.3.7 葡萄酒基础理化分析 SO2含量根据《葡萄酒、果酒通用分析方法》(GB/T 15038—2006)规定的方法检测,酒精度、总酸、pH、挥发酸利用葡萄酒全自动分析检测仪进行基础理化的检测。
1.4 统计分析与数据处理
采用SPSS 20.0分析软件对数据进行统计分析;使用Origin 2019b进行作图。
2 结果与分析
2.1 大罐中总花色苷含量的变化
由图2可知,在3次总花色苷含量测量中,随着罐体深度的增加,葡萄酒中花色苷的含量逐渐增加,样品A尤为明显(P<0.01),样品B变化则较为平缓。随着贮藏时间的延长,样品A和样品B的总花色苷含量均有所下降,并且样品A整体总花色苷含量下降的速率高于样品B,分析原因是葡萄酒中花色苷主要以游离、结合以及聚合的状态存在,其中游离态花色苷主要存在于新鲜葡萄酒中,贮藏的前几年便与其他物质结合而消失,结合态及聚合态花色苷受酒龄影响较小[11]。通过在大罐陈酿期间检测到葡萄酒中总花色苷随着陈酿时间变化的规律,并且,Beattie等[12]和Scalzo等[13]发现在葡萄酒贮存过程游离SO2含量较低时通过氧化作用使酒体产生 H2O2,H2O2与亲核物质破坏花色苷的 C2位,使花色苷开环形成查尔酮进而降解。不同浓度的游离SO2以及不同浓度的溶解氧均会对总花色苷含量造成影响,因此,还需进一步研究总花色苷含量的变化与游离SO2以及溶解氧之间的关系。

A1、A2、A3、B1、B2、B3分别为两款葡萄酒在3次测量中花色苷的含量图2 大罐中总花色苷含量的变化Figure 2 Changes of total anthocyanin content
in large tanks
2.2 不同浓度游离SO2处理对葡萄酒品质的影响
2.2.1 葡萄酒颜色 由表1可知,CK、C1、C2、C3和C4都保持着相同明亮的酒红色,说明0~30 mg/L的游离SO2对葡萄酒颜色影响不大。但随着游离SO2浓度的升高,葡萄酒褪色较明显,由酒红色迅速褪色至淡红色。
2.2.2 葡萄酒色度和色调 由表2可知,通过添加不同质量浓度游离SO2使葡萄酒的色度发生不同变化,当游离SO2质量浓度较低(15 mg/L)时,色度变化幅度较小,随着SO2质量浓度的增加,色度值变化逐渐增大,参照CK的色度值变化,C2、C3、C4、C5、C6、C7在30 d内色度值变化明显(P<0.05),随着陈酿时间的增加,各处理组的色度逐渐减小,C1在30~90 d色度值变化与CK差异不显著(P>0.05),说明低浓度游离SO2在30 d后被消耗殆尽。C1、C2、C3、C4、C5、C6、C7陈酿90 d后色度值分别降低0.576,1.347,1.562,1.739,1.847,2.047,2.739。

表1 不同浓度游离SO2处理对葡萄酒颜色的影响Table 1 Effects of different concentration of free SO2 treatment on color change of wine
色调值越低代表酒体越红,数值越高则酒体逐渐显橙色。由表3可知,通过添加不同质量浓度游离SO2使葡萄酒的色调发生不同变化,变化趋势与色度相反,陈酿90 d后,C1、C2、C3、C4、C5、C6、C7色调值分别上升0.067,0.111,0.115,0.129,0.221,0.295,0.492,说明添加质量浓度为15~30 mg/L的游离SO2对葡萄酒的色调值影响不大,但对色度影响较为明显,当游离SO2质量浓度>30 mg/L时会使葡萄的酒颜色逐渐显橙色。
在不同浓度游离SO2对葡萄酒颜色变化的影响研究中,发现当游离SO2在低浓度时,葡萄酒颜色稳定处于明亮的酒红色,色度变化和吸光度变化幅度较小,当游离SO2浓度升高时,花色苷与亚硫酸氢根离子发生缩合反应后使葡萄酒颜色衰退。这与张珍珍等[14]和邓玉杰[15]的研究一致,SO2在质量浓度0~60 mg/L时都保持着相同明亮的酒红色,颜色影响不大,SO2的添加量若减少,杀灭其他杂菌的能力就不足以具备,但随着SO2浓度的升高,褪色较明显,由酒红色缓慢褪色至淡红色。但在实际生产过程中,长时间陈酿的葡萄酒总SO2含量都较高,这也是造成陈酿葡萄酒颜色退变较快的原因之一。
2.2.3 葡萄酒总花色苷含量 由图3可知,在90 d陈酿过程中葡萄酒总花色苷含量呈下降趋势(P<0.05),SO2处理组总花色苷含量变化高于CK,游离SO2质量浓度<25 mg/L,色度变化幅度较小,此时花色苷处于比较稳定的状态。当游离SO2质量浓度>25 mg/L时,样品中的总花色苷变化量逐渐变大。分析原因是SO2在水溶液中形成亚硫酸氢根,对花色苷C2或C4位亲核攻击生成了无色的花色苷亚硫酸盐复合物进而使葡萄酒中总花色苷含量下降,随陈酿时间的延长,总花色苷含量呈下降趋势,并且高浓度游离SO2处理组总花色苷含量变化显著高于低浓度游离SO2处理组的,说明游离SO2对葡萄酒中颜色的影响作用一直存在[16]。综合表1~表3得出,25 mg/L 的游离SO2适合葡萄酒的陈酿。
2.3 大罐陈酿时葡萄酒总酚的变化
Castellari等[17]指出,通过增强缩合和聚合反应,氧溶解也可以影响酚类化合物作为抗氧化剂的能力。缩合产物如单宁—花青素(T-A)和单宁—花青素—单宁(T-A-T)对葡萄酒抗氧化活性的贡献较小,聚合物化合物的抗氧化活性随其分子量的增加而降低。由图4可知,样品A的总酚含量比样品B的高,可能与陈酿时间有关。在罐中,总酚含量随深度的增加而增加,分析原因是随着深度的增加,溶解氧含量降低,同时,游离SO2的含量增加,抗氧化性增强,因此总酚被消耗的量减少。深度较浅的部分,溶解氧含量较大,低剂量的游离SO2抗氧化性薄弱,酚类物质参与氧化还原反应,导致被消耗。
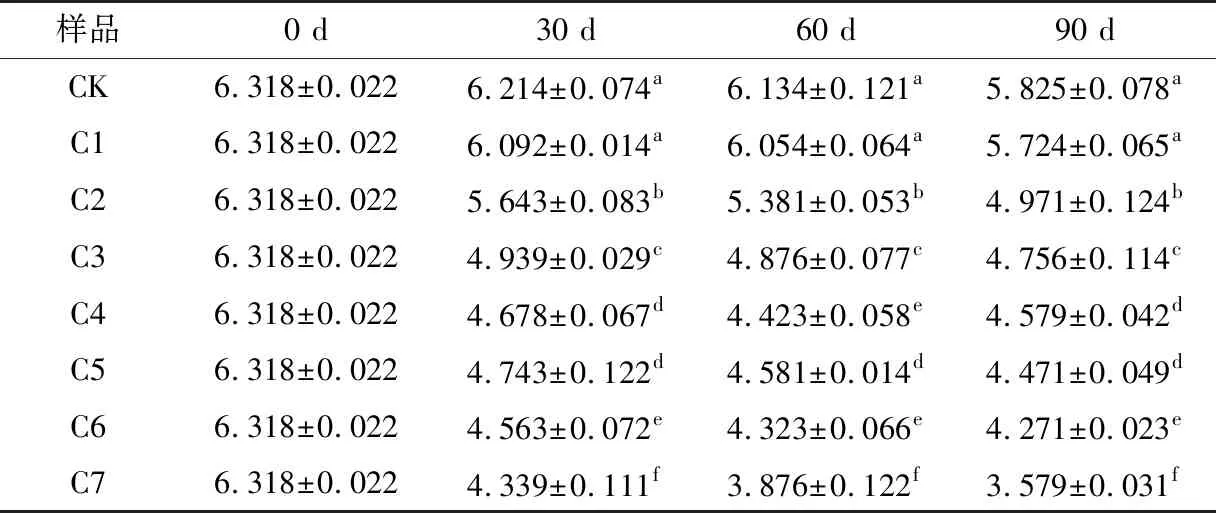
表2 不同浓度游离SO2处理对葡萄酒色度的影响†Table 2 Effects of different concentrations of free SO2 treatment on chromaticity of wine
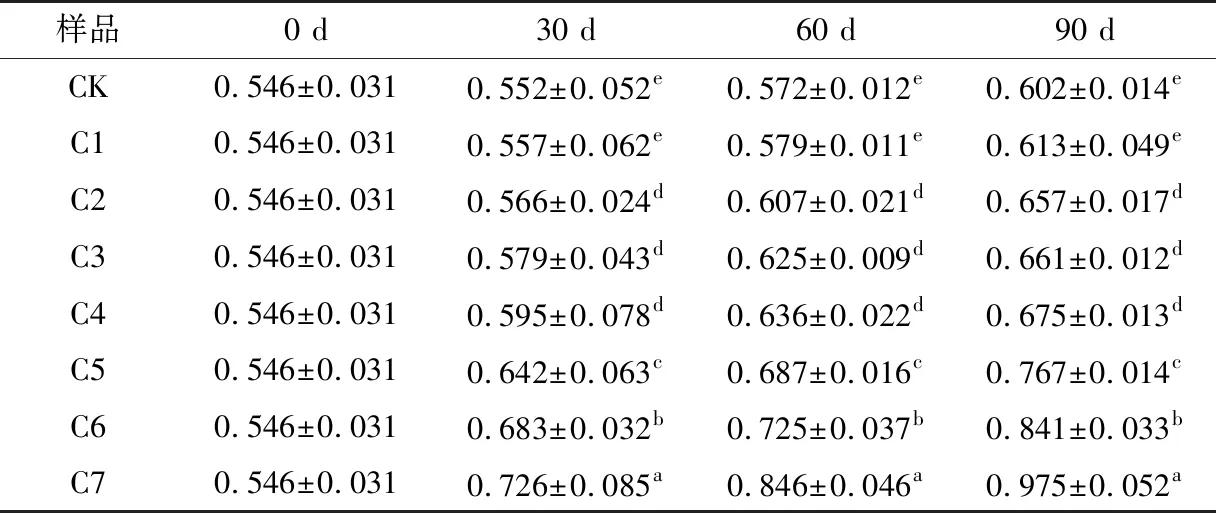
表3 不同浓度游离SO2处理对葡萄酒色调值的影响†Table 3 Effects of different concentrations of free SO2 treatment on wine tones

图3 不同浓度游离SO2处理下总花色苷含量的变化Figure 3 Changes of total anthocyamin content treatment under different concentrations of free SO2
2.4 不同浓度溶解氧对葡萄酒品质的影响
2.4.1 葡萄酒总酚含量 如图5所示,陈酿90 d后DC1、DC2、DC3、DC4的总酚含量均低于DCK,其中DC4的总酚含量下降幅度最大,与Audrey等[16]的试验结果一致,在高浓度的溶解氧影响下,酚类物质被氧化而使之含量下降。
2.4.2 葡萄酒总花色苷含量 由图6可知,在整个陈酿过程中葡萄酒花色苷呈明显下降趋势。经充氧处理后其总花色苷含量均较DCK有所下降,DC1的总花色苷含量下降幅度与DCK差异不大,DC2、DC3、DC4的总花色苷含量均下降明显,其中DC4的总花色苷含量在前30 d下降较快,之后的60 d下降幅度较小。
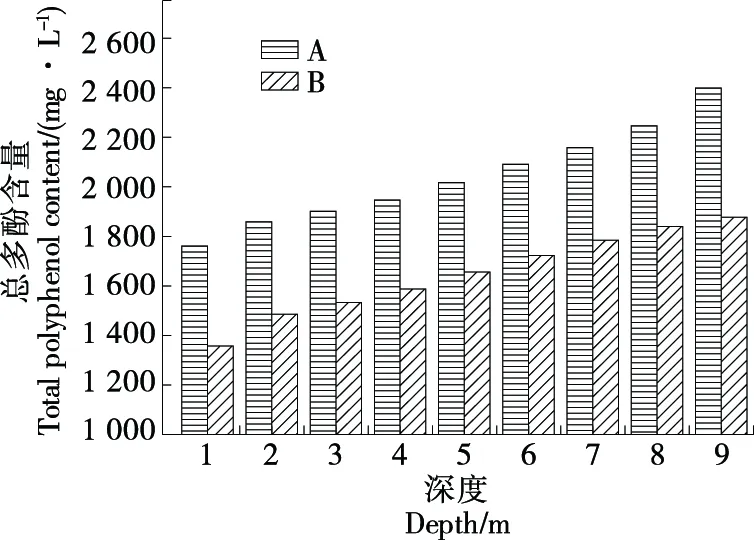
图4 大罐中总酚含量的变化Figure 4 Variation of total phenol content in large tank
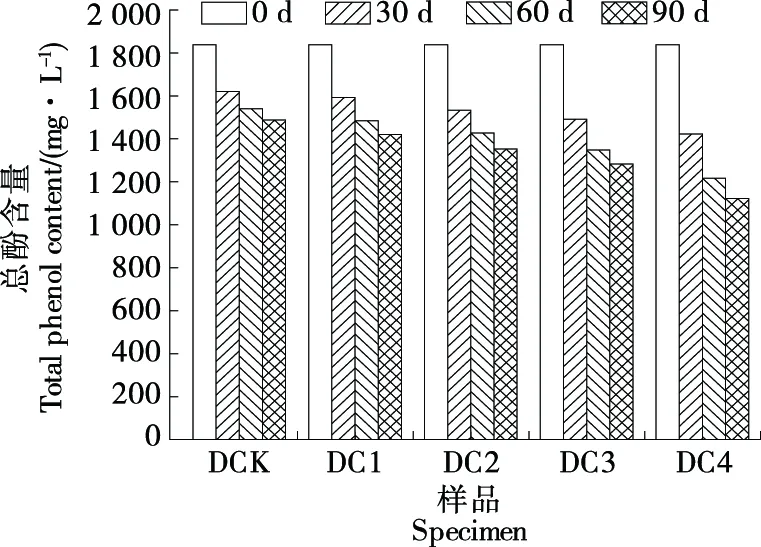
图5 不同浓度溶解氧下葡萄酒总酚含量的变化Figure 5 Changes of total phenol content in wine under different concentrations of dissolved oxygen
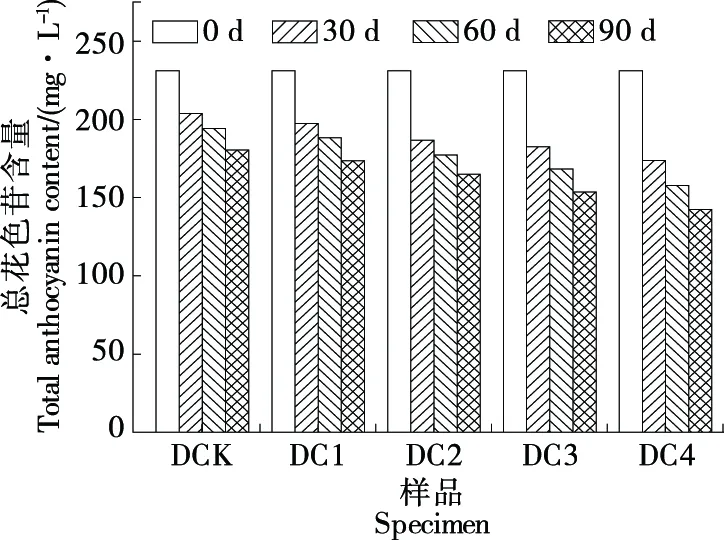
图6 不同浓度溶解氧下葡萄酒总花色苷含量的变化Figure 6 Changes of total anthocyanin content in wine under different concentrations of dissolved oxygen
2.4.3 葡萄酒颜色 由表4可知,DCK、DC1、DC2都保持着相同明亮的酒红色,说明0~2 mg/(L·30 d)的充氧量对葡萄酒颜色影响不大,但随着溶解氧的增多,褪色较明显,由酒红色迅速褪色至淡红色。
2.4.4 葡萄酒色度、色调 由表5可知,陈酿期间各样品的色度值总体呈下降趋势,陈酿90 d后DCK、DC1、DC2、DC3、DC4色度值分别下降0.888,1.486,2.035,2.738,3.559,其中DC4的色度下降最快。分析原因是葡萄酒陈酿过程中酚类物质会相互结合,形成呈色更强且更稳定的化合物,其中适宜的氧会促进该结合反应的进行,而过量的氧会使酚类物质发生氧化,导致葡萄酒在陈酿过程中花色素苷含量下降[18]。
由表6可知,从色调的变化上看,陈酿90 d后DCK、DC1、DC2、DC3、DC4色调值分别上升0.056,0.082,0.111,0.175,0.289。与对照相比,DC1、DC2、DC3、DC4的色度降低,但色调升高。
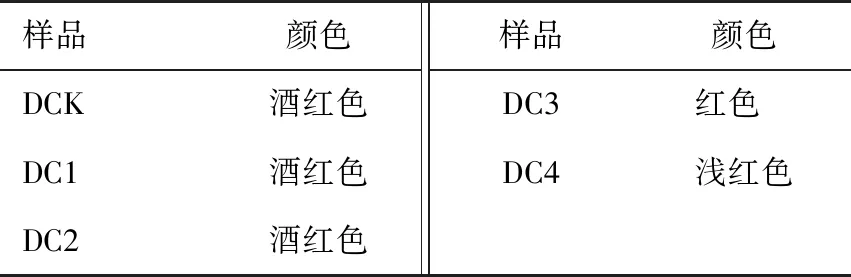
表4 不同浓度溶解氧下葡萄酒颜色的变化Table 4 Effects of different concentrations of dissolved oxygen on color change of wine
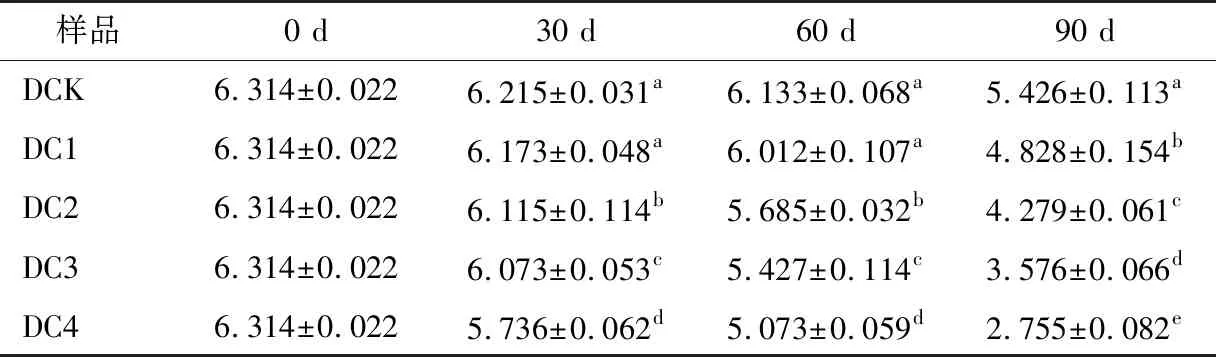
表5 不同浓度溶解氧下葡萄酒色度的变化†Table 5 Changes of wine chromaticity under different concentrations of dissolved oxygen
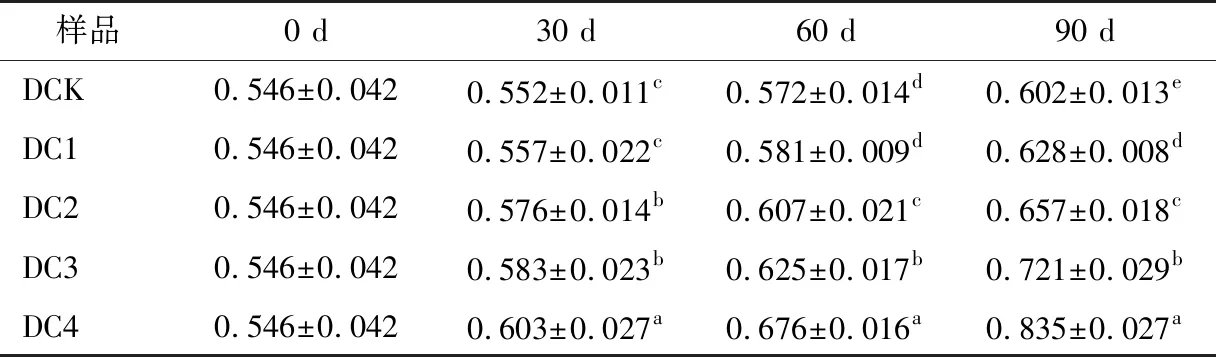
表6 不同浓度溶解氧下葡萄酒色调的变化†Table 6 Changes of wine hue under different concentrations of dissolved oxygen
葡萄酒陈酿30 d内,花色素苷会发生降解反应,由游离态向结合态转变,氧气的加入促进了降解反应,导致花色素苷含量急速下降,使结合态的花色素苷性质趋于稳定[19]。加入适宜浓度的溶解氧会加速葡萄酒颜色的稳定,如DC3,在补充3 mg/(L·30 d)后,色度值与DCK第90天色度值相近,而过量的溶解氧会导致葡萄酒失去应有的感官品质[20]。这与康文怀[21]在实验室条件研究微氧处理后其聚合指数可达到40%左右的结果相似。另外一个原因是乙醇通过氧化作用形成乙醛,乙醛能增强花色素苷与单宁的聚合作用,进而影响总花色苷的含量[22-23]。葡萄酒色调的变化主要是葡萄酒中酚类物质变化所引起,需深入研究葡萄酒中酚类物质变化机理才能更好地理解葡萄酒色调的变化。
3 结论
通过对葡萄酒陈酿期间游离SO2含量的变化规律以及不同浓度游离SO2对葡萄酒颜色的影响进行分析,得出25 mg/L的游离SO2适合葡萄酒的酿造。在不同浓度溶解氧对总酚含量、花色苷含量、色度、色调值变化的影响中,发现在陈酿90 d后充氧量为4 mg/(L·30 d)的处理组的总花色苷含量下降最快、总酚含量下降幅度最大、色度值下降3.559,色调上升0.289。研究未对于其他葡萄品种葡萄酒陈酿进行不同浓度游离SO2及溶解氧添加量的研究,最适宜干红葡萄酒陈酿管理的工艺也有待进一步探索。
