基于高通量测序对绝经后骨质疏松症肾阴虚证中基因差异表达的研究
2022-11-01方莉萍姜丹生林树梁吴俊琪王金华浮苗
方莉萍 姜丹生 林树梁 吴俊琪 王金华 浮苗
金华市中心医院 浙江,金华 321000
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是一种多因素的慢性疾病,主要病因是女性绝经后卵巢功能低下,导致雌激素不足,骨量丢失过快、骨脆性明显升高,其最严重的并发症即骨质疏松性骨折,是全球关注的一个健康问题[1]。临床肾虚常见肾阴虚和肾阳虚,PMOP以肾阴虚证为主[2]。“证”是机体在各种致病因素影响下所发生的综合表现,包括整体体质反应特点及整体与外在环境之间、脏腑经络之间、细胞之间、细胞与体液之间的相互关系[3-4]。研究发现,细胞之间的通讯是通过被膜包裹的小囊泡颗粒(称为外泌体)介导的,它能够与循环途径中周围细胞的细胞膜发生融合,释放其所含的蛋白质、DNA和RNA等,进而激活靶细胞内的信号通路[5]。骨髓中的间充质干细胞(bone mesenchymal stem cells,BMSCs)是骨再生的种子细胞,对维持正常骨代谢功能起到重要作用。BMSCs来源的外泌体在多种生理条件下更稳定,无免疫原性,因此更适合于多种疾病的治疗[6]。
BMSCs外泌体的特性使得它成为目前的研究热点,但其在PMOP肾虚症中的研究甚少。本研究在证候理论指导下,结合基于整体思维的系统生物学方法,探索PMOP肾阴虚证BMSCs外泌体差异基因表达变化,从分子水平寻找临床防治PMOP肾阴虚证的关键基因及基因调控途径,为PMOP肾阴虚证的机制研究提供新的见解。
1 材料和方法
1.1 研究对象 以金华市中心医院关节外科2019年7月至2021年6月收治的股骨头坏死或股骨颈骨折患者为对象。在人工股骨头置换及全髋关节置换手术过程中,从股骨骨髓腔中抽取骨髓和血液,分离培养BMSCs。检测肝肾功能、血尿常规、心电图和B超等,以双能X线骨密度仪检测正位腰椎L1-4和左侧股骨上端骨密度,联合中医辨证,共选择40例患者,其中20例被诊断为PMOP肾阴虚证,20例为骨量正常对照组。纳入标准:(1)骨质疏松诊断参照世界卫生组织PMOP的诊断标准[7],中医证候诊断标准参照文献[8];(2)无服用可能影响骨骼或钙磷代谢的药物史;(3)无影响骨代谢的全身性疾病;(4)无血液系统疾病及骨肿瘤等疾病;(5)所有参与研究的患者均知情同意,并签署知情同意书。排除标准:(1)不符合骨质疏松症诊断及中医肾阴虚证辨证标准者;(2)因类风湿性关节炎、糖尿病、甲状腺功能亢进等继发骨质疏松症者;(3)合并心脑血管严重疾病,合并肝、肾功能检查异常者;(4)最近1个月用过中药治疗骨质疏松症者,或近3个月内行激素替代治疗或使用降钙素者,或近6个月内有连续15 d以双膦酸盐等防治骨质疏松症者。本研究已获得金华市中心医院伦理委员会的伦理批准(2020-255-001)。
1.2 主要试剂和仪器 外泌体RNA分离试剂盒购于加拿大Norgen 有限公司(批号:25700);TUREscript 1st Stand cDNA SYNTHESIS Kit 逆转录试剂盒、SYBR green qPCR mix试剂盒均购于成都丹凤科技有限公司(批号:K1622、K0521)。NanoDrop ND-2000紫外分光光度仪为美国Thermo Scientific有限公司产品;Agilent Bioanalyzer 2100 生物分析仪购于美国Agilent Technologies有限公司。
1.3 BMSCs分离培养及其外泌体提取鉴定 采用全骨髓培养法体外分离培养BMSCs,并鉴定其成脂和成骨分化能力,以流式细胞术检测BMSCs细胞表型。取PMOP组及骨量正常对照组BMSCs第三代细胞培养上清液30 mL,以试剂盒提取外泌体。为了验证外泌体提取的效果,通过免疫印迹法鉴定其标记蛋白CD9、CD63和CD81,并用透射电镜分析外泌体的超微结构,具体方法结果参考本课题组前期研究[9]。
1.4 外泌体RNA提取及基因芯片mRNA表达谱 随机从两组各取3例患者的BMSCs外泌体,分别命名为PMOP 1~3和C1~3,使用外泌体RNA分离试剂盒提取BMSCs外泌体总RNA,利用NanoDrop ND-2000紫外分光光度仪定量并经Agilent Bioanalyzer 2100生物分析仪检测RNA完整性,送至杭州联川生物技术股份有限公司进行高通量测序分析。
1.5 mRNA功能组分析 对标准化后的数据进行后续分析,利用P值和倍数变化值进行差异基因筛选,筛选标准为:P≤0.05,且上调或者下调倍数变化值≥1.5。差异表达mRNA的聚类分析中选取P值最小的top 200绘制聚类图。以log2(倍数变化值)为横坐标,-log10(P值)为纵坐标,对差异表达分析中所有的基因绘制火山图。通过基因本体分析(gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,预测差异表达mRNA的生物学功能。
1.6 定量逆转录聚合酶链式反应(quantitative reverse transcription polymerase chain reaction,RT-qPCR)验证分析 为验证基因芯片结果的可靠性,提取20例PMOP肾阴虚证组和20例骨量正常对照组患者的BMSCs外泌体RNA,对部分差异表达的mRNA进行RT-qPCR验证。按照说明书使用逆转录试剂盒将RNA逆转录成cDNA,随后采用SYBR green qPCR mix试剂盒进行RT-qPCR,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因。mRNA的相对表达量采用2-ΔΔCT方法计算,引物由杭州联川生物技术股份有限公司设计,序列见表1。

表1 引物序列Tab.1 Primer sequences
2 结果
2.1 受试者一般资料分析 本研究共纳入绝经后女性40例,其中PMOP肾阴虚组20例,骨量正常对照组20例。见表2。随机从两组各取3例患者,分别命名为PMOP 1~3和C1~3,进行高通量测序分析。见表3。
表2 受试者一般资料比较Tab.2 Comparison of subjects' general data()
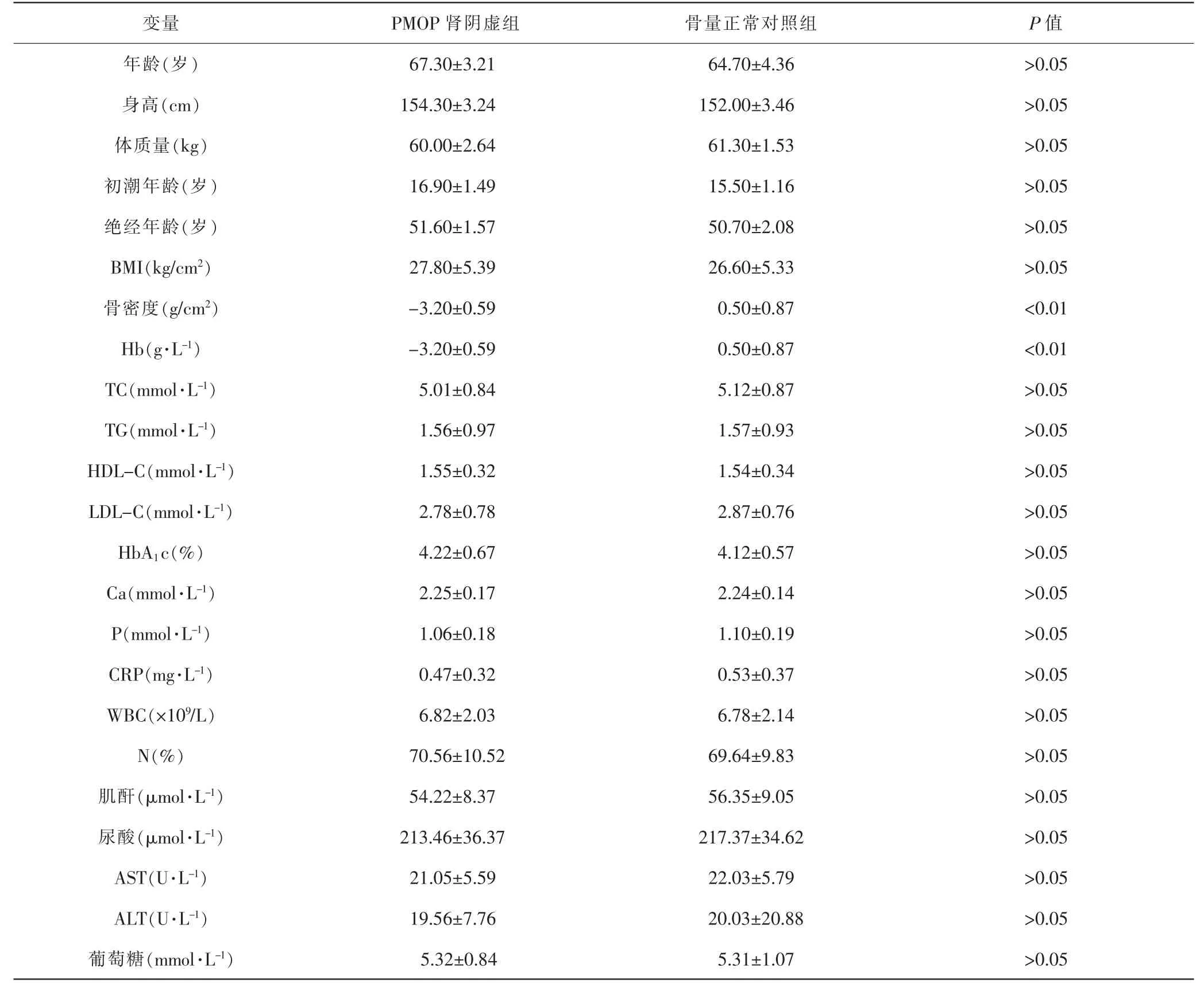
表2 受试者一般资料比较Tab.2 Comparison of subjects' general data()
注:BMI:体质量指数;TC:总胆固醇;TG:甘油三酯;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇。Note: BMI: body mass index;TC: total cholesterol;TG: triglyceride;HDL-C: high density lipoprotein cholesterol;LDL-C: low density lipoprotein cholesterol.

表3 测序组患者一般资料比较Tab.3 Comparison of general data in sequencing group
2.2 两组患者BMSCs外泌体中mRNA的差异分析 比较两组患者BMSCs外泌体中mRNA表达谱,将差异表达的标准化数据制作成热图。见图1a。如果两组中mRNA水平至少相差1.5倍,则认为其表达存在差异(P≤0.05)。两组BMSCs外泌体鉴定出174个差异表达的mRNA,其中92个上调,82个下调。见图1b。基因芯片筛选的前10个显著上调和前10个显著下调的mRNA见表4。在mRNA失调的转录物中,甲状腺转录因子1(thyroid transcription factor 1,TTF1)上调最多,log2(倍数变化值)为2.22,而γ-氨基丁酸受体相关蛋白1(γ-aminobutyric acid receptor associated protein like 1,GABARAPL1)的下调程度最大,log2(倍数变化值)为-2.18。
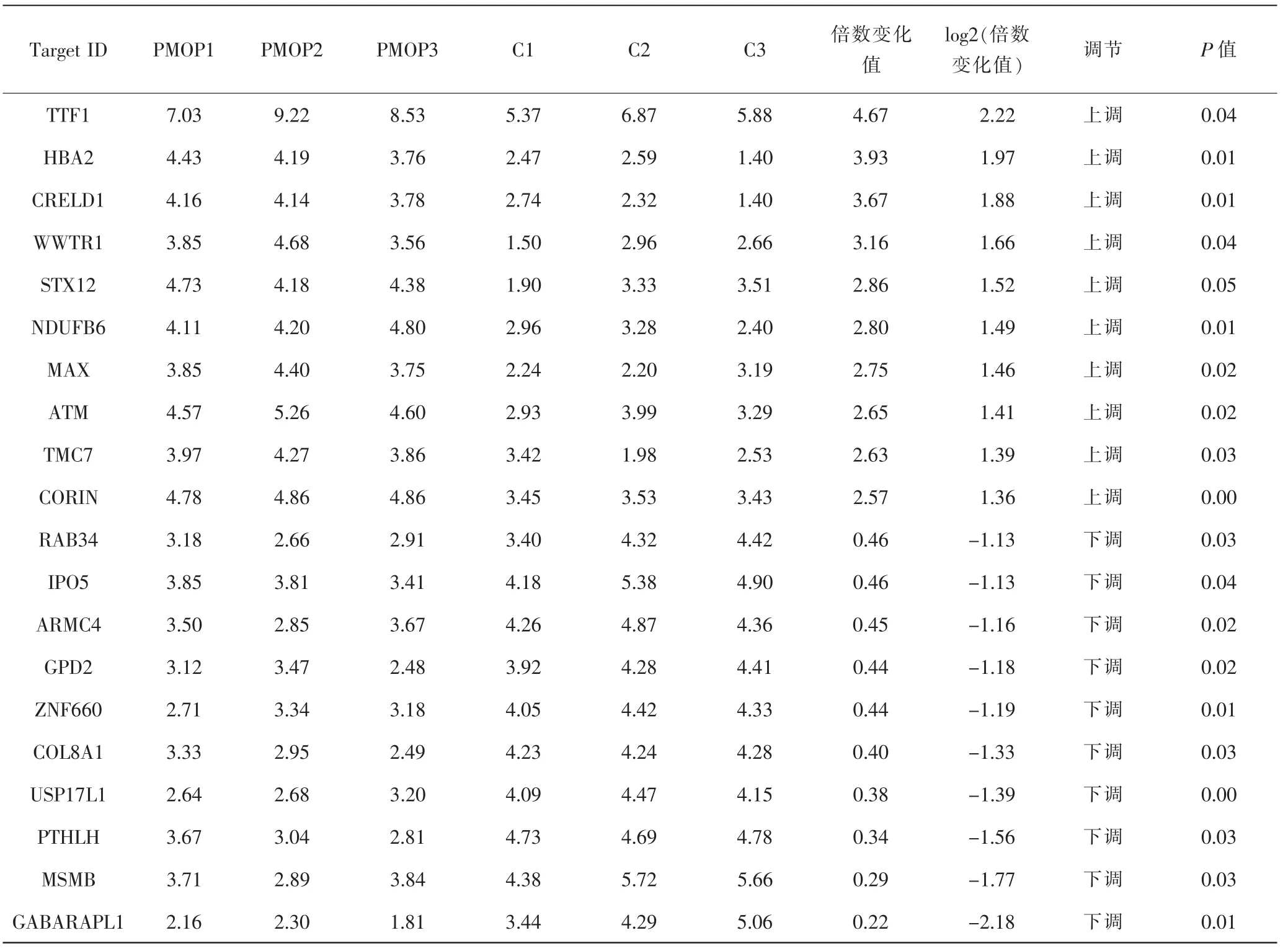
表4 基因芯片结果中上调和下调前10位mRNATab.4 Top 10 mRNA up-regulated and down-regulated in microarray results

图1 两组患者BMSCs外泌体中mRNA表达谱Fig.1 mRNA expression profiles in exosomes of BMSC in two groups
2.3 RT-qPCR验证差异表达mRNA 为验证基因芯片测序结果,选取10个mRNA(P≤0.05,倍数变化值≥2)进行RT-qPCR验证。10个mRNA中4个上调(ATM、MAX、THBS3和WWTR1),6个下调(COL8A1、GABARAPL1、HLA-DQA1、HSPA1L、PPP2R2D和PTHLH)。为了确定这些mRNA在BMSCs外泌体中的表达水平,对20例PMOP肾阴虚证组和20例骨量正常对照组进行验证。10个mRNA的表达谱与基因芯片检测结果均一致。见图2。两组间ATM、COL8A1、GABARAPL1、HLA-DQA1、HSPA1L、MAX、PPP2R2D、PTHLH和WWTR1的表达水平差异有统计学意义(P<0.001)。
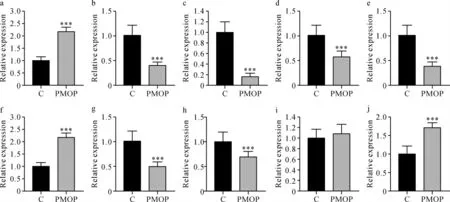
图2 两组患者mRNA的RT-qPCR验证Fig.2 RT-qPCR verification of mRNA in two groups
2.4 差异表达mRNA功能分析 对差异表达mRNA的进行GO功能分析和KEGG通路富集分析。GO功能分析结果显示,分子功能主要集中在DNA、RNA和蛋白质的结合;生物功能主要集中在细胞和蛋白质运输、骨成熟参与、骨小梁形成、钙离子结合方面;细胞功能主要集中在细胞核、细胞膜和线粒体中。见图3a。KEGG富集结果显示,差异mRNA在参与成骨分化的信号通路如丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、自噬调节、磷脂酰肌醇3激酶-蛋白激酶B(phosphatidylinositol 3 kinase-protein kinase B,PI3K-AKT)、钙离子信号通路、雌激素信号通路和叉头框转录因子O(forkhead box transcription factor O,FoxO)亚族信号通路富集。见图3b。

图3 功能富集分析Fig.3 Functional enrichment analysis
3 讨论
PMOP是一种多因素慢性疾病,随着老年人口的增加,骨质疏松症的发病率呈上升趋势,PMOP成为了一个全球关注的健康问题[10]。由于缺乏有效的治疗方法,探索PMOP的发病机制和寻找新的治疗策略一直是PMOP研究的重要目标。“浙派中医”骨伤学家肖鲁伟发现中医理论中的“髓”的概念与现代医学的干细胞及其组织微环境在生物学上存在着高度相似性,将干细胞及其微环境功能紊乱引起骨与关节病损的骨伤疾病定义为“髓系骨病”,特别是对股骨头坏死、骨质疏松症、骨性关节炎,提出了髓系骨病的“肾虚髓萎”的病因病机学说[11]。本研究选择了PMOP肾阴虚证组与骨量正常对照组的BMSCs,然后对其微环境外泌体内的差异表达基因进行分析,通过基因芯片获得了174个差异表达基因,其中92个上调,82个下调;RT-qPCR鉴定出的9个关键mRNA(ATM、COL8A1、GABARAPL1、HLA-DQA1、HSPA1L、MAX、PPP2R2D、PTHLH和WWTR1)与基因芯片数据一致,且在两组间差异有统计学意义。
基于功能注释分析,本研究发现MAPK和自噬调节是PMOP肾阴虚证组中差异表达基因显著富集的通路。有研究报道,MAPK信号通路在调节成骨分化中起着至关重要的作用[12]。MAPK信号通路是缺氧触发的核心调控通路,缺氧影响MSCs的细胞周期、增殖、凋亡、迁移和分化[13]。通过对HSPA1L进行调节,可保护MSCs免受凋亡衰老的影响[14]。最近研究表明,自噬与骨代谢疾病的发病机制具有相关性,包括骨硬化症、Paget骨病和PMOP[15-17]。自噬可以抵抗衰老过程中的氧化应激反应,在PMOP 中起着重要作用[18]。GABARAPL1是一个与自噬相关的重要基因[19],本研究提示其在PMOP肾阴虚证组下调最明显。有研究证实,GABARAPL1存在于分泌型外泌体的外膜上,使用抗体封闭GABARAPL1 可导致外泌体的功能抑制,这使GABARAPL1可能成为疾病治疗的一个新靶点[20]。因此,笔者推测GABARAPL可能成为PMOP肾阴虚证的一个非常有意义的治疗靶点。
有学者利用药理学方法来预测传统中药四物汤的活性化合物和潜在靶标,发现参与的信号通路有PI3K-AKT信号通路、MAPK信号通路和FoxO信号通路,四物汤可以通过干预与骨质疏松症发展有关的生物学过程和信号传导通路起到治疗骨质疏松症的效果[21]。PI3K-AKT信号通路可促进成骨细胞增殖、分化和成骨,从而抑制骨质疏松症[22]。本研究结果提示,PPP2R2D、THBS3和CDC37参与PI3K-AKT信号通路,这些基因可能与PMOP肾阴虚证发生相关。本研究还发现,ATM基因参与FoxO信号通路,它是细胞氧化防御的关键调节因子,也是一种参与DNA损伤反应的应激酶,是保持基因组完整性和干细胞更新所必需的,在调节成骨细胞特异性转录因子osterix的表达中起积极作用,正向调节成骨细胞分化和骨形成[23-24]。COL8A1是胶原蛋白,在骨质流失和骨质疏松症的发病机制中起着核心作用[25]。研究发现,软骨内骨化途径中的关键基因PTHLH,与汉族女性PMOP有关[26]。
总之,本研究利用基因芯片筛选出PMOP肾阴虚证患者BMSCs外泌体相关的mRNA及其参与的信号通路,这些差异表达的mRNA是否可以成为PMOP肾阴虚证特异的mRNA,需要进一步验证。本研究仍有不足之处,收集的病例均为股骨头坏死或股骨颈骨折患者,可能造成选择性偏倚,亟待在后期研究中改进。然而,本研究可能是较早应用高通量测序技术筛选PMOP肾阴虚证BMSCs外泌体相关mRNA的研究,筛选出的9个关键mRNA可能作为PMOP肾阴虚证患者的特异性诊断及预后靶点,为中医“证”实质的研究提供了新的突破口。
