静脉输注利多卡因对脉冲射频治疗相关疼痛的影响 *
2022-11-01欧册华
卢 巧 金 涛 欧册华△ 张 悦△
(1 西南医科大学附属医院疼痛科,泸州 646000;2 遂宁市第一人民医院麻醉科,遂宁 629000)
脉冲射频 (pulsed radiofrequency, PRF) 通过多种途径调节神经功能治疗疼痛[1]。由于病人对有创治疗的恐惧以及穿刺时的不适,常导致手术中断和病人对治疗满意度低。目前对于PRF 治疗期间病人满意度及相关疼痛的研究未见报道。
钠离子通道抑制剂利多卡因具有抗伤害、抗痛觉过敏和抗炎作用,也正是这些机制,使其除了具有局部麻醉作用,还能在输注完成数小时后有明显的镇痛作用[2,3]。已有研究报道将静脉输注利多卡因用于难治性癌痛和术后疼痛的治疗[4,5]。然而,利多卡因输注在PRF 治疗相关疼痛中少有研究。多种神经痛的病例中均发现炎症因子表达增加[6,7]。故本研究拟对PRF 治疗相关疼痛的现状进行调查,并根据调查结果选取疼痛剧烈的病种静脉输注利多卡因,探讨其对PRF 治疗过程中的疼痛、血清应激、炎症因子水平的影响,以期提高病人治疗舒适度的同时,为PRF 治疗相关疼痛的缓解提供策略。
方 法
1.一般资料
本研究经西南医科大学附属医院伦理委员会批准(KY-2021-058),并在中国临床试验中心注册(注册号:ChiCTR2100043609)。
(1)PRF 治疗相关疼痛调查:纳入2020 年7月至2021 年4 月在西南医科大学附属医院疼痛科接受PRF 治疗慢性疼痛的病人,并签署知情同意书。
纳入标准:①年龄≥18 岁;②视觉模拟评分法 (visual analogue scale, VAS) 评分≥4;③需要接受PRF 治疗。
排除标准:①凝血功能异常或穿刺部位畸形、感染、肿瘤者;②有智力、认知功能障碍等可能影响受试者合作的行为障碍。
(2)静脉输注利多卡因对PRF 治疗相关疼痛的 影 响:纳 入2021 年3 月 至2021 年12 月 接 受PRF 治疗颈源性头痛及三叉神经痛的病人各30 名。按照随机数字表法分为利多卡因组(L 组)和对照组(C 组),每组30 例(三叉神经射频和C2背根神经节射频各15 例)。L 组术前2 小时内静脉输注2 mg/kg 利多卡因,C 组静脉输注等量生理盐水。
纳入标准:①诊断为颈源性疼痛或三叉神经痛需接受PRF 治疗者;②年龄≥18 岁;③VAS 评分≥4;④药物、理疗等无创治疗疼痛缓解率< 50%者。
排除标准:①凝血功能异常或穿刺部位畸形、感染、肿瘤者;②有智力、认知功能障碍等可能影响受试者合作的行为障碍;③阿-斯综合征、严重窦房结功能障碍;④局部麻醉药过敏史。
2.方法
PRF 操作:根据治疗部位选择合适长度的射频针套管和射频针(北京北琪医疗科技有限公司),在超声引导下进行穿刺,直至针尖到达目标靶点位置。穿刺成功后,予以感觉刺激(50 Hz, 0.2 V~0.5 V),若病人诉神经刺激支配区出现酸胀、麻木等情况提示穿刺部位正确。采用脉冲射频模式(射频控温热凝器 R-2000B M1,北京北琪医疗科技有限公司)将参数统一设定为:脉宽20 ms,频率500 Hz,脉冲频率4 Hz,温度42.5℃,治疗时间360 s,两个循环。PRF 治疗结束后,回抽无血液或脑脊液,可注射镇痛复合液(2%利多卡因40 mg + 甲钴胺0.5 mg + 地塞米松5 mg + 0.9%NaCl 共10 ml) 3 ml。
炎症因子及应激水平检测:取病人静脉血4 ml,3000 r/min 离心12 min 后取上清置于-80℃冰箱保存。采用酶联免疫吸附法并按试剂盒(泉州市睿信生物科技有限公司)说明书中的步骤,检测白介素1β (interleukin 1β, IL-1β)、肿瘤坏死因子α (tumor necrosis factor α, TNF-α)及去甲肾上腺素 (norepinephrine, NE) 含量。
3. 临床疗效评估和观察
(1)PRF 治疗相关疼痛调查:分别于术前(T0)、术中(T1, 每3 分钟测量1 次,以最高值为准)、术后0、1、2 小时(T2、T3、T4)记录VAS 评分、心率 (heart rate, HR) 和平均动脉压 (mean arterial pressure, MAP)。PRF 治疗结束后记录血管活性药物干预病例的例数及病人对治疗的满意度。
(2)利多卡因静脉输注:分别记录术前(t0)、术中(t1,以PRF 治疗中疼痛最剧烈为准)、术后0、1、24 小时(t2、t3、t4) VAS 评分、HR 和MAP。于t0、t3、t4 取病人静脉血测IL-1β、TNF-α、NE 水平。治疗结束后记录病人满意度及静脉输注利多卡因相关不良反应(头晕、感觉异常、肌肉震颤、惊厥、心律失常等)。
4. 统计学分析
采用SPSS 19.0 软件进行统计分析,计量资料以均数±标准差(±SD)表示。计数资料各组之间差异采用X2检验。两组间比较采用独立样本t检验;两组各时间点比较采用重复测量方差分析。P<0.05 为差异有统计学意义。
结 果
1. PRF 治疗相关疼痛
(1)一般资料
本研究纳入病人年龄为20~92 岁(59.3±13.2),病程1~240 个月(13.7±26.6)。包括带状疱疹相关神经痛、颈源性头痛、脊柱源性疼痛(颈脊神经后支、腰椎间盘突出等)、三叉神经痛、其他(舌咽神经痛、坐骨神经痛、膝关节病、骶髂关节炎等)中重度疼痛病人共206 例。血管活性药物使用率7.3%。病人对PRF 治疗满意度为34.5%(见表1)。
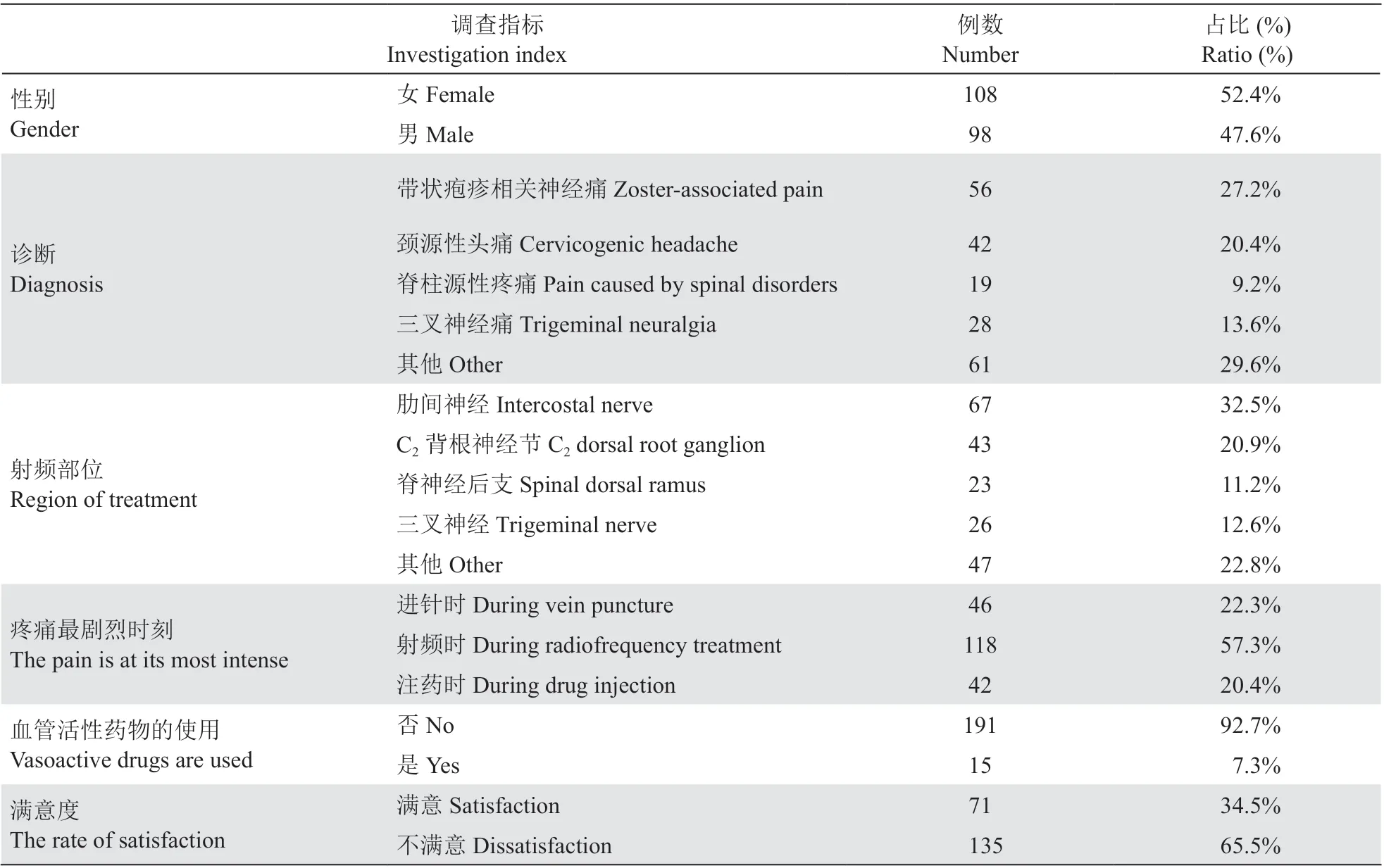
表1 病人一般资料情况Table 1 The characteristics of patients
(2)各时间点VAS 评分、MAP 和HR 比较
VAS 评分:T1 较T0 显著增加;T2、T3、T4较T0 下降。MAP 和HR:T1、T2 较T0 明显增加,差异均有统计学意义(P< 0.05),T3、T4 较T0 无显著性差异(见图1)。
(3)射频部位亚组分析
VAS 评分:T1 时,C2背根神经节射频组高于肋间神经组、脊神经后支组及其他组(P< 0.05);三叉神经组高于肋间神经组和其他组(P< 0.05)。满意度分析发现,C2背根神经节组、三叉神经组病人满意度较低(见表2)。
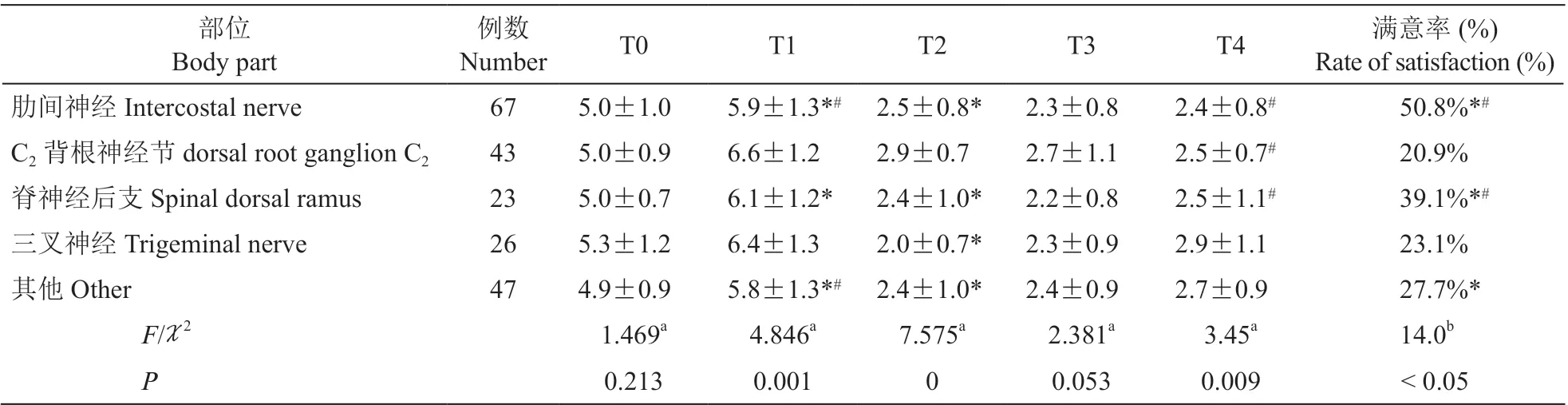
表2 不同部位PRF 操作时各时间点VAS 评分比较Table 2 Comparison of VAS score at each time points among the different part of PRF procedure
2.静脉输注利多卡因缓解PRF 治疗相关疼痛
(1)两组病人的病例数、性别、射频部位、年龄、病程、VAS 评分、MAP 和HR 等一般资料比较差异无统计学意义(见表3)。
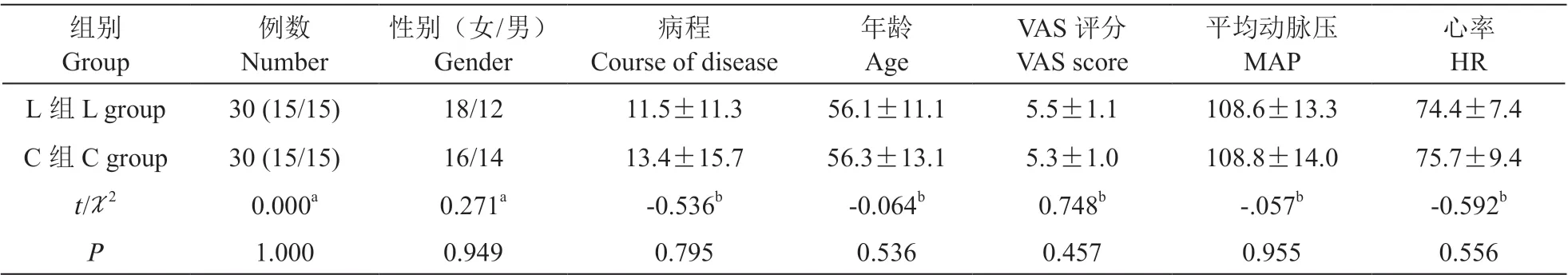
表3 两组病人的一般情况比较Table 3 Comparison of general conditions between two groups
(2)两组VAS 评分、MAP 和HR 比较
VAS 评分:两组t1 高于t0;t1、t3、t4 时L 组低于C 组;HR、MAP:两组t1、t2 均高于t0;t3、t4 与t0 比较差异无统计学意义; t1、t2 时L 组MAP、HR 较C 组低,其余时间点两组间差异无统计学意义(见图2)。
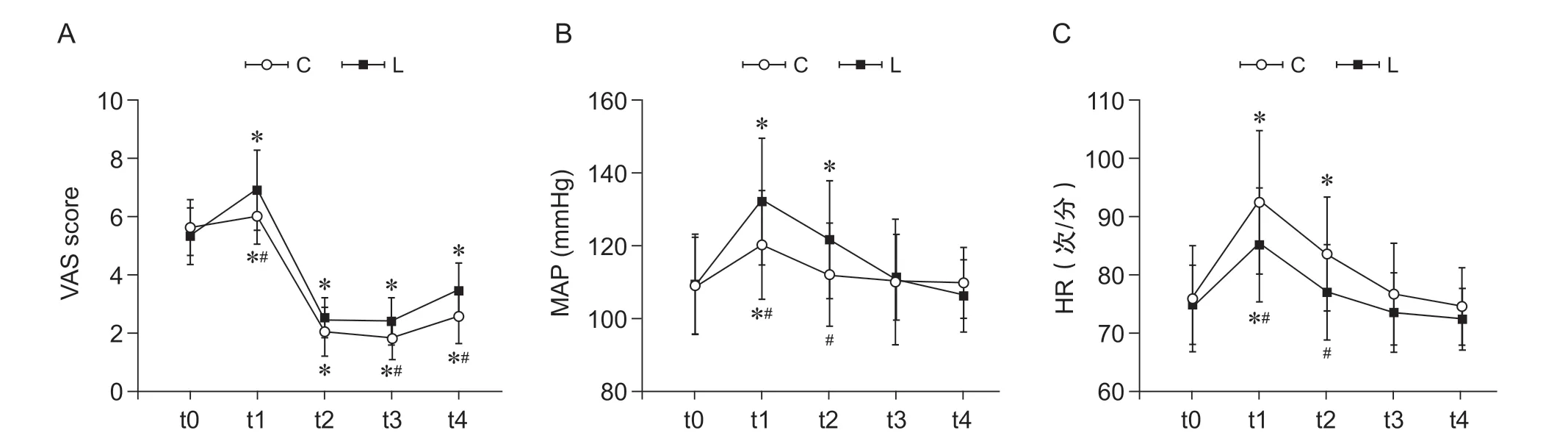
图2 静脉输注利多卡因组和对照组中各时间点VAS、MAP 和HR 的变化(A) VAS 评分;(B)平均动脉压;(C)心率*P < 0.05,与t0 相比;# P < 0.05,与C 组相比Fig. 2 Comparison of VAS score, MAP and HR at different time points between group lidocaine (group L) and group control (group C)(A) VAS score; (B) MAP; (C) HR*P < 0.05, compared with t0; #P < 0.05, compared with group C.
(3)血清IL-1β、TNF-α、NE 变化
t2 时L 组IL-1β、TNF-α 含量与C 组比较差异无统计学意义。t4 时两组IL-1β、TNF-α 含量均低于t0 (P< 0.05),其中L 组低于C 组(P< 0.05)。
t2 时两组NE 含量均高于t0 (P< 0.05),L 组低于C 组(P< 0.05);t4 时两组NE 水平与t0 比较差异无统计学意义,L 组与C 组比较差异无统计学意义(见图3)。

图3 两组病人各时间点IL-1β、TNF-α 和NE 血清浓度比较*P < 0.05,与T0 相比;#P < 0.05,与C 组相比Fig. 3 Comparison of serum concentrations of IL-1β, TNF-α, and NE at each time point between the two groups*P < 0.05, compared with t0; #P < 0.05, compared with group C.
(4)病人治疗满意度和不良反应
C 组满意度26.7%,L 组满意度比例为63.3%,L 组的满意度高于C 组(P< 0.05)。L 组不良反应分别为:头晕6 例、心率减慢3 例、特发性震颤1 例;C 组头晕4 例,两组不良反应差异无统计学意义。
讨 论
PRF 已被证实可导致短暂的胶原沉积和神经水肿,电镜下可以观察到轴突超微结构损伤、膜异常、线粒体形态、微管和微丝解体[8,9]。即使这些损伤是可逆的,PRF 对神经短暂的刺激作用仍不可避免。而神经性疼痛病人常合并痛觉过敏、自主神经功能紊乱、焦虑抑郁等,对疼痛刺激更敏感,这也会加剧恐惧紧张心理,引起病人应激进而影响病人治疗体验。本研究病人PRF 治疗时疼痛加剧的发生率为57.3%,高于进针时(22.3%)及注药时(20.4%),这与陈栋樑等[10]的结果一致。其可能原因是治疗时射频产生的刺激与病人本身痛觉过敏共同作用加剧了疼痛。
本研究PRF 治疗中VAS 评分、MAP、HR 较术前升高。VAS 评分在PRF 治疗结束后下降,MAP 和HR 的升高在PRF 治疗结束时仍存在,治疗后1 小时恢复至基线值。疼痛持续时间以及血压心率升高时间短于陈栋樑等[10]的结果。PRF 治疗结束后对目标神经的支配区进行神经阻滞,阻断了该区域的痛觉传导,并且PRF 的温度始终不超过42.5℃,不会造成神经永久性损伤,使得PRF 成为一个相对较短的刺激,因此疼痛在治疗后缓解。PRF 治疗的病人对治疗过程舒适度的满意率仅为34.5%,与既往研究结果一致[11]。
根据射频部位进行亚组分析发现,C2背根神经节与三叉神经PRF 治疗相关疼痛评分高,满意度低,这可能是解剖部位特殊性导致的。C2背根神经节被寰枢椎韧带所覆盖,不受骨性结构的保护,容易受到损伤,头下斜肌的痉挛或炎症均可压迫或刺激该神经[12]。超声引导下C2背根神经节PRF 治疗定位于头下斜肌与头半棘肌之间深处,即可诱发出该处的疼痛。三叉神经为面部最粗大的混合神经,包含感觉支和运动支[13],形成三叉神经的纤维分为伤害性纤维(Aδ 和 C 纤维)和低阈值机械感受器(Aα和 Aβ 纤维)。在伤害性纤维中,C 纤维和Aδ 纤维都可以被有害的触发因素(如机械、热、电等)刺激激活[14]。加之,C2背根神经节与三叉神经均位于头面部,在进行射频时病人更易感觉到紧张,更易诱发疼痛。
周围神经损伤促使巨噬细胞和产生髓鞘的施万细胞协调炎症反应,使病人血清中IL-1β、IL-6、IL-8 和TNF-α 水平均显著升高[15]。局部伤害感受器阈值下降及中枢神经系统广泛敏感化在颈源性牵涉痛发生机制中占据着重要作用并伴随血清炎症因子的改变[16]。利多卡因可以激活配体门控离子型谷氨酸受体,减少兴奋性突触前释放,通过减少红藻氨酸离子型谷氨酸受体的激活来减少细胞因子IL-1β、IL-6 和TNF-α 释放,减轻神经炎症,使疼痛缓解[17]。本研究观察到利多卡因组VAS 评分低于对照组与上述研究相符,且在射频后1 小时和24 小时,利多卡因组的VAS 评分也低于对照组。PRF 治疗24 小时后血清IL-1β、TNF-α 浓度较对照组下降,与Chu等[5]在神经病理性疼痛的疼痛评分及炎症因子变化一致。 PRF治疗中病人因紧张及疼痛刺激,激活肾素-血管紧张素-醛固酮系统,继而引起血清NE 浓度上升,血压、心率上升。本研究也观察到PRF 治疗中,利多卡因组的VAS 评分、NE 水平较对照组下降。
本研究存在以下局限性:本研究为单中心的研究,尚需大样本多中心的研究来充实和丰富研究结论;本研究未对利多卡因的血药浓度进行检测,尚不能确定疼痛作用的峰值,因此无法完全确定其治疗相关疼痛的最佳预处理时间;利多卡因是否有远期效应也需进一步研究证实。
综上所述,静脉输注利多卡因能缓解PRF 治疗相关疼痛,从而降低术中的应激,使病人在射频治疗中的循环更加平稳,提高病人满意度,同时可通过降低炎症因子水平缓解PRF 治疗术后的疼痛。
利益冲突声明:作者声明本文无利益冲突。
