利多卡因通过miR-146b-5p调控胃癌细胞增殖、迁移、侵袭的分子机制研究
2022-06-23吕艳玲王冰
吕艳玲,王冰
宝鸡市人民医院麻醉科,陕西 宝鸡 721000
利多卡因是临床常用的局部酰胺类麻醉剂,对急性或慢性疼痛疾病,如神经性疼痛、炎症和伤害性疼痛具有突出的疗效[1]。除此之外,利多卡因还具有显著的抗癌活性[2]。研究表明,利多卡因可以抑制胃癌[3]、肺癌[4]、膀胱癌[5]和卵巢癌[6]等癌症的生长和转移。利多卡因是一种有效的肿瘤抑制剂,但其对胃癌作用机制的研究有限。微小RNA(microRNA,miRNA)不仅是管理细胞生长和发育的关键调节器,并且在调节药物疗效和毒性方面也发挥着重要作用[7]。研究证实miR-146b-5p在胃癌细胞中表达上调,被认为是胃癌的诊断和预后生物标志物[8]。较高水平的miR-146b-5p 能促进胃癌细胞增殖和减轻凋亡[9]。由于miR-146b-5p 在胃癌的发病机制中起重要作用,因此深入研究miR-146b-5p 在利多卡因功效中扮演的角色十分必要。本研究旨在探讨利多卡因对胃癌细胞生物学行为的影响,以及其作用机制是否与miR-146b-5p 有关。
1 材料与方法
1.1 材料 胃癌细胞SNU-1(武汉普诺赛),利多卡因(≥99.7%,100 mg;中国食品药品检定研究院),anti-miR-NC、anti-miR-146b-5p、miR-NC、miR-146b-5p(上海Genepharma),CCK-8 溶液(日本Dojindo),BCA Protein Assay Kit(美国Pierce),细胞周期蛋白D1(CyclinD1)兔单克隆抗体、活化的含半胱氨酸的天冬氨酸蛋白水解酶-3(Cleaved-cysteinyl aspartate specific proteinase-3,Cleaved Caspase-3)兔单克隆抗体、基质金属蛋白酶2 (matrix metalloprotease,MMP2)兔单克隆抗体、MMP9 兔单克隆抗体(美国Abcam),膜联蛋白V(Annexin V)-FITC/碘化丙啶(propidium iodide,PI) (上海Sangon),逆转录试剂盒(上海Toyobo),SYBR Green实时PCR试剂盒(德国Roche Diagnostics)。
1.2 细胞培养 SNU-1细胞在青霉素(100 IU/mL)、含链霉素(100 μg/mL)和10%胎牛血清的RPMI-1640培养基中培养,培养箱保持湿润、95%空气、5%CO2的环境,温度为37℃。
1.3 实验分组 实验共分为NC组、50 μmol/L利多卡因组、100 μmol/L利多卡因组、200 μmol/L利多卡因组、anti-miR-NC 组、anti-miR-146b-5p 组、miR-NC+200 μmol/L 利多卡因组和miR-146b-5p+200 μmol/L利多卡因组8 组。其中,NC 组SNU-1 细胞未经任何处理,50 μmol/L、100 μmol/L、200 μmol/L 利多卡因组SNU-1 细胞以50 μmol/L、100 μmol/L、200 μmol/L 利多卡因处理24 h[2]。anti-miR-NC组、anti-miR-146b-5p组、miR-NC+200 μmol/L利多卡因组和miR-146b-5p+200 μmol/L 利多卡因组SNU-1 细胞分别按照Lipofectamine 2000 试剂操作指南转染anti-miR-NC、anti-miR-146b-5p、miR-NC、miR-146b-5p,转染48 h后,收集细胞或以200 μmol/L利多卡因处理24 h。
1.4 CCK-8 法检测细胞增殖 SNU-1 细胞重新接种到96孔板中(大约5×103个细胞/孔)。然后,将10 μL CCK-8 溶液加入到细胞中。细胞在由湿润、95%空气和5%CO2的环境中孵育1 h 后,通过酶标仪测定吸光度A值(450 nm)评估细胞增殖。
1.5 流式细胞仪检测细胞凋亡 SNU-1 细胞经不同处理后,接种到6孔板(大约1×105个细胞/孔),用冷磷酸盐缓冲液洗涤,然后重悬于结合缓冲液中,将细胞在5 μL Annexin V-FITC 和PI 中避光染色15 min。根据FACS can 流式细胞仪的说明进行流式细胞术检测。凋亡结果通过FlowJo软件计算。
1.6 Transwell 检测细胞迁移及侵袭 细胞迁移测定通过Transwell 小室进行。上层填充有稀释于无血清培养基的SNU-1 细胞。下层补充有血清培养基。37℃孵育后,用甲醇固定细胞,将SNU-1 细胞用0.5%结晶紫染色10 min,计算迁移到膜下侧的细胞数。细胞侵袭测定与细胞迁移测定类似,但在细胞侵袭测定中,Transwell小室上层预先涂有基质胶。其余步骤与细胞迁移测定相同。
1.7 Western blot 检 测CyclinD1、Cleaved Caspase-3、MMP2、MMP9 蛋白相对表达 通过使用蛋白提取试剂盒获得SNU-1 细胞中的蛋白质,采用BCA Protein Assay Kit计算蛋白浓度。等量的蛋白质(30 μg)在100℃下于上样缓冲液中变性15 min。将含有等量蛋白并在样品缓冲液中制备的样品加载到8%~12%SDS/PAGE 孔中,并通过电压梯度转移到PVDF 膜上。将膜在5%脱脂牛奶中封闭过夜,与抗CyclinD1、抗Cleaved Caspase-3、抗MMP2、抗MMP9、抗β-actin(内源性对照)一抗在4℃下轻摇过夜,与羊抗兔二抗孵育。显影后通过Image Lab软件估计不同的蛋白条带。
1.8 实时定量PCR 检测miR-146b-5p 表达 用TRIzol 试剂从不同处理SNU-1 细胞中提取总RNA。使用逆转录试剂盒和miRNA 特异性miRNA RT 引物从RNA样品中产生cDNA。U6 snRNA用作数据标准化的内源性对照。使用SYBR Green实时PCR试剂盒在ABI Prism 7500序列检测系统上进行实时PCR。使用2-ΔΔCt方法确定相对miR-146b-5p 表达。引物序列(5′-3′)为miR-146b-5p F:GGGCGGTGAGAACTGAATT,miR-146b-5p R:CAGTGCGTGTCGTGGAGT;U6 F:CTCGCTTCGGCAGCACA,U6 R:AACGCTTCACGAATTTGCGT。
1.9 统计学方法 应用SPSS22.0 软件进行数据统计分析。计量数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组数据间比较采用独立样本t检验,组间多重比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度利多卡因对SNU-1 细胞增殖、凋亡、迁移、侵袭的影响 不同浓度利多卡因处理SNU-1细胞后,与NC组比较,50 μmol/L利多卡因组、100 μmol/L利多卡因组、200 μmol/L利多卡因组细胞的增殖能力逐渐减弱,凋亡率逐渐增加,迁移和侵袭数量逐渐减少,差异均有统计学意义(P<0.05),见表1和图1。
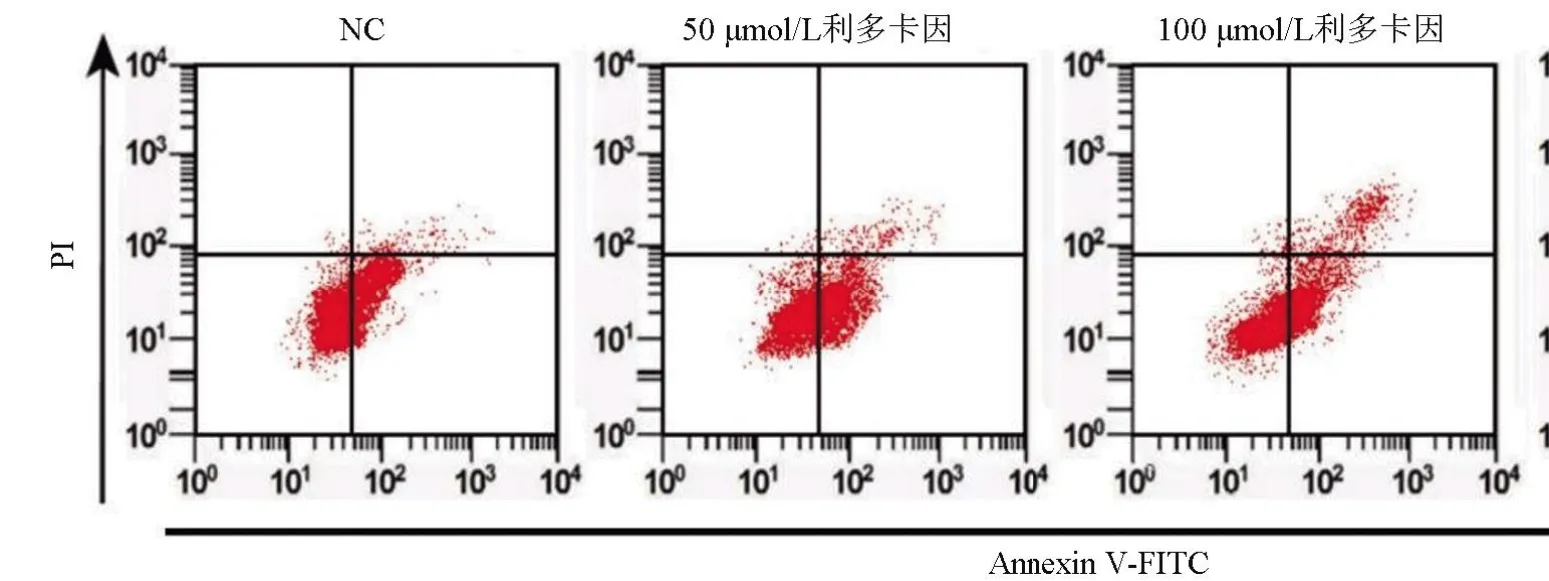
图1 流式细胞仪检测细胞凋亡
表1 不同浓度利多卡因对SNU-1细胞增殖、凋亡、迁移、侵袭的影响(±s,n=9)

表1 不同浓度利多卡因对SNU-1细胞增殖、凋亡、迁移、侵袭的影响(±s,n=9)
注:与NC比较,aP<0.05。
?
2.2 不同浓度利多卡因对SNU-1 细胞中有关蛋白表达的影响 不同浓度利多卡因处理SNU-1细胞后,与NC 组比较,50 μmol/L 利多卡因组、100 μmol/L利多卡因组、200 μmol/L 利多卡因组细胞的CyclinD1蛋白、MMP2 蛋白和MMP9 蛋白的表达量逐渐降低,Cleaved Caspase-3 蛋白表达量逐渐增加,差异均有统计学意义(P<0.05),见表2和图2。
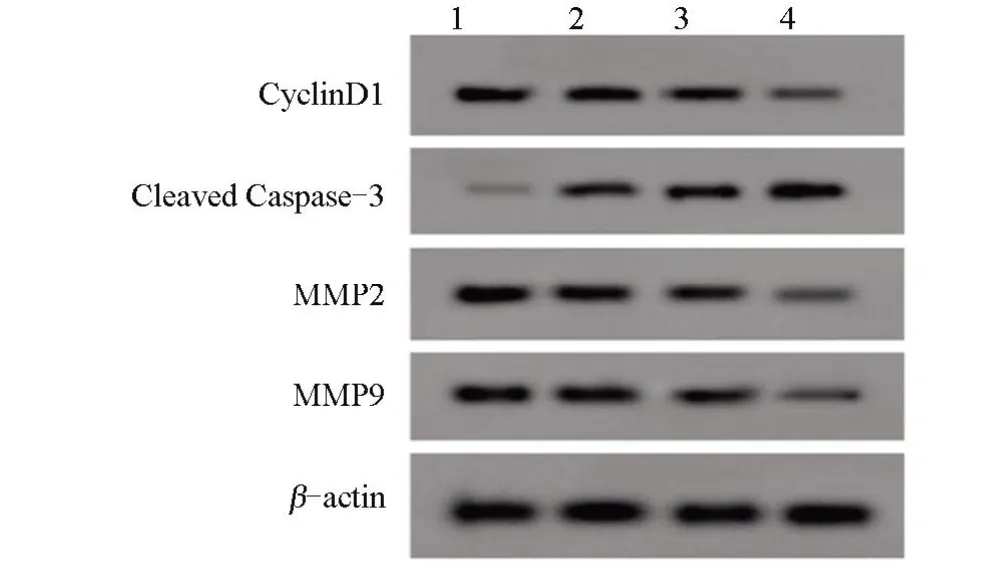
图2 Western blot检测CyclinD1、Cleaved Caspase-3、MMP2、MMP9蛋白相对表达
表2 不同浓度利多卡因对SNU-1细胞中有关蛋白表达的影响(±s,n=9)
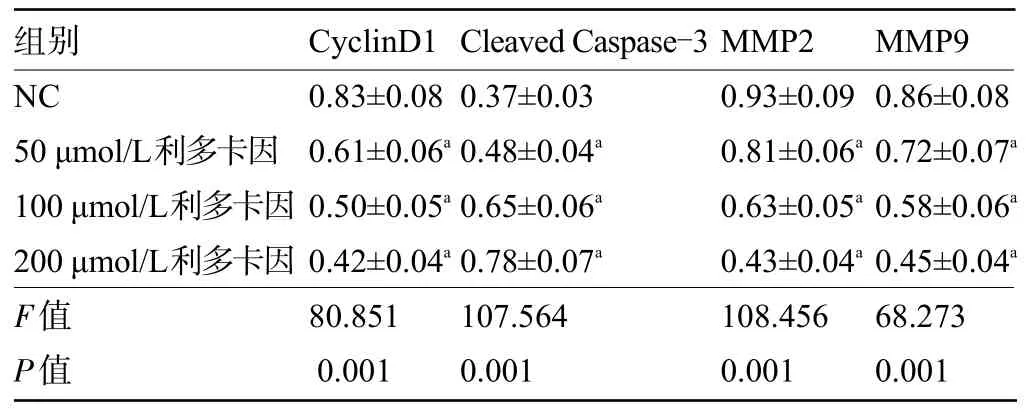
表2 不同浓度利多卡因对SNU-1细胞中有关蛋白表达的影响(±s,n=9)
注:与NC比较,aP<0.05。
?
2.3 不同浓度利多卡因对miR-146b-5p表达的影响 50 μmol/L 利多卡因组、100 μmol/L 利多卡因组、200 μmol/L 利多卡因组SNU-1 细胞的miR-146b-5p表达量分别为0.86±0.08、0.61±0.07、0.47±0.04,均少于NC 组的1.00±0.09,差异均有统计学意义(F=98.114,P<0.05)。
2.4 anti-miR-146b-5p 对SNU-1 细胞增殖、凋亡、迁移和侵袭的影响 转染anti-miR-146b-5p后,anti-miR-146b-5p 组SNU-1 细胞的miR-146b-5p和CyclinD1 蛋白的表达量比anti-miR-NC 组低,Cleaved Caspase-3 蛋白表达量比anti-miR-NC 组高,MMP2、MMP9 蛋白的表达量、增殖能力比anti-miR-NC 组低,凋亡率比anti-miR-NC 组高,且迁移和侵袭数量比anti-miR-NC 组低,差异均有统计学意义(P<0.05),见表3和图3。
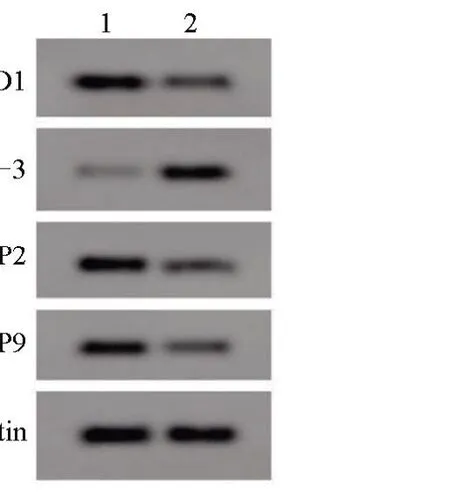
图3 anti-miR-146b-5p上调对SNU-1细胞凋亡及相关蛋白表达的影响
表3 anti-miR-146b-5p对SNU-1细胞增殖、凋亡、迁移和侵袭的影响(±s,n=9)

表3 anti-miR-146b-5p对SNU-1细胞增殖、凋亡、迁移和侵袭的影响(±s,n=9)
注:与anti-miR-NC比较,aP<0.05。
?
2.5 miR-146b-5p 可以逆转利多卡因对SNU-1细胞增殖、凋亡、迁移和侵袭的影响 miR-146b-5p+200 μmol/L 利多卡因组SNU-1 细胞的miR-146b-5p、CyclinD1 蛋白的表达量高于miR-NC+200 μmol/L 利多卡因组,Cleaved Caspase-3 蛋白表达量低于miR-NC+200 μmol/L 利多卡因组,MMP2、MMP9蛋白表达量、增殖能力高于miR-NC+200 μmol/L 利多卡因组,凋亡率低于miR-NC+200 μmol/L 利多卡因组,迁移和侵袭数量高于miR-NC+200 μmol/L 利多卡因组,差异均有统计学意义(P<0.05),见表4和图4。

图4 miR-146b-5p可以逆转利多卡因对SNU-1细胞凋亡及相关蛋白表达的影响
表4 miR-146b-5p可以逆转利多卡因对SNU-1细胞增殖、凋亡、迁移和侵袭的影响(±s,n=9)
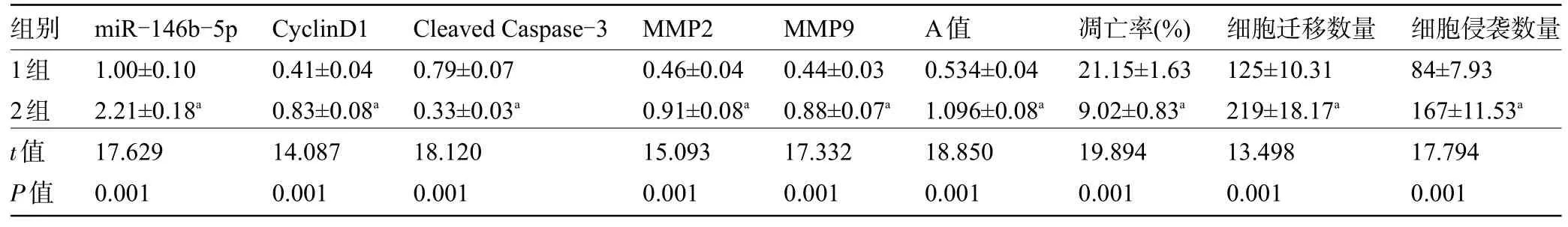
表4 miR-146b-5p可以逆转利多卡因对SNU-1细胞增殖、凋亡、迁移和侵袭的影响(±s,n=9)
注:1组,miR-NC+200 μmol/L利多卡因;2组,miR-146b-5p+200 μmol/L利多卡因;与1组比较,aP<0.05。
?
3 讨论
麻醉剂也可能影响癌症的进展。利多卡因是一种常用的局部麻醉剂,其抗癌作用被广泛报道。诸多研究揭示利多卡因不仅抑制癌细胞生长、加速细胞凋亡,还抑制细胞迁移和侵袭[10-11]。资料显示,利多卡因通过调节miR-145 表达抑制胃癌MKN45 细胞的活力、增殖、迁移和侵袭,同时增强细胞凋亡[12]。利多卡因通过调节胃癌细胞中的环状RNA ANO5/miR-21-5p/LIFR轴导致细胞增殖、迁移、侵袭减少,以及细胞凋亡增加[13]。在肝癌中,利多卡因通过靶向肝癌细胞中的环状RNA DYNC1H1/miR-520a-3p/USP14 轴来阻止肿瘤进展[14]。本研究探讨了利多卡因对胃癌SNU-1 细胞生长、迁移和侵袭的抑制作用。根据本研究的数据,50 μmol/L、100 μmol/L 和200 μmol/L 利多卡因显著抑制SNU-1 细胞的增殖、迁移和侵袭,但促进细胞凋亡,这些发现与先前的研究一致。Cleaved Caspase-3 被认为是调节细胞凋亡的因子[15]。MMP2、MMP9 是迁移和侵袭的关键调节因子。本研究还发现利多卡因下调CyclinD1、MMP2 和MMP9 水平,同时促进Cleaved Caspase-3 表达,与SUI 等[12]报道的利多卡因下调胃癌MKN45 细胞中CyclinD1、MMP2、MMP9 表达及上调Cleaved Caspase-3 表达一致。总之,本研究的数据与之前的结果一致,这为利多卡因抗胃癌作用提供了新的证据。
作为细胞生长发育的重要调节因子,miRNA参与控制包括胃癌在内的多种癌细胞的增殖、凋亡和侵袭行为。miR-146b-5p是一种具有致癌[16]和肿瘤抑制活性[17]的癌症相关miRNA。最近,有人提出miR-146b-5p在胃癌中的表达增加[18-19],诱导miR-146b-5p 的下调有助于治疗胃癌[9]或抑制结肠癌的生长和转移[20]。此外,miR-146b-5p 表达与晚期甲状腺乳头癌相关,miR-146b-5p 在体外促进甲状腺乳头癌细胞的增殖、迁移、侵袭和细胞周期[21]。可见miR-146b-5p是胃癌、甲状腺乳头癌等的肿瘤促进剂。本研究的结果表明,沉默miR-146b-5p使SNU-1细胞的增殖能力、迁移和侵袭能力减弱,而凋亡水平增加,与前人研究[9,20]吻合。利多卡因使SNU-1 细胞中的miR-146b-5p 表达减少,猜测利多卡因可以通过降低miR-146b-5p水平来阻滞胃癌的发生发展。此前,一些miRNA被报道参与利多卡因的抗癌功能,如利多卡因抑制肺癌A549 和NCI-H1299细胞的增殖和转移,同时诱导细胞凋亡,机制与上调miR-539有关[22]。利多卡因通过下调miR-10b减轻顺铂耐药,并抑制胃癌顺铂耐药细胞的迁移和侵袭[23]。进一步的结果表明,miR-146b-5p 高表达逆转了利多卡因诱导的SNU-1 细胞增殖、迁移、侵袭的降低和细胞凋亡的增加。此外,miR-146b-5p 高表达逆转了利多卡因诱导的增殖、转移和凋亡相关蛋白的变化。因此,利多卡因对胃癌细胞具有抗生长和抗转移作用,其抗肿瘤特性可能是通过下调miR-146b-5p 实现的。
总之,本研究阐明了利多卡因在胃癌中发挥抗生长和抗转移作用的机制,利多卡因通过下调miR-146b-5p来抑制胃癌细胞的增殖、迁移和侵袭,并加速凋亡,为利多卡因在胃癌中的作用机制提供了新的见解。
