10-11 易位蛋白2 调节足底炎症和炎性疼痛*
2022-11-01孟庆余李春华马灵杰高永静
孟庆余 李春华 马灵杰 高永静
(南通大学疼痛医学研究院,特种医学研究院,南通 226019)
疼痛是一种与实际或潜在的组织损伤相关的不愉快的感觉和情绪情感体验,或与此相似的经历[1]。慢性疼痛是指持续或反复发作3 个月以上的疼痛[2],包括炎性疼痛、神经病理性疼痛、癌性疼痛等[3],影响了全球30%以上的成年人。慢性疼痛可导致病人行动不便、日常活动受限、生活质量降低等,造成极大的个人和社会负担。目前对慢性疼痛的药物治疗主要包括非甾体抗炎镇痛药 (NSAIDs)、阿片类药物、5-羟色胺再摄取抑制剂、三环类抗抑郁药物等。这些药物一方面会带来毒副作用和不良反应,另一方面,部分药物(如阿片类药物)会引起耐受和依赖。尽管如此,通过上述治疗也并不能有效地缓解慢性疼痛,因此亟须寻找更有效的治疗方法和药物靶点。
慢性疼痛伴随外周和中枢中多种基因表达的变化,表观遗传学(包括DNA 甲基化、组蛋白修饰和染色质重塑等)是调节基因表达和慢性疼痛的重要因素[4]。DNA 异常甲基化及其对基因表达的影响参与多种疾病过程,如神经系统疾病、血液系统疾病、免疫系统疾病等[5]。10-11 易位蛋白(ten-eleven translocation, TET) 是生物体内存在的一种α-酮戊二酸 (α-KG) 和Fe2+依赖的双加氧酶[6]。其家族成员包括TET1、TET2 和TET3,是DNA 去甲基化的关键调节因子,均可催化5-甲基胞嘧啶 (5mC) 转化为5-羟甲基胞嘧啶 (5hmC),进而启动 DNA 去甲基化过程[7]。其中TET2 具有“管家”作用,是正常造血的重要调节因子,与急性髓细胞白血病、骨髓增生异常综合征和其他髓系疾病有关[8]。TET2参与的表观遗传调控是调节炎症的关键因素,参与免疫反应和炎症的发生与消退过程[9]。此外,TET2 还参与动脉粥样硬化[10]、I 型糖尿病等疾病过程[11]。
近年来研究表明,TET1 和TET3 在脊髓中参与调控炎性疼痛[12];脊髓中的TET1 还参与调节慢性内脏性疼痛[13];另外,背根神经节 (dorsal root ganglion, DRG) 中的TET1参与神经病理性疼痛[14]。因此,尽管TET 家族在疼痛中的作用已有报道,但主要集中在TET1 和TET3,且主要在脊髓和DRG水平。TET2 蛋白与炎症密切相关,如TET2 缺陷型巨噬细胞表现出 NLRP3 炎性小体介导的IL-1β 分泌增加,因此TET2 促进炎症消退[15];艾滋病毒辅助蛋白通过促进TET2 降解,增加促炎细胞因子IL-6的过度表达而阻碍炎症消退并加速疾病的进展[16]。TET2在外周组织炎症和炎性疼痛中起怎样的作用,在外周是否参与炎症调节进而影响疼痛?上述问题尚未见报道。本研究主要围绕小鼠足底皮肤中的TET2 在炎性疼痛中的作用进行研究,研究结果将为开发新的镇痛药物提供思路。
方 法
1.实验动物
雄性C57BL/6 野生型小鼠30 只,Tet2-/-小鼠30 只,6~8 周龄,体重20~28 g,由南通大学动物实验中心提供;Tet2基因全敲除小鼠B6(Cg)-Tet2tm1.2Rao/J(Tet2-/-)从美国Jackson Laboratory 购买。所有小鼠的饲养条件遵循实验动物标准。小鼠均在每12 h 明/暗循环、温度20~22℃和湿度50%±5%的标准条件下饲养,自由摄取水和食物。
2.主要仪器和试剂
仪器:vonFrey Filament(Stoeling 公司)、Model 390 足热痛觉测试仪(IITC Life Science 公司)、肢体肿胀测量仪(Ugo Basile 公司)、冰冻切片机(Thermo公司)、石蜡切片机(Leica 公司)、黏附性载玻片(Thermo Scientific 公司)、正置荧光显微镜(Leica公司)。
试剂:福尔马林(Formalin)溶液(Sigma 公司)、完全弗氏佐剂(complete Freund's Adjuvant, CFA)(Sigma 公司)、异氟烷(瑞沃德公司)、多聚甲醛(Sigma-Aldrich 公司)、苏木素伊红染色试剂盒(碧云天公司)、兔抗TUJ1(CST 公司)、Cy3-驴抗兔IgG(Jackson 公司)、DAPI 染色试剂(Abcam 公司)。
3.方法
(1)模型制备:将小鼠分为对照组和实验组,每组6 只。正常小鼠清醒状态下,实验组小鼠足底皮下注射0.5%和5% Formalin 10 μl,对照组小鼠注射生理盐水,建立急性炎性疼痛模型,检测小鼠注射前和注射后第一时相(0~10 min)与第二时相(10~45 min)产生的自发性疼痛行为;足底皮下注射50% CFA 15 μl 建立慢性炎性疼痛模型,检测注射后6 h、1 天、3 天、7 天、10 天和14 天的热痛觉过敏及机械性触诱发痛;并用鼠足体积测量仪评估小鼠后足的体积。
(2)行为学检测:将小鼠置于温度20±2℃,相对湿度50%~60%,昼夜各12 h 环境条件下适应48 ~72 h,行为学均采用盲法检测。
福尔马林诱导的自发痛行为:正常小鼠清醒状态下,足底皮下注射0.5% 和5% Formalin 10 μl,置于透明鼠笼中,录像50 min。之后回放,用秒表记录每5 min 内小鼠舔足和抬足的时间。将结果汇总并分为两个阶段:第一时相(0~10 min)和第二时相(10~45 min)。
热痛觉过敏测试:小鼠放于专用的透明有机玻璃格并置于热痛仪恒温玻璃板上,玻璃板温度设置为30℃,调节照射强度将基础缩足潜伏期控制在8~14 s 之间,将20 s 设置为光照最长时间。在小鼠安静清醒的状态下,将光照点对准小鼠左后足中心位置,按下光照开始按钮,待小鼠出现缩足、舔足现象时立刻按下按钮停止光照,记录所得相应时间即为该小鼠本次热缩足反射潜伏期 (thermal withdrawal latency, TWL)。每只小鼠需重复测量3 次,以3 次的平均值作为该时间点的 TWL。缩足潜伏期越短说明该小鼠热痛觉过敏越严重。
机械性触诱发痛测试:将小鼠置于金属网架上的有机玻璃格内适应30~60 min,待其安静后用vonFrey Filament 纤维丝刺激小鼠左后足底后缘皮肤,观察小鼠缩足、舔足反应。纤维丝竖直刺激小鼠足底,以纤维丝稍弯曲作为用力标准,刺激时间为2 s,在不同部位共刺激5 次。在多次刺激中,若小鼠出现缩足、舔足现象则视为疼痛,根据“Dixon's up-down”检测法测量和计算机械刺激缩足反射阈值 (mechanical withdrawal threshold, MWT)。
(3)组织免疫荧光染色:异氟烷麻醉小鼠,0.9% 氯化钠溶液(20 ml)经心内灌注至小鼠血液完全排出,再换用4% 多聚甲醛 (PFA) 灌流50 ml。取小鼠足底皮肤用4% PFA 进行后固定4~6 h,再依次用20% 和30% 蔗糖溶液过夜脱水至组织沉底。使用Thermo 冰冻切片机进行冰冻切片。修剪组织,用OCT 包埋,连续切片,皮肤切片厚度为14 μm,使用粘附载玻片贴片,晾干后染色。染色:用0.01 M 磷酸缓冲盐溶液(PBS) 漂洗切片3 次,每次15 min;1% BSA 封闭液,室温封闭1 h;加入一抗4℃过夜孵育;次日拿出组织,0.01 M PBS 漂洗切片3 次,每次15 min;用0.01 M PBS 稀释免疫组化用荧光二抗,室温避光孵育2 h;弃去二抗,用0.01 M PBS 漂洗3 次,每次15 min;晾干后用防淬灭荧光封片剂避光封片,于显微镜下拍片。
(4)苏木素伊红 (HE) 染色:灌注方法同(3),取足底皮肤用4% PFA 后固定过夜。依次用梯度浓度乙醇对组织进行脱水处理,分别为30%×30 min;50%×30 min;75%×30 min;80%×30 min;95%×60 min;95%×30 min;100%×5 min;100%×5 min;二甲苯透明5 min×2 次,完全浸蜡1 h,进行石蜡包埋,石蜡切片(厚5 μm),37℃摊片,45℃烤片,以防脱片。HE 染色:二甲苯脱蜡5 min×2 次,用梯度浓度乙醇进行脱二甲苯处理,分别为100%×2 min;95%×2 min;80%×2 min;75%×2 min,再用流水冲洗30 s。苏木素染色8 min,流水冲洗30 s,1%盐酸乙醇处理2~3 s,流水冲洗30 s;热水加速蓝化,流水冲洗数分钟至颜色不再加深即可。伊红染色45 s,流水冲洗适当长时间,用梯度浓度乙醇进行脱水处理,分别为75%×2 min;95%×2 min;100%×2 min;二甲苯脱乙醇处理,2 min×2 次。中性树胶封片剂封片,通风橱晾干,正置荧光显微镜拍片。
(5)蛋白芯片检测:正常小鼠清醒状态下,对WT 及Tet2-/-小鼠均进行足底皮下注射50% CFA 15 μl,7 天后灌注取小鼠足底皮肤,由Bio-Rad 公司进行蛋白芯片检测。
4. 统计学分析
数据统计分析使用GraphPad Prism (version 8.01),均采用均数 ± 标准误(±SEM)表示。主要采用Student'st-test 检验,双因素方差分析 (Two-way ANOVA followed by the Bonferroni test)。P< 0.05 为差异有统计学意义。
结 果
1. Tet2-/- 小鼠的鉴定以及WT 和Tet2 小鼠足底TUJ1 与DAPI 的表达与分布
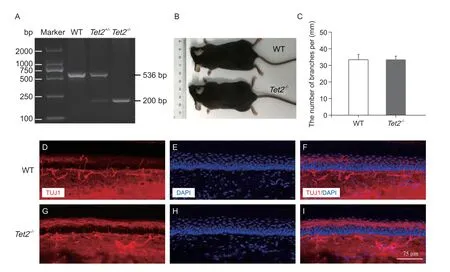
取小鼠耳部全基因组DNA,经普通PCR 扩增区分Tet2-/-小鼠与WT 小鼠。DNA 凝胶电泳显示,WT 小鼠对应的条带大小为536 bp,杂合型(Tet2+/-)小鼠对应的条带大小为536/ 200 bp,Tet2-/-小鼠对应的条带大小为200 bp(见图1A)。Tet2-/-小鼠与WT 小鼠外观无差异(见图1B)。免疫荧光检测Tet2-/-小鼠与WT 小鼠足底皮肤中神经纤维标记物TUJ1 及表皮层角质细胞标记物DAPI 的表达,结果差异无统计学意义(见图1C-I)。
2. WT 和Tet2-/-小鼠的急、慢性炎性疼痛行为
WT 和Tet2-/-小鼠足底注射5% Formalin,观察其自发痛行为。结果显示,WT 小鼠和Tet2-/-小鼠在第一时相(0~10 min)与第二时相(10~45 min)均呈现抬足、舔足、甩足等自发痛行为。在第一时相,Tet2-/-小鼠的自发痛行为比WT 小鼠强烈(P<0.05, Student'st-test),第二时相无显著性差异(见图2A)。注射低浓度的Formalin (0.5%) 后,Tet2-/-小鼠在第一时相和第二时相的抬足、舔足、甩足均高于WT 小鼠(P< 0.05, Student'st-test,见图2B)。
小鼠单侧足底注射50% CFA,检测WT 小鼠与Tet2-/-小鼠的热痛觉过敏(见图2C)和机械性触诱发痛(见图2D)。结果显示CFA 引起 WT 小鼠和Tet2-/-小鼠均产生明显的热痛觉过敏和机械性触诱发痛,两者均在注射后6 h 产生并持续10 天以上;但Tet2-/-小鼠的TWL 和MWT 均短于WT 小鼠。
3. WT 和Tet2-/- 小鼠在急、慢性炎性疼痛模型中的足底皮肤肿胀程度
足底注射0.5% Formalin 引起的Tet2-/-小鼠足底肿胀程度比WT 小鼠更明显(见图3A)。单侧足底注射50% CFA 后WT 小鼠与Tet2-/-小鼠均表现出明显的足底肿胀,并从注射后6 h 一直持续到第10天;在整个CFA 时程中,与WT 小鼠相比,Tet2-/-小鼠表现出更为明显的足底肿胀(见图3B)。
对WT 和Tet2-/-小鼠Saline 7 天和CFA 7 天的足底皮肤染色(见图3C-F)。结果表明,在慢性炎性疼痛模型中,WT 和Tet2-/-小鼠均表现出足底皮肤的真皮层 (dermis) 和皮下组织 (hypodermis) 增厚,并且Tet2-/-小鼠更为明显。
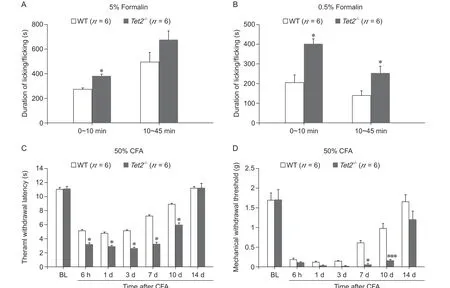
图 2 WT 和Tet2-/- 小鼠的急、慢性炎性疼痛行为(A) WT 与Tet2-/- 小鼠足底注射5% Formalin 后的自发痛行为;(B) WT 和Tet2-/- 小鼠足底注射0.5% Formalin 后的自发痛行为;(C) WT 与Tet2-/- 小鼠足底注射50% CFA 后的热缩足反射潜伏期;(D) WT 与Tet2-/- 小鼠足底注射50% CFA 后的机械刺激缩足反射阈值*P < 0.05,***P < 0.001,与WT 组相比Fig. 2 Acute and chronic inflammatory pain behavior in WT and Tet2-/-mice(A) The spontaneous pain of WT and Tet2-/-mice after intraplantar injection of 5% Formalin; (B) The spontaneous pain of WT and Tet2-/-mice after intraplantar injection of 0.5% Formalin; (C, D) The thermal withdrawal latency (C) and mechanical withdrawal threshold (D) after intraplantar injection of 50% CFA in WT and Tet2-/- mice.*P < 0.05,***P < 0.001, compared with group WT. Two-way ANOVA followed by the Bonferroni test.
4. CFA 模型小鼠足底皮肤中炎症介质表达
采用蛋白芯片检测WT 和Tet2-/-小鼠CFA 造模后7 天144 种炎症介质在皮肤组织的表达。与WT组相比,Tet2-/-小鼠足底皮肤中的104 种炎症介质表达变化(图中未显示),19种炎症介质表达明显上调,包括MMP9 (pro)(Matrix metalloproteinase 9,基质金属蛋白酶9 前体)、Resistin(抗素)、MMP3(基质金属蛋白酶3)、OPG(Osteoprotegerin,骨保护素)、IGF-II(Insulin-like growth factor 2,胰岛素样生长因子2)、TCK-1(Thymus chemokine-1,胸腺趋化因子1)、PF4(Platelet factor 4,血小板因子4)、TIMP2(Tissue inhibitor of metalloproteinase 2,金属蛋白酶组织抑制剂2)、IL-28(Interleukin-28,白介素28)、MIP-3alpha(Macrophages inflammatory protein-3alpha,巨噬细胞炎症蛋白3α)、GITRLigand(Glucocorticoid-induced tumor necrosis factor receptor ligand,糖皮质激素诱导的肿瘤坏死因子受体的配体)等(见图4A, B)。
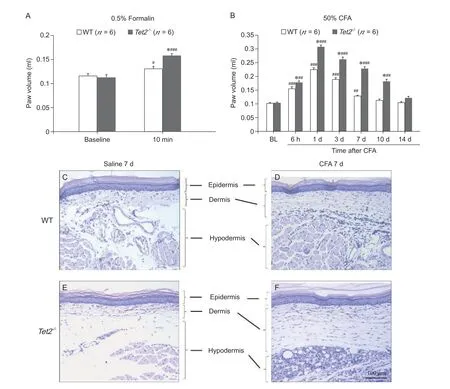
图 3 WT 和Tet2-/- 小鼠在急、慢性炎症性疼痛模型中足底皮肤肿胀程度(A) 足底注射0.5% Formalin 后,WT 和Tet2-/- 小鼠足底体积;(B)足底注射50% CFA 后WT 与Tet2-/- 小鼠足底体积;(C-F)组化染色显示对照组和CFA 组的WT 和Tet2-/- 小鼠足底皮肤结构*P < 0.05,与WT 组相比;#P < 0.05,## P < 0.01,### P < 0.001,与Baseline 相比Fig. 3 The plantar skin swelling in WT and Tet2-/-mice in acute and chronic inflammatory pain models(A) The paw volume of WT and Tet2-/- mice after injection of 0.5% Formalin; (B) The paw volume of WT and Tet2-/-mice after injection of 50% CFA; (C-F) Histochemistry showing the structure of paw skin in WT and Tet2-/- mice after injection of saline or CFA.*P < 0.05, compared with group WT; #P < 0.05, ##P < 0.01, ###P < 0.001, compared with Baseline.
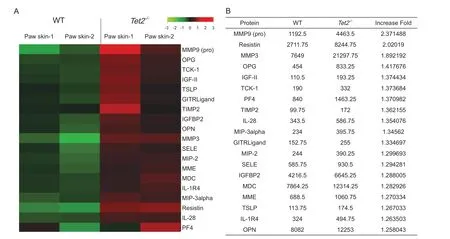
图 4 CFA 模型小鼠足底皮肤中炎症介质表达(A) WT 与Tet2-/- 小鼠CFA 7 d 模型中足底皮肤中炎症蛋白表达(n = 2)。红色越亮代表相应蛋白表达水平越高,绿色越亮代表该蛋白表达水平越低;(B)图A 的数据表Fig. 4 The expression of inflammatory mediators in plantar skin after CFA injection(A) Protein assay of plantar skin in WT and Tet2-/- mice 7 d after CFA injection (n = 2). The brighter the red is, the higher the expression level of the corresponding protein, and the brighter the green is, the lower the expression level of the protein; (B) Data sheet of Figure A.
讨 论
TETs 最初在急性骨髓和淋巴细胞白血病中被发现,是Fe2+和α-酮戊二酸依赖的10-11 易位蛋白(ten-eleven translocation),它的三个家族成员TET1、TET2、TET3 均可催化 5-甲基胞嘧啶 (5mC)依次氧化成5-羟甲基胞嘧啶 (5hmC),5-甲酰胞嘧啶 (5FC)、和5-羧基胞嘧啶 (5cac)。TET2 功能障碍与急性髓细胞白血病、骨髓增生异常综合征和其他髓系疾病有关[17]。TET2 通过催化5mC 调节DNA 甲基化/去甲基化过程参与免疫和炎症相关的多种疾病,如抑制TET2 可加速动脉粥样硬化性心血管疾病病程[9];TET2 可通过TGF-β1 启动子中CpG岛的去甲基化激活TGF-β1 的表达,在糖尿病肾病(DN) 的发病机制中发挥作用[18];TET2 在类风湿关节炎病人的单核细胞和T 细胞中的表达增加[19]。
本研究发现,敲除Tet2基因使小鼠产生更明显的急性炎性疼痛和慢性炎性痛觉过敏行为;并且在福尔马林引起的双时相反应中,两个时相均有变化。既往的研究表明,福尔马林引起的第一时相主要反映外周机制,由外周伤害性感受器的直接激活引起,第二时相主要反映中枢机制,由脊髓和脊髓以上的结构发生的中枢敏化引起。因此,本研究结果提示Tet2基因可能在外周和中枢均发挥作用。既往的研究显示,在脊髓神经元中,敲低或下调METTL3 与YTHDF2 协调机制,通过稳定上调TET1 调节炎性疼痛[20]。在脊髓背角星形胶质细胞,TET3 和GATA1协同调节DNA 去甲基化参与慢性内脏疼痛[13]。脊髓和脊髓上中枢中的TET2 在慢性疼痛中的作用还需要以后进一步研究。
本实验中观察到足底注射Formalin 和CFA 后Tet2-/-小鼠足底皮肤肿胀明显增加、真皮层和皮下组织增厚,说明外周皮肤中的TET2 发挥抑制炎症的作用。炎症的特征是免疫细胞浸润以及炎症介质的产生,典型的炎症相关的变化通常导致神经纤维对周围的化学环境敏化,在慢性疼痛的诱导和维持中有重要作用。相应地,炎症的消退是指一个复杂的过程,包括炎症因子的清除,炎症介质的分解或抑制等。研究发现,TET2 参与调节炎症反应,通过与Iκbζ 相互作用抑制巨噬细胞和树突状细胞中促炎细胞因子IL-6,并通过介导组蛋白去乙酰化酶1/2 (HDAC1/2) 的募集以抑制IL-6和IL-1β表达[21,22]。缺乏TET2 表达的肿瘤相关巨噬细胞表现出免疫活性表型,包括炎性细胞因子表达增加和ARG1 表达减少[23]。与此相一致,本研究的蛋白芯片结果显示,在CFA 诱导的慢性炎性疼痛模型中,敲除Tet2基因可导致小鼠足底皮肤中pro-MMP9、Resistin、MMP-3、OPG、PF4、IL-28 等19 种细胞因子表达上调。MMP-9 由非活性的pro-MMP-9 活化生成;而且MMP-3 是MMP-9 最有效的激活剂[24]。MMP-9 在神经退行性疾病的病理生理机制中发挥重要作用[25],并且参与多种急性和慢性炎性疾病[26]。Resistin 通过诱导炎性细胞因子、促进细胞黏附分子表达调节炎症、免疫和自身免疫反应[27],因此我们推测Tet2可能通过MMP-9 和Resistin 在炎性疼痛中发挥镇痛作用。
根据上述结果,Tet2-/-小鼠炎性疼痛和组织炎症程度增加很有可能与我们检测到的这些因子(如MMP-9、Resistin、OPG、IL-28、MIP-2)的表达上调有关,已有较多报道表明了它们与炎症的相关性。因此我们推测可能是敲除Tet2基因后导致小鼠足底皮肤细胞释放神经炎症物质增加,进而增强疼痛。通过外源性给予TET2 过表达病毒上调TET2 的水平可能为抗炎、镇痛提供有效的治疗途径。但是,TET2 在外周调节炎症和炎性疼痛的机制以及其是否参与脊髓水平疼痛调节还需要以后进一步研究。
利益冲突声明:作者声明本文无利益冲突。
