lncRNA TOPORS-AS1靶向miR-718对胃癌细胞增殖、迁移和凋亡调控作用研究
2022-10-31邱实曹佳懿余雅靖
邱实 曹佳懿 余雅靖
胃癌是全球第五大常见癌症和第三大癌症相关死亡原因,虽然部分患者可从手术、辅助化疗中获益,但大多数患者确诊时已处于疾病晚期或发生转移,治疗往往无效[1,2]。研究显示包括长链非编码RNA(lncRNA)、微小RNA(miRNA)在内的非编码RNA在胃癌进展中发挥重要作用,lncRNA通过与miRNA结合调节下游靶基因表达广泛参与细胞周期、凋亡、转移、血管生成等细胞过程,其表达改变与胃癌的肿瘤特征显著相关,具有作为胃癌治疗靶点的潜力[3,4]。有报道称lncRNA TOPORS反义RNA 1(TOPORS-AS1)在胃癌组织中的表达显著低于癌旁非肿瘤组织[5],但TOPORS-AS1在胃癌中的作用和调控机制并未有研究。研究报道miR-718高表达与胃癌患者预后不良显著相关,下调miR-718可通过抑制磷脂酰肌苷3-激酶/蛋白激酶B(PI3K/Akt)信号通路,从而抑制胃癌细胞增殖和侵袭[6]。miR-718还可作为FBXL19反义RNA 1(FBXL19-AS1)的直接靶点,介导干扰FBXL19-AS1对乳腺癌进展的抑制作用[7]。生物信息学分析显示TOPORS-AS1与miR-718存在相互作用,但TOPORS-AS1是否靶向miR-718调控胃癌进展尚需验证。本研究探讨了TOPORS-AS1在胃癌中的表达、生物学功能及其潜在机制,旨在为胃癌治疗提供新的抗癌靶点。报告如下。
1 材料与方法
1.1 材料
1.1.1 胃癌组织:以2018年7月至2019年12月我院住院的43例胃癌患者,其中男23例,女20例;年龄45~76岁,平均年龄(61.3±7.5)岁,术中取人胃癌组织及癌旁组织(正常组织标本)。患者术前均未接受任何辅助治疗。标本立即冷冻,-80℃保存。本研究的开展获得我院伦理委员会的批准,患者均签订知情同意书。
1.1.2 细胞与试剂:人胃癌细胞系HGC-27、正常胃黏膜上皮细胞系GES-1购自美国ATCC;Lipofectamine 2000购自美国Invitrogen公司;PrimerScript逆转录试剂盒、miRNA cDNA合成试剂盒、SYBR green Premix Ex Taq Ⅱ购自大连宝生物公司;荧光素酶报告载体、pcDNA-TOPORS-AS1、pcDNA、anti-miR-NC、anti-miR-718、miR-NC、miR-718 mimics购自广州锐博生物公司;CCK-8试剂盒购自南京恩晶生物科技公司;Transwell板(24孔)美国BD公司;Annexin-FITC/碘化丙啶双染凋亡检测试剂盒购自上海锐赛生物公司。
1.2 方法
1.2.1 细胞培养:HGC-27、GES-1细胞均接种在RPMI-1640培养基中在37℃、含5%CO2、湿润培养箱中培养,该培养基中添加1%青链霉素混合液和10%胎牛血清。
1.2.2 RT-qPCR检测TOPORS-AS1、miR-718表达:用TRIzol试剂提取胃癌组织和细胞系的总RNA,分别用PrimerScript逆转录试剂盒、miRNA cDNA合成试剂盒进行反转录,应用SYBR green Premix Ex Taq II进行RT-qPCR。GAPDH上游引物5’-ACCCACTCCTCCACCTTTGAC-3’,下游引物5’-TGTTGCTGTAGCCAAATTCGTT-3’;TOPORS-AS1上游引物5’-GCAAGCAGCAAGTAAGAAGCG-3’,下游引物5’-GCAAGCAGCAAGTAAGAAGCG-3’;U6上游引物5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物5’-CGCTTCACGAATTTGCGTGTCAT-3’;miR-718上游引物5’-CAGTGCGTGTCGTGGAGT-3’,下游引物5’-CAGTGCGTGTCGTGGAGT-3’。2-ΔΔCt法计算TOPORS-AS1、miR-718表达量。
1.2.3 实验分组:将HGC-27细胞接种6孔板,培养24 h后进行转染,即用Lipofectamine 2000转染pcDNA、pcDNA-TOPORS-AS1、anti-miR-NC、anti-miR-718、pcDNA-TOPORS-AS1+miR-NC、pcDNA-TOPORS-AS1+miR-718 mimics至50%融合细胞。转染48 h后收集细胞进行RT-qPCR分析。HGC-27细胞共分为pcDNA组、pcDNA-TOPORS-AS1组、anti-miR-NC组、anti-miR-718组、pcDNA-TOPORS-AS1+miR-NC组、pcDNA-TOPORS-AS1+miR-718组。
1.2.4 CCK-8和克隆形成实验检测增殖:CCK-8实验:将转染细胞(5×103个/孔)接种在96孔板并在培养箱孵育48 h。每孔加入10 μl CCK-8试剂,再孵育4 h。酶标仪测量450 nm处的吸光度(A)。抑制率(%)=(1-实验A/对照A)×100%克隆形成实验:将转染细胞(5×102个/孔)接种到6孔板置于培养箱孵育。每3天更换1次培养基。2周后,用甲醇固定细胞集落,用0.1%结晶紫染色。计数超过50个细胞的集落。
1.2.5 Transwell法检测细胞迁移:取200 μl无血清培养基重悬的细胞悬液接种于上室,下室加入含10%胎牛血清的培养基。孵育24 h后,用棉签去除未穿膜细胞。用4%多聚甲醛固定穿膜细胞,0.1%结晶紫染色15 min。显微镜下计数膜上随机5个视野的细胞数,用平均值表示细胞迁移数量。
1.2.6 流式细胞术评估细胞凋亡:用冷PBS洗涤转染细胞2次,用500 μl的1×结合缓冲液(含5 μl Annexin-FITC和5 μl碘化丙啶)重悬,避光孵育15 min,流式细胞术检测细胞凋亡情况。
1.2.7 双荧光素酶报告实验:将含有miR-718结合位点的TOPORS-AS1片段克隆到psiCHECK-2载体构建野生型(WT)荧光素酶报告载体WT-TOPORS-AS1;将突变TOPORS-AS1片段克隆到psiCHECK-2载体构建突变型(MUT)荧光素酶报告载体MUT-TOPORS-AS1。用Lipofectamine 2000将WT-TOPORS-AS1、MUT-TOPORS-AS1分别与miR-718 mimics、miR-NC共转染细胞。用双荧光素酶报告基因检测系统在转染后48 h测量萤火虫和海肾荧光素酶活性,相对荧光素酶活性以二者的比值表示。
1.2.8 Western blot检测蛋白表达:RIPA缓冲液裂解转染细胞提取总蛋白。测定蛋白浓度后,取等量变性蛋白用SDS-PAGE分离,并转移到PVDF膜。用5%脱脂牛奶溶液封闭膜后,用针对Cleaved-caspase3、GAPDH的的特异性抗体在4℃下孵育过夜。随后,将膜与酶标二抗在室温下孵育1 h。化学光光发法进行显色反应,Image J软件分析Cleaved-caspase3相对于GAPDH条带灰度值表示其蛋白表达量。
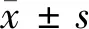
2 结果
2.1 胃癌组织和细胞中TOPORS-AS1、miR-718表达的检测 胃癌组织中TOPORS-AS1表达水平显著高于癌旁组织(P<0.05),miR-718表达水平显著低于癌旁组织(P<0.05)。HGC-27细胞TOPORS-AS1表达水平显著低于GES-1细胞(P<0.05),miR-718表达水平显著高于GES-1细胞(P<0.05)。见表1。

表1 TOPORS-AS1、miR-718表达的检测
2.2 TOPORS-AS1对HGC-27增殖、迁移、凋亡的影响 转染pcDNA-TOPORS-AS与转染pcDNA比较HGC-27细胞TOPORS-AS1表达水平显著升高(P<0.05),表明转染pcDNA-TOPORS-AS1可促进TOPORS-AS1表达。与pcDNA组比较,pcDNA-TOPORS-AS1组HGC-27细胞抑制率、凋亡率、Cleaved-caspase3蛋白表达显著升高(P<0.05),克隆形成数、迁移细胞数显著减少(P<0.05)。见图1,表2。

图1 TOPORS-AS1促进HGC-27凋亡及Cleaved-caspase3蛋白的表达
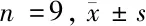
表2 TOPORS-AS1抑制HGC-27增殖迁移促进凋亡
2.3 TOPORS-AS1和miR-718靶向关系 DIANA Tools预测到TOPORS-AS1和miR-718存在互补核苷酸序列。miR-718+ WT-TOPORS-AS1组HGC-27的相对荧光素酶活性显著低于miR-NC+WT-TOPORS-AS1组(P<0.05);miR-718+MUT-TOPORS-AS1组HGC-27的相对荧光素酶活性与miR-NC+ MUT-TOPORS-AS1组比较无明显变化。pcDNA-TOPORS-AS1组HGC-27细胞miR-718表达显著低于miR-718组(P<0.05)。见图2,表3、4。

图2 TOPORS-AS1和miR-718互补序列
2.4 抑制miR-718对HGC-27增殖、迁移、凋亡的影响 转染anti-miR-718与转染anti-miR-NC比较HGC-27细胞miR-718表达显著降低,表明转染anti-miR-718可抑制miR-718表达。与anti-miR-NC组比较,anti-miR-718组HGC-27细胞抑制率、凋亡率、Cleaved-caspase3蛋白表达显著升高,差异有统计学意义(P<0.05),克隆形成数、迁移细胞数显著减少(P<0.05)。见图3,表5。

表3 双荧光素酶报告实验

表4 TOPORS-AS1调控miR-718的表达

图3 抑制miR-718促进HGC-27凋亡及Cleaved-caspase3蛋白的表达

表5 抑制miR-718抑制HGC-27增殖迁移促进凋亡
2.5 过表达miR-718逆转TOPORS-AS1过表达对HGC-27增殖、迁移、凋亡的影响 与pcDNA-TOPORS-AS1+miR-NC组比较,pcDNA-TOPORS-AS1+miR-718组HGC-27细胞miR-718表达、克隆形成数、迁移细胞数显著升高(P<0.05),细胞抑制率、凋亡率、Cleaved-caspase3蛋白表达显著降低(P<0.05)。见图4,表6。

图4 miR-718逆转TOPORS-AS1对HGC-27凋亡的促进作用及Cleaved-caspase3蛋白表达的促进作用
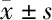
表6 过表达miR-718和TOPORS-AS1对HGC-27增殖迁移凋亡的作用
3 讨论
lncRNA在癌症的发生和转移中发挥着重要作用。研究显示lncRNA在胃癌组织中的表达显著改变,并参与多种肿瘤生物学过程,例如,LINC00511在胃癌中上调,并与晚期临床特征和预后不良呈正相关[8]。lncRNA肿瘤易感基因11(CASC11)参与调控胃癌细胞周期阻滞、凋亡、迁移[9]。lncRNA HOX转录反义RNA(HOTAIR)通过靶向miR-1277-5p和上调COL5A1表达来促进胃癌的生长和转移[10]。然而,笔者发现差异表达的lncRNA在胃癌中的作用并未完全阐明。本研究检测到胃癌组织、细胞系中TOPORS-AS1表达显著减少,提示TOPORS-AS1低表达可能有助于胃癌进展。
已有研究证实TOPORS-AS1低表达乳腺癌患者总生存率较差,过表达TOPORS-AS1可抑制乳腺癌细胞增殖,抑制细胞侵袭行为[11]。为探讨TOPORS-AS1在胃癌进展中的作用,本研究转染pcDNA-TOPORS-AS1至胃癌细胞HGC-27分析其功能,结果表明,过表达TOPORS-AS1可抑制细胞克隆形成和增殖能力,提高细胞凋亡率,这与乳腺癌中TOPORS-AS1的抑制作用一致。Cleaved-caspase3是凋亡执行蛋白,具有促凋亡作用,Cleaved-caspase3水平被认为是评估细胞凋亡的重要指标[12,13]。本研究中过表达TOPORS-AS1能够诱导Cleaved-caspase3表达上调,者进一步证实过表达TOPORS-AS1的凋亡促进功能。
miRNA是在基因表达的转录后调控中发挥功能的短链非编码RNA分子,近年研究发现lncRNA可结合特定miRNA进而调控肿瘤进展[14]。本研究证实miR-718是TOPORS-AS1的直接靶点。研究表明非小细胞肺癌中miR-718表达降低与肿瘤大小、淋巴结转移、较差的总生存率显著相关[15]。乳头状甲状腺癌中miR-718表达降低,上调miR-718表达可抑制肿瘤细胞葡萄糖代谢和迁移[16]。肝癌中miR-718过表达导致肿瘤细胞增殖率升高,lncRNA SEMA3B反义RNA 1(SEMA3B-AS1)靶向下调miR-718可抑制肝癌细胞增殖[17]。本研究发现胃癌组织、细胞系中miR-718表达显著升高,抑制miR-718表达可下调Cleaved-caspase3水平,诱导细胞凋亡,抑制细胞增殖,这与Liu等[6]报道miR-718在胃癌致癌作用吻合。
过表达TOPORS-AS1后HGC-27细胞中miR-718是表达降低,且抑制miR-718表达和过表达TOPORS-AS1的抗胃癌作用一致,提示胃癌中存在潜在TOPORS-AS1/miR-718调控分子轴。回复实验表明,过表达miR-718还可减弱TOPORS-AS1过表达对HGC-27细胞增殖、凋亡和迁移的影响,基本恢复HGC-27细胞恶性行为,这提示TOPORS-AS1在胃癌中至少通过部分调控miR-718表达发挥抑癌功能。
综上所述,TOPORS-AS1在胃癌中呈低表达,TOPORS-AS1通过靶向负调控miR-718可抑制胃癌细胞增殖、迁移并促进凋亡。这些发现可为研究胃癌发生、进展机制提供新的视角,并可能为胃癌治疗提供新的抗癌靶点。
