LncRNA GAS6-AS1靶向miR-324-3p激活Wnt/β-catenin通路调控脑胶质瘤细胞增殖及放疗敏感性的研究
2022-10-31徐华张海萍王虹伊赵钦郭巧宁马蕾陆军
徐华 张海萍 王虹伊 赵钦 郭巧宁 马蕾 陆军
脑胶质瘤是中枢神经系统最常见、最具侵袭性的原发肿瘤,约占脑肿瘤原发恶性肿瘤的80%[1]。尽管手术切除后放疗和化疗的联合治疗取得了进展,但患者的预后仍然很差,诊断后的中位生存期约为15个月[2]。因此,有必要识别特定于胶质瘤阶段或胶质瘤对抗癌药物易感性的新生物标记物,为胶质瘤的治疗管理提供重要的见解。在众多被证实参与胶质瘤的分子中,lncRNA因其在癌变过程中的异常表达越来越受到关注[3,4]。LncRNA通常被定义为长度在200 bp~100 kbp的非蛋白质编码RNA分子[5]。研究表明lncRNA以通过多种方式调控基因表达,包括染色体重构、转录和转录后加工,并参与细胞周期控制、转录和翻译调控[6]。此外,lncRNA的失调越来越多地与许多人类疾病,特别是癌症有关[7,8]。如高表达lncRNA CCND2-AS1通过Wnt/β-catenin信号促进胶质瘤细胞增殖[9]。另外发现lncRNA CCAT1通过海绵化miR-181b促进胶质瘤的发生[10]。目前研究表明LncRNA GAS6-AS1参与了乳腺癌、肺腺癌等癌症的发生发展[11]。然而,关于LncRNA GAS6-AS1在胶质瘤中的特异性表达模式尚未有全面的研究报道,LncRNA GAS6-AS1参与胶质瘤发展的潜在作用和机制尚不清楚,因此本研究主要揭示了LncRNA GAS6-AS1在胶质瘤增殖过程中的作用及其影响放疗敏感性的作用机制。
1 材料与方法
1.1 实验材料 脑胶质瘤样本均来自本院经病理确诊的脑胶质瘤患者。所有患者术前未接受化疗或放疗。所有标本切除后立即用液氮冷冻,并在-80℃保存直到使用。本研究经本院的伦理委员会批准,并获得所有患者的书面知情同意。脑胶质瘤T98G细胞来自武汉普诺赛生命科技有限公司。CCK-8检测试剂盒购自大连美仑生物技术公司。DMEM培养基(Dulbecco改良的Eagle培养基)来自美国ATCC。TRIzol试剂来自美国Invitrogen公司。Lipofectamine 2000转染试剂购自美国Invitrogen公司。GAS6-AS1 siRNA质粒及其对照质粒来自上海生物工程有限公司。
1.2 细胞培养 人脑胶质瘤T98G细胞在添加10%胎牛血清Dulbecco’s-modified Eagle培养基(DMEM)中培养,并置于37℃、5% CO2湿化培养箱中。
1.3 细胞转染 T98G细胞铺于12孔板,查看细胞汇合至75%,根据制造商的说明利用Lipofectamine 2000将质粒转染至T98G细胞中,并用X射线垂直照射细胞,48 h后进行检测。
1.4 T98G细胞增殖能力测定 6孔板中的T98G细胞稀释后接种到96孔板中,同时设置6 Gy X射线照射细胞作为实验组,将10 μl CCK-8溶液加入96孔板中并在37℃培养箱中孵育4 h。实验重复3次后分析细胞吸光度值。
1.5 双荧光素酶报告基因活性检测 包含miR-324-3p结合位点的GAS6-AS1序列克隆到pmirGlO双荧光素酶载体中制备GAS6-AS1 wt质粒,利用点突变试剂盒制备GAS6-AS1 mut质粒。按照说明书取Lipofectamine 2000将LncRNA GAS6-AS1 wt、LncRNA GAS6-AS1 mut分别与miR-324-3p mimics、mimics NC转染至T98G细胞,检测双荧光素酶活性。
1.6 细胞侵袭实验 取Transwell上室加入Matrigel并在37℃下使其干燥,取含10%胎牛血清的培养基加入,将转染48 h的细胞悬液加入上室中。48 h后用4%多聚甲醛固定,并加入0.1%结晶紫染色,利用显微镜随机选取视野进行细胞计数。
1.7 实时定量PCR 使用TRIzol试剂从组织或培养细胞中提取总RNA。使用PrimeScript RT试剂试剂盒(Takara,辽宁大连,中国)将RNA逆转录为互补DNA (cDNA)。其合成是按照说明书在37℃孵育15 min,然后85℃孵育5 s。采用ABI7500系统进行实时荧光定量PCR反应。实时聚合酶链反应重复进行3次。以GAPDH作为内参基因。见表1。
1.8 流式细胞仪检测T98G细胞凋亡率 取转染48 h后的T98G细胞,消化后将细胞进行离心,并取流式缓冲液加入细胞中,取5 μl Annexin V-APC置于其中,静置30 min,取5 μl PI置于其中,静置5 min用上机检测细胞凋亡率。
1.9 Western blot 使用RIPA裂解缓冲液裂解细胞,并提取总蛋白,所有步骤均按照厂家的操作规程进行。随后将细胞裂解液放入5× SDS-PAGE上样缓冲液中煮沸10 min,用12% SDS-PAGE溶液溶解并转移到硝化纤维素膜中。一抗和二抗分别孵育蛋白后用ECL试剂盒检测蛋白表达。
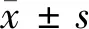
2 结果
2.1 4组细胞增殖、侵袭及放疗敏感性比较 与癌旁正常组织比较,脑胶质瘤组织中LncRNA GAS6-AS1 mRNA表达显著升高,差异有统计学意义(P<0.01)。2、4、6 Gy X射线照射T98G细胞后中GAS6-AS1 mRNA表达低于0 Gy剂量X射线照射(P<0.05)。下调LncRNA GAS6-AS1表达后,GAS6-AS1 mRNA表达明显降低(P<0.01)。下调GAS6-AS1表达后,T98G细胞活力降低(P<0.01),细胞侵袭数目减少。6 Gy X射线照射细胞后活力明显降低(P<0.05),细胞凋亡率显著升高(P<0.05);下调GAS6-AS1表达后并用6 Gy X射线照射细胞,活力明显降低(P<0.05),细胞凋亡率明显升高(P<0.05)。见图1,表2、表3。
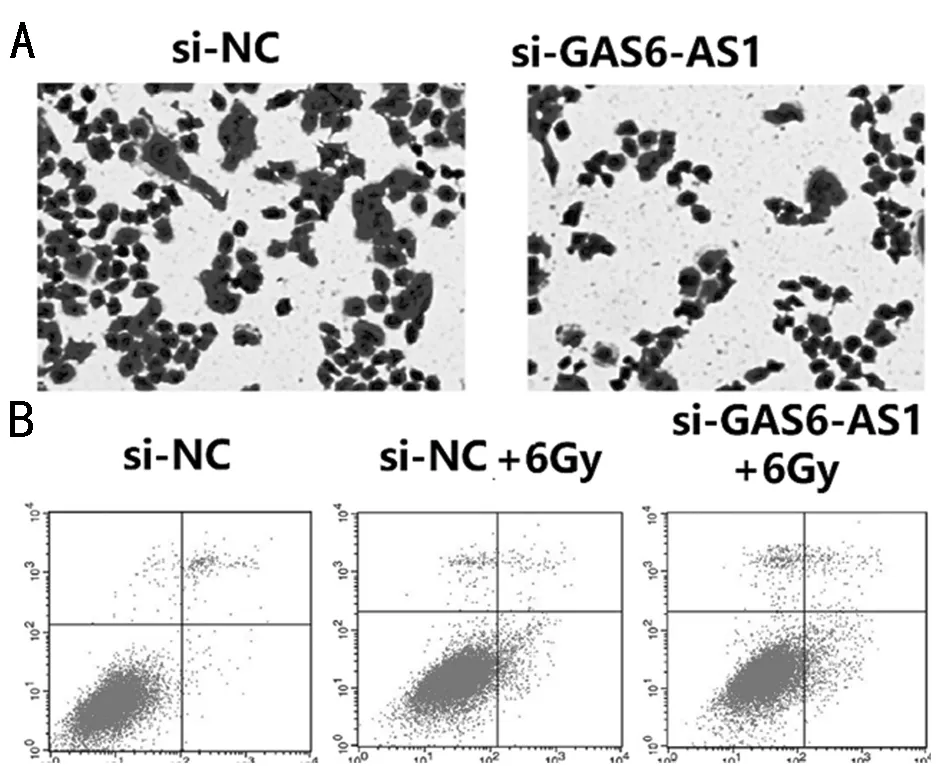
图1 下调LncRNA GAS6-AS1影响T98G细胞增殖、侵袭及放疗敏感性;A 下调LncRNA GAS6-AS1表达后检测细胞侵袭情况(结晶紫染色,×200);B 下调LncRNA GAS6-AS1表达后用6 Gy X射线照射检测细胞凋亡率
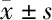
表2 LncRNA GAS6-AS1 mRNA表达
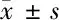
表3 4组细胞增值、侵袭能力比较
2.2 4组双荧光素酶活性比较 GAS6-AS1 wt+miR-324-3p mimics组荧光素酶活性显著低于mimics NC+GAS6-AS1 wt组(P<0.01),GAS6-AS1 mut+miR-324-3p mimics组荧光素酶活性与mimics NC+GAS6-AS1 mut组比较,差异无统计学意义(P>0.05)。见表4,图2。
表4 4组双荧光素酶活性比较
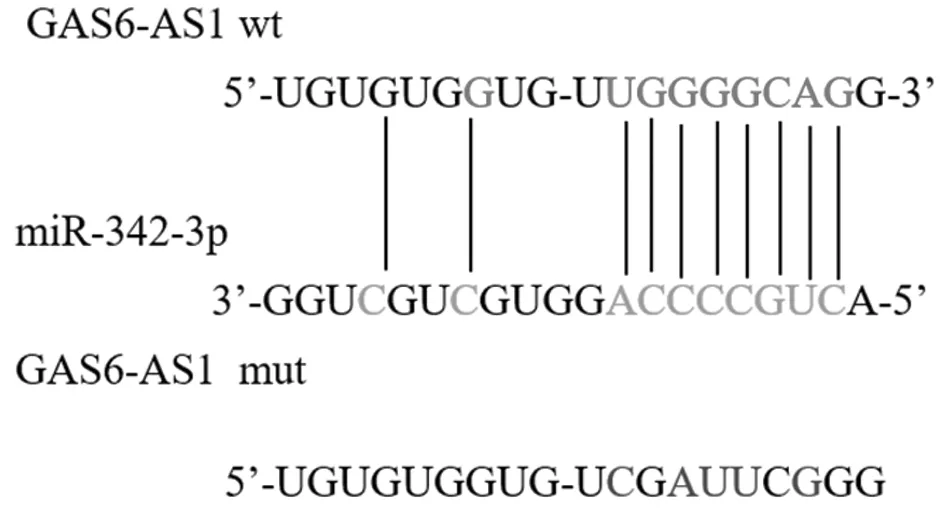
图2 LncRNA GAS6-AS1与miR-324-3p的结合位点
2.3 上调LncRNA GAS6-AS1通过miR-324-3p影响T98G细胞增殖、侵袭及放疗敏感性 与癌旁正常组织比较,脑胶质瘤组织中miR-324-3p mRNA表达显著降低(P<0.01)。2、4、6 Gy X射线照射T98G细胞后中miR-324-3p mRNA表达高于0 Gy剂量X射线照射(P<0.05)。上调GAS6-AS1和miR-324-3p表达后,GAS6-AS1、miR-324-3p mRNA表达明显升高(P<0.01)。与pcDNA-3.1(+)+mimics NC组比较,pcDNA-GAS6-AS1+mimics NC组T98G细胞活力和侵袭数目显著升高(P<0.05),pcDNA-3.1(+)+miR-324-3p mimics组细胞活力和侵袭数目显著降低(P<0.05);与pcDNA-3.1(+)+miR-324-3p mimics组比较,pcDNA-GAS6-AS1+miR-324-3p mimics组细胞活力和侵袭数目显著升高(P<0.05)。与pcDNA-3.1(+)+mimics NC+6 Gy组比较,pcDNA-GAS6-AS1+mimics NC+6 Gy组细胞活力明显上升,细胞凋亡率明显降低(P<0.05);pcDNA-3.1(+)+miR-324-3p mimics +6 Gy组细胞活力明显降低,细胞凋亡率明显上升(P<0.05);与pcDNA-3.1(+)+miR-324-3p mimics +6 Gy组比较,pcDNA-GAS6-AS1+miR-324-3p mimics +6 Gy组细胞活力明显上升,细胞凋亡率明显降低(P<0.05)。见表5~7,图3。
表5 miR-324-3p mRNA表达
表6 4组细胞增值、侵袭能力比较
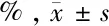
表7 4组细胞增值能力和凋亡率比较
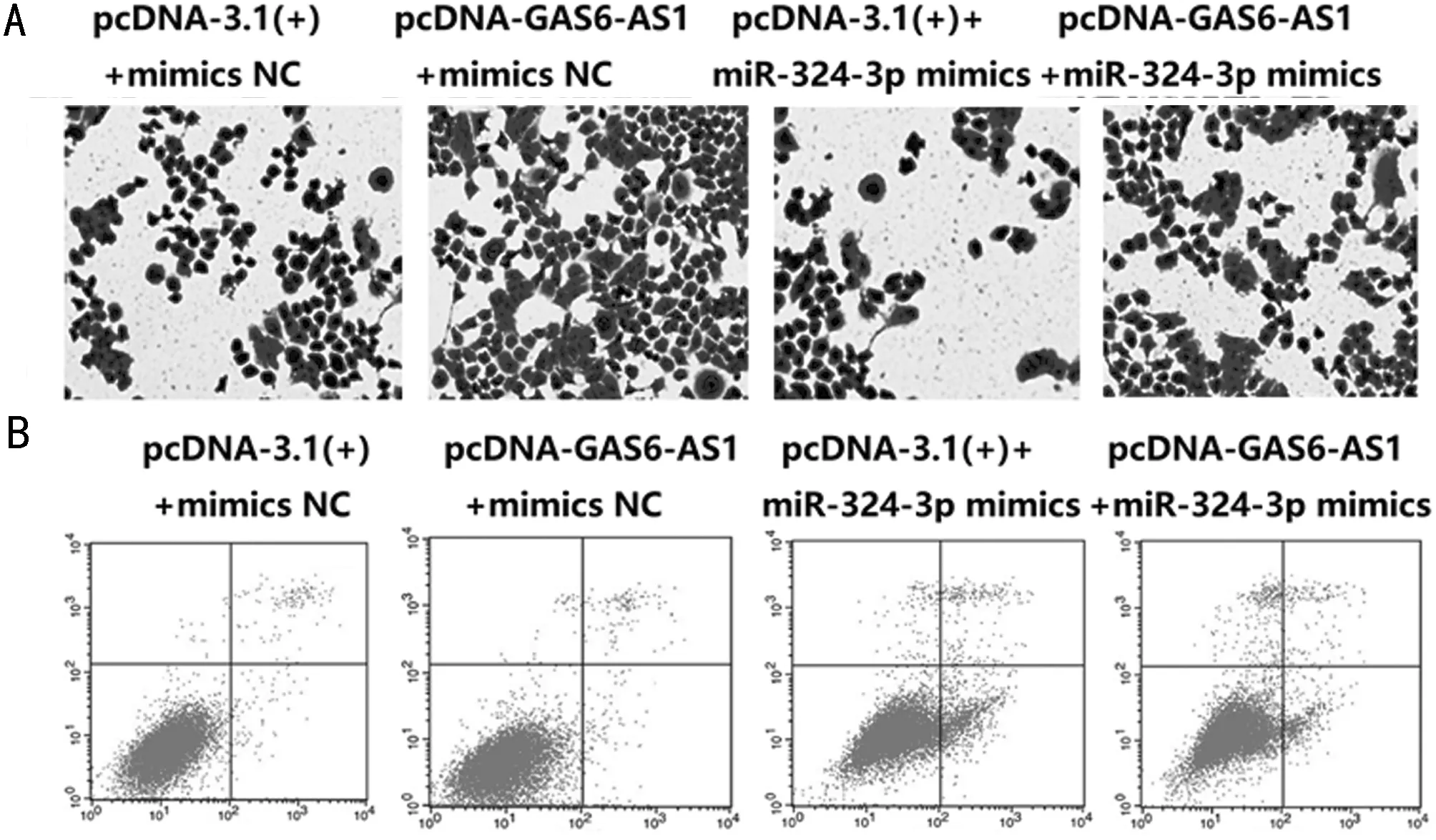
图3 上调LncRNA GAS6-AS1通过miR-324-3p影响T98G细胞增殖、侵袭及其放疗敏感性;A Transwell实验检测上调LncRNA GAS6-AS1通过miR-324-3p对T98G细胞侵袭的影响(结晶紫染色×200);B 流式细胞仪检测同时LncRNA GAS6-AS1和miR-324-3p表达且用6 Gy处理细胞后对T98G细胞凋亡的影响
2.4 miR-324-3p对Wnt/β-catenin信号通路的影响 与mimics NC组比较,miR-324-3p mimics组细胞内β-catenin和CyclinD1蛋白表达显著降低,β-catenin/GAPDH、CyclinD1/GAPDH比值显著降低(P<0.01)。与inhibitor NC组比较,miR-324-3p inhibitor组细胞内β-catenin和CyclinD1蛋白表达显著升高,β-catenin/GAPDH、CyclinD1/GAPDH比值显著升高(P<0.01)。见表8,图4。
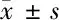
表8 4组细胞CyclinD1/GAPDH、β-catenin/GAPDH比较
图4 Western blot检测过表达及下调miR-324-3p表达对A549细胞内CyclinD1、β-catenin表达的影响
2.5 下调miR-324-3p通过Wnt/β-catenin信号通路对T98G细胞增殖、侵袭及放疗敏感性的影响 与inhibitor NC组比较,miR-324-3p inhibitor转染T98G细胞48 h后增殖活力显著上调(P<0.05),细胞侵袭数目明显增加(P<0.01);与miR-324-3p inhibitor组比较,miR-324-3p inhibitor+XAV939组细胞增殖活力显著降低(P<0.05),细胞侵袭数目明显减少(P<0.01)。用6 Gy X射线照射T98G细胞后,与inhibitor NC组比较,miR-324-3p inhibitor组细胞增殖活力显著上调(P<0.05),细胞凋亡率明显降低(P<0.01),与miR-153-3p inhibitor组比较,miR-153-3p inhibitor+XAV939组细胞增殖活力显著降低(P<0.05),细胞凋亡率明显升高(P<0.01)。见图5,表9、10。
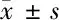
表9 3组细胞增值、侵袭能力比较
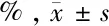
表10 3组细胞增值能力和凋亡率比较
3 讨论
在本研究中,我们首先发现lncRNA GAS6-AS1在胶质瘤恶性组织中较邻近正常组织高表达。我们的研究表明,LncRNA GAS6-AS1靶向miR-324-3p激活Wnt/β-catenin通路促进了T98G细胞增殖和侵袭,降低了放疗敏感性。
lncRNA具有不同的功能,包括基础转录机制中的基因转录调控、转录后RNA剪接调控和表观遗传调控[12]。随着对lncRNA功能属性的研究不断研究,lncRNA可能在生理过程和病理状态中发挥重要作用[13]。在以往的研究中,许多lncRNA已被证实为肿瘤抑制基因和预后生物标志物。例如,内质网应激和p53参与lncRNA meg3诱导人肝癌HepG2细胞凋亡[14]。LncRNA TNRC6C-AS1作为miR-129-5p的竞争性内源性RNA,调节甲状腺癌中的UNC5B,影响细胞增殖、迁移和侵袭[15]。lncRNA GAS6-AS1作为一种重要的lncRNA参与各种癌症发展,如长链非编码RNA GAS6-AS1作为microRNA-585的ceRNA,从而增加EIF5A2的表达,促进肝细胞癌的致癌性[16]。lncRNA GAS6-AS1通过靶向miR-324-3p/SETD1A轴激活PI3K/AKT通路,促进乳腺癌的进展。然而lncRNA GAS6-AS1在胶质瘤中的作用尚未见报道。在目前的研究中,我们发现了lncRNA GAS6-AS1在胶质瘤组织和细胞中高表达,而在X射线照射的T98G细胞中表达明显下调,这是之前在肿瘤生物学领域未见报道的。我们进一步发现,沉默lncRNA GAS6-AS1可以显著抑制细胞增殖和侵袭,增强细胞的放疗敏感性。这些结果表明,高表达的lncRNA GAS6-AS1促进了胶质瘤细胞的增殖和生长。
研究表明,lncRNA调控胶质瘤细胞发展的作用机制可能会通过靶向miRNA实现,如LncRNA NFIA-AS2通过调节miR-655-3p/ZFX轴促进胶质瘤进展[17]。另外还有文献发现,lncRNA KTN1AS1通过负调控miR-505-3p促进胶质瘤细胞增殖和侵袭[18]。受上述观点启发,我们通过软件预测了lncRNA GAS6-AS1的作用位点,结果发现lncRNA GAS6-AS1能够靶向miR-324-3p。我们还发现,miR-324-3p在胶质瘤组织和细胞中低表达,而在X射线照射的T98G细胞中表达明显上升。接下来的功能研究提示我们上调lncRNA GAS6-AS1靶向miR-324-3p可以促进细胞增殖和侵袭,降低细胞的放疗敏感性。据相关研究结果所知,Wnt/β-catenin信号通路在多种肿瘤中被激活,在调节癌细胞增殖、生长和存活中起着至关重要的作用,胶质瘤也是如此[19,20]。我们的研究结果揭示了下调miR-324-3p激活了Wnt/β-catenin信号通路促进细胞生长的机制。但miR-324-3p调控Wnt/β-catenin信号通路的具体机制有待进一步研究。
综上所述,在目前的研究中,我们证实了lncRNA GAS6-AS1在胶质瘤组织中普遍上调,并且这种表达模式发挥了致癌作用。高表达的lncRNA GAS6-AS1促进胶质瘤细胞增殖和侵袭,进一步研究发现lncRNA GAS6-AS1靶向miR-324-3p调控Wnt/ β-catenin信号通路影响胶质瘤细胞增殖和放疗敏感性。这些结果表明,lncRNA GAS6-AS1在胶质瘤中发挥了重要作用,找出其机制可能是治疗胶质瘤的一种潜在的新策略。
