碳源对白桦茸菌丝体生长及多糖活性的影响
2022-10-31秦锦涛王亮曹羽杰赖玉婷郑钦华林翰黄卓欣杨东生王兰英
秦锦涛,王亮,曹羽杰,赖玉婷,郑钦华,林翰,黄卓欣,杨东生,王兰英
(珠海科技学院药学与食品科学学院,广东 珠海 519041)
桦褐孔菌(Phaeoporus obliquus)又称白桦茸、斜管纤孔菌、褐多孔菌[1],具有良好药用价值。白桦茸在我国主要分布于东北地区,国外多分布于俄罗斯远东等地,其次在朝鲜北部、日本北海道等地区也有一定的分布[2]。白桦茸在世界上享有“西伯利亚灵芝”的盛名,其成熟的子实体颜色呈现出深栗色或黄褐色或炭黑色,通常生长于桦树树皮的破损处,子实体外形多数为类球形或不规则的块状,质地坚硬而无菌柄[3]。白桦茸具有抗癌、抗氧化、抗炎、抗病毒、抗过敏、增强免疫能力、降血糖或血脂以及保肝护肝作用,被广泛地用于胃部癌症、胃溃疡、胃炎等疾病的治疗,具有较高的应用价值[4-9]。目前已明确的白桦茸化学成分具有200余种,其中具有主要生物学活性的成分为多糖类物质、萜类物质等[10-11]。随着药用真菌被不断深入地研究与开发,白桦茸逐渐成为当下的研究热点,基于其抗癌功效,现阶段大部分研究主要集中于白桦茸培养条件的优化,以及白桦茸生物活性物质作用机制的研究,而对于培养过程中菌丝生物学特性及活性物质含量变化的相关研究较为少见。本研究以不同碳源作为自变量,通过平板培养,得出不同碳源对白桦茸菌丝生长速度的影响,以及不同碳源对白桦茸菌落的生长状态以及显微结构的影响;以液体培养的方式,拟得出碳源对菌丝生物量及活性物质含量变化的影响,为白桦茸的人工培养及进一步的深入研究与相关开发提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌种
白桦茸菌株(菌种编号:JZ-2#):珠海科技学院药学与食品科学学院实验教学中心210实验室提供。
1.1.2 试验试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)(纯度>97%)、葡萄糖标准品(纯度≥99.5%):北京酷尔化学科技有限公司;无水乙醇(分析纯):西陇科学股份有限公司;苯酚(分析纯):国药集团化学试剂有限公司;浓硫酸(分析纯):广州化学试剂厂;甘露醇、果糖、乳糖(均为生化试剂):北京索莱宝科技有限公司;麦芽糖(生化试剂)、七水硫酸镁(分析纯):上海源叶生物科技有限公司;葡萄糖(分析纯)、蔗糖(分析纯)、磷酸二氢钾(分析纯)、琼脂粉(生化试剂)、氯化钙(分析纯):天津市福晨化学试剂厂;酵母浸粉lp0021(生化试剂):赛默飞世尔科技(中国)有限公司;细菌学蛋白胨(生化试剂):广东环凯微生物科技有限公司;可溶性淀粉(分析纯):天津市百世化工有限公司;维生素B1(食品级):河南万邦实业有限公司;红薯淀粉(食品级):山东厨禾食品有限公司;玉米面粉、玉米淀粉、马铃薯(均为食品级):市售。
1.1.3 仪器与设备
洁净工作台(VS-1300L-U):苏州安泰空气技术有限公司;光学显微镜(XS-218):江南光电(集团)股份有限公司;数显式恒温水浴锅(HH-S4):金坛市朗博仪器制造有限公司;防爆冰箱(KRC180):优莱博技术(北京)有限公司;立式双层气浴恒温摇床(SKY-2112B):上海苏坤实业有限公司;电子天平(AR224CN):美国奥豪斯仪器(上海)有限公司;干燥箱(GZX-9240MBE):上海博迅医疗生物仪器股份有限公司;电热恒温培养箱(DHP-9162):上海一恒科学仪器有限公司;紫外可见分光光度计(UV-2450):日本岛津公司;高速离心机(1580R):中国香港 Gene公司;酶标仪(Epoch):美国Bio Tek InstrumentsInc公司。
1.1.4 培养基配方
1.1.4.1 母种固体培养基
酵母浸粉1 g、葡萄糖3 g、琼脂粉2 g、马铃薯20 g,去离子水补足100 mL,pH自然[12]。
1.1.4.2 母种液体培养基
酵母浸粉1 g、葡萄糖2 g、维生素B10.01 g、蛋白胨1 g、磷酸二氢钾 0.025 g、七水硫酸镁0.025 g,去离子水补足100 mL,pH自然。
1.1.4.3 不同碳源液体发酵培养基
碳源6 g、酵母浸粉0.12 g、蛋白胨0.3 g、磷酸二氢钾0.1 g、七水硫酸镁0.02 g、维生素B10.01 g、氯化钙0.05 g,去离子水补足 100 mL,pH 自然[13]。
10种碳源分别为乳糖、甘露醇、麦芽糖、红薯淀粉、玉米淀粉、玉米面粉、果糖、葡萄糖、蔗糖、可溶性淀粉。
1.1.4.4 不同碳源固体培养基
按照1.1.4.3方法配制成100 mL液体培养基,加琼脂粉4.8 g,加热溶解,pH自然。
1.2 试验方法
1.2.1 菌种制备
1.2.1.1 平板菌种制备
取恢复至室温26℃的白桦茸试管菌种,无菌操作,取0.5 cm2菌块接种到母种固体培养基中,25℃避光恒温培养10 d。
1.2.1.2 液体菌种制备
将配制的母种液体培养基分装200 mL/500 mL锥形瓶,121℃下灭菌20 min后,冷却至室温26℃。取5块0.5 cm2活化后的固体平板菌种,接种至液体培养基中。摇床25℃、150 r/min培养10 d。
1.2.2 不同碳源条件下菌丝生长速度的测定
按照不同碳源固体培养基的配制方法,配制固体培养基。每个配方3个平板。选用0.8 cm平板打孔器,在平板母种上打出均匀的菌块,之后用接种针挑菌块至不同碳源的固体培养基上培养。培养条件:25℃避光培养13 d。接种3 d后分别用直尺对所有平板的菌落进行测定,之后隔天测定1次,每个平板测定垂直两条线上的菌落直径,记录、统计并分析结果。根据下列公式计算菌丝生长速度[14]。
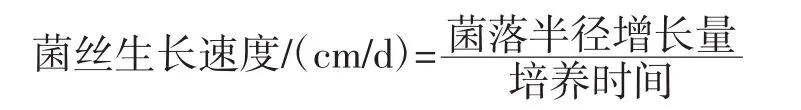
1.2.3 不同碳源条件下菌落生长状态及菌丝显微结构观察
1.2.3.1 宏观形态学鉴定
取1.2.2中培养13 d的平板进行菌丝体观察,比较菌落大小及颜色、菌丝密度、是否蓬松、是否有明显的同心纹,并进行记录[14-15]。
1.2.3.2 微观形态学鉴定
制作菌丝爬片:采用不同碳源的固体培养基进行接种,在距接种点2 cm左右的培养基上围绕菌块,以40°~45°斜插入4片无菌的盖玻片,25℃避光培养。待菌丝体长满盖玻片一半左右时,夹取盖玻片,显微镜下观察菌丝[16-17]。
1.2.4 不同碳源条件下液体发酵菌丝生物量的测定
按1.1.4.3配方配制液体培养基,121℃下灭菌20 min,冷却至室温26℃,无菌转接10%的液体菌种。将接种好的培养瓶置于25℃的摇床,150 r/min回旋培养13 d。培养期间进行6次取样,每2 d取样1次,每次随机取出3瓶菌,13 d后全部取样。取样时,采用布氏漏斗抽滤法分离菌丝及菌液,用蒸馏水冲洗菌丝2次后,收集菌丝,置于50℃烘箱中烘干至恒重,称质量并保存。
1.2.5 菌丝多糖的提取
取烘干的白桦茸菌丝于研钵内研磨,过40目筛网,按料液比1∶100(g/mL)加入去离子水,85℃恒温浸提4 h,提取液10 000 r/min离心15 min,取0.6 mL上清液定容至10 mL,即得到多糖待测溶液。
1.2.6 多糖含量测定
采用苯酚硫酸法测定菌丝多糖含量。取0.005 g无水葡萄糖标准品,去离子水定容至50 mL配制成葡萄糖标准溶液。分别取 2、3、4、5、6、7 mL 的葡萄糖标准溶液至10 mL容量瓶中,去离子水定容并摇匀。分别从6个10 mL容量瓶中各取1 mL液体于试管中,加入0.5 mL、6%苯酚后,迅速加入5 mL浓硫酸,静置10 min,40℃水浴15 min,冷却至室温26℃,测定反应液A490,绘制葡萄糖标准曲线[12,18]。回归方程为y=10.773x-0.004,R2=0.999 4。
取1 mL待测样品溶液,按照上述方法加入苯酚与浓硫酸,测定反应液A490,根据葡萄糖标准曲线得到的回归方程计算多糖含量。
1.2.7 多糖水提液抗氧化活性的测定
采用DPPH自由基清除法测定多糖水提液抗氧化活性。取1.2.5多糖水提液与无水乙醇按体积比1∶1混合,避光反应30 min,移液枪吸取0.3 mL混合液至96孔板中,各3个复孔。测定反应液A517,吸光度记为A1;取样品提取液与0.2 mmol/L DPPH按体积比1∶1混合,避光反应30 min,移液枪吸取0.3 mL混合液至96孔板中,各3个复孔。测定反应液A517,吸光度记为A2;取无水乙醇与DPPH按体积比1∶1混合,避光反应30 min,移液枪吸取0.3 mL混合液至96孔板中,各3个复孔。测定反应液A517,吸光度记为AD[19-20]。根据下列公式计算DPPH自由基清除率。
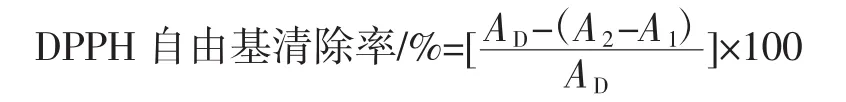
1.3 数据处理
采用SPSS 25.0软件对结果进行分析处理,试验结果均以平均值±标准差表示。
2 结果与分析
2.1 不同碳源对白桦茸菌丝生长速度的影响
不同碳源条件下菌丝平板生长直径变化见图1。

图1 不同碳源条件下菌丝平板生长直径变化Fig.1 Variation of mycelial growth diameter under different carbon sources
由图1可知,白桦茸在不同碳源的培养基上均可以生长。乳糖为唯一碳源时,随着培养时间的延长,菌丝生长最慢;与红薯淀粉及玉米淀粉相比,可溶性淀粉中菌丝随培养时间的延长,生长缓慢;以麦芽糖、蔗糖、果糖、甘露醇、玉米面粉、葡萄糖为碳源时,随着培养时间的延长,菌落直径增加明显。
碳源对白桦茸菌丝生长的影响见表1。
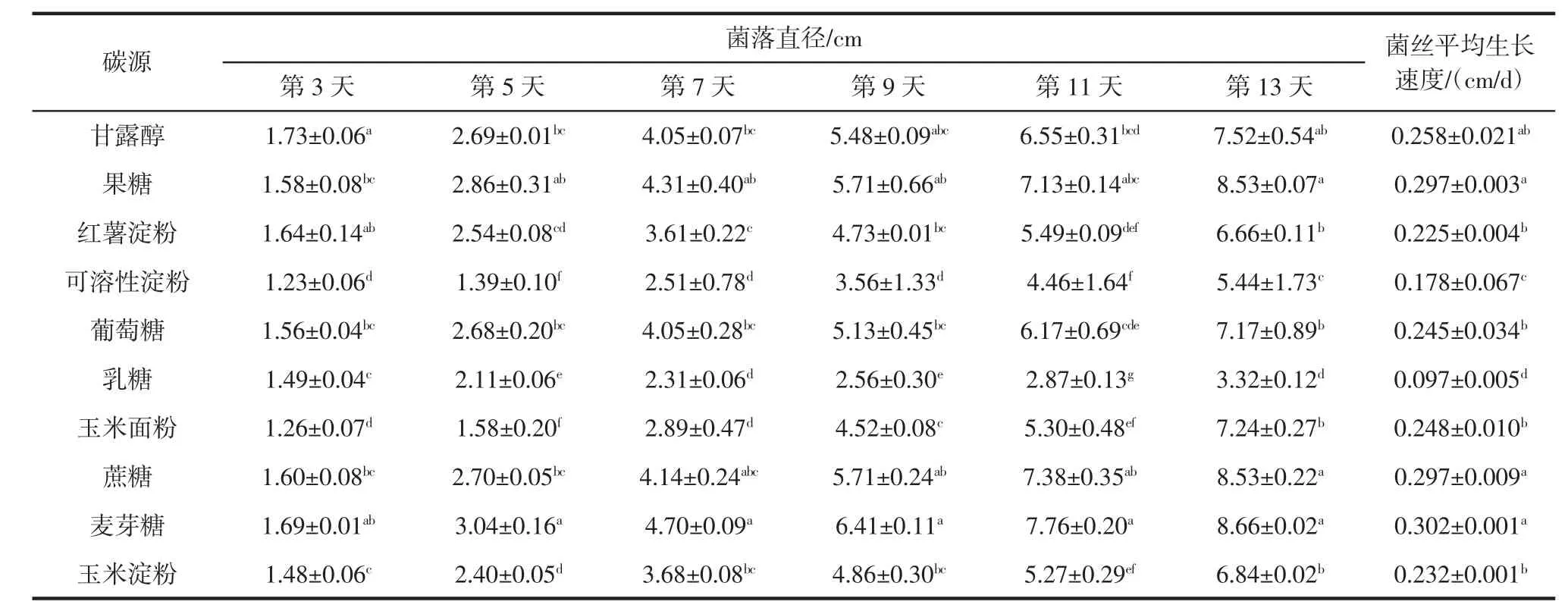
表1 碳源对白桦茸菌丝生长的影响Table 1 Effects of carbon sources on mycelial growth of Inonotus obliquus
由表1可知,与麦芽糖相比,乳糖、玉米面粉、可溶性淀粉在全阶段培养时间内,白桦茸菌丝生长差异显著(P<0.05)。与乳糖相比,甘露醇、红薯淀粉在全阶段培养时间内,白桦茸菌丝生长差异显著(P<0.05)。与麦芽糖相比,果糖在全阶段培养时间内,白桦茸菌丝生长差异不显著(P>0.05)。不同碳源菌丝平均生长速度大小顺序为麦芽糖>果糖=蔗糖>甘露醇>玉米面粉>葡萄糖>玉米淀粉>红薯淀粉>可溶性淀粉>乳糖。麦芽糖菌丝生长速度为0.302 cm/d,生长最快。蔗糖及果糖的菌丝生长速度较麦芽糖次之,为0.297 cm/d;乳糖最慢,为0.097 cm/d,这与王丽莹等[21]的研究结果相近。
2.2 不同碳源对白桦茸菌落生长状态及菌丝显微结构的影响
不同碳源固体培养条件下菌丝正面和生长情况见图2和图3,不同碳源条件下菌丝显微观察情况见图4。
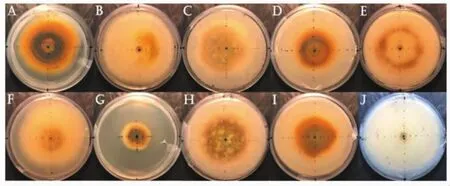
图2 不同碳源条件下平板菌丝生长状况(正面)Fig.2 Growth status of flat mycelium under different carbon sources(front)
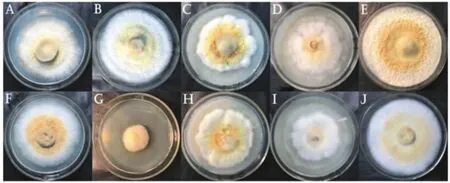
图3 不同碳源条件下平板菌丝生长状况(背面)Fig.3 Growth status of flat mycelia under different carbon sources(back)
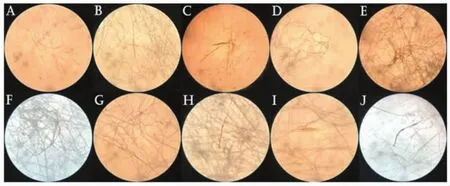
图4 不同碳源条件下菌丝显微观察Fig.4 Microscopic observation of mycelium under different carbon sources
A.甘露醇 ;B.果糖;C.红薯淀粉;D.可溶性淀粉;E.麦芽糖;F.葡萄糖;G.乳糖;H.玉米淀粉;I.玉米面粉;J.蔗糖 。
由图2~图4可知,麦芽糖、果糖、蔗糖的菌丝生长最快,其中麦芽糖菌落生长最致密,表面呈现羊毛毡状,接种中心有明显的气生菌丝,周围环绕有黄褐色菌丝,且菌丝有分支,菌落背面有一定的褐化。乳糖菌落最小,且菌丝生长较稀疏,多为气生菌丝,菌丝中有少量淡黄色色素沉积,菌丝纤细有分支,菌落背面褐化重。总体来说,菌落的差异主要体现在菌丝褐化程度、菌丝生长速度、菌丝颜色、菌丝密度等,而对于显微状态下的菌丝,其结构差异不大。这与韩鹏等[22]的研究结果基本一致。
2.3 不同碳源对白桦茸菌丝生物量的影响
本试验进行了碳源的初筛小试发酵培养,通过统计其菌丝生物量的变化,并结合2.1菌丝生长速度的试验数据,决定后期测定阶段不对可溶性淀粉碳源培养得到的菌丝测定生物量、多糖含量以及DPPH自由基清除率进行测定。
不同碳源条件下随培养时间的延长,白桦茸菌丝液体发酵生物量测定结果见表2。
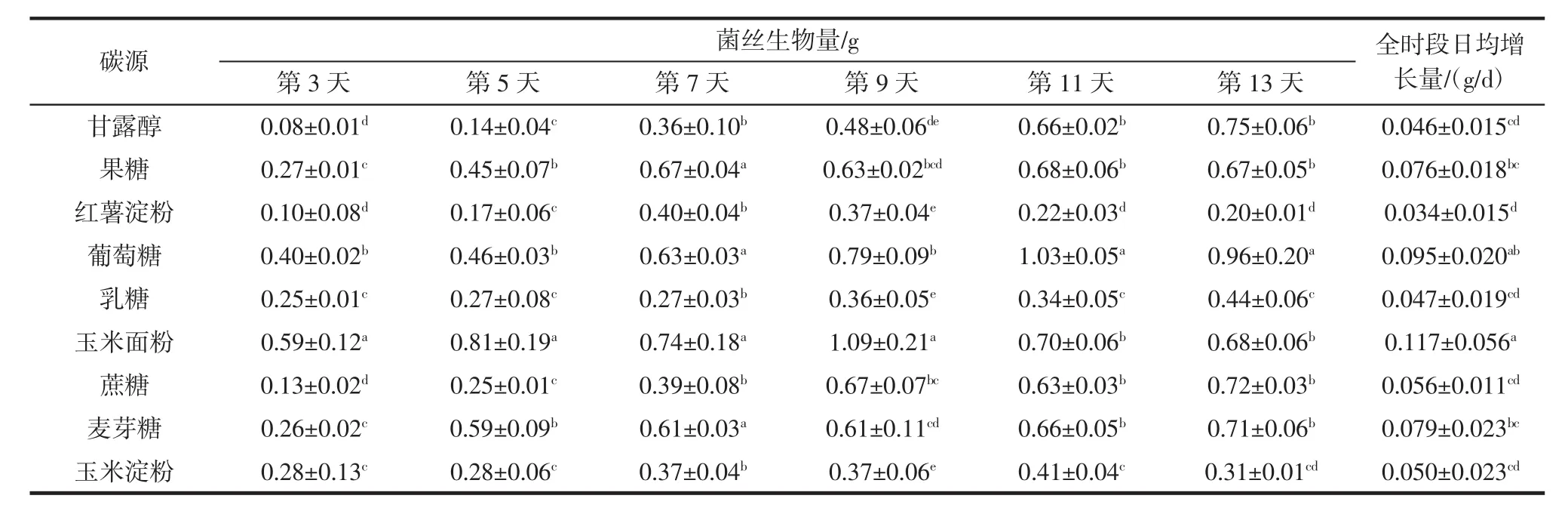
表2 碳源对白桦茸菌丝生物量的影响Table 2 Effects of carbon sources on mycelial biomass of Inonotus obliquus
由表2可知,与玉米面粉碳源相比,玉米淀粉、乳糖碳源在全阶段培养时间内,白桦茸菌丝生长差异显著(P<0.05)。与葡萄糖碳源相比,甘露醇、乳糖、玉米淀粉、红薯淀粉碳源在全阶段培养时间内,白桦茸菌丝生长差异显著(P<0.05)。与红薯淀粉碳源相比,玉米面粉、麦芽糖、果糖碳源在全阶段培养时间内,白桦茸菌丝生长差异显著(P<0.05)。麦芽糖与果糖碳源,乳糖与玉米淀粉碳源,在全阶段培养时间内菌丝生长差异不显著(P>0.05)。不同碳源菌丝全时段日均增长量大小顺序为玉米面粉>葡萄糖>麦芽糖>果糖>蔗糖>玉米淀粉>乳糖>甘露醇>红薯淀粉,其中玉米面粉菌丝生物量最大,分析认为,可能是玉米面粉中氮源含量丰富,使菌丝生长迅速,其次是葡萄糖,由于葡萄糖是自然界分布最广泛的单糖,其代谢非常容易,所以利于菌丝体的快速生长。而菌丝生物量较少的是乳糖和淀粉类碳源,分析认为,乳糖属于较难利用的糖,在菌体内较难分解利用,所以造成菌丝生物量较低,对于淀粉类碳源,由于淀粉分子量较大,在分解应用过程中也存在一定的困难,所以菌丝生物量不高。
2.4 不同碳源对白桦茸液体发酵菌丝多糖含量的影响
不同碳源条件下随培养时间的延长,白桦茸菌丝多糖含量测定数据见表3。
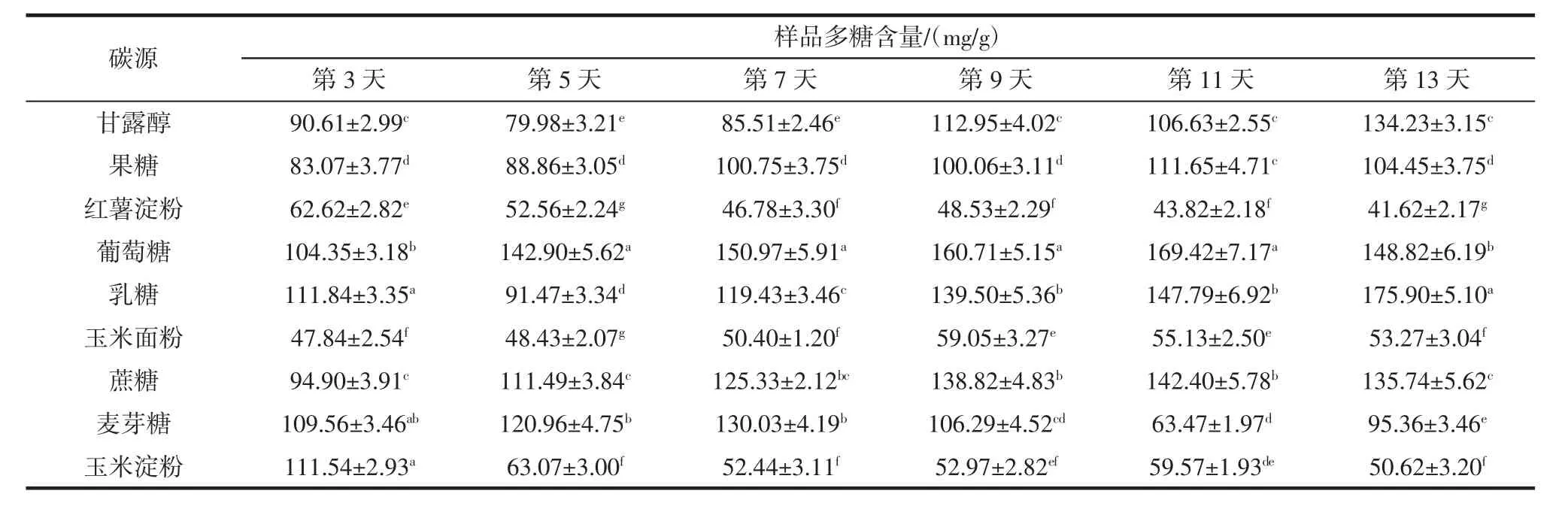
表3 碳源对白桦茸多糖含量的影响Table 3 Effects of carbon sources on polysaccharide content of Inonotus obliquus
由表 3 可知,培养时间为 5、7、9、11、13 d 时,以葡萄糖为碳源的菌丝多糖含量与其它碳源菌丝多糖含量均差异显著(P<0.05)。进一步对比发现,以葡萄糖、乳糖、蔗糖为发酵碳源时,菌丝内最终多糖积累量较高。葡萄糖为碳源,其菌丝多糖含量在11 d即达峰值,随后出现下降,分析认为,随着培养时间的延长,菌丝出现部分自溶现象,导致胞内多糖含量下降,而以乳糖为碳源时,菌丝体内多糖含量从第5天开始稳步增加(后期仍增加),这可能是由于乳糖分解利用较慢,利于产物的积累。综合分析得知,以葡萄糖为碳源进行发酵产多糖效果最佳,培养11 d即可使多糖含量达到169.42 mg/g。这与毛庆莲等[23]的研究结果一致。
2.5 不同碳源对白桦茸液体发酵产物DPPH自由基清除率的影响
不同碳源条件下随培养时间的延长,白桦茸菌丝多糖提取液抗氧化测定结果见表4。
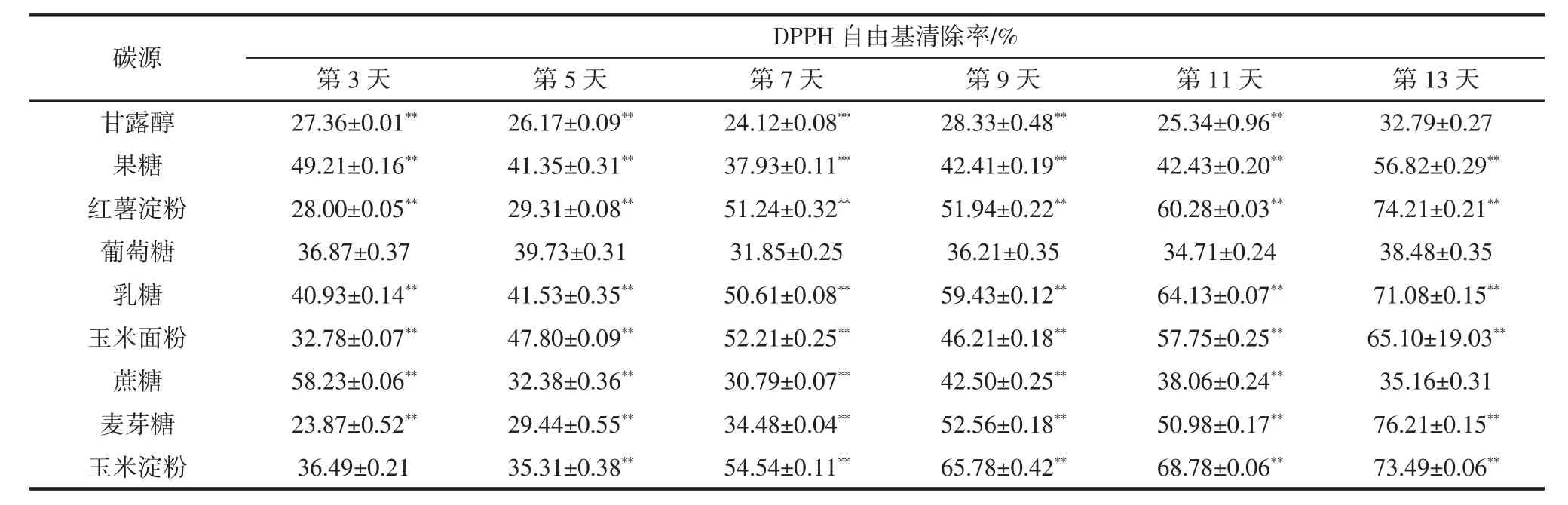
表4 碳源对白桦茸多糖提取液DPPH自由基清除率的影响Table 4 Effects of carbon sources on DPPH free radical scavenging rates of Inonotus obliquus polysaccharide extract
由表 4 可知,当培养时间为 5、7、9、11 d 时,各碳源均与葡萄糖的DPPH自由基清除率差异极显著(P<0.01)。当培养时间为3 d时,除了玉米淀粉与葡萄糖的DPPH自由基清除率差异不显著(P>0.05),其余各碳源均与葡萄糖的DPPH自由基清除率差异极显著(P<0.01)。当培养时间为13 d时,除了甘露醇和蔗糖与葡萄糖的DPPH自由基清除率差异不显著(P>0.05),其余各碳源均与葡萄糖的DPPH自由基清除率差异极显著(P<0.01)。此外,红薯淀粉、玉米淀粉、麦芽糖为碳源时,菌丝水提液的DPPH自由基清除率也随培养时间的延长而增加,在第13天均达到最大值,分别为74.21%、73.49%、76.21%。由此可见,较难分解利用的碳源有利于多糖产物活性的提高,这可能与胞内环境稳定有关,当然也与菌丝分裂代谢较慢有一定联系。
3 讨论与结论
综上,固体培养基以果糖、麦芽糖、蔗糖为唯一碳源时,菌丝生长促进作用明显,且蔗糖及果糖为唯一碳源添加时,有减缓菌丝褐变老化作用。玉米面粉、葡萄糖为碳源时菌丝生长粗壮,碳源为红薯淀粉以及麦芽糖时,菌丝生长密度最高。液体培养条件下,碳源为玉米面粉时,其全时段菌丝日均增长量最高,其次是葡萄糖和麦芽糖及果糖等。当葡萄糖充当唯一的碳源添加时,菌球较大,菌球质地较疏松,菌丝细长,利于营养物质的吸收与代谢,是大规模液体发酵的首选碳源。虽然以玉米面粉为碳源,其全时段菌丝日均增长量最高,但是此时培养液较为浓稠,不利于大规模液体发酵培养,也不利于后续菌丝的收集和发酵液中活性物质的提取纯化。对于活性物质收集,以葡萄糖为单一碳源进行培养得到的菌丝体,其胞内多糖在第11天含量最高,为最优碳源,其可以保证多糖快速且大量产生。乳糖、麦芽糖为碳源时,培养得到的菌丝体提取液DPPH自由基清除能力较强,若需要提升产物的抗氧化活性,可将葡萄糖碳源与乳糖碳源或麦芽糖碳源联用,从而达到优化产物的目的。本试验对比了不同碳源时白桦茸菌丝生物学特性异同,并对菌丝体在不同碳源条件下活性物质积累的差异和活性的不同做了相关的研究,这将为白桦茸液体发酵培养碳源的选择提供一定的参照,同时也为白桦茸进一步的深入研究提供参考。
