带鱼蛋白抗菌肽抑菌效果的影响因素
2022-10-29李远慧郑霖波谢超郑炜
李远慧,郑霖波,谢超,郑炜
(1.浙江海洋大学食品与药学学院,浙江 舟山 316022;2.舟山市常青海洋食品有限公司,浙江 舟山 316021)
带鱼(Trichiurus lepturu),在各地区[1]尤其沿海城市[2]海洋渔业的发展中,都占据重要位置[3]。带鱼的肉质口感滑嫩,深受人们的喜爱[4]。带鱼富含蛋白质和脂肪,质量分数分别为17.57%、5.16%[5]。带鱼还含有各种人体所必需的氨基酸,具有抗癌、降低血脂和胆固醇等功能;同时因带鱼中不饱和脂肪酸含量高,其营养成分能够较好地被人体吸收。
抗菌肽(antibacterial peptide)是一种抗生素肽[6],在生物体中普遍存在,具有免疫效果,有阻止病原微生物入侵生物体的作用[7]。抗菌肽可构成生物体内的天然保护屏障,这使其具有抑制病毒、真菌、细菌等微生物繁殖的功能[8],深入研究发现肿瘤细胞在抗菌肽作用下会生长和扩散减缓甚至死亡[9],抗菌肽的优点有抗菌范围大、肽种类繁多、抗菌机理独一、产生耐药性的几率低等,可在一定程度上代替青霉素等抗生素对生物体的作用[10],可用于食品业、农业和医药业[11]。
大部分抗菌肽在一定程度的高温处理后,仍然可以表现出较好的抑菌性,也有的抗菌肽在进入人体后,由于消化系统具有酶解作用,抗菌肽的抑菌性可能会发生改变[12]。有研究发现胰蛋白酶对牙鲆不同组织的抗菌粗提物的抑菌性有一定的促进效果[13]。这说明经过胰蛋白酶处理后,抗菌肽很有可能会产生一些抑菌效果更强的新组分。带鱼蛋白抗菌肽营养组成丰富且均衡,抑菌效果良好,在食品添加剂行业具有很好的前景。但在食品加工、贮藏等环节,一些不可避免的因素(高温、pH值、金属效应等)会使抗菌肽的抑菌性能发生改变。本文主要研究带鱼蛋白抗菌肽的抑菌性,及其抑菌性在不同温度、pH值、胰蛋白酶、β-内酰胺酶、冻融次数和金属离子条件下的稳定性,为带鱼蛋白抗菌肽的应用提供基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
舟山带鱼:市售。
胃蛋白酶(200 000 U/g)、胰蛋白酶(200 000 U/g)、木瓜蛋白酶(800 000 U/g)、β-内酰胺酶(200 000 U/g):北京鸿润宝顺科技有限公司;邻苯二甲酸氢钾-HCl、氯化钠、氯化锌、青霉素、氯化钙、硫酸亚铁、三氯化铁、氯化镁(均为分析纯):天津恒兴化学试剂制造有限公司。
1.1.2 仪器与设备
高速组织捣碎机(JJ-2):常州方科仪器有限公司;智能生化培养箱(BPC-70F):上海一恒仪器有限公司;离心机(TD4C):前沿科技有限公司;海尔冰柜(BD-203HTD):青岛海尔集团;电子分析天平(FA1004)、电热恒温水浴锅(HWS)、水浴恒温振荡器(ZD-85A):浙江力辰仪器科技有限公司;搅拌机(M-402028-IKA):北京海富达科技有限公司;pH计(PHS-25):上海越平仪器有限公司;鼓风干燥箱(DHG):上海尚仪仪器有限公司;超净工作台(SW-CJ-1D):苏州净化科技有限公司;紫外分光光度计(752G):上海荣惠仪器有限公司。
1.2 试验方法
1.2.1 原料处理
取冷冻舟山带鱼,流动水解冻后人工去除头部和内脏,清洗干净,将其置于高速组织捣碎机中搅碎,得到带鱼鱼糜,按每100 g分装于保鲜袋中,置于-20℃下贮藏。
1.2.2 带鱼抗菌肽的制备
将冷冻带鱼鱼糜在流动水下解冻,取10 g带鱼鱼糜加入到100mL蒸馏水中,溶解搅匀,调节至蛋白酶的最适酶解pH值和温度,加入0.2g/100mL的蛋白酶[14],为酶解完全将溶液放入搅拌机中搅拌10 min~15 min,放入80 r/min摇床中酶解[15]。酶解完成后将酶解液进行灭酶处理(电热恒温水浴,95℃~100℃,20 min)。取灭酶后酶解液进行离心处理(4℃,8 000 r/min,15 min),取中间澄清液,于-20℃冷冻保藏。
1.2.3 抑菌率的测定
参考文献[16]中的光密度法,并稍作改动。各蛋白酶解液用0.22 μm滤膜过滤后,调节成一致浓度,各取2 mL,加入10 mL肉汤液体培养基中,并和200 μL大肠杆菌(107CFU/mL)混合均匀,37℃下培养24 h,测定吸光值(570 nm波长)记为A样品。不加大肠杆菌且其他条件一致的为空白样品,测定吸光值记为A空样;对照样品为相同量的肉汤液体培养基加入2 mL灭菌生理盐水和200 μL大肠杆菌,测定其吸光值记为A对照。每个样品进行3次平行测定,抑菌率计算公式如下。

1.2.4 酶的筛选
根据前期研究结果[17],选择胃蛋白酶∶木瓜蛋白酶(体积比)=1∶1为复合酶制剂,以最佳酶解条件进行后续试验[12],最佳酶解条件见表1。

表1 酶解条件Table 1 Conditions of enzymatic hydrolysis
1.2.5 带鱼蛋白抗菌肽抑菌效果的影响因素
1.2.5.1 热稳定性
将抗菌肽酶解液于温度为 70、80、90、100、121 ℃的烘箱中进行加热处理,加热时间为30 min,取出后放置至室温。将未经过加热处理的抗菌肽抗菌效力做为对照组,其抑菌率记为100%,测定处理后各组抗菌肽的抑菌率。
1.2.5.2 pH耐受性
将抗菌肽酶解液加入邻苯二甲酸氢钾-HCl调节pH 值,获得 pH 值为 2.8、3.8、4.8、5.8、6.8、7.8、8.8、9.8的相同质量浓度(100 mg/mL)的抗菌肽溶液。将抗菌肽溶液静置1 h(室温),测定各组的抑菌率。
1.2.5.3 胰蛋白酶稳定性
将抗菌肽酶解液分成相同质量的若干份,部分加入等质量浓度为0.25%胰蛋白酶150 μL,在37℃水浴锅中分别酶解 1、2、3、4、5 h;酶解结束后进行灭酶处理,95℃加热15 min,测定各组分酶解液抑菌率。对照组为未经胰蛋白酶处理的抗菌肽酶解液,其抑菌率记为100%。
1.2.5.4 β-内酰胺酶稳定性
取相同质量浓度的青霉素和抗菌肽酶解液若干份,部分加入等质量浓度的β-内酰胺酶150μL,在37℃中水浴1 h进行酶解,当酶解过程完成,95℃水浴加热15 min,测定各组分酶解液抑菌率。
1.2.5.5 对反复冻融的稳定性
将抗菌肽酶解液分成相同质量的若干份,在-18℃的冰柜中冷冻,取出后再用流动水解冻。每次冷冻确保中心温度达到-18℃方可取出进行解冻,解冻后测定抗菌肽酶解液的抑菌率,冻融次数为1次~6次。对照组为未进行冷冻的抗菌肽酶解液,其抑菌率记为100%。
1.2.5.6 对金属离子的稳定性
配制 0.04 mol/L Na+、K+、Zn2+、Fe2+、Ca2+、Mg2+、Fe3+7种金属离子溶液[18],与等体积的抗菌肽酶解液混合,在室温中静置3 h,充分反应后测定每个组分的抑菌率。以未与金属离子混合的组分为对照组,其抑菌率记为100%。
1.3 数据处理
每组样品均进行3次重复测定,用Excel软件对原始数据进行处理,并进行单因素方差分析。
2 结果与分析
2.1 抗菌肽的热稳定性
因为存放抗菌肽时,会不可避免地遇到高温高热的情况,所以研究抗菌肽的热耐受性是十分必要的。各温度下抗菌肽抗菌效力结果如图1所示。

图1 抗菌肽的热稳定性Fig.1 Thermal stability of antimicrobial peptide
通过分析图1可得,随着温度的升高,抗菌肽的抑菌率先增大后减小。在70℃~90℃范围内,温度对抗菌肽的抗菌效果影响较小(p>0.05),在90℃时抗菌肽的抑菌率相对于对照组依然有97.26%,而当温度上升至121℃时抑菌率只有86.43%,原因可能是在100℃以上的高温条件下,部分有抗菌效果的肽链被破坏,导致抗菌效力下降。总的来说,各组分在高温处理后抑菌率能够保持在85%以上,表明抗菌肽的热稳定性较强,能够适应较高的温度而不失去抗菌活性。
2.2 抗菌肽的pH值耐受性
抗菌肽在一系列过程中会接触到不同的pH值环境,因此研究在不同pH值环境下抗菌肽的抑菌率是否会改变是十分必要的。抗菌肽的pH值耐受性试验结果如图2所示。

图2 抗菌肽的pH值耐受性Fig.2 pH tolerance of antimicrobial peptide
pH值溶液本身对指示菌没有抑菌效果,所以可以推断抗菌肽的抑菌率变化是因为环境pH值的变化引起的。从图2中可以看出,抗菌肽的抑菌率随着pH值的增加出现了先增大后减小再增大的趋势,最大抑菌率是在pH值为4.8时,为45.12%;之后随pH值继续增大,抗菌肽抑菌率下降,在pH值为8.8时出现最低值40.08%。
2.3 抗菌肽对胰蛋白酶的稳定性
作为人体消化道中的主要蛋白酶,胰蛋白酶在人体进行消化时起到重要的作用,所以研究抗菌肽的胰蛋白酶稳定性具有现实意义。胰蛋白酶酶解不同时间对抗菌肽抑菌率的影响见图3。
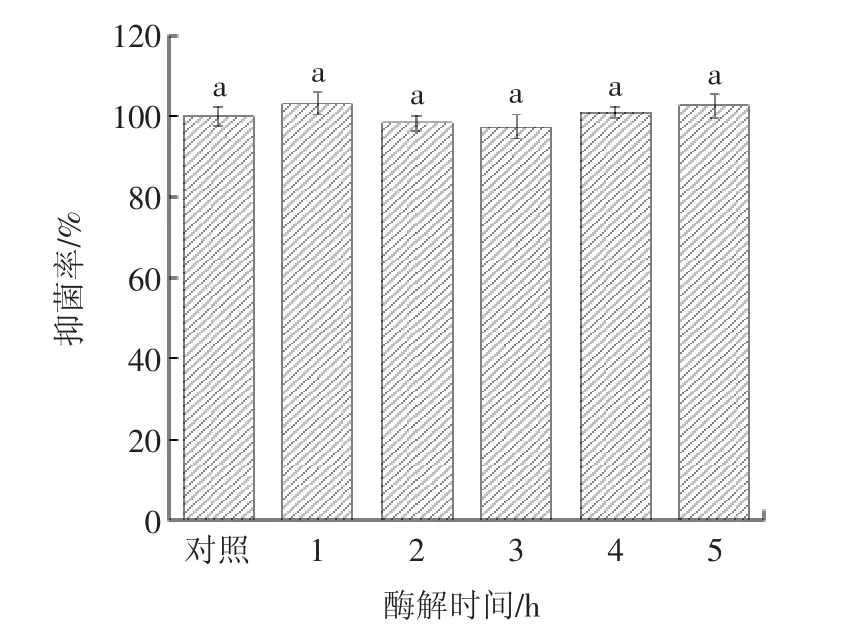
图3 抗菌肽对胰蛋白酶的稳定性Fig.3 Stability of antimicrobial peptide to trypsin
从图3中可以看出在酶解较长时间时,抑菌率出现小幅度的上升,可能是因为胰蛋白酶属于族专一性酶,专一为对碱性氨基酸一端进行水解[19],水解后出现的肽链也存在抗菌效力,对总体的抑菌率有正向作用。总体而言各组分之间的抑菌率差别不大,说明胰蛋白酶对抗菌肽几乎没有影响(p>0.05),抗菌肽有较强的胰蛋白酶稳定性。
2.4 抗菌肽对β-内酰胺酶的稳定性
现代医学中,β-内酰胺类抗生素是医学使用较多的抗生素[20],很多致病菌由于长期使用此类抗生素,已经出现了耐药性,就是因为细菌内出现了β-内酰胺酶[21]。此类酶的产生,使β-内酰胺类抗生素被破坏,从而丧失了一定的抗菌效果[22]。β-内酰胺酶对抗菌肽的抑菌率影响见图4。

图4 抗菌肽对β-内酰胺酶的稳定性Fig.4 Stability of antimicrobial peptide to β-lactamase
分析图4可以得出,抗菌肽和抗菌肽+β-内酰胺酶组的抑菌率无显著差异,但经过β-内酰胺酶处理后,青霉素的抑菌率出现了大幅度的下降,可以证明该酶在试验中起到了水解β-内酰胺环的作用,导致青霉素失去抑菌活性。而抗菌肽的抗菌效果没有被抑制,依然保持了原有的抗菌效果,说明抗菌肽的有效抗菌组分不包含β-内酰胺环,因此不受β-内酰胺酶影响,抗菌肽有较强的β-内酰胺酶稳定性。
2.5 抗菌肽在不同冻融次数下的稳定性
在食品的保藏过程中,低温冻藏是非常有效的一种保存方式。在反复冻融过程中,蛋白质的构型会发生变化,可能会失去原有的活性[23]。冻融次数对抗菌肽抑菌率的影响见图5。

图5 抗菌肽在不同冻融次数下的稳定性Fig.5 Stability of antimicrobial peptides at different freeze-thaw times
从图5中可以得出,反复冻融使抗菌肽的抑菌率呈下降的趋势,在冻融了6次以后,抑菌率下降到了90.28%,但大部分具有抗菌活性的肽链形态不受影响(p>0.05)。
2.6 抗菌肽对金属离子的稳定性
由于食品加工需要经过多道程序步骤,在加工包装过程中不可避免地会接触到不同的金属离子,因此有必要对抗菌肽的金属离子稳定性进行讨论。试验结果见图6。

图6 抗菌肽对金属离子的稳定性Fig.6 Stability of antimicrobial peptide to metal ions
由图6可知,当抗菌肽与 Na+、K+、Ca2+、Mg2+接触作用时,抑菌率并没有被影响(p>0.05),依旧保持了原有的抑菌活性,对这些金属离子保持了很高的稳定性。当抗菌肽被Zn2+接触作用后,抑菌率下降到86.25%,而接触到Fe2+和Fe3+时则下降得更多,分别为76.38%、74.97%,抑菌率出现了较大幅度的下降。
3 讨论
抗菌肽在生产中,受到多种环境因素的影响,例如高温环境、酸碱度、人和动物口腔、胃、肠道内的蛋白酶,反复冻融以及金属离子等方面,故本文从以上几个方面研究带鱼蛋白抗菌肽的稳定性。
研究表明,电荷是决定抗菌肽生物活性的重要因素,细菌细胞膜一般带负电荷,而抗菌肽带正电荷,当环境pH值发生变化时,会改变电荷的分布情况,进而对抗菌肽的活性产生影响[24]。当电荷发生改变时,抗菌肽的二、三级结构也发生了改变,进而改变抗菌肽与细菌细胞膜之间的作用,使抗菌效力也发生了改变[25-26]。研究发现[27],在酸性pH值条件下,肽强烈干扰细菌膜的阴离子脂质成分,引起细菌溶解,抗菌肽的抗菌效力增强。但是总体而言,抗菌肽有较好的pH值耐受性,在pH值变化的情况下仍能保持较好的活性,且在酸性条件下保持得更好。
在冻融过程中,肽链的构型发生了变化,具有抗菌效力的形态逐渐被破坏,从而导致了抗菌效力的下降;但是大部分具有抗菌活性的肽链形态不受影响,所以总体而言抗菌肽对冻融次数具有良好的稳定性。在试验过程中,发现经过多次(4次以上)冻融后,会出现酶解液分层的现象,试管上部有淡黄色覆盖层,底部出现白色沉淀物,可能是因为受到温度变化的影响,一些蛋白肽出现了聚集沉淀的现象,但是对抗菌效力不产生影响,因此可以表明抗菌肽酶解液可以进行冻藏保存。
金属离子的存在会让蛋白肽链发生疏水聚集[28],改变肽链的溶解度[29],使一些具有抗菌活性的肽链不发挥作用;同时因其带不同的正电荷量,也会改变肽链间静电斥力[30],影响肽链间以及肽链结合细胞膜的相互作用,从而影响肽链展开和空间结构变化[31],最终导致了抗菌效力的下降。因此在抗菌肽产品的生产流程中应当尽量避免接触到Zn2+、Fe2+和Fe3+,以此保证抗菌肽的抑菌活性不受影响。
4 结论
本研究通过复合酶解法制备带鱼蛋白抗菌肽,主要对酶解所得带鱼蛋白肽的稳定性作了探究。得出的结果如下。
1)抗菌肽有较强的热稳定性,各组分在高温处理后抗菌率能够保持在相对85%以上,能够适应较高的温度而不失去抗菌活性。同时抗菌肽有较好的pH值耐受性,在pH值为4.8时达到最大的抗菌效力(45.12%),当pH值达到碱性时,抗菌效力下降,在pH值为8.8时出现最低值(40.08%),表明抗菌肽能够适应pH值环境的改变而不失活,且在酸性条件下有更好的抑菌活性。
2)抗菌肽有较强的胰蛋白酶稳定性,各组分之间的抑菌率差别不大,胰蛋白酶对抗菌肽几乎没有影响。同时抗菌肽有较强的β-内酰胺酶稳定性,因抗菌肽的有效抗菌组分不包含β-内酰胺环,不受β-内酰胺酶影响,其抑菌效力没有被抑制,依然保持了原有的抑菌活性。
3)随着冻融次数的增多,抗菌肽的抗菌效力呈下降的趋势,但在冻融了6次之后,也只下降到90.28%,大部分具有抗菌活性的肽链形态不受影响。带鱼蛋白抗菌肽对 Na+、K+、Ca2+、Mg2+具有较强的稳定性,抑菌活性基本不受影响;但是对Zn2+、Fe2+和Fe3+表现出了较低的稳定性,其相对抗菌效力分别降低至86.25%、76.38%和74.97%,应当避免带鱼蛋白抗菌肽与这些离子的接触。
本研究初步对带鱼抗菌肽的制备和其抑菌性进行了探究,并重点对此抗菌肽的稳定性进行了研究。在此基础上对带鱼蛋白抗菌肽进行产业化生产,应用于食品保鲜等领域,可提高低值带鱼的利用率。
