烯烃叠氮化和芳基化合成吲哚啉酮衍生物
2022-10-28姚媛璐石亮亮
张 杰, 卢 欣, 姚媛璐, 石亮亮
(天津力生制药股份有限公司,天津 300380)
吲哚啉酮衍生物是由多种天然产物和人工合成的具有活性小分子核心结构单元的化合物。由于吲哚啉酮衍生物特有的药理活性,吸引了广大药物化学研究者的关注。目前,许多研究人员以吲哚啉酮为核心骨架单元,设计开发了多款小分子药物,用于治疗癌症、抗真菌和抗病毒等[1-6]。例如,Oxindole是针对HIV-1的非核苷类逆转录酶而开发的化合物;SU11248是用于治疗早期癌症的酪氨酸激酶口服抑制剂;AG-041R具有治疗脊柱软骨萎缩的功效;SM-130686是重要的生长激素促分泌素[3-6](Chart 1)。有机叠氮化合物含有叠氮基高能活性官能团,是一类重要的有机合成中间体,广泛应用于药物化学领域。例如,阿度西林用于治疗敏感菌引起的呼吸道以及软组织感染;齐多夫定用于治疗人类免疫缺陷病毒(HIV)感染;阿兹夫定是新型核苷类抗病毒药物,用于治疗艾滋病和新型冠状病毒。近年来,基于烯烃的双官能团化制备吲哚啉酮衍生物吸引了研究人员的关注[7-14]。基于这一合成策略,同时考虑吲哚啉酮衍生物和有机叠氮化合物的药理性质,化学研究者们开发了多种方法来制备含有叠氮基的吲哚啉酮衍生物。2013年,Antonchick课
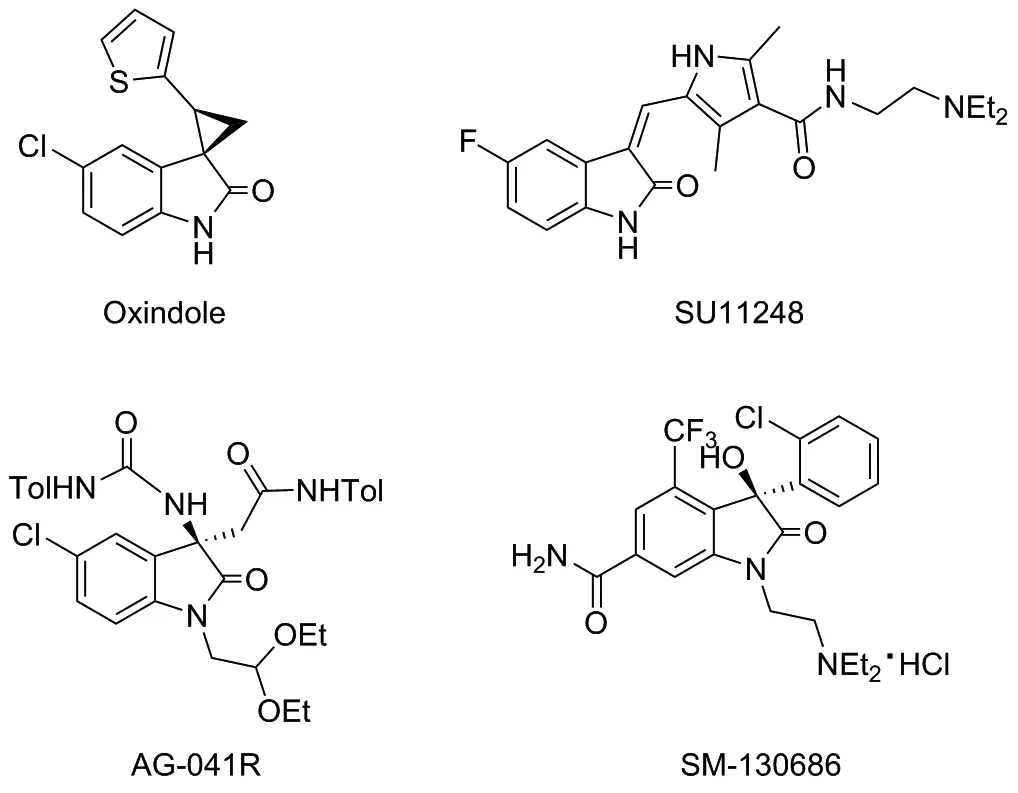
Chart 1

Scheme 1
题组[15]以N-烷基-N-芳基甲基丙烯酰胺衍生物和叠氮基三甲基硅为起始原料,合成了含有叠氮取代基的吲哚啉酮衍生物;同年,杨尚东课题组[16]报道了以N-烷基-N-芳基甲基丙烯酰胺衍生物和叠氮基三甲基硅为起始原料,硝酸银为催化剂,五水合硝酸锆为添加剂,合成了含有叠氮取代基的吲哚啉酮衍生物。焦宁课题组[17]报道了类似的合成方法,以硫酸铈为氧化剂合成了相同产物。
本文以N-烷基-N-芳基甲基丙烯酰胺衍生物和叠氮化钠为原料,碘苯二乙酸为氧化剂,1,2-二氯乙烷(DCE)为溶剂,以中等及以上的收率得到含有叠氮取代基的吲哚啉酮衍生物(Scheme 1)。该方法反应条件温和,取代基适用范围广。
1 实验部分
1.1 仪器与试剂
BrukerAscendTM 400 MHz型核磁共振仪(CD3Cl为溶剂,TMS为内标);Waters ARc-QDa型质谱仪。
N-烷基-N-芳基甲基丙烯酰胺及其衍生物参照文献[12,18-19]方法合成,苯胺类原料、碘甲烷、碘乙烷、甲基丙烯酰氯类原料、碘苯二乙酸。其余试剂除标明外均为分析纯。
1.2 化合物3的合成(以3a为例)
向反应瓶中依次加入N-甲基-N-苯基甲基丙烯酰胺(1a)43.80 mg(0.25 mmol)、叠氮化钠48.80 mg(0.75 mmol)和碘苯二乙酸161.10 mg(0.50 mmol),之后加入1,2-二氯乙烷2.50 mL作为溶剂,氮气保护,于80 ℃条件下搅拌反应24 h,TLC监测反应。反应结束后,经硅胶柱层析(洗脱剂:石油醚 ∶乙酸乙酯=4 ∶1,V∶V)纯化得目标化合物3a。
3-叠氮甲基-1,3-二甲基吲哚啉-2-酮(3a):淡黄色液体,收率81%;1H NMR(CDCl3, 400 MHz)δ: 7.34~7.28(m, 2H), 7.10(t,J=7.8 Hz, 1H), 6.88(d,J=7.8 Hz, 1H), 3.63(s, 2H), 3.23(s, 3H), 1.38(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 178.3, 143.6, 131.5, 128.9, 123.2, 122.9, 108.5, 57.4, 48.9, 26.5, 20.6; MS(ESI)m/z: {[M+H]+}217.3。
3-叠氮甲基-1-乙基-3-甲基吲哚啉-2-酮(3b):淡黄色液体,收率80%;1H NMR(CDCl3, 400 MHz)δ: 7.35~7.27(m, 2H), 7.09(t,J=7.8 Hz, 1H), 6.91(d,J=7.6 Hz, 1H), 3.84~3.74(m, 2H), 3.63(s, 2H), 1.37(s, 3H), 1.28(td,J1=7.2 Hz,J2=1.7 Hz, 3H);13C NMR(CDCl3, 100 MHz)δ: 177.9, 142.8, 131.8, 128.8, 123.4, 122.7, 108.7, 57.5, 48.9, 34.9, 20.6, 12.8; MS(ESI)m/z: {[M+Na]+}253.2。
3-叠氮甲基-1-异丙基-3-甲基吲哚啉-2-酮(3c):淡黄色固体,收率76%;1H NMR(CDCl3, 400 MHz)δ: 7.31~7.26(m, 2H), 7.10~7.04(m, 2H), 4.68~4.59(m, 1H), 3.60(q,J=4.1 Hz, 2H), 1.51(s, 3H), 1.49(s, 3H), 1.35(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 178.1, 142.4, 132.1, 128.6, 123.4, 122.4, 110.3, 57.7, 48.7, 44.2, 20.7, 19.6; MS(ESI)m/z: {[M+H]+}245.1。
3-叠氮甲基-1,3,5-三甲基吲哚啉-2-酮(3d):淡黄色液体,收率82%;1H NMR(CDCl3, 400 MHz)δ: 7.13~7.09(m, 2H), 6.77(d,J=7.6 Hz, 1H), 3.62(s, 2H), 3.21(s, 3H), 2.36(s, 3H), 1.35(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 178.3, 141.3, 132.5, 131.6, 129.1, 124.1, 108.3, 57.5, 48.9, 26.6, 21.3, 20.7; MS(ESI)m/z: {[M+Na]+}253.2。
3-叠氮甲基-1,3,7-三甲基吲哚啉-2-酮(3e):淡黄色固体,收率73%;1H NMR(CDCl3, 400 MHz)δ: 7.11~6.95(m, 3H), 3.59(s, 2H), 3.51(s, 3H), 2.59(s, 3H), 1.34(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 179.1, 141.4, 132.6, 132.2, 122.8, 121.0, 120.2, 57.7, 48.2, 29.8, 21.0, 19.2; MS(ESI)m/z: {[M+H]+}231.3。
3-叠氮甲基-1-乙基-3,7-二甲基吲哚啉-2-酮(3f):淡黄色液体,收率66%;1H NMR(CDCl3, 400 MHz)δ: 7.12~6.96(m, 3H), 4.09~3.97(m, 2H), 3.61(q,J=6.2 Hz, 2H), 2.55(s, 3H), 1.33(s, 3H), 1.29(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 100 MHz)δ: 179.1, 140.8, 132.8, 132.6, 122.7, 121.1, 119.8, 57.8, 48.1, 36.9, 21.0, 19.1, 14.9; MS(ESI)m/z: {[M+Na]+}267.3。
3-叠氮甲基-5-甲氧基-1,3-二甲基吲哚啉-2-酮(3g):淡黄色固体,收率85%;1H NMR(CDCl3, 400 MHz)δ: 6.91~6.77(m, 3H), 3.80(s, 3H), 3.62(s, 2H), 3.21(s, 3H), 1.35(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 177.9, 156.4, 137.1, 132.9, 112.9, 110.9, 108.8, 57.4, 56.0, 49.2, 26.6, 20.7; MS(ESI)m/z: {[M+Na]+}269.2。
3-叠氮甲基-5-氟-1,3-二甲基吲哚啉-2-酮(3h):淡黄色液体,收率65%;1H NMR(CDCl3, 400 MHz)δ: 7.06~6.99(m, 2H), 6.86~6.78(m, 1H), 3.63(s, 2H), 3.27(s, 3H), 1.38(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 177.9, 159.6(d,J=241.1 Hz), 139.6, 133.3(d,J=7.9 Hz), 115.0(d,J=23.1 Hz), 111.6(d,J=24.6 Hz), 109.0(d,J=8.7 Hz), 57.2, 49.3, 26.7, 20.6; MS(ESI)m/z: {[M+Na]+}257.2。
3-叠氮甲基-5-氯-1,3-二甲基吲哚啉-2-酮(3i):淡黄色固体,收率72%;1H NMR(CDCl3, 400 MHz)δ: 7.32~7.26(m, 2H), 6.80(d,J=8.2 Hz, 1H), 3.64(s, 2H), 3.22(s, 3H), 1.37(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 177.8, 142.2, 133.3, 128.7, 128.3, 123.8, 109.4, 57.2, 49.1, 26.6, 20.5; MS(ESI)m/z: {[M+Na]+}273.2。
3-叠氮甲基-5-溴-1,3-二甲基吲哚啉-2-酮(3j):淡黄色固体,收率75%;1H NMR(CDCl3, 400 MHz)δ: 7.45~7.39(m, 2H), 6.75(d,J=7.8 Hz, 1H), 3.63(s, 2H), 3.22(s, 3H), 1.37(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 177.8, 142.7, 133.7, 131.7, 126.6, 115.6, 109.9, 57.2, 49.1, 26.7, 20.6; MS(ESI)m/z: {[M+Na]+}317.1。
3-叠氮甲基-5-三氟甲基-1,3-二甲基吲哚啉-2-酮(3k):淡黄色固体,收率73%;1H NMR(CDCl3, 400 MHz)δ: 7.62(d,J=8.3 Hz, 1H), 7.52(s, 1H), 6.96(d,J=8.3 Hz, 1H), 3.62(s, 2H), 3.27(s, 3H), 1.36(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 178.3, 146.6, 132.2, 126.7(d,J=3.6 Hz), 124.5(q,J=271.7 Hz), 123.4(d,J=3.6 Hz), 108.3, 57.2, 48.9, 26.8, 20.5; MS(ESI)m/z: {[M+Na]+}307.1。
5-乙酰基-3-叠氮甲基-1,3-二甲基吲哚啉-2-酮(3l):淡黄色固体,收率65%;1H NMR(CDCl3, 400 MHz)δ: 7.99(dd,J1=8.3 Hz,J2=1.7 Hz, 1H), 7.92(d,J=1.4 Hz, 1H), 6.94(d,J=8.3 Hz, 1H), 3.69(s, 2H), 3.29(s, 3H), 2.61(s, 2H), 1.41(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 196.8, 178.7, 147.9, 132.5, 131.9, 130.9, 123.0, 107.9, 57.2, 48.7, 26.8, 26.5, 20.8; MS(ESI)m/z: {[M+Na]+}281.3。
3-叠氮甲基-3-甲基-1-苯基吲哚啉-2-酮(3m):淡黄色固体,收率80%;1H NMR(CDCl3, 400 MHz)δ: 7.54~7.10(m, 8H), 6.85(d,J=7.6 Hz, 1H), 3.72(q,J=8.6 Hz, 2H), 1.48(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 177.8, 143.7, 134.5, 131.3, 129.8, 128.8, 128.3, 126.7, 123.4, 123.3, 109.8, 57.8, 49.1, 20.9; MS(ESI)m/z: {[M+H]+}279.2。
3-叠氮甲基-3-苄基-1-甲基吲哚啉-2-酮(3n):淡黄色液体,收率67%;1H NMR(CDCl3, 400 MHz)δ: 7.26~7.20(m, 2H), 7.09~7.02(m, 4H), 6.85~6.82(m, 2H), 6.62(d,J=7.5 Hz, 1H), 3.78(s, 2H), 3.08(s, 2H), 2.98(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 176.9, 144.1, 134.8, 129.9, 128.9, 127.8, 126.9, 124.1, 122.5, 108.3, 56.4, 84.7, 40.8, 26.2; MS(ESI)m/z: {[M+Na]+}315.2。
3-叠氮甲基-1-甲基-3-苯基吲哚啉-2-酮(3o):淡黄色液体,收率54%;1H NMR(CDCl3, 400 MHz)δ: 7.44~7.27(m, 7H), 7.17(t,J=7.1 Hz, 1H,), 6.95(d,J=7.5 Hz, 1H), 4.08(s, 2H), 3.24(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 176.5, 144.5, 136.8, 129.6, 129.4, 129.0, 128.3, 127.3, 125.6, 123.1, 108.9, 57.5, 56.9, 26.9; MS(ESI)m/z: {[M+Na]+}301.1。
3-叠氮甲基-1,3-二甲基-1,3-二氢-2H-吡咯[2,3-b]吡啶啉-2-酮(3p):淡黄色液体,收率69%;1H NMR(CDCl3, 400 MHz)δ: 8.23(dd,J1=5.3 Hz,J2=1.7 Hz, 1H), 7.53(dd,J1=7.4 Hz,J2=1.5 Hz, 1H), 6.99(dd,J1=5.5 Hz,J2=1.7 Hz, 1H), 3.65(d,J=1.7 Hz, 2H), 3.32(s, 3H), 1.42(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 178.0, 157.1, 147.8, 130.9, 126.2, 118.6, 57.0, 48.7, 25.8, 20.2; MS(ESI)m/z: {[M+H]+}218.3, {[M+Na]+}240.2。
2 结果与讨论
2.1 反应条件的筛选
为了顺利得到目标化合物,以N-甲基-N-苯基甲基丙烯酰胺(1a)与叠氮化钠(2)的反应作为模板,对影响反应的条件进行优化,分别探讨了催化剂、氧化剂、反应溶剂和反应温度对该反应的影响,筛选结果见表1。首先,对影响反应的催化剂进行考察,该反应分别在醋酸钯、醋酸铜和溴化亚铜的催化下均以较好的收率得到了目标化合物3a(Entries 1~3)。当该反应体系中不加入任何的过渡金属催化剂时,该反应依然可以进行,并且分离收率比加入过渡金属催化剂的收率高,分离收率达到81%(Entry 4)。之后对影响反应的溶剂进行筛选,分别考察了DCE、甲苯、二氧六环、乙腈、四氢呋喃(THF)和三氯甲烷对反应的影响。研究结果表明,在这些溶剂中经反应后均可得到目标化合物3a(Entries 4~9),其中在DCE中反应效果最好,分离收率高达81%(Entry 4)。由表1可以看出,当反应体系中不加入氧化剂时,该反应中未能检测到目标化合物3a(Entry 10)。而当加入氧化剂2,3-二氯-5,6-二氰基苯醌(DDQ)、过二硫酸钾(K2S2O8)、过硫酸氢钾(oxone)、 2,2,6,6-四甲基哌啶氧化物(TEMPO)、叔丁基过氧化氢(THBP)和二叔丁基过氧化物(DTBP)后,研究结果表明,以碘苯二乙酸作为氧化剂时反应效果明显优于其他氧化剂(Entries 4, 11~16)。由反应温度对反应产生的影响结果可以看出,当反应温度降低至60 ℃时,该反应的收率大幅降低至51%(Entry 17)。而当反应温度升高至100 ℃时,该反应的收率略微下降至79%(Entry 18)。此外,当反应温度为80 ℃时,反应效果最佳为81%(Entry 4)。

表1 反应条件的的筛选a
综上所述,最优的反应条件为:以N-甲基-N-苯基甲基丙烯酰胺1a(0.25 mmol)和叠氮化钠2(0.75 mmol)为原料,碘苯二乙酸(0.50 mmol)为氧化剂,DCE(2.50 mL)为溶剂,氮气氛围中,于80 ℃条件下反应24 h(Entry 4)。
2.2 反应底物范围
根据上述最优反应条件,本文进一步探究了底物的适用范围(Scheme 1)。研究结果表明,这些底物均以中等及以上的收率合成了3-叠氮甲基-吲哚啉-2-酮衍生物,其反应效率取决于电子效应和空间位阻效应。对于芳香基来说,当芳环的4-位上含有给电子取代基时(3d,3g),反应活性优于含有吸电子取代基的底物(3k,3l)。当芳香基上的取代基R1在氮原子的邻位时,底物的反应活性降低,反应时间延长,收率下降(3e,3f)。当苯环的4-位上含有卤素时(3h,3l,3j),反应收率下降。当4-位是氟原子时,收率明显下降为65%(3h)。当氮原子上的取代基R2为乙基、异丙基、苯基时,与甲基相比底物的反应活性降低,目标化合物的收率略有降低(3b,3c,3m)。对甲基丙烯酰胺而言,当取代基R2为较大的取代基(3n,3o)时,目标化合物的收率下降较为明显,这可能是由空间位阻效应引起的。由此可见,基于烯烃的双官能团化(芳基化和叠氮化的)的反应展现了良好的官能团容忍性。因此,采用该方法合成的目标化合物含有C—O—C(3g)、 C—F(3h)、 C—Cl(3i)、 C—Br(3j)、三氟甲基(3k)和乙酰基(3l),且该方法对含有杂原子的芳香化合物同样适用(3p)。

Scheme 2

Scheme 3
2.3 反应机理预测
为了深入探究该反应的可能机理,设计了如下的控制实验(Scheme 2)。在标准的反应条件下,向反应体系中加入自由基捕获剂2,2,6,6-四甲基哌啶氧化物(TEMPO)。实验结果表明,产物中只能得到痕量的目标化合物;TLC监测反应表明,该反应体系中存在大量化合物1a,说明该反应可能是通过自由基机理进行的。
基于上述的实验结果以及结合相关文献报道[15-16],本文提出了一个可能的无过渡金属催化烯烃的双官能团化(芳基化,叠氮化)合成3-叠氮甲基-吲哚啉-2-酮衍生物的反应机理(Scheme 3)。首先,在氮气氛围下,碘苯二乙酸和叠氮化钠2在加热的条件下脱去一分子醋酸钠,得到中间体Ⅰ;中间体Ⅰ在加热的条件下产生两个自由基,即叠氮基自由基和乙酸基自由基,同时游离出一分子碘苯;叠氮基自由基和N-烷基-N-芳基甲基丙烯酰胺衍生物(底物1)通过发生自由基加成反应,得到自由基中间体Ⅱ;中间体Ⅱ发生分子内的环化反应(烯烃的芳基化反应)形成吲哚啉酮环,同时释放出一分子醋酸,最终合成3-叠氮甲基-吲哚啉-2-酮衍生物3。
本文以廉价、易得的N-甲基-N-芳基甲基丙烯酰胺衍生物为起始原料,叠氮化钠为叠氮源,碘苯二乙酸为氧化剂,1,2-二氯乙烷为反应溶剂,在80 ℃条件下反应24 h或36 h,最后在氮气氛围下合成了一系列3-叠氮甲基-吲哚啉-2-酮衍生物。该反应经历了烯烃的双官能团化,即芳基化和叠氮化。考察了催化剂、溶剂、氧化剂以及反应温度等条件对该反应的影响。采用该方法合成的3-叠氮甲基-吲哚啉-2-酮衍生物具有反应条件温和、收率高等优点,并且对多种官能团展现出良好的容忍性。
