生物3D打印PLCL/PPDO基骨修复支架
2022-10-28杜雨寒侯培杰邢璐瑶刘锡亮陈栋梁熊成东张丽芳
杜雨寒, 侯培杰, 邢璐瑶, 刘锡亮, 陈栋梁, 熊成东, 张丽芳*
(1. 中国科学院 成都有机化学研究所,四川 成都 610041; 2. 中国科学院大学,北京 100049)
近年来,由于骨缺损的发生率较高,临床上对骨移植的需求量很大。骨缺损主要是由骨感染、骨肿瘤和外伤造成的[1-3]。目前,传统的骨移植如自体骨移植、同种异体骨移植和异种骨移植已不能完全满足临床需要。自体骨移植通常受到供体短缺和供体部位发病率的限制,而异体骨移植在实际应用中存在骨结合性差,免疫排斥,血液病传播和植入技术复杂等问题[4-6]。
随着3D打印技术的发展,骨组织工程支架的出现为临床应用解决骨缺损问题提供了新的思路,并制造了大量的组织工程支架。与传统组织工程支架的制备技术相比,3D打印可以精确地控制支架的孔径大小、几何形状和互连性,同时该技术可以根据用户定义的图案,在短时间内“自下而上”创建3D人工植入物[7-8]。挤出生物3D打印技术包括生物陶瓷颗粒、药物和生物分子等打印方法,其作为一种可以在室温或低温环境下进行溶剂共混的打印方式,主要通过将合成的聚酯溶解在1,4-二氧六环、二甲基亚砜(DMSO)等多种有机溶剂中,从而形成印刷油墨,并负载大量的生物制剂。同时还可以通过对材料和溶剂比例进行调整,进而调节支架的表面形态,从而仿生人体骨骼的微结构,达到提高细胞增殖和粘附的目的[9]。LAI等[10]利用低温挤出生物3D打印构建了PLGA/β-TCP/Mg+骨修复支架。该支架不仅具备良好的力学性能和生物相容性,并且在Mg2+的存在下还具备良好的骨诱导性和光热效应,此外,还可以针对性地解决内固醇等骨科疾病。
目前,部分合成聚合物因其良好的生物相容性、生物可降解性以及可调节的力学性能而被用于模拟骨组织细胞外基质(ECM)的组织工程支架[11],主要包含聚-L-旋乳酸(PLLA)、聚己内酯(PCL)、聚乳酸-ε-己内酯(PLCL)和聚乳酸-羟基乙酸共聚物(PLGA)等[12-15]。PLCL作为己内酯和乳酸的共聚物,具备降解速度可控、柔韧性高、弹性可调和拉伸强度可调等优势,因而引起研究人员的广泛关注并已成功应用到骨组织工程支架中[16]。然而,PLCL的降解周期过长,极大限制了PLCL在骨组织工程中的应用[17]。因此,需要引入快速降解的生物材料对PLCL降解周期进行调整。聚对二氧环己酮(PPDO)因其高柔韧性、良好的生物相容性、生物降解性快和高亲水性的特征,被人们认为是一种理想的生物材料,并被美国食品和药物管理局批准为临床生物材料[18]。PAN等[19]报道了熔融3D打印不仅可以吸收胰肠,还可以通过使用不同比例的PPDO来改善聚乳酸降解速率和亲水性,从而为PPDO改善PLCL的亲水性和降解速率提供了可行性。
本研究将PPDO与PLCL共混,通过3D打印技术制备了两种不同共混比例的PLCL/PPDO三维多孔骨修复支架PLCL91、 PLCL73。并以PLCL作为对照组,考察了共混材料的热性能以及支架的表面形态,并进一步探究了PLCL/PPDO共混后对复合支架降解性能的影响。
1 实验部分
1.1 仪器与试剂
Thermo Fisher Nicolet 6700型傅立叶红外光谱;DSC Q20型差式扫描量热仪;MP Bioprint 3.0型生物印刷机;AMRAY 1000B型扫描电子显微镜。
聚(L-丙交酯-己内酯(PLCL)和聚二氧杂环乙酮(PPDO)均由组内合成,纯度>99.5%;六氟异丙醇,二氯甲烷为分析纯。
(1) 红外光谱实验
将2.0 mg样品与200.0 mg溴化钾粉末于玛瑙研钵中顺时针研磨2 min。之后将混合粉末加入压片机中,升压至15 Mpa,保持20 s。取出压片进行测试,通过OMNIC软件对得到的谱图进行处理并标峰。
(2) 热力学性能表征
使用差示扫描量热仪对PLCL、 PPDO原材料以及PLCL/PPDO共混支架的玻璃化转变温度以及熔融温度进行检测。检测条件为:在高纯氮气保护条件下首先以10 ℃/min的速度降温至-20 ℃,再以10 ℃/min的速度升温至180 ℃。将得到的DSC曲线进行数据处理。
1.2 PLCL/PPDO骨修复支架的制备
首先将PLCL及PLCL/PPDO分别按照10/0, 9/1和7/3的质量比溶解到六氟异丙醇中。将生物3D打印机的填充密度设置为70%,用内径为0.4 mm的针头在100 KPa气压下以15 mm/s的平均速度挤出。挤出成型后将支架置于-20 ℃条件下进行冷冻干燥,直至溶剂完全蒸发。打印后的支架分别命名为PLCL, PLCL91和PLCL73。
1.3 PLCL/PPDO骨修复支架的性能表征
(1) 支架孔隙率表征
根据阿基米德定律,在以乙醇作为介质的条件下,测试尺寸大小为1.0 mm×1.0 mm×4.0 mm的3D打印支架样品(n=5),并计算支架的内部孔隙率。每组支架选取尺寸大小为1.0 mm×1.0 mm×4.0 mm的样品置于液氮中冷冻20 min,之后用虎口钳对微球进行脆断处理,从而制得断面样品。
(2) SEM表征
将表面和断面微球样品分别进行真空喷金处理5 min,并在5 kV条件下利用扫描电镜观测材料表面和断面的微观结构。选取支架样品SEM照片上10个孔径,并采用Nano-measure方法对支架孔径进行处理和分析。
1.4 PLCL/PPDO骨修复支架的降解实验
将尺寸大小为1.0 mm×1.0 mm×4.0 mm的各组支架样品试样称量并记下初始干重,之后将其置于10.0 mL离心管中。加入8.0 mL磷酸盐缓冲液(PBS, pH=7.4),然后在37 ℃恒温培养箱中进行体外模拟降解。依据设置的时间点,在3, 5, 7, 11和15 w时取出样品,用去离子水浸泡并冲洗3次,滤纸小心吸去表面水分并测量湿重。之后将样品置于真空烘箱常温烘干1 w至恒重并测量其干重。最后分别计算降解周期里各个时间点处的样品质量损失率和吸水率,同时测量每个降解时间点处待测样品取出后模拟体液的pH值。
1.5 显著性差异分析
所有的数据以均数±标准差(SD)表示,统计学差异采用单因素方差分析(ANOVA)。由Tukey’s多重比较检验(SPSS Statistics 17.0, IBM Corp., USA)可知,当P<0.0001, ****; P<0.0010, ***; P<0.0100, **; P<0.0500, *时,该数据被认为是具有统计学意义的。而n, s:则不显著。
2 结果与讨论
2.1 PLCL和PPDO的红外表征
PLCL和PPDO的红外谱图如图1所示。由图1可知,1184.0 cm-1和1759.0 cm-1特征峰分别为PLCL上C—O伸缩振动峰和C=O伸缩振动峰。以上两种波数在聚合物中都有明显的特征吸收,证明了共聚物PLCL的化学结构[20]。1755.5 cm-1处有一个尖而窄的吸收峰,该峰归属于C=O的伸缩振动峰;2917.7 cm-1附近的峰为C—H伸缩振动;1186.2 cm-1处的峰为C—O的伸缩振动;在1430.5 cm-1处的峰为CH2基团的弯曲振动,证明了共聚物PPDO的化学结构[21]。

ν/cm-1图1 PLCL和PPDO的红外谱图Figrue 1 Infrared spectra of PLCL and PPDO
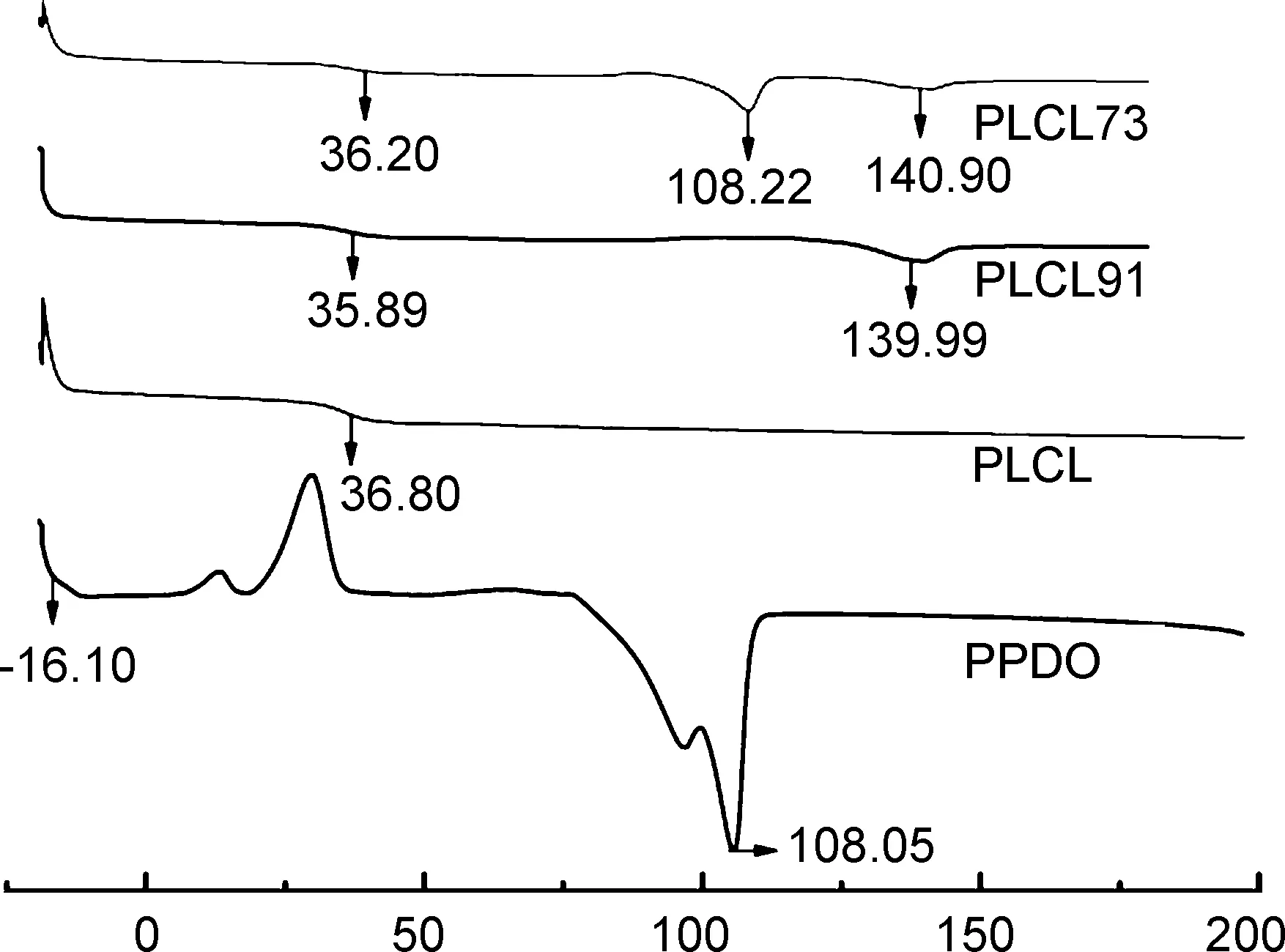
Temperature/℃图2 PPDO、 PLCL、 PLCL91和PLCL73的DSC曲线Figrue 2 DSC curves of PPDO, PLCL, PLCL91 and PLCL73

表1 材料PLCL和PPDO的粘度以及支架PLCL、PLCL91和PLCL73的玻璃转化温度Table 1 The viscosity of the materials PLCL and PPDO and the glass transition temperatures of the scaffolds PLCL, PLCL91 and PLCL73
2.2 PLCL和 PLCL/PPDO共混物支架的热性能
采用差示扫描量热法(DSC)对材料和支架进行热稳定分析,其结果如图2和表1所示。由图2 DSC曲线可知,PLCL不存在结晶峰,属于无规共聚物,因而其玻璃化转变温度(Tg)为36.8 ℃。而PPDO为结晶聚合物,Tg为-16.10 ℃。此外,也可以观察到PLCL91和PLCL73也存在明显的Tg,分别为35.89 ℃和36.20 ℃。从图2还可以看出,PLCL91和PLCL73均存在明显的熔融峰。其中,PLCL91在139.99 ℃处的熔融峰为PLCL的熔融峰。而PLCL73的两个明显的熔融峰分别属于PPDO和PLCL。DSC的研究结果表明,PLCL和PPDO两种聚合物不具备良好的相容性。
2.3 PLCL/PDOO骨修复支架表面形态表征
从图3骨修复支架的SEM照片可知,所有支架均为白色且尺寸(25.0 mm×200.0 mm×1.0 mm)大小一致,孔洞分布规则均匀。利用扫描电镜检测支架中大孔的平均尺寸和形貌,其结果如图4所示。由图4可知,支架的孔径为400.0 μm,各组之间无显著性差异。PLCL支架表面较为光滑,然而随着PPDO的加入,可以观察到支架表面粗糙程度明显增加。这种粗糙的表面形态有利于成骨细胞的增殖和粘附。此外,PLCL支架的断面和表面相同,都较为光滑。然而,在PLCL91支架的内部可以看到明显的相分离现象,这是由于PPDO以均匀的颗粒形式分布在PLCL中,为典型的海岛结构。在PLCL73的支架内,相分离现象进一步加深,PPDO颗粒变大,并且分布极不均匀。这些现象可以说明PLCL与PPDO之间的相容性不佳,该结果与DSC分析结果一致。通过乙醇浸泡法检测,支架的平均孔隙率均约为60%(表2)。据文献显示,孔径大于300.0 μm、孔隙率大于50%的生物材料支架因其良好的血管化性能而成为骨替代植入物的首选材料[2]。

图3 PLCL、 PLCL91和PLCL73支架的宏观照片和SEM照片

图4 PLCL、 PLCL91和PLCL73支架断面的SEM照片

Table 2 Pore size and pore space of PLCL, PLCL91 and PLCL73 scaffolds
2.4 PLCL/PPDO骨修复支架的降解
在复合骨修复支架浸泡的PBS微环境中,溶液的pH值随时间的变化规律如图5所示。由图5可知,随着浸泡时间的延长,各个支架的pH值均呈现下降趋势。其中,PLCL的下降速率最慢,在浸泡时间达到12 w时,pH降低至7.22,之后变化不明显。而对于PLCL91和PLCL73,在浸泡时间达到15 w后,pH分别下降至6.70和6.20。值得注意的是,PLCL73在整个降解的过程中,各个降解时间点上的pH始终低于其他两组支架,说明支架中PPDO的含量越多,支架的pH下降越快,这种现象主要是由PPDO的酸性降解以及降解过程中的自加速效应导致的。

Time/weeks图5 降解过程中PLCL、 PLCL91和PLCL73支架的pHFigrue 5 pH values of PLCL, PLCL91 and PLCL73 scaffolds during degradation

Time/weeks图6 降解过程中PLCL、 PLCL91和PLCL73支架的质量损失Figrue 6 Mass loss of PLCL, PLCL91 and PLCL73 scaffolds during degradation
浸泡过程中,复合骨修复支架的质量损失随时间的变化规律如图6所示。由图6可知,在浸泡15 w期间,PLCL与PLCL91的降解趋势接近,说明两者降解速率基本相同。而在15 w后,支架的质量损失为15.72%±1.25%。然而,当支架中PPDO组分达到30%后,PLCL73支架在降解1 w后的质量损失就已达到23.00±2.12%,高于PLCL和PLCL91在12 w时的质量损失。当支架降解12 w后,PLCL73支架的质量损失为60.30%±2.30%,由此可见,PPDO可明显加速PLCL降解。
通过计算各个时间点的吸水率,便于检测支架的亲水和疏水行为。复合骨修复支架的吸水率随时间的变化规律如图7所示。由图7可知,PPDO的加入对于PLCL/PPDO复合骨支架的吸水率存在显著影响。在浸泡了15 w后,PLCL91和PLCL73支架的吸水率分别达到21.20%±4.21%和35.10%±2.21%,而PLCL的吸水率较低,仅有19.10%±2.30%。PLCL/PPDO复合骨支架的降解加速效应可能是由于PPDO和PLCL的相容性不佳,从而使得支架内部存在相分离现象。因此,在支架降解过程中,PPDO首先降解成小分子PDO,由支架内部向表面迁移,并向外扩散,从而产生了孔洞和裂缝,进而导致支架的吸水率增大,同时这也是支架质量损失增加的原因。
本文首次采用生物3D打印制备出PLCL, PLCL91和PLCL73 3种复合骨修复支架。该系列支架具有良好的孔隙率(60%)和规则均匀的孔隙(400 μm)。相较于PLCL支架,PPDO的加入增加了复合支架表面的粗糙程度。由于PLCL和PPDO之间的相容性较差,支架内部的相分离现象会随着PPDO组分的增加进一步增强。支架降解实验结果表明:PPDO的加入可有效调整支架的降解周期,弥补PLCL支架的降解速度过慢的缺陷,使其更好地符合骨修复速度。因此利用生物3D打印PLCL/PPDO基复合骨支架在骨修复支架领域具有很好的发展前景。

Time/weeks图7 PLCL、 PLCL91和PLCL73支架的在降解过程中的吸水率Figrue 7 Water uptake of PLCL, PLCL91 and PLCL73 scaffolds during degradation
