LC-MS/MS测定水果制品中的5种农药残留
2022-10-27李丽鑫唐一秋
李丽鑫,唐一秋
(1.昆明市食品药品检验所,云南昆明 650000;2.云南商务信息工程学校,云南昆明 650000)
1 材料与方法
1.1 仪器和试剂
Triple Quad 3500液相色谱-串联质谱-质谱仪(AB科技有限公司)、AL104电子天平(梅特勒-托利多国际贸易有限公司)、Multi Reax振荡器(德国海道尔夫公司)、ALLEGRA X-30R大容量冷冻离心机(美国贝克曼公司)、Arium comfort超纯水器(赛多利斯公司)、FSJ-A05B1粉碎机、IKA T18均质器及KQ5200DB超声波清洗器。
100 μg·mL-1的咪鲜胺、多菌灵、啶虫脒、噻虫嗪、吡虫啉标准溶液(天津农业农村部环境保护科研监测所);甲酸(色谱纯,阿拉丁试剂);乙腈(色谱纯,赛默飞世尔科技有限公司);盐包(含4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸二水合物、0.5 g柠檬酸二钠盐倍半水合物,美国Agilent公司);15 mL SPE净化管(含150 mg无水硫酸镁、25 mg PSA,美国Agilent公司);待测样品为市售木瓜干、香蕉干和葡萄干。
1.2 样品前处理
将木瓜干、香蕉干和葡萄干分别放入粉碎机打碎,样品按1∶9(质量比)比例复水,静置30 min[1]。再用均质机把水和样品均匀混合后,准确称取10 g(精确至0.01 g)于50 mL的离心管中,加入10 mL乙腈,在振荡器下震荡5 min,加入QuEChERS提取盐包,振荡提取5 min后4 200 r·min-1离心5 min,准确移取6 mL上清液于15 mL SPE净化管中,在振荡器上振荡混匀5 min,4 200 r·min-1离心5 min,吸取1 mL上清液经0.22 μm尼龙有机滤膜过滤,待分析。
1.3 仪器工作条件1.3.1 色谱条件
色谱柱:CAPCELL PAK ADME-HR S2(2.1 mm×100 mm,2 μm);进样量:3 μL;流速:0.300 0 mL·min-1;流动相:0.1%甲酸水和乙腈,洗脱梯度见表1。
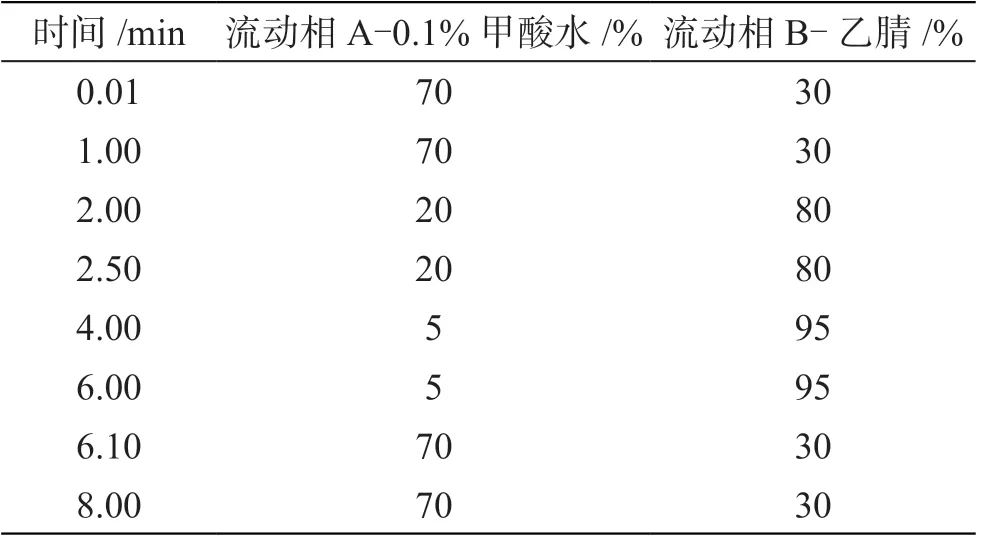
表1 农药残留洗脱梯度
1.3.2 质谱条件
离子化模式:正离子扫描;质谱扫描方式:多反应监测;气帘气(CUR):35 psi;离子化电压:5 500 V;离子源温度:550 ℃;GS1:50 psi;GS2:50 psi。具体参数见表2。

表2 农药残留的质谱条件
1.4 标准溶液的配制
溶剂标液的配制:用乙腈稀释得系列浓度分别为0.5 ng·mL-1、1 ng·mL-1、5 ng·mL-1、10 ng·mL-1、20 ng·mL-1、40 ng·mL-1、80 ng·mL-1和160 ng·mL-18个浓度的标准混合溶液。
基质标液的配制:用基质溶液稀释得系列浓度分别为0.5 ng·mL-1、1 ng·mL-1、5 ng·mL-1、10 ng·mL-1、20 ng·mL-1、40 ng·mL-1、80 ng·mL-1和160 ng·mL-18个浓度的标准混合溶液。
空白样品按样品前处理1.2的方法提取后配制基质标液。
2 结果与分析
2.1 色谱条件的优化
本次实验在国标的基础上,通过对流动相、进样量和洗脱梯度的不断尝试、优化,观察在不同的条件下5种农药残留色谱图的峰形、分离效果和保留时间,选择最佳的分析条件,尽可能缩短分析时间、提高效率的同时又能确保实验数据的可靠性和准确性[2]。经过实验,本次实验采用了0.1%的甲酸水和乙腈为流动相。
2.2 提取方法的选择
实验尝试了复水和不复水2种方法。不复水时5种农药残留加标回收率在65.49%~88.91%;复水后加标回收率在76.00%~104.14%。2种方法的加标回收率的结果相比,复水时5种农药残留的提取效果更理想,回收率更高,因此在实验过程中采用了样品与水按1∶9的比例进行复水。
2.3 基质效应
实验还对基质效应进行了分析考察,用乙腈和不含目标物的木瓜干、香蕉干和葡萄干样品提取液配制成和溶剂标液等浓度的标液,各连续进样2针[3]。结果显示,木瓜干、香蕉干和葡萄干样品用溶剂标液定量时,5种农药残留的加标回收率在69.25%~84.26%,用空白基质溶液配制标液5种农药的回收率在76.00%~104.14%。因此,为保证检测结果的准确度,在样品的检测过程中,为消除基质效应对检测结果的影响,需要使用基质配制基质标准溶液来定量[4]。
2.4 色谱条件的选择
依据2.1优化的色谱条件(1.3.1的色谱条件),噻虫嗪、吡虫啉、多菌灵、啶虫脒和咪鲜胺5种农药残留的分离效果如图1所示,多菌灵的保留时间为1.37 min,啶虫脒的保留时间为2.78 min,吡虫啉的保留时间为2.68 min,噻虫嗪的保留时间为2.07 min,咪鲜胺的保留时间为4.18 min。
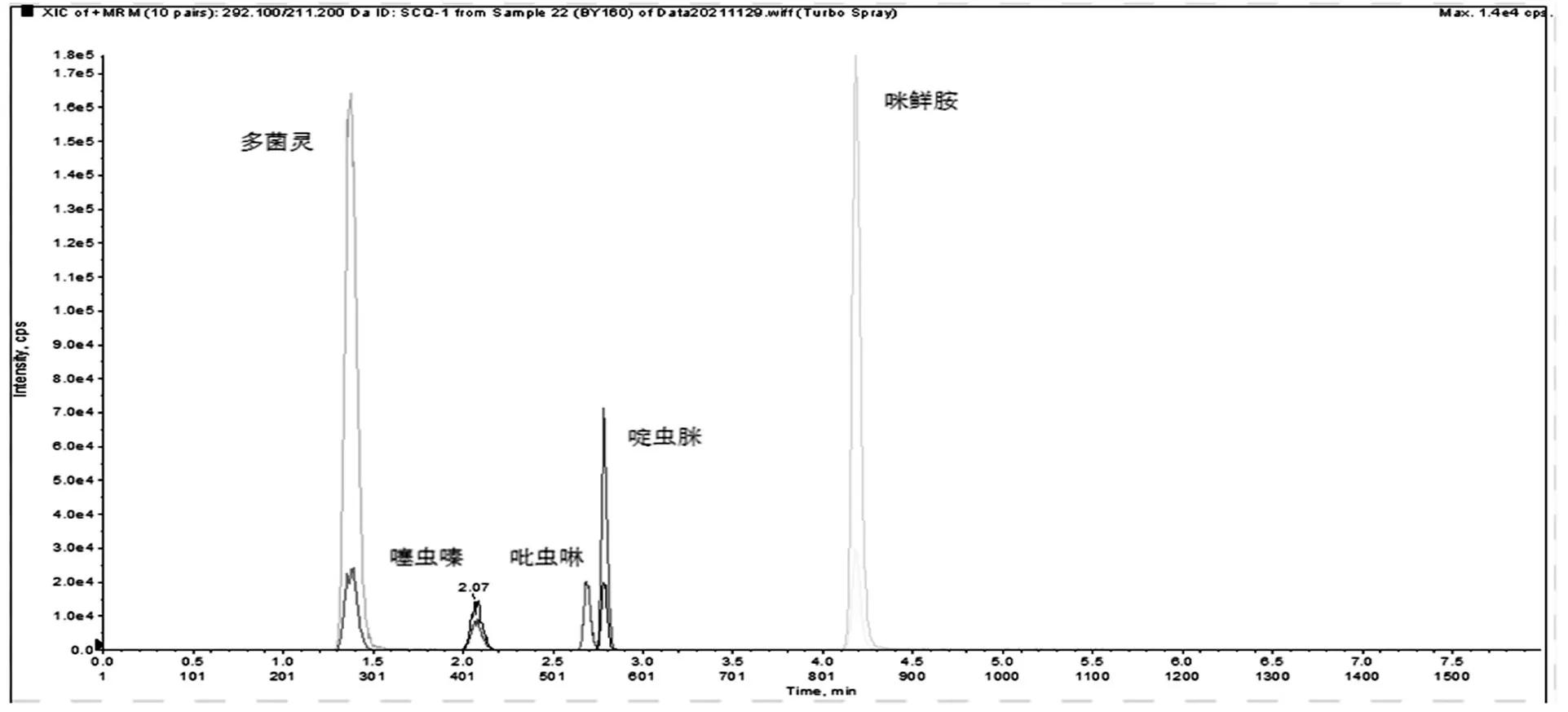
图1 噻虫嗪、吡虫啉、多菌灵、啶虫脒和咪鲜胺5种农药残留标准色谱图
2.5 方法学验证
在上述实验条件下检测木瓜干、香蕉干和葡萄干样品中噻虫嗪、吡虫啉、多菌灵、啶虫脒和咪鲜胺5种农药残留,样品均未检出5种农药残留。在该实验条件下,在空白的木瓜干、香蕉干和葡萄干中分别加入1 μg·mL-1混合标准储备液50 μL、400 μL、1 000 μL,按1.2的方法进行处理,每个浓度处理6个样,经过LC-MS/MS检测,根据各个组分的测定浓度与加标浓度之间的差异来计算5种农药残留的精密度与加标回收率[5]。由表3可知,加标回收率在79.64%~100.60%,相对标准偏差在1.2%~4.9%,满足测定需求。

表3 木瓜干、香蕉干、葡萄干中5种农药的相关系数、平均回收率、精密度
2.6 检出限与定量限的测定
在1.3.1色谱条件和1.3.2质谱条件下,将浓度标样1 ng·mL-1连续测定10次,确定其基线信噪比(S/N),求其平均值,然后根据3倍的信噪比计算出检出限,根据10倍信噪比计算出定量限,可以得出噻虫嗪的检出限为0.000 55 μg·kg-1、定量限为0.001 8 μg·kg-1;吡虫啉的检出限为0.001 μg·kg-1、定 量 限 为0.003 3 μg·kg-1;多 菌 灵 的 检 出 限 为0.000 15 μg·kg-1、 定 量 限 为0.000 49 μg·kg-1;啶 虫 脒 的 检 出 限 为0.000 19 μg·kg-1、定 量 限 为0.000 65 μg· kg-1;咪鲜胺的检出限为0.000 061 μg·kg-1、定量限为0.000 202 μg·kg-1。
3 结论
实验结果表明,建立的检测木瓜干、香蕉干、葡萄干中噻虫嗪、吡虫啉、多菌灵、咪鲜胺和啶虫脒的方法,加标回收率在79.64%~100.60%,相对标准偏差在1.2%~4.9%。5种农药残留的检出限均小于国家标准GB 23200.121—2021所给出的检出限。当针对性检测水果干制品的这5种农药残留时,此方法在样品前处理过程中所用的时间简短,过程简单,容易操作,再结合灵敏度较高的检测仪器,能够在短时间内实现对目标物的提取和检测,且完全满足农药残留检测的要求,有一定的实际应用价值,可为水果制品中多种农药残留的检测提供科学依据。
