植物胞外囊泡的结构、生物活性及其在食药递送方面的应用
2022-10-27朱珍珠廖柳月张琳曼谢丁宇张婧艺
朱珍珠,江 睿,廖柳月,张琳曼,谢丁宇,张婧艺
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏南京 210023)
外泌体对细胞间的信息交流起传导作用,同时能作为一种天然载体,参与人体内多种疾病的生理过程。外泌体具有良好的生物相容性,不会引起特异性免疫等问题,既跨越生物学屏障,又可反映来源于细胞的生理、病理情况,因此,其可作为运载功能营养因子或药物的高效载体材料。随着人们对外泌体的关注程度越来越高,首先要解决的便是如何分离纯化外泌体并对其进行表征的问题,而成功分离外泌体后,如何开发外泌体的生物学功能并将其运用于食药领域更是困扰着研究学者们。本文旨在探讨可食性植物来源胞外囊泡从分离纯化到活性研究,重点关注植物胞外囊泡在食品工业方面及递送药物方面的应用,建立完整的知识体系,为后续研究奠定理论基础,促进植物外泌体产品的研发,拓展其在食药领域的应用。
1 植物胞外囊泡概况
1.1 结构组成
1983年科学家在绵羊网织红细胞中首次发现由活细胞分泌的纳米级胞外囊泡,将其定义为外泌体(exosome)。2007年,An等研究发现了果蔬类可食性植物细胞也可分泌出纳米级胞外囊泡,通过透射电子显微镜发现,植物胞外囊泡的结构和组分与动物外泌体相似,直径约为40~150 nm且具有脂双层膜的囊状结构,富含核酸、蛋白质和脂质,呈茶托状或杯状。随着研究的深入,人们认为外泌体的产生机制如下:细胞通过胞吞作用,在浆膜双重内陷形成管腔状囊泡的过程中,脂质、蛋白质与核酸会被有目的地挑拣出来,以形成具有亚细胞结构的多囊体,多囊体通过Ca依赖途径与细胞膜进行融合后,将内部的小囊泡释放出来(图1)。多囊体与质膜结合的主要目的是将小泡释放到真菌和高等植物的细胞外空间。目前没有明确的方法来区分植物胞外囊泡和具有相似直径但不具备外泌体生物学功能的外泌体样囊泡,而在分离时,这些直径相似的囊泡可能会被分离到一起,为了规范文献,Marcela等提出,当不确定该细胞由何种细胞分化而来时应使用“植物胞外囊泡(plant extracellular vesicles, PEVs)”来代替“exosomes”。因此,本文中可食性植物胞外囊泡用PEVs表示。

图1 外泌体产生过程Fig.1 The production process of exosome
PEVs具有磷脂双分子层结构,由脂质、蛋白质和核酸组成。PEVs含有的核酸主要为微小RNA(microRNA, miRNA),miRNA是一种内源单链非编码RNA,长度通常为21~25个核苷酸,在生物体内起到基因表达调控的作用。PEVs含有的RNA种类明显少于动物外泌体,因为动物外泌体中含有丰富的信使 RNA(message RNA,mRNA)、miRNA 和长链非编码 RNA(long non-coding RNA,lncRNAs)。
PEVs所含蛋白质的种类较少,含量较低,现已鉴定出的主要种类有调节糖脂代谢的蛋白质、鸟苷三磷酸酶、与膜和囊泡相关的蛋白质等。动物外泌体中含有的蛋白包括四次跨膜蛋白、热休克蛋白、与细胞内转运和融合相关的蛋白以及胞质蛋白和膜联蛋白等。通过比对柠檬PEVs与动物外泌体中蛋白质种类,发现其中有56.7%相重合,提示这些蛋白质可能是与外泌体形成相关的特征性蛋白。
PEVs中富含磷脂酸(phosphatidicacid,PA)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰肌醇(phosphatidylinositol,PI)、双半乳糖基二酰基甘油(digalactosyl diacylglycerol,DGDG)和单半乳糖基二酰基甘油(monogalactosyldiacylglycerol,MGDG)等脂质分子,是构成囊泡磷脂双分子层的重要成分。其中,PA是重要的脂质信号分子,能够通过不同的作用模式调节细胞进程;DGDG和MGDG是重要的糖脂,可以在冻融冻干过程中稳定PEVs。不同果蔬来源的EVs中脂质的种类和相对含量均有所不同[14-15]。
功能上PEVs可以介导细胞间的通讯,也可为细胞中生物活性代谢物的储存和分泌提供安全的隔室。PEVs作为细胞间的通讯通路,在进入消化系统或免疫系统时,可对受体细胞产生特异的生物学效应,如生姜来源的PEVs可诱导巨噬细胞表达出血红素加氧酶(oxygenase-1,HO-1)。作为隔室,PEVs在木本植物木质部和韧皮部中参与木本植物细胞壁重塑的1,4--葡聚糖内酯酶的储存和运输。
1.2 提取方法
PEVs的提取借鉴动物外泌体的提取方法,包括超速离心法、蔗糖密度梯度离心法、尺寸排阻色谱法(size exclusion chromatography,SEC)、超滤离心法、免疫磁珠法、聚乙二醇(polyethylene glycol,PEG)沉淀法、微流控芯片法、非对称场流分级分离法、超声波纳米过滤技术等(表1)。此部分已有综述,此处不再赘述。本文就非对称场流分级分离法和超声波纯化技术做补充叙述。

表1 现有外泌体提取方法Table 1 Methods for exosome extraction
非对称场流分级分离法也叫单项色谱法,其原理是溶质分子在流动过程中由于受到与流动方向相垂直或成某种角度的外场作用改变原来的流动方式而造成组分的分离。Liu等根据颗粒的分散系数不同开发了一种用于分离各种线性和双链环状DNA链的方法。此法主要由不可渗透的上板和可渗透的底板组成的通道进行分离,底板被确定孔径的半渗透膜覆盖。通过在流动剖面上施加垂直横流,来达到分离不同尺寸颗粒的目的。Sitar等将非对称场流分级分离与多检测系统耦合,结果显示外泌体样品中存在两个颗粒亚群,较大的外泌体和较小的囊泡状颗粒,且横流速度和通道厚度对分离效率的影响较大。非对称场流分级分离系统可分离纳米到微米级的颗粒,因此该法适用于外泌体分离且纯度较高。然而,非对称场流分级分离法提取到的纳米级囊泡的样品量较少。
超声波纯化技术是基于超声驻波,根据微粒的大小和密度并对其施加声力来分离的,突出的优点是连续且无接触。不同大小的微粒会在叉指换能器产生的声波场中受到辐射力而向两侧的压力节点移动,辐射压力与颗粒体积成正比,所以较大的微粒留在侧面,而较小颗粒留在通道中心,并且可以通过控制声波功率和流速来截留不同尺寸的颗粒。Lee等采用一种声波纳米过滤系统从人卵巢癌细胞中分离纯化出粒径小于200 nm的外泌体。超声波纯化技术在提取外泌体的过程中耗时短,不存在外界污染,纯度高,但是仪器较为昂贵。
虽然已存在多种分离纯化外泌体的方法,但是这些方法的提取产量和纯度还有待提高,成本有待降低,以满足PEVs在食品工业发展和生物医药行业的迫切需求。随着研究的深入,根据研究对象和目的对提纯方法进行合理优化,选择高效、低廉、简便的外泌体提纯方法是开展外泌体相关研究的基础环节。无论是基于何种提取方法得到的外泌体,都需要进一步对其物理化学性质进行表征,这是研究外泌体生物学功能和实用价值的必要环节。
1.3 表征方法
1.3.1 物性表征 PEVs与外泌体的表征可借鉴纳米颗粒的表征手段(表2)。透射电子显微镜(transmission electron microscope, TEM)通过电压将高密度的电子束与样品相碰撞,根据样品密度和厚度的不同,产生的散射角大小也不同,成像的明暗亮度出现差异,生成具有分辩度的电镜图片。经高倍放大后,可以观测到动植物样品的亚显微结构,提供形态学、尺寸分布、均匀性和表面结构的信息。目前研究人员利用TEM观测到葡萄柚胞外囊泡超微结构,以椭圆形的双层膜结构为主,颗粒大小在200 nm以内。然而,对于PEVs在制样过程中会导致原结构的破坏,这可能影响样品的形态,导致无法观察到样品的真实形貌。

表2 植物胞外囊泡的表征手段Table 2 The characterization methods of PEVs
扫描电子显微镜(scanning electron microscope,SEM)利用二次电子信号成像原理来观测样品表面的形貌特征,包括样品的整体形态和细微结构。SEM精度略不如TEM,但高于传统的光学显微镜。Liu等通过SEM图像清晰观察到韭菜来源胞外囊泡是一侧凹陷的半球形结构,且分散良好,其尺寸都在200 nm附近。扫描电子显微镜可提供PEVs的大小和立体形态的一般细节,但是无法提供囊泡的层状结构和内部信息,不能分析异质囊泡群体,且分散样品成像条件苛刻,通量低。
原子力显微镜(atomic force microscope, AFM)借助一种弱相互作用力(即原子力)来观测样品,将探针与样品极近距离接触即可通过原子力表征样品的形貌,且能达到极高的分辨率。Zu等通过AFM在动态模式下表征并确定茶叶来源PEVs为100 nm左右,有完整膜的球形纳米颗粒外观。AFM通过力测量提供样品表面的机械和化学性质的信息,提供三维可视化分析;可在空气或液体状态下操作,不需要在真空中操作。AFM探针尖端的周期性接触会造成囊泡的移动,导致信号干扰。
纳米颗粒跟踪分析(nanoparticle tracking analysis, NTA)结合微电泳技术和布朗运动,利用Stockes-Einstein方程式计算出单个粒子的流体力学直径和浓度。此法是国际细胞外囊泡学会和广大研究者认可的外泌体鉴定技术之一,既适用于单分散体系,也适用于多分散体系样品。Jae等通过NTA测定了从甘蓝分离出胞外囊泡的粒径范围都在100~200 nm。该法操作简单快速且不破坏外泌体的原始状态,样本可视化,尺寸分布数据更可靠。当仪器搭配相应滤光片,NTA可以测量荧光抗体标记的外泌体来分析其纯度。该法不足之处在于,样品处理方式可能会影响尺寸分布,测定时间较长等。
纳米粒径分析法通过观测粒子在溶液中的布朗运动来测定粒径大小,粒径越大布朗运动的速度就越慢,反之则越快。具体观测可使用激光照射粒子,激光起伏的速度会表明粒子布朗运动的速度快慢,通过检测散射光强度反应粒子的粒径,即动态光散射(dynamic light-scattering,DLS)。Raimondo 等通过DLS测定了柠檬汁胞外囊泡的尺寸分布在10~300 nm内。该法操作简单、耗时短、精度高,适用于单分散体系。
Zeta电位反映了溶液中的粒子在分散体系中受静电作用的影响情况,可表征粒子分散体系的物理稳定性。Zeta电位的绝对值越大,体系越稳定;一般认为Zeta电位的绝对值大于30 mV时,体系稳定。如葡萄胞外囊泡在-11.2到-13.8 mV之间,生姜胞外囊泡-24.6到-29.7 mV之间。该法操作简单,样品量较少、耗时短。
目前对PEVs的表征方法虽然有很多,但是单一检测手段均不能覆盖样品的全部信息,因此,综合各种表征手段是全方位研究PEVs的关键步骤。同时,生物样本具有复杂性,在胞外囊泡中含有粒径形貌相近的颗粒,使用基于物理特性的仪器可能无法鉴定出具有生物功能的类似外泌体的PEVs。所以,利用分子生物学技术对PEVs的生物大分子进行化学成分表征是非常必要的。
1.3.2 组分表征 PEVs所含脂质可用高效液相色谱法(high performance liquid chromatography,HPLC)、薄层色谱法(thin-layer chromatography,TLC)对脂质进行表征。PEVs 中所含蛋白质可用蛋白印迹法测定其蛋白质的表达水平,通过质谱仪进行蛋白质组学分析。PEVs中所含RNA可用琼脂糖凝胶电泳、Northern印迹法、实时荧光聚合酶链反应(polymerase chain reaction,PCR)分析;或放射性同位素如P标记miRNA然后使核酸探针与miRNA杂交;或转录组基因测序,可检测靶基因的表达水平。如Zhao等从椰子水中提取的PEVs,通过PCR和基因测序鉴定了PEVs中miRNA的存在。
1.3.3 原位荧光标记 PEVs组成成分的差异会对受体细胞产生不同的影响,其表面不同的特异性标志物也可以用来标记并纯化特定来源的PEVs。上述提及PEVs的提取方法,尤其是基于PEVs直径的分离方法,其实无法将PEVs与那些不具备外泌体生物学功能但在直径上类似的囊泡分离。目前,已有三种对PEVs进行标记的方法,荧光染料可与PEVs特异性结合,利用悬浮液的荧光强度来衡量PEVs的含量。不同的荧光染料与PEVs特异性结合的部位也有所不同。第一种,借助荧光染料对PEVs脂质双分子层的标记方法。如亲脂性染料一般与PEVs膜脂质区结合,这种结合非常稳定,通常能保持10 d以上。其原理是该种荧光染料可与细胞膜结合并使自身处于激发态,发出荧光且不会破坏细胞膜结构。Zheng等用一种红色亲脂性荧光染料(1,1'-dioctadecyl-3,3,3',3'-tetramethylindocarbocyanine perchlorate, DiI)标记血浆中的外泌体,以此追踪阮病毒在未感染受体中的传播方式。第二种,借助PEVs表层特异性蛋白的标记方法。根据对拟南芥、橄榄、烟草和向日葵来源PEVs的研究,Marcela 等确定了PEVs的标志蛋白有三个,热休克蛋白70(heat shock protein 70,HSP70),S-腺苷同型半胱氨酸酶(S-adenosyl-homocysteinase)和3-磷酸甘油醛脱氢酶(glyceraldehyde 3 phosphate dehydrogenase, GAPDH)(图2)。当含有这三种标志性蛋白,可将PEVs和其他不具备外泌体生物学功能的囊泡区分开来。第三种,借助荧光染料对PEVs内的特定酶发生反应的标记方法。如渗透型化合物通过被动扩散进入PEVs后与内容物中的特定酶反应,从而形成稳定的荧光分子。Warren等用乙酰甲氧基甲酯钙黄绿素(Calcein-AM)对PEVs进行追踪和检测,以了解其在生理或病理过程中所扮演的角色以及其在医学上的应用潜力。其原理是AM基团为钙黄绿素提供用于穿透细胞膜的疏水性,而在进入PEVs后,AM基团被酯酶剪切,从而让钙黄绿素可以停留在目标PEVs内并发出绿色荧光。
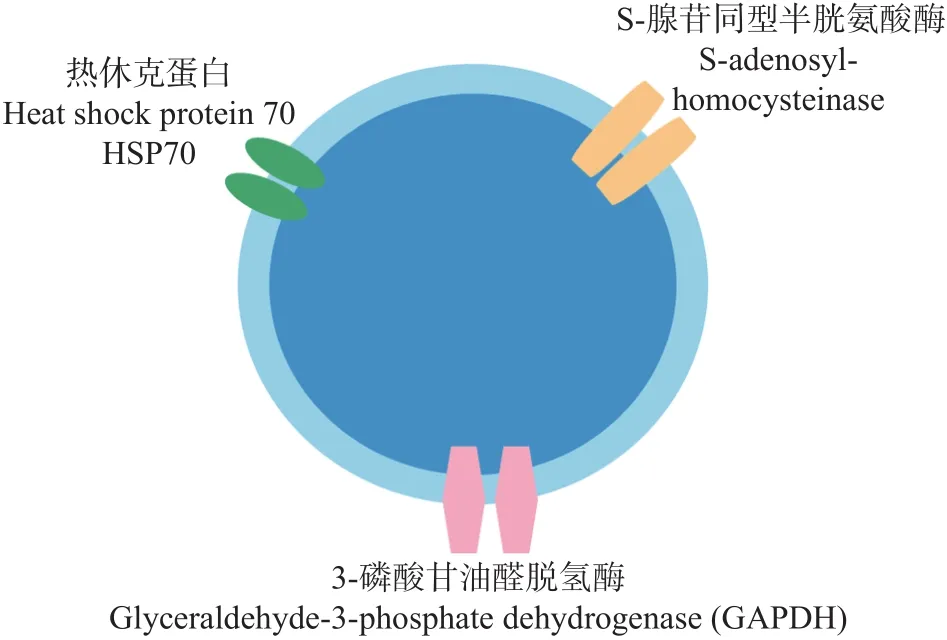
图2 PEVs标志性蛋白Fig.2 Protein markers in PEVs
2 植物胞外囊泡的抗炎活性
可食性PEVs经口服摄入后,在胃部酸性环境下保持稳定结构,通过囊泡运输机制到达小肠部位,通过受体蛋白识别,PEVs脂质双分子层与宿主细胞膜融合,经内吞作用进入肠道细胞内,释放其携带的内容物。PEVs被肠道特异性吸收,这促使学者们重点关注PEVs对机体肠道健康所发挥的作用。炎症性肠病(inflammatory bowel disease,IBD)是胃肠道慢性自身免疫性疾病,症状可表现为间歇性复发和炎症缓解,其致病机制包括环境或遗传因素、肠道微生物群和免疫反应。大量研究表明,摄入可食用PEVs在缓解肠道炎症方面起着重要作用。通过构建肠上皮细胞模型和小鼠肠炎模型,研究学者评估了可食用性植物来源胞外囊泡的对肠道屏障的保护作用。其中,机械屏障的结构基础是完整的肠粘膜上皮细胞以及上皮细胞间的紧密连接,柑橘来源PEVs可参与调节紧密连接蛋白的基因表达恢复肠道屏障功能;葡萄PEVs通过诱导肠道干细胞增殖加速肠粘膜上皮的恢复。肠道微生物群是肠道黏膜屏障的重要组成部分,肠道菌群失衡,会加速肠道炎症。口服茶叶来源PEVs可增强肠道菌群的多样性和整体丰度,厚壁菌门/拟杆菌门比例下降,从而缓解葡聚糖硫酸钠(dextran sulphate sodium salt,DSS)诱导的肠炎。富含脂质PEVs会被肠道乳酸菌科优先吸收,靶向调节鼠李糖乳杆菌单加氧酶ycnE产量,诱导白介素-22(interleukin-22,IL-22),改善小鼠肠道屏障,减轻结肠炎。PEVs通过靶向肠道巨噬细胞,上调血红素加氧酶-1的表达,抑制促炎因子的生成,上调白介素-10 (interleukin-10, IL-10)的分泌,从而维持肠道稳态。PEVs还可参与调节免疫应答,如鱼腥草来源PEVs促进由脂多糖刺激引起的M1型活化向M2表型的转化,并抑制核因子B(nuclear factor kappa-B,NF-B)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的激活。除此之外,韭菜PEVs可通过激活核苷酸结合寡聚化结构域样受体蛋白 3(NOD-like receptor protein 3,NLRP3)炎症小体及其下游信号通路,包括半胱天冬酶-1自切割、细胞因子释放和原代巨噬细胞的焦亡。这些发现揭示了PEVs可保护肠道屏障,调控炎症通路,维持肠道稳态,从而减轻机体炎症。
不同植物来源胞外囊泡在抗炎分子作用机制略有差异,这可能与PEVs携带的核酸种类有关。Xiao等通过基因测序技术预测出大豆、哈密瓜、橙子、生姜、番茄5种来源PEVs中的靶向细胞因子的miRNA基因序列(表3)。PEVs内miRNAs既可以调控肠道屏障功能,又可调节树突细胞、T细胞、巨噬细胞的功能以及NF-B相关信号通路提高机体免疫功能。除了miRNA以外,PEVs内的蛋白对IBD进程中的免疫反应、肠道屏障以及肠道菌群均具有一定的调控作用。玉米来源PEVs的脂质成分葡萄糖神经酰胺,已被证实可以抑制IBD中的结肠炎症。以上研究表明,PEVs各组分对缓解IBD的均可起到重要作用。综上所述,PEVs的结构和内容物决定了其在肠道内的抗炎活性。值得关注的是,PEVs携带的miRNAs在调节免疫功能和炎症信号通路方面发挥的关键作用,使PEVs可能成为炎症性肠炎治疗的一个具有前景的研究方向。

表3 可食性植物胞外囊泡miRNAs和预测靶基因Table 3 miRNAs and predicted target human genes of PEVs
3 植物胞外囊泡在食品工业和药物递送方面的应用
3.1 植物胞外囊泡在食品工业中的应用
3.1.1 在功能饮料中的应用 植物胞外囊泡具有抗炎、抗病毒、抗肿瘤、降脂及免疫调节等多种生理活性,且其含有蛋白质、脂质和核酸等营养成分。进食后PEVs会暴露在消化道环境中,但磷脂双分子层会保护PEVs不受消化道和胃酸环境的破坏。因此,PEVs腔内的生物活性物质(miRNA、蛋白质和代谢物)不会与肠道的降解酶接触,从而确保了其稳定
性。食用后PEVs能被肠道细胞吸收发挥局部作用,并通过血液循环到达其他组织影响整个机体健康。饮品如豆浆、椰汁、橙汁、蔬菜汁、姜茶中富含PEVs,可促进肠胃吸收,加强人体营养健康。鉴于PEVs可有效缓解炎症性肠病,为患者定制个性化的复配饮品,具有一定的应用前景。PEVs还可以通过冻干的方式得到粉末,比如从新鲜茶叶中提取的胞外囊泡冻干粉,将其添加到饮料中,或可以做成茶包,经水复溶,制备茶饮。
3.1.2 食品加工过程对PEVs的影响 PEVs主要从新鲜水果、蔬菜及其他可食性草本植物制得,在食品加工过程中,能否保持PEVs的营养成分和生物活性至关重要。炖煮是最常用的加热方式,研究表明,蒲公英、金银花和红景天经过煮沸半小时左右,PEVs携带的核酸经胃肠道被人体吸收,进入循环系统输送到各器官,发挥抗炎、抗肿瘤等功能。水果可直接食用或榨汁,主要涉及物理过程,可保证胞外囊泡的结构和活性。微波加热豆浆,会造成磷脂耗损量增加,蛋白质和碳水化合物会和磷脂产生络合物。牛奶作为食源外泌体的重要来源,经微波处理,脂肪整体含量变化不大,但是脂肪球受微波的作用逐步分解缩小,导致脂肪分离。因此,微波处理要控制好加热时间,避免食源外泌体营养成分的流失。商业灭菌牛奶和鲜牛奶相比,商业灭菌牛奶外泌体所含的蛋白质种类有43%和鲜牛奶是一致的,有8127个RNAs相同,且两种牛奶外泌体都具有抗肿瘤的活性。发酵会导致酸奶外泌体的内容物和生物活性物质发生改变,如从新鲜马奶和酸马奶中分离得到的外泌体对小鼠巨噬细胞可产生不同的免疫调节作用,新鲜马奶外泌体可促进IL-12p40和TNF-的分泌,而酸马奶外泌体促进抗炎因子IL-10的分泌。在煮熟或加工肉制品中也发现外泌体的存在,如煎炸的和巴氏杀菌的牛里脊肉、牛心、肾上腺的深度测序分析已经证实,miRNA的存在,且可潜在靶向人类特定细胞的mRNAs。总的来说,经过煮沸、微波、商业灭菌和发酵工艺处理后的食品原料中依然能分离出外泌体或PEVs,并且能够较大程度地保护其中的活性物质,发挥多种生物功能和营养价值。然而,在食品加工过程中仍然存在PEVs原始结构破裂、蛋白质变性等问题,加工食品中的miRNA的稳定性是否由于外泌体的包封所致,目前具体机制尚未明确,还需要进一步研究。
3.1.3 植物胞外囊泡作为壁材递送食品功能因子在食品工业中,花青素作为食品着色剂,易受酸碱度、温度等因素影响导致其稳定性差;虾青素作为重要的营养物质,其在体内的消化吸收受到溶解度和酯化程度的限制;姜黄素作为药食同源物质,生物利用度低、水溶性差,在人体内尚未完全发挥作用便被排出体外。选择合适的壁材,有望解决这些食品功能因子的稳定性和生物利用度差等问题。PEVs作为纳米级囊泡,在生理环境下具有尺寸效应,类似脂质体,且内含核酸和蛋白质,在细胞间具有天然的通信功能。PEVs可直接从口腔摄入,生物相容性好,有助于提高功能因子的生物利用度,增强功能因子营养价值,这使得PEVs成为优良的壁材。
目前有六种方法有望将目标分子包埋到PEVs中,分别是渗透休克法、脂质体膜融合、冻融法、电穿孔法、超声法、皂苷处理法和共孵育法(图3)。渗透休克法通过瞬时改变胞外囊泡的渗透压,使其产生轻微裂解,从而将目标分子包埋进囊泡中。Kunisawa等利用渗透休克法成功将模型分子包埋进胞外囊泡中,同时也尝试了其余几种方法,如脂质体膜融合技术利用脂质体与细胞膜的融合性或细胞的胞吞作用将预装在脂质体中的目标分子随着膜融合过程递送进PEVs中。冻融法在脂质体膜融合技术的基础上,通过迅速冷冻在PEVs内部形成冰晶,进而使PEVs表膜破碎,破碎的表膜和冰晶同时存在;当融解时,破碎的表膜会重新融合形成完整的PEVs,通过反复冻融目标分子得到了多次被包埋的机会,从而提高目标分子的包埋率。电穿孔法通过施加外加电场使细胞膜轻微破裂,使目标分子得以进入PEVs中。超声法是在特定频率下,目标分子和PEVs共同超声,通过空化作用、机械效应和热效应,将目标分子包埋进PEVs中。鲍少杰用超声的方法将虾青素包载进西兰花来源的PEVs中,可提高虾青素生物利用度,抑制肠炎。皂苷有着自组装特性,可形成稳定乳液,皂苷处理能使目标分子更易被包埋进PEVs中。共孵育法是目前最常用的方法,通过疏水相互作用、扩散作用或静电相互作用将目标分子包埋进PEVs中。水溶性的花青素与牛奶外泌体共孵育一定时间,得到的递送体系可以有效抑制乳腺癌的恶化。采用PEVs来运载脂溶性目标分子已有成功案例,如吴菊萍等用番茄来源的PEVs分别包裹脂溶性模型药物细胞膜红色荧光探针(DiI)和目的基因来培育细胞,且比阳离子脂质体负载目的基因的效果更好(表4)。这几种方法中渗透休克法包载水溶性分子的效率最高,冻融法次之,其他方法包载效率低。根据目标分子溶解性差异,借助PEVs来运载脂溶性和亲水性目标分子的策略也有所不同。
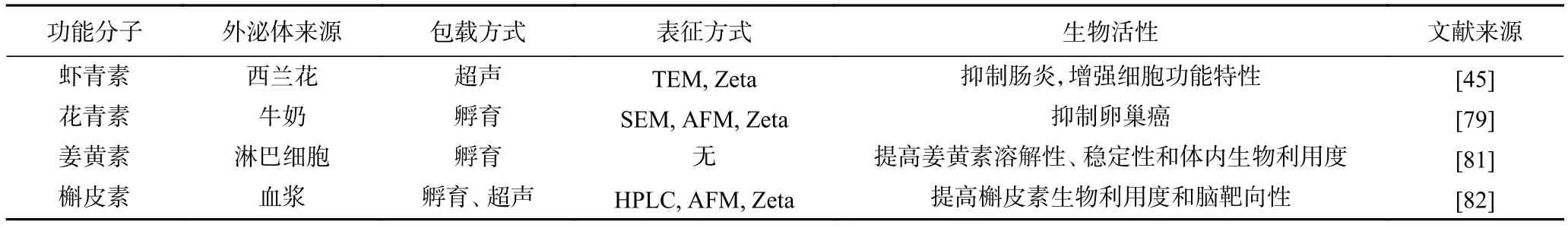
表4 植物胞外囊泡运载食品功能因子的实例Table 4 Food functional factors as cargos in PEVs delivery system

图3 PEVs递送目标分子的策略Fig.3 Delivery strategies of target molecules by PEVs
3.2 植物胞外囊泡作为药物递送体系的应用
药物分子的溶解性直接影响药物的口服利用度及药效。采用PEVs或动物外泌体作为运载体系,可直接从口腔摄入,生物相容性好,有助于提高药物摄入量,增强体内药物积累量,从而提高治疗效果。PEVs还可以运输抗癌药物,因为它们突破了非食品来源的外泌体和合成脂质对生物利用度、稳定性和安全性的限制(表5)。甲氨蝶呤(methotrexate, MTX)是脂溶性抗癌药,经口服给药,毒副作用大。Wang等研究发现葡萄柚来源PEVs作为载体,通过共孵育的方法,包封MTX后,可将MTX靶向递送至肠道细胞,缓解由DSS诱导的结肠炎。将阿霉素或生存素的小干扰RNA(small interfering RNA, siRNA)与含有叶酸的重组生姜来源PEVs整合,用于靶向小鼠结肠癌和乳头状瘤。与传统递药体系(如脂质体、乳液、微胶囊、“核-壳”结构无机纳米粒子等)相比,PEVs作为药物递送体系,具有的优势在于取材方便、易于提取纯化、食用安全,且具有良好的生物相容性。尽管目前对PEVs选择性包装和释放药物以及与靶细胞相互作用的具体机制还不完全了解,但是由于其在控制生理和病理过程中以及作为药物载体方面的潜在重要作用,未来对各种来源PEVs中的生物分子进行全面系统分析,将促进PEVs在药物递送方面的应用。
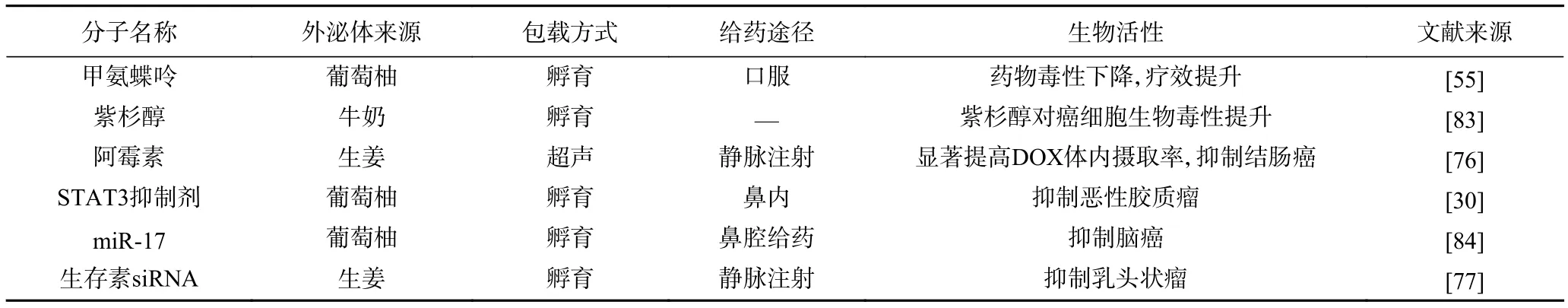
表5 植物胞外囊泡在药物递送方面的应用实例Table 5 The applications of PEVs on drug delivery system
4 结论和展望
总而言之,PEVs的分离方式和表征手段多种多样,既取决于PEVs的来源,也取决于仪器的限制。不同分离方式的结合可以在一定程度上提高分离的效果,不同表征方式的联用可以体现PEVs综合性质。在应用方面,PEVs可对肠炎起到干预作用,其作用机理如下:a.保护肠道屏障,诱导肠道干细胞增殖,加速肠道粘膜的恢复;b.维持肠道菌群稳态;c.通过免疫调节作用,抑制炎症信号通路。PEVs作为递送载体,具有良好的生物相容性和口服安全性,可跨越生物学屏障,无副作用和潜在毒性,将脂溶性和亲水性目标分子递送至体内组织,提高目标分子的生物利用度或药效。当然,PEVs在走向实际应用的过程中,还存在诸多问题,比如PEVs的储藏条件较为苛刻;不同植物来源PEVs含量存在较大差异,如何选择合适的可食性植物来源至关重要。外泌体的研究在临床上已有成功案例,如何在食品行业寻找到合适的应用方向,一方面需要科研人员奠定好食源性PEVs的理论基础,另一方面要与工业生产实际相结合。相信随着分离方式和表征手段的不断优化,能有更多PEVs在食药领域发挥作用的例子涌现,拥有更广阔的前景。
