基于红松籽油辅酶Q10纳米乳的制备、表征和药代动力学研究
2022-10-27王忠娟李紫菡张秀娟刘治廷陈小强
王忠娟,李紫菡,张秀娟,刘治廷,陈小强,3,4,5,6,张 莹,3,4,5,
(1.森林植物生态学教育部重点实验室,东北林业大学,黑龙江哈尔滨 150040;2.东北林业大学化学化工与资源利用学院,黑龙江哈尔滨 150040;3.东北林业大学林业生物制剂教育部工程中心,黑龙江哈尔滨 150040;4.黑龙江省林源活性物质生态利用重点实验室,黑龙江哈尔滨 150040;5.东北林业大学生物资源生态利用国家地方联合工程实验室,黑龙江哈尔滨 150040;6.西藏农牧学院资源与环境学院,西藏林芝 860000)
辅酶 Q(Coenzyme Q,CoQ)是天然醌类化合物,别名泛醌,是细胞自身合成的具有清除作用的唯一内源性亲脂抗氧化剂。CoQ具有清除人体自由基,降低血脂,提高免疫力等作用,同时在预防和辅助治疗心血管疾病、糖尿病、肿瘤等方面也具有良好的效果。CoQ在幼年时期合成量相对较低,随着年龄的增长,含量逐渐增加并达到最大值,但在20岁以后,其含量随着自身合成速率降低而减少。因此,外源性补充CoQ对维持人体正常的新陈代谢具有积极意义。但从CoQ结构可知,它具有较长疏水性侧链基团,如图1所示。因此,CoQ存在水溶性差,化学性质不稳定、生物利用度低等问题,从而使其应用受限。红松籽油来源于松科松属植物红松(Sivb.ct Zucc)的种子红松籽,在我国东北地区分布较广、资源丰富,具有良好的开发利用价值。红松籽油风味独特,富含对人体有益的不饱和脂肪酸,其中皮诺敛酸是红松籽油特有的多不饱和脂肪酸,具有一定的抗氧化能力。同时,红松籽油具有减肥降脂、免疫抗炎、抗肿瘤转移等多种生理功效。然而,由于其自身结构的高度不饱和,使其容易被氧化,从而应用受限。
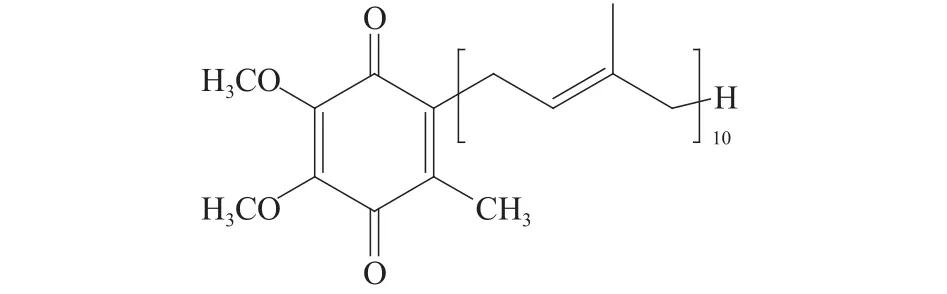
图1 CoQ10化学结构Fig.1 Chemical structure of CoQ10
纳米乳液一般指液滴粒径范围在50~200 nm的乳液,是油相(或水相)分散于水相(或油相)中形成的多相分散体系,可以分为O/W型和W/O型,是动力学稳定体系,制备过程中需要输入能量。近年来,纳米乳液常被用来递送亲脂性化合物,而负载CoQ的纳米乳液具有很多优势:可以穿越细胞膜,具有靶向和缓释双重效果,负载率高,还能增强CoQ的理化稳定性。采用纳米乳负载CoQ,一方面可以使其处于一个更加稳定的体系当中,生物活性成分更加稳定,另一方面纳米乳粒径小,负载活性物的能力高,使活性物更容易被机体吸收利用,从而有效提高其生物利用度。然而,近年来,在制备CoQ纳米乳液过程中,对油相的选择上大多采用合成类油脂,如中碳链甘油三酯或中长碳链甘油三酯,这些油脂仅有增大CoQ溶解度的作用且获取途径可能存在安全性问题,因此,选用新型的、健康的、安全的天然植物油为油相成为研究的新思路。
目前采用天然植物油红松籽油为油相制备纳米乳的研究较少。本文采用高压均质技术制备基于红松籽油的CoQ纳米乳(Coenzyme Qnanoemulsion,CoQ-NE)。这既能解决红松籽油不饱和脂肪酸因高度不饱和而易被氧化的问题,同时也会解决CoQ水溶性差,生物利用度低等问题,二者的生理功效又可以发挥协同作用。本文通过单因素实验和正交优化实验,确定了制备CoQ-NE的最佳工艺,对CoQ-NE通过透射电镜(Transmission electron microscope,TEM)、傅立叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)、包封率、稳定性、体外释放行为及药代动力学进行表征和研究。为基于红松籽油CoQ-NE的应用提供数据和理论支撑。
1 材料与方法
1.1 材料与仪器
动物:SPF 级 SD 大鼠,体重为(300~325 g),雄性,辽宁长生生物科技有限公司,合格证编号:SCXK(辽)2020-0001。所有涉及动物的实验均按照中国哈尔滨医科大学动物护理指南进行,并经中国黑龙江省实验动物管理委员会批准。CoQ(纯度>98%),CoQ(纯度>98%) 西安圣青生物科技有限公司;大豆卵磷脂(20200106) 北京奥博星生物技术有限责任公司;红松籽 哈尔滨东北特产有限公司;红松籽油(纯度为 97.3%,得率>60%,Y30 R0.6,碘值为141.65±0.02 g/100 g,过氧化值为 2.62±0.04 mmol/kg,皂化值为 185.73±0.45 mg KOH/g,酸值为 0.34±0.10 mg KOH/g) 实验室自制;其它化学药品均为分析纯或色谱纯。
FSH-2高速匀浆机 江苏金坛市环宇科学仪器厂;AH100D高压均质机 上海阳溢生物科技有限公司;FA114A 0880电子分析天平 上海奔普仪器科技有限公司;ZetaPALS激光粒度仪 美国Brookhaven公司;JEM-2100透射显微镜 日本电子株式会社;IRAffitiny-1傅里叶变换红外光谱仪 日本岛津公司;1260型高效液相色谱仪 美国安捷伦公司;MICRO 220R高速低温离心机 德国Hettich科学仪器公司;TCQF-3800氮气吹干仪 北京通德创业科技有限公司。
1.2 实验方法
1.2.1 CoQ标准曲线的建立 精密称取20 mg纯度为99.0%的CoQ,用无水乙醇溶解定容于100 mL的容量瓶中,配置浓度为0.2 mg/mL的CoQ乙醇溶液,并将其作为母液。从母液中分别移取3.125、6.250、9.375、12.50、15.625 mL体积至 25 mL容量瓶中,无水乙醇定容并混合均匀,得到浓度梯度分别为 0.025、0.05、0.075、0.1、0.125 mg/mL的标准溶液。通过液相色谱HPLC测定CoQ的浓度和峰面积之间的关系。HPLC进样操作条件为:色谱柱为Symmetry C(250 mm×4.6 mm,5 μm;美国 Waters公司)柱;流动相甲醇∶乙醇(V/V,10:90);流速1 mL/min;检测波长 275 nm;柱温 25 ℃;进样量20 μL。以CoQ浓度为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线。线性拟合方程为:Y=25961X-85.55,=0.9995,线性范围为 0.025~0.125 mg/mL。
1.2.2 CoQ纳米乳的制备 以30 mg CoQ于红松籽油中加热至完全溶解为油相,以0.35 g表面活性剂大豆卵磷脂和0.05 g助表面活性剂无水乙醇于蒸馏水中加热至完全溶解为水相,水相和油相混合后于高速匀浆机以8000 r/min匀浆3 min,得到初乳液,将得到的初乳液以均质压力800 bar,循环次数为6次,进行高压均质,得到CoQ纳米乳。将30 mg CoQ溶解于生理盐水中,得到CoQ混悬液。
以0.12 g红松籽油为油相,以0.35 g表面活性剂大豆卵磷脂和0.05 g助表面活性剂无水乙醇于蒸馏水中加热至完全溶解为水相,水相和油相混合后于高速匀浆机以8000 r/min匀浆3 min,得到初乳液,将得到的初乳液以均质压力800 bar,循环次数为6次,进行高压均质,得到空白纳米乳。
1.2.3 单因素实验 固定CoQ与混合表面活性剂质量比为3:30,CoQ和红松籽油的质量比为1:4,均质压力为800 bar,循环次数为6次。在上述工艺条件下,以平均粒径和PDI为考察指标,分别探讨CoQ与混合表面活性剂质量比3:10、3:20、3:30、3:40、3:50;CoQ与红松籽油质量比 1:3、1:4、1:5、1:6、1:7;均质压力 400、600、800、1000、1200 bar;循环次数3、6、9、12、15次,每次实验重复三次。
1.2.4 正交优化试验设计 在单因素实验的基础上,选择CoQ与混合物表面活性剂(大豆卵磷脂和无水乙醇)的质量比、CoQ与红松籽油的质量比、均质压力和循环次数4因素3水平的正交试验设计对CoQ纳米乳的粒径参数工艺进行优化,如表1所示。

表1 正交试验因素与水平设计Table 1 Orthogonal experiment factor and level
1.2.5 粒径和多分散系数的测定 本实验采用动态激光散射(Dynamic light scattering,DLS),使用的仪器为ZetaPALS激光粒度仪,测试温度为25 ℃,测试角度为90°,平衡条件为90 s,测定结果以平均粒径和多分散系数(Polydispersity Index,PDI)为指标。将纳米乳的稀释液进行测定,待测样品用去离子水稀释200倍,稀释成透明状态,每次实验重复三次。
1.2.6 包封率的测定 将1 mL CoQ纳米乳稀释10倍,取稀释液1 mL,涡旋2 min,超声破乳10 min,5000 r/min离心10 min,得到CoQ破乳液。上清液0.22 μm滤膜过滤后,取20 μL进行分析,根据所得峰面积计算出总的CoQ量(W)。
将1 mL CoQ纳米乳稀释10倍,取稀释液1 mL,置于超滤管内室,4 ℃条件下5000 r/min离心20 min,将外室的滤液用乙醇定容至1 mL,0.22 μm滤膜过滤后,取20 μL进行分析,根据所得峰面积计算出CoQ量(W)。
根据公式(1),计算得到包封率(Encapsulation efficiency,EE):
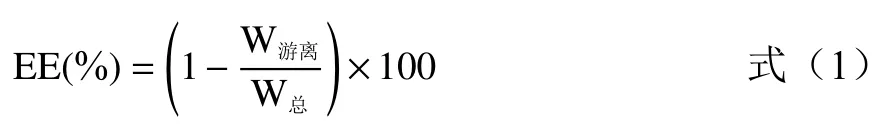
1.2.7 透射电镜(Transmission electron microscope,TEM)的测定 根据最优配方得到的CoQ纳米乳,稀释50倍,滴加到铜网表面,用滤纸吸取多余的液体,用磷钨酸负染2 min,滤纸吸取多余液体,自然晾干,用透射电镜观察CoQ纳米乳的微观形貌。
1.2.8 傅立叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)测定 采用IRAffitiny-1傅立叶变换红外光谱仪(Fourier transform infrared spectroscopy,FT-IR)进行红外光谱分析。采用KBr压片法对CoQ原药、冷冻干燥后的空白纳米乳和CoQ-NE在25 MPa压力条件下进行压片,设置分辨率为4 cm,扫描范围为 500~4000 cm。
1.2.9 稳定性实验 本实验主要通过以下四个实验验证其稳定性。
加速离心实验:分别取15 mL纳米乳液于离心管中,于转速8000 r/min分别离心5、10、15、20 min,观察样品是否分层,以平均粒径和PDI作为指标进行测定。
常温静止稳定试验:将15 mL纳米乳液储存室温下,分别于30、60、90和120 d取出样品,以平均粒径和PDI作为指标进行测定。
低温静置稳定实验:分别将5份15 mL的纳米乳放入4 ℃冰箱中分别冷处理20、40、60、80和100 min,以平均粒径和PDI作为指标进行测定。
冻融升温稳定实验:分别将6份15 mL的纳米乳放入不同温度-20、-10、0、10、20和 30 ℃ 的条件下放置3 h,以平均粒径和PDI作为指标进行测定。
1.2.10 体外释放实验 采用透析袋法对药物的体外释放行为进行考察,以300 mL 0.5%十二烷基硫酸钠溶液(pH=6.8)为溶出介质,在温度37 ℃条件下于烧杯中搅拌振荡,转速为50 r/min。分别精密量取适量的CoQ混悬液和CoQ-NE(相当于CoQ10 mg)置于事先处理过的透析袋(MWCO:3500 g/mol)中,并捆扎好两侧,置于溶出介质中,分别于10、20、30、60、90、120、180、240 min吸取溶出介质 5 mL,同时向烧杯中补加相同体积的空白介质,经0.22 μm滤膜过滤,吸取滤液20 μL,按1.2.1色谱条件进样,计算CoQ的累积释放量。
1.2.11 大鼠体内药代动力学研究
1.2.11.1 动物分组及血样采集 SD雄性大鼠12只,体重300~325 g,实验前将大鼠置于单独的金属笼中,室温 25±1 ℃,相对湿度 50%±5%,明暗循环12 h,大鼠随意喂食食物和水。
给药前禁食12 h后,将大鼠随机分成两组,每组六只。两组大鼠分别灌胃60 mg/kg CoQ混悬液(分散于0.9%生理盐水中)和CoQ-NE。给药后于 0.08、0.5、1.0、2.0、4.0、6.0、8.0、12.0和 24.0 h通过眼眶穿刺取血收集全血样本,将血液置于含有肝素钠的抗凝管中,立即在4 ℃下以12000 r/min离心10 min,血浆样品在-20 ℃下储存直至分析。
1.2.11.2 血浆中CoQ含量的测定 大鼠血浆分析:在1.0 mL离心管中混合80 μL大鼠血浆、300 μL甲醇和 20 μL 内标 CoQ(20 μg/mL)。将混合物涡旋3 min,以10000 r/min离心10 min,收集上清液并在真空termovap样品浓缩器下干燥,将残留物溶解在100 μL流动相中。将20 μL试样注入HPLC系统进行分析,CoQ与CoQ的峰面积比值用于CoQ的定量。按照上述“1.2.1”完成色谱进样操作。
1.2.11.3 大鼠血浆分析标准曲线的建立及方法学验证 CoQ标准储备液的配制:精密称取CoQ标准品5 mg,置50 mL容量瓶中,用色谱级乙醇定容,得浓度100 μg/mL CoQ储备液,置4 ℃冰箱中保存,临用时稀释至所需浓度。
内标储备液的配制:精密称取CoQ标准品1 mg,置50 mL容量瓶中,用色谱级乙醇定容,得到浓度20 μg/mL CoQ储备液,置4 ℃冰箱中保存,临用时稀释至所需浓度。
首先配制不同浓度的血浆生物样品,精密移取大鼠空白血浆80 μL,分别加入系列浓度CoQ对照品溶液 20 μL,得一系列浓度梯度,20、10、5、0.6250、0.3125和0.0391 μg/mL的血浆生物样品,然后血浆生物样品处理方法按“1.2.11.2”进行处理,色谱进样条件按“1.2.1”进行分析,记录每个血浆样品浓度记为C。
回收率实验:配制5份CoQ浓度为低(0.0391 μg/mL)、中(0.6250 μg/mL)以及高(10 μg/mL)的血浆生物样品。按“1.2.11.2”进行处理,按“1.2.1”进样分析,记录CoQ和CoQ内标的峰面积比值。
精密度实验:在SD大鼠空白血浆80 μL中加入20 μL的CoQ对照品溶液,涡旋混匀,得到低(0.0391 μg/mL)、中(0.6250 μg/mL)、高(10 μg/mL)浓度的血浆生物样品,按“1.2.11.2”进行处理,-20℃冷藏。每个浓度6份,连续三天每天同时按“1.2.1”色谱条件分析,记录CoQ和CoQ内标峰面积的比值。
1.3 数据处理
使用正交设计助手II V3.1软件进行正交实验设计及实验数据处理,使用DAS 2.0 软件进行药代动力学参数分析。每组实验数据设置3个平行,实验数据以平均值±标准误差来表示,采用Origin 2019b进行数据和图像处理并生成图片。
2 结果与分析
2.1 单因素实验
如图2a所示,随着CoQ与混合表面活性剂质量比的变化,平均粒径呈先减小后增加的趋势,质量比为3:30时平均粒径为最小值298.1 nm,多分散系数为0.153。这可能是因为表面活性剂可以较好的降低油/水界面张力,形成界面膜而促使纳米乳的形成。而在纳米乳液形成过程中加入适量的助表面活性剂,可以降低界面膜弯曲应力,使界面膜获得足够弹性,从而促进纳米乳的形成,使纳米乳液粒径更小,更加稳定。Kaci等研究发现,添加表面活性剂会得到粒径更小的纳米乳液,乳化率大大提高,与本文研究结果相似。因此,确定CoQ和混合表面活性剂的质量比为3:30。

图2 单因素实验结果Fig.2 Results of single factor experiments
由图2b所示,随着CoQ和红松籽油的质量比的增加,平均粒径整体呈逐渐减小的趋势,在质量比为1:7时,平均粒径为138.8 nm。而多分散系数呈先减小后增大的变化趋势,在质量比为1:4时PDI为0.098。这可能是因为,随着油相比例的增加,药物在油相中的溶解性提高,油相在水相中的分散更好,有利于纳米乳的形成,平均粒径逐渐减小。但是当油相比例过高,粘度增加,反而不利于纳米乳的形成,影响纳米乳的均一性。Kommuru等研究不同组成和比例的油脂对纳米乳的影响,当油脂的质量分数为40%时,纳米乳平均粒径和分散性最小,纳米乳的稳定性和生物利用度最高。因此,综合平均粒径和PDI的整体变化,最终确定CoQ和红松籽油的质量比为1:4。
由图2c所示,随着均质压力的增加,均质压力对平均粒径和多分散系数有显著影响。平均粒径随着均质压力的增大呈先减小后增加的趋势,在均质压力为800 bar时,平均粒径为182.5 nm,多分散系数为0.155,当均质压力上升到1000 bar和1200 bar时,平均粒径增大到203.7 nm和248.2 nm,这是可能因为随着均质压力的增大,体系温度升高,纳米乳液颗粒发生聚集,粒径随后又增大,PDI也增大。因此选择均质压力为800 bar为最佳值。
由图2d所示,随着循环次数的增加,平均粒径呈先减小后增加而后又减小的趋势,循环次数为6次时,平均粒径和多分散系数分别为200.4 nm,PDI为 0.165。循环次数为9、12、15次时,平均粒径分别增加到212.4、243.8、218.5 nm。过多的循环次数导致体系温度升高,纳米乳颗粒开始发生聚集,平均粒径变大,PDI也有一定变大趋势,出现粒径不均一的现象。因此选择循环次数为6次为最佳值。
2.2 正交优化试验结果
表1为A、B、C、D四因素三水平试验的正交设计编号,正交软件设计了9组试验,试验正交结果如下表2所示。在正交试验的过程中发现,9组正交试验的PDI值均表明纳米乳具有良好的均一性,为了下一步统计学上S值、K值及极差R计算方便,因此,本正交试验只以平均粒径为考察指标。从表2可以得出,CoQ纳米乳的粒径范围在151.4 nm到228.8 nm。对正交软件得到的试验数据进行分析,通过极差R确定因素的主次顺序为B>D>A>C,即四个因素影响的主次顺序分别为CoQ与红松籽油的质量比,循环次数,CoQ与混合表面活性剂的质量比,均质压力。由实验结果可知,最佳组合为ABCD,分别为CoQ和混合表面活性剂的质量比3:40,CoQ和红松籽油的质量比为1:4,均质压力为800 bar,循环次数为6次。
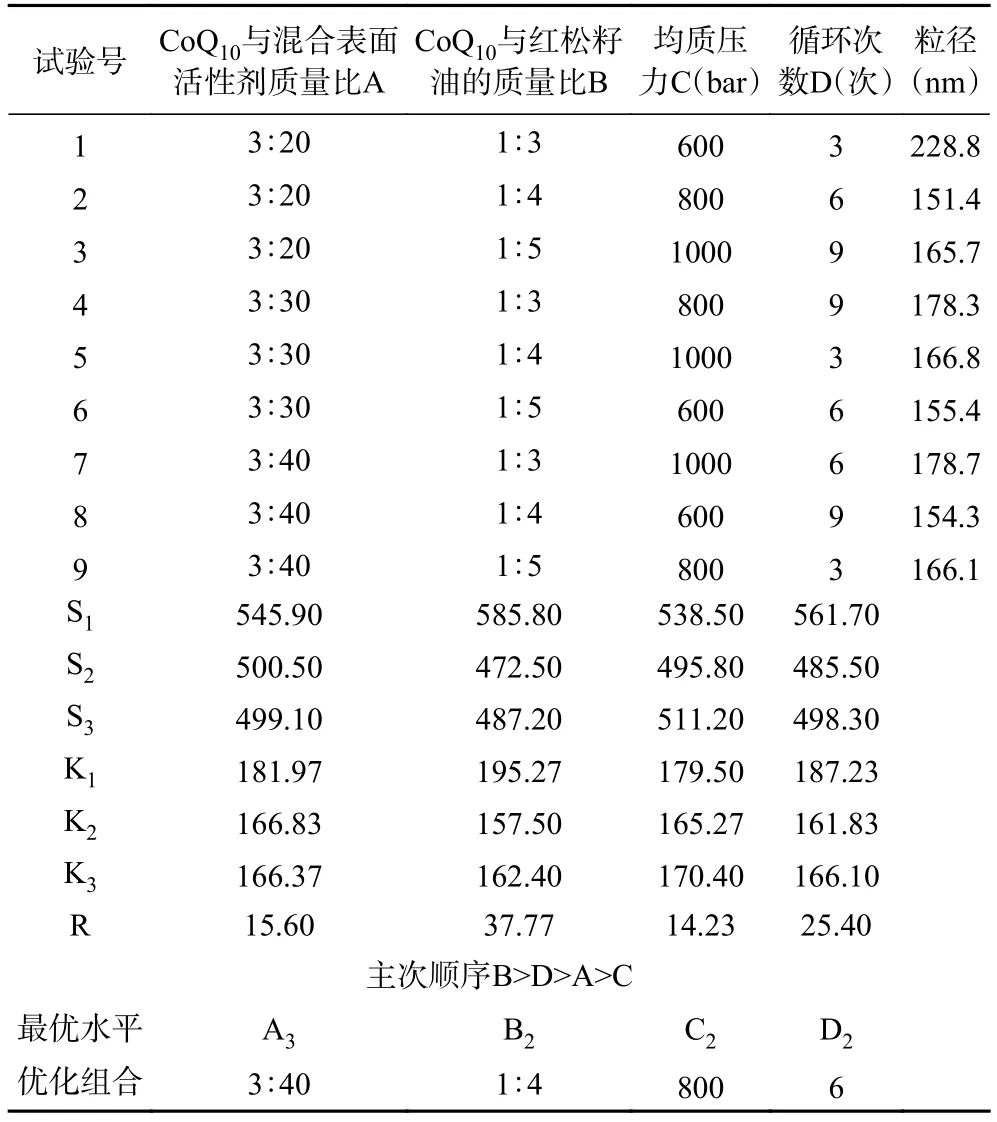
表2 正交试验结果Table 2 Results of orthogonal experiments
2.3 验证试验及包封率的测定
通过单因素和正交优化试验,得到的最佳参数为:CoQ与混合表面活性剂的质量比3:40,CoQ与红松籽油的质量比为1:4,均质压力为800 bar,循环次数为6次。为了验证最佳条件下制备的平均粒径,在最优条件下进行3次重复实验,得到平均粒径为 150.30±1.43 nm,多分散系数为 0.234±0.012的CoQ-NE,达到预期。
包封率的测定:纳米乳液包封率高低与活性物质的物理化学性质、制备方法等因素有关。本实验采用超滤离心法检测包封率。CoQ-NE的包封率为87.48%±0.59%,表明大部分CoQ已被成功包裹到纳米结构载体中。这与研究酚类化合物纳米乳的包封率所得到的结果相似。
2.4 TEM的测定
图3是1 μm 和500 nm尺寸下的TEM微观形貌,如图所示,CoQ-NE呈圆形,大小均匀,无粘连,成型性好。CoQ-NE的形态与Fathordoobady等研究的纳米乳液观察到的形态相似。此外,TEM形貌观察的图像与Wu等研究使用丙泊酚的纳米乳液非常相似。

图3 CoQ10纳米乳形貌图Fig.3 TEM morphology of CoQ10 nanoemulsion
2.5 FT-IR测定
采用FT-IR探讨CoQ纳米乳液中分子间相互作用的形式。如图4所示,从上到下分别为CoQ-NE、空白纳米乳和原料药CoQ的红外图谱。CoQ在2960 cm是乙烯基的振动峰,2850 cm是烷基伸缩振动峰,1260 cm是醚基团的伸缩振动峰。从CoQ-NE中还可以找到相应的特征峰,但发生了偏移,说明CoQ只是分散在载体中,并没有在载体化后发生化学性质变化。CoQ-NE中并没有出现和CoQ在同样波段之间的特征峰,且与空白纳米乳液的红外谱图基本一致,这说明CoQ被完全包埋在纳米乳液体系当中。这与椰子油中含有姜黄素的纳米乳剂的研究结果相似。
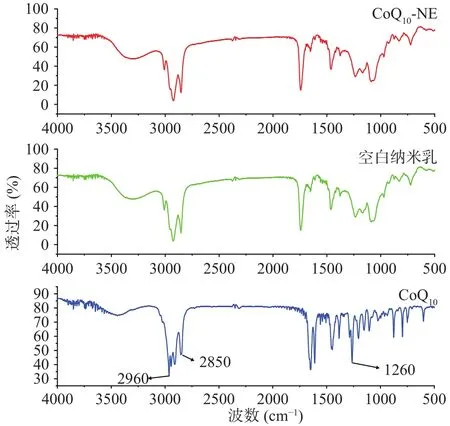
图4 CoQ10原药、CoQ10-NE和空白纳米乳的红外光谱图Fig.4 Fourier infrared spectrum of CoQ10, CoQ10-NE and blank nanoemulsion
2.6 稳定性实验
如图5a所示,与初始纳米乳液相比,平均粒径随着离心时间的变化没有发生显著变化(>0.05),因此体系是稳定的,离心后也没有发生明显的分层现象,表明纳米乳液具有良好的稳定性。
如图5b所示,在室温下,随着考察天数的延长,纳米乳液的平均粒径虽有略微的上浮,由150.4 nm到161.9 nm,但整体没有发生显著变化(>0.05),表明纳米乳随着静置时间的变化保持良好的稳定性。
为了考察在较低的温度下,纳米乳液仍具有良好的稳定性,将纳米乳液放置在低温4 ℃下保存,对其平均粒径和PDI进行测定。如图5c所示,与初始纳米乳液相比,随着考察天数的变化,平均粒径和PDI没有发生显著变化(>0.05),说明纳米乳液稳定性良好。
考察不同温度下纳米乳的稳定性对当储存温度超过正常室温储存的突发状况有很大的意义。如图5d所示,温度从-20 ℃到30 ℃变化,平均粒径没有显著变化(>0.05)。尤其在纳米乳冷冻后,在室温下放置恢复到原来的状态后,平均粒径和PDI均没有发生显著变化(>0.05)。因此,在不同的温度下,纳米乳液具有良好的稳定性。观察到的结果与先前的研究发现一致,即纳米乳液可稳定长达数月。

图5 稳定性实验结果Fig.5 Results of stability experiments
纳米乳的稳定性取决于脂类、乳化剂和水体系的性质和浓度。乳化剂在液滴周围形成一层膜,降低界面能,为纳米乳的聚集提供机械屏障,从而提高纳米乳的稳定性。Chutia等在研究高压均质得到的淀粉纳米颗粒用于开发类胡萝卜素富集粉纳米乳中,发现富含类胡萝卜素的纳米乳剂对热和冻融处理稳定。同时,开发的纳米乳液在储存期间显示出良好的物理稳定性,与本文的研究结果相似。
2.7 体外释放实验
通过HPLC检测CoQ混悬液和CoQ-NE的体外累积释放量。如图6所示,CoQ-NE累计释放量高于混悬液,30 min内CoQ混悬液的累积释放量分别为4.17%、5.32%、8.30%,CoQ-NE的累积释放量分别为46.61%、51.15%、52.17%。两者在30 min内都呈上升趋势,CoQ-NE上升更为明显。60 min时,CoQ-NE的累积释放量达到63.41%,而混悬液的只有11.83%,随后两者累积释放量均缓慢上升,120 min后基本保持不变。在300 min时,CoQ混悬液的累积释放量为18.01%,CoQ-NE为84.66%,是混悬液的4.7倍。这可能是药物的释放量与溶解度和比表面积有关,纳米乳的比表面积较大以及表面活性剂的存在均提高了药物的释放量。这与陈家铃等研究发现的高压均质制备水杨酸纳米乳的体外释放量显著提高的结果相似。
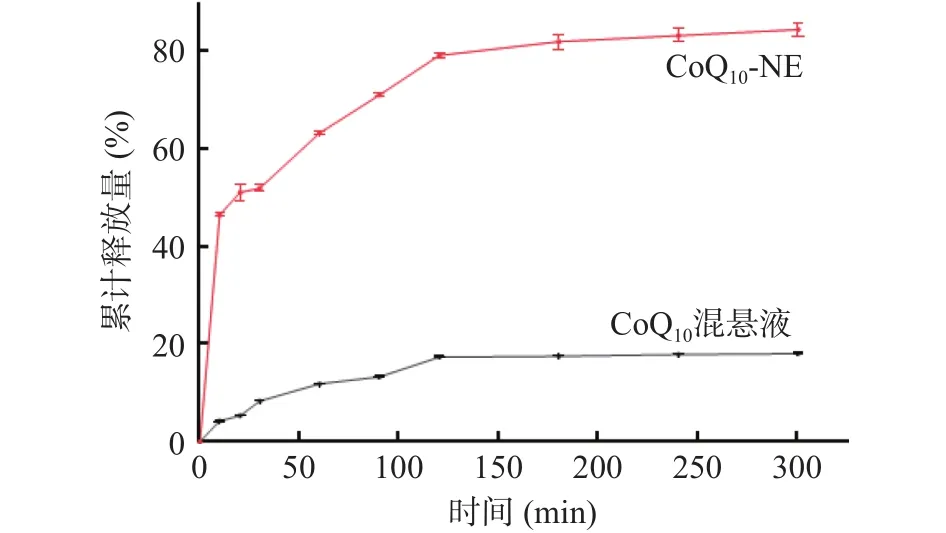
图6 体外释放实验结果Fig.6 Results of in vitro release experiments
2.8 大鼠药代动力学研究
2.8.1 体内分析方法的建立结果 血浆中CoQ的浓度测定采用内标法。选择内标法是为了抵消上样体积、流动相以及检测器的影响。操作过程中样品和内标物混合一起注入色谱柱,因此,只要混合溶液中被测组分与内标的量的比值是恒定的,上样体积的变化不影响定量的结果。本文选择和CoQ保留时间接近但不重叠的CoQ为内标,它与CoQ是同系物,且具有一致的色谱行为和相应特征。在色谱分析条件下,CoQ内标物与样品各组分充分分离。方法专属性实验结果图7表明,内标峰CoQ和CoQ峰型良好,两者的保留时间分别为9.86和12.37 min,且血浆中内源物质不干扰实验的测定。

图7 方法专属性考察Fig.7 Result of chromatographic method specificity investigation
标准曲线以待测物浓度C为横坐标,待测物和内标物的峰面积比值R为纵坐标,得到直线回归方程为 R=0.7307C-0.041,=0.9996,表明 CoQ在0.0391~20 μg/mL范围内线性关系良好。精密度实验表明,低、中、高浓度的日间精密度分别为5.15%、2.35%、1.33%,日内精密度分别为7.80%、2.65%、1.80%。回收实验结果表明,低、中、高浓度的回收率分别为99.23%、101.73%、100.67%。以上结果均表明,该方法灵敏度好、准确度高,符合方法学要求。
2.8.2 药时曲线的绘制 如图8所示,在每个时间点,CoQ-NE组的血药浓度均高于CoQ混悬液组。CoQ-NE和CoQ混悬液组的血浆浓度分别在0~2.0 h和0~4.0 h之间趋于增加,属于吸收分布过程。CoQ混悬液的达到最大血药浓度的时间T是 CoQ-NE的 2倍,可知 CoQ-NE在体内更快达到峰浓度。CoQ混悬液组的浓度从4.0~24.0 h趋于下降,而CoQ-NE组的浓度从2.0~24.0 h趋于下降,属于代谢排泄过程。CoQ混悬液组4.0 h时血样中 CoQ浓度为 0.850±0.024 μg/mL,CoQ-NE 组 2.0 h时为 2.450±0.040 μg/mL。CoQ-NE 组的最大血药浓度C是CoQ混悬液的2.80倍,说明CoQ-NE在体内的血药浓度更高。
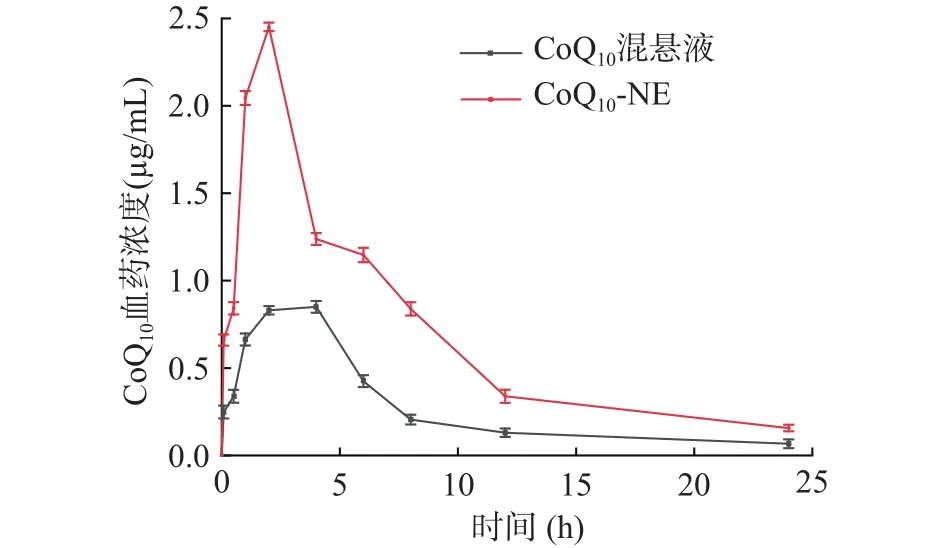
图8 CoQ10-NE和CoQ10混悬液在体内吸收曲线的比较Fig.8 Comparison of in vivo absorption profiles of CoQ10-NE and CoQ10 suspension
2.8.3 药代动力学参数分析 本实验通过DAS 2.0软件对大鼠药代动力学数据进行房室模型拟合,所得的药代动力学参数如表3所示。依照拟合度及赤池信息量准则(Akaike's Information Criterion,AIC)进行模型判断,拟合度越接近1、AIC越小,模型拟合越好。由软件分析可知,混悬组和纳米乳组的大鼠药代动力学均属于二室模型,权重系数分别为1和1/cc。药时曲线下面积(AUC)是判断药物吸收程度的重要指标之一。CoQ-NE的药时曲线下面积 A UC是 CoQ混悬液组的 3.25倍,CoQ-NE组药时曲线下面积AUC更大,这表明CoQ-NE生物利用度明显提高,吸收更好。对于二室模型来说,V1和V2分别表示中央室和外周室分布容积,CL表示从中央室向外药物的清除率,F为生物利用度。从药物在体内的平均滞留时间M RT和清除率CL/F可以看出,CoQ-NE的 M RT是 CoQ的 1.14倍,CoQ混悬组的CL/F是CoQ-NE的3.04倍。说明CoQ-NE比CoQ在体内滞留时间更长,清除速率更慢。综上所述,这些不同可能是由于药物被纳米乳负载后,纳米乳粒径变小,比表面积变大,且被负载的药物结构良好,给药后,药物释放量提高,药物与胃肠壁接触面积变大,在体内作用时间变长,更容易被机体吸收,生物利用度显著提高。统计结果分析显示,以上参数均具有统计学差异。Belhaj等制备的一种由鲑鱼油、鲑鱼卵磷脂、CoQ组成的纳米乳液,和大豆油和CoQ组成的油性混合物相比较,纳米乳液的生物利用度提高了2倍,这与本文得出相似的结论。
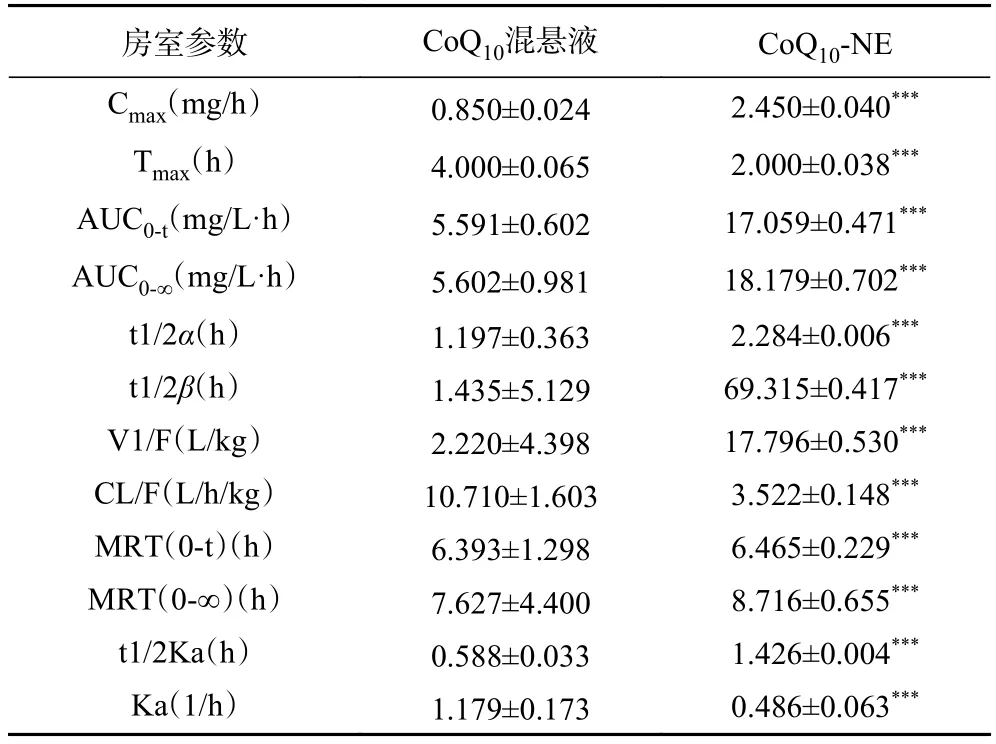
表3 灌胃给药CoQ10-NE和CoQ10混悬液后CoQ10的药代动力学参数(n=6)Table 3 Pharmacokinetic parameters of CoQ10 after intragastric administration of CoQ10-NE and CoQ10 suspension (n=6)
3 结论
本文以CoQ为原料药,采用高压均质技术制备基于红松籽油CoQ的纳米乳,在单因素实验的基础上,通过正交优化确定CoQ-NE的最佳工艺。对最佳工艺条件下制备得到的CoQ-NE分别进行TEM、包封率实验、FT-IR、稳定性实验、体外释放行为等表征。同时,对CoQ-NE在大鼠体内的药代动力学特征进行研究。结果表明:在CoQ与混合表面活性剂的质量比3:40,CoQ与红松籽油的质量比为1:4,均质压力为800 bar,循环次数为6次的最佳工艺条件下,得到平均粒径为150.30±1.43 nm,多分散系数为 0.234±0.012的 CoQ-NE。在 1 μm和500 nm条件下,CoQ-NE大小均匀,成型性良好;FT-IR实验表明CoQ被完全包裹在纳米乳液中且CoQ没有在载体化后发生化学性质的改变;CoQ-NE的包封率为87.48%±0.59%,表明大部分CoQ已被成功包裹到纳米结构载体中;此外,在加速离心和储存实验中,CoQ-NE的平均粒径和PDI变化不显著(>0.05),CoQ-NE维持了良好的稳定性;同时,CoQ-NE的体外累积释放量高达84.66%,约是CoQ混悬液的4.7倍,累计释放量显著提高。大鼠药代动力学参数表明:由最高血药浓度C和达到最高血药浓度所需时间T可知,CoQ-NE组的C比CoQ混悬组提高了 1.80倍,T缩短了1倍,这表明纳米乳组比混悬组更快达到最大血药浓度。两组分别经灌胃给药后,CoQ-NE组的体内平均滞留时间MRT和药时曲线下面积AUC相对于CoQ混悬组均显著提高(<0.05),结果表明,CoQ-NE较混悬液更易被吸收,且在体内的作用时间更长,生物利用度显著提高。本研究为探索CoQ新剂型的研发及提高其生物利用度奠定了良好的基础。
