茯苓渣多糖组成分析及体外抗癌、免疫活性研究
2022-10-27关玉婷温思萌白云鹏陈瑞瑞沈晓勇冯佳宁常世敏程鑫颖
关玉婷,温思萌, ,冯 雪,白云鹏,陈瑞瑞,沈晓勇,冯佳宁,常世敏, ,程鑫颖,
(1.河北工程大学生命科学与食品工程学院,河北邯郸 056038;2.邯郸市天然产物与功能食品开发重点实验室,河北邯郸 056038;3.晨光生物科技集团邯郸有限公司,河北邯郸 056004)
茯苓(),属于多孔菌科真菌的干菌核,为药食两用真菌。茯苓中的生物活性成分主要包括多糖、三萜类、氨基酸和类固醇等。茯苓已广泛应用于制药和食品加工领域,生产过程中会产生大量的茯苓残渣,但暂无对茯苓残渣中多糖活性的相关报道,提取茯苓残渣中的多糖既可以提升茯苓残渣的附加值,又可以降低生产废料带来的环境压力。
茯苓多糖占茯苓干菌核中所有成分重量的84%。目前,已从茯苓中提取出34种多糖,包括茯苓聚糖、-茯苓聚糖等。茯苓多糖具有良好的抗炎、抗肿瘤及增强免疫等功效。与抗癌药物相比,茯苓多糖对小鼠重要器官功能和肌肉力量的副作用较低。研究表明,当机体内出现肿瘤细胞时,茯苓多糖可通过提升免疫细胞增殖分化的速度,提高抗体的数量,阻止肿瘤细胞进一步扩散,最终实现肿瘤细胞的消亡。同时,茯苓多糖可通过提高抗炎症因子的水平减轻炎症反应,在慢性炎症实体试验中,灌胃茯苓多糖减轻了小鼠耳肿症状,阻止大鼠皮下肉芽肿的生成。
目前国内外已有大量提取茯苓多糖的相关研究,常用的提取方法有碱水浸提法、热水浸提法和酶辅助提取法。由于碱水浸提法和酶辅助提取法需要引入大量溶剂造成提取的多糖安全性降低,而热水浸提法工艺简单,安全经济。有关茯苓残渣的研究目前较少,对于茯苓残渣中的多糖组成及生物活性未知,因此,本文对利用热水浸提法从茯苓残渣中提取的茯苓多糖进行单糖成分及含量测定、结构分析,并进行抗肿瘤及免疫活性测定,以提升茯苓残渣的利用率,为茯苓的综合利用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
茯苓渣(可溶性多糖含量为0.12%) 云南省孟连县;巨噬细胞(RAW264.7)、胃癌细胞(SGC-7901)、乳腺癌细胞(MDA-MB-231)、肝癌细胞(HepG2)上海青旗生物;半乳糖醛酸(GalA)、鼠李糖(Rha)、半乳糖(Gal)、阿拉伯糖(Ara)、葡萄糖(Glc)、葡萄糖酸(GlcA)、木糖(Xyl)、甘露糖(Man)、岩藻糖(Fuc)标准品及DMEM培养基 北京索莱宝科技有限公司;CCK-8试剂盒、IL-6细胞因子检测试剂盒、TNF-细胞因子检测试剂盒 深圳市达科为生物技术股份有限公司;胎牛血清 浙江天杭生物科技有限公司;苯酚、浓硫酸、甲醇 天津欧博凯化工有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)、RPMI-1640 完全培养基 上海阿拉丁生化科技股份有限公司;AB-8型大孔树脂 东鸿化工有限公司。
UV1102紫外分光光度计 上海天美科学仪器有限公司;LG-18N冷冻干燥机 北京亚星仪科科技发展有限公司;RID-20A折射率探测器、SPD-20A紫外-可见检测器、LC-20AT高效液相色谱仪 日本岛津公司;FTIR-650红外光谱仪 天津港东公司;Epoch2全波长酶标仪 美国伯腾仪器有限公司;BX43+UC90光学显微镜 日本奥林巴斯株式会社。
1.2 实验方法
1.2.1 茯苓多糖的提取及纯化 茯苓渣粉碎后过24目筛,于55 ℃干燥至恒重,在500 mL锥形瓶中加入70 g茯苓渣和300 mL 90%乙醇,进行混匀,75 ℃水浴回流2 h,抽滤,留滤渣干燥,得到茯苓粉。
精确称1.00 g茯苓粉,加入40 mL蒸馏水,加热,回流提取3 h后过滤,收集滤液,并将残渣重复过滤2次,合并滤液,2500 r/min离心5 min,取上清液,抽滤,加入1/4体积的Sevage试剂(三氯甲烷与正丁醇体积比为 4:1),搅拌 30 min,4000 r/min离心10 min,取水相多次重复以上步骤,直至中间无明显乳状层,浓缩水相,灌注至透析袋(3.5 kD)中,流水透析24 h后,冷冻干燥,得淡黄色粉末,加蒸馏水溶解,使溶液最终浓度为5.0 mg/mL,过再生后的AB-8型大孔树脂,多糖溶液以2 BV/h 流速上样,吸附后将50%乙醇溶液以2 BV/h的流速进行洗脱,浓缩,冷冻干燥,得到茯苓多糖;依次使用无水乙醇、丙酮、无水乙醚对所得茯苓多糖进行洗涤,冷冻干燥,得纯化后的茯苓多糖。
1.2.2 茯苓多糖单糖组成分析 根据参考文献[18-19]的方法并进行适当修改,精密称取纯化后的茯苓多糖10 mg,加蒸馏水制备成浓度为1 mg/mL的溶液,加入2 mol/L的三氟乙酸2 mL,搅拌6 h,浓缩,取100 μL加入5 mL 0.3 mol/L NaOH溶液为溶剂,加入同体积的0.5 mo1/L PMP/甲醇溶液,在70 ℃下反应100 min,加入盐酸调节 pH至7.0,加入l mL蒸馏水及1 mL氯仿,振荡后取水相,重复多次,5000 r/min离心2 min,稀释,过0.22 μL有机膜,备用。
标准品溶液:半乳糖醛酸、鼠李糖、半乳糖、阿拉伯糖、葡萄糖、葡萄糖酸、木糖、甘露糖、岩藻糖9种对照标准品,分别称取 10、10、20、10、20、10、10、10、10 mg,加蒸馏水溶解,定容至 10 mL,配制成混合对照品,吸取100 μL,进行衍生化,备用。
色谱条件:色谱柱为 COSMOSIL 5C-PAQ(4.6 mm×250 mm),洗脱液为 80.8% PBS溶液(0.1 mol/L,pH7.0),19.2% 乙腈(v/v),洗脱方式为连续流动,柱温为 35 ℃,进样量为 10 μL,流速为1.0 mL/min,检测器为SPD-20A紫外-可见检测器,紫外检测波长为245 nm。
1.2.3 茯苓多糖红外光谱分析 参考杨大俏等的方法,精密称取纯化后的水提茯苓多糖样品0.01 g,加入0.5 g溴化钾混合均匀,研磨,称取0.2 g混合物进行压片,利用红外光谱仪在400~4000 cm范围内扫描分析,绘制红外吸收图谱。
1.2.4 茯苓多糖抗肿瘤活性测定 通过CCK-8法分析水提茯苓多糖对SGC-7901(胃癌细胞),MDAMB-231(人乳腺癌细胞)、HepG2(肝癌细胞)的抑制作用。分别将细胞悬液移入装有完全培养基的培养瓶中,“8”字法摇匀,置于含5% CO的细胞培养箱中进行培养,选对数期细胞在96孔板内进行接种,每孔接种浓度为5×10个/mL的细胞100 μL,接种孔数以每个药物每个浓度设置3个复孔,设置空白组(培养基)、药物处理组(培养基+细胞+药物),DMSO孔(含2.5‰ DMSO的培养基)每组3个复孔,96孔板最外圈加PBS,减少不同位置因水分蒸发造成的细胞生长差异。接种培养后,次日细胞贴壁加入5-氟尿嘧啶溶液(0、2.5、5.0、10.0、20.0、40.0 μg/mL)和茯苓多糖溶液(0、100、200、400、800、1600 μg/mL)。
CCK-8试剂为10:1的比例配制反应液。细胞经药物处理48 h后,弃去96孔板中的液体,每孔添加100 μL的CCK-8反应液。将96孔板置于培养箱中培养2 h。利用酶标仪于450 nm处记录吸光度。

1.2.5 小鼠脾淋巴细胞增殖试验 茯苓多糖样品溶液配制:称0.1000 g样品,加入5 mL RPMI-1640完全培养基溶解后,配制成浓度为2000 μg/mL的样品母液,对样品母液稀释,得到浓度为50、100、200、500、1000 μg/mL 的样品溶液。
以100 μL/孔的体积将细胞浓度为1×10个/mL的小鼠脾淋巴细胞悬液接种到96孔板上,每孔再加入100 μL不同浓度的茯苓多糖溶液,浓度分别为0、50、100、200、500、1000 μg/mL,每组设 5个复孔,置于含有5% CO、温度为37 ℃的培养箱中培养23 h后取出,每孔加入 10 μL CCK-8,混合均匀,放入培养箱中孵育1 h,于450 nm波长处记录各孔(空白孔:RPMI-1640 完全培养基;阳性孔:100 μL 细胞悬液+100 μL含有5% ConA的RPMI-1640完全培养基)OD值。
1.2.6 茯苓多糖对巨噬细胞增殖的影响 在细胞培养瓶中加入RAW264.7细胞悬液和适量的DMEM完全培养基置培养箱培养24 h,1~2 d更新一次培养基。将消化所获取的RAW264.7细胞悬液置于灭菌的离心管中,血球计数板计数,稀释,以获得浓度为1×10个/mL的RAW264.7细胞悬液。按照100 μL每孔的体积将浓度为1×10个/mL的RAW264.7细胞接种于96孔板中,培养箱中培养贴壁24 h,丢弃培养基,每孔加入100 μL不同浓度的茯苓多糖溶液,浓度分别为 0、50、100、200、500、1000 μg/mL,放于细胞培养箱中干预培养24 h后,将原培养基弃去,加入100 μL含10% CCK-8染色剂的无酚红DMEM培养基,培养1 h后取出,450 nm处记录吸光度值,通过计算巨噬细胞存活率,分析水提茯苓多糖对巨噬细胞存活率的影响。

1.2.7 茯苓多糖对炎症因子IL-6和TNF-的影响 按照2×10个/孔的细胞浓度接种RAW264.7细胞于六孔板中,置于细胞培养箱中贴壁培养3 h,细胞贴壁后,更换培养基,加入10 μg/mL LPS的DMEM培养基1 mL,加入不同浓度茯苓多糖溶液1 mL,浓度分别为 0、50、100、200、500、1000 μg/mL 及同时设定LPS对照组和空白组,培养24 h,上清液1000 r/min离心10 min,弃去沉淀,200 μL/管分装于灭菌后的0.5 mL离心管中,供ELISA分析检测。
1.3 数据处理
各组试验均重复三次,数据采用SPSS 20.0进行统计学分析,采用均值±标准误差进行表示,采用GraphPad Prism5进行制图。
2 结果与分析
2.1 单糖组成分析
单糖组成和纯度是决定多糖理化特性和生物活性的重要因素。本研究利用苯酚硫酸法测定茯苓多糖中多糖含量为76%,标准曲线y=8.1149x+0.0106(=0.9993)。图1和表1为单糖标准品的高效液相色谱图及茯苓残渣水提多糖(PCOS)的单糖组成表,从茯苓渣中提取的多糖主要由葡萄糖、甘露糖、半乳糖、岩藻糖组成,其物质的量之比为1:0.107:0.079:0.018,还有微量的阿拉伯糖和木糖,其中葡萄糖的含量为82.40 mol%。

图1 单糖标准品的HPLC-UV色谱图Fig.1 HPLC-UV chromatogram of monosaccharide standard

表1 茯苓多糖的单糖组成Table 1 Monosaccharide composition of enzymatic Poria cocos polysaccharide
2.2 红外光谱分析
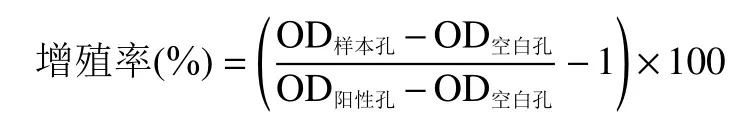
傅利叶红外光谱(FTIR)是检测多糖化学结构的常用方法,它可以通过分子中振动能级和旋转能级的转变检测多糖官能团吸收峰的位置和强度,从而反映多糖的特性。如图2可知,PCOS有明显糖类特征吸收峰,在3362 cm处出现强吸收峰,是分子间O-H收缩振动引起,在2926 cm处出现多糖特征吸收峰,是亚甲基(-CH-)中C-H 伸缩振动引起,1655 cm处是由O-H变角振动造成的,在1240 cm处有硫酸基S=O键信号,在1078 cm处的吸收峰为吡喃糖结构的特征吸收峰,在870 cm附近为-糖苷键的特征吸收峰。
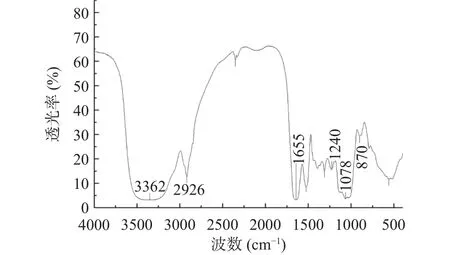
图2 水提茯苓多糖红外光谱图Fig.2 Infrared spectrum of water extracted Poria cocos polysaccharide
2.3 茯苓多糖对肿瘤活性的影响
PCOS和5-氟尿嘧啶对三种肿瘤细胞的影响如图3、图4所示,PCOS 的浓度在 0~800 μg/mL 时,对肝癌细胞无抑制作用,在1600 μg/mL时,对肝癌细胞有抑制作用,但未到半抑制作用,5-氟尿嘧啶对肝癌细胞有抑制作用,在浓度为40 μg/mL时达到半抑制,IC=7.56 μg/mL。PCOS 浓度在 0~100 μg/mL时,人乳腺癌细胞的存活率增加,随着PCOS浓度的增加,在100~1600 μg/mL,人乳腺癌细胞的存活率逐渐降低,PCOS对人乳腺癌细胞的抑制作用逐渐提升,IC=1174 μg/mL,证实了 PCOS对人乳腺癌细胞增殖有抑制作用,细胞存活率前期上升可能是由于PCOS浓度过低,而5-氟尿嘧啶的半抑制浓度为5.03 μg/mL,PCOS并不能替代5-氟尿嘧啶作为治疗药物。胃癌细胞经过PCOS的干预后,在0~100 μg/mL时,细胞存活率呈现上升趋势,此时的PCOS浓度还不足以抑制胃癌细胞生长,在100~400 μg/mL时,细胞存活率呈现缓慢下降趋势,在400~1600 μg/mL时,细胞存活率急剧下降,IC=1096 μg/mL,茯苓多糖浓度为1600 μg/mL时,抑制作用最强。

图3 5-氟尿嘧啶对肝癌细胞、人乳腺癌细胞及胃癌细胞的影响Fig.3 Effects of 5-fluorouracil on hepatocellular carcinoma,human breast cancer and gastric cancer cells

图4 茯苓多糖对肝癌细胞、人乳腺癌细胞及胃癌细胞的影响Fig.4 Effects of Poria cocos polysaccharides on hepatocellular carcinoma, human breast cancer and gastric cancer cells
从PCOS对三种癌细胞的抑制结果可以看出PCOS对三种癌细胞都有不同程度的抑制,但不足以替代5-氟尿嘧啶成为治疗药物。先前研究以黄芪多糖、人参多糖等作为注射液,对小鼠体内的癌细胞进行干预治疗,对小鼠体内癌细胞的抑制效果更佳,可能是由于PCOS分子量较大,细胞对其的吸收率较低,造成PCOS对癌细胞的抑制能力较低。
2.4 茯苓多糖对脾淋巴细胞增殖的影响
淋巴细胞的增殖率可以反映出机体免疫应答的强度及机体免疫系统的状态,因此,可用来评价药物是否具有免疫功效。由图5可知,在给药浓度为0~1000 μg/mL范围内时,随着PCOS浓度的提升,小鼠脾淋巴细胞的增殖率逐渐增加,且随着浓度的增加,小鼠脾淋巴细胞出现了对PCOS干预的浓度依赖,与浓度成正相关性,这也表明了PCOS的抗肿瘤作用靶点可能不是在肿瘤细胞,而是通过提升脾淋巴细胞的增殖率,从而提升免疫应答的强度,最终抑制肿瘤细胞的生长。
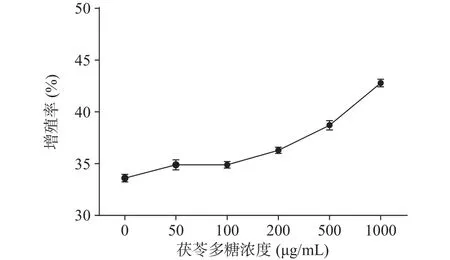
图5 脾淋巴细胞增殖试验结果Fig.5 Results of splenic lymphocyte proliferation test
2.5 茯苓多糖对巨噬细胞毒性的影响
巨噬细胞可识别致病物质,对其进行直接清除,是免疫系统中的关键组成部分。由图6可知,在50~1000 μg/mL浓度范围内,PCOS与空白对照组差异不明显,即对巨噬细胞抑制无明显影响,表明PCOS对于巨噬细胞无细胞毒性和抑制作用。
图6 茯苓多糖对巨噬细胞存活率的影响Fig.6 Effect of Poria cocos polysaccharide on the survival rate of macrophages
2.6 茯苓多糖对炎症因子IL-6和TNF-α的影响
活化的巨噬细胞可以产生炎症因子(IL-6、TNF-等)来对抗癌细胞和病原体。因此,选择IL-6和TNF-作为PCOS对免疫调节作用的指标。由图7可 知 , 在 PCOS 浓度 为 0~1000 μg/mL时 ,IL-6、TNF-炎症因子的表达量都呈上升趋势,但IL-6、TNF-炎症因子的表达量组内无显著性差异(>0.05),表明 PCOS 对 IL-6、TNF-炎症因子无显著抑制作用(>0.05),即PCOS的免疫应答能力暂未有抗炎作用。PCOS虽然对巨噬细胞无抑制作用,但是可能由于巨噬细胞受到PCOS刺激,提升了IL-6、TNF-的分泌量。
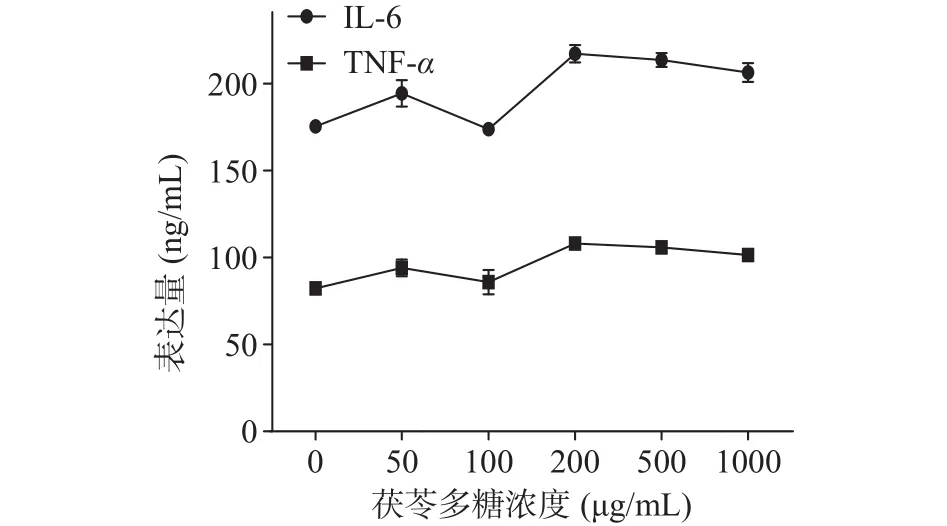
图7 茯苓多糖对IL-6和TNF-α的影响Fig.7 Effect of Poria cocos polysaccharide on IL-6 and TNF-α
3 结论
通过高效液相色谱测定PCOS的单糖组成,结果表明PCOS主要含有葡萄糖、甘露糖、半乳糖和岩藻糖,还含有微量的阿拉伯糖和木糖。红外光谱表明茯苓渣提取的多糖有明显的糖类特征吸收峰;体外抗肿瘤和免疫实验表明,PCOS对胃癌细胞、人乳腺癌细胞和肝癌细胞的增殖都有不同程度的抑制作用,其中,对胃癌细胞的抑制效果最佳,IC=1096 μg/mL,对巨噬细胞无抑制作用,对小鼠脾淋巴细胞、炎症因子IL-6和TNF-都有促进作用,因此,PCOS具有应用于抗肿瘤及免疫疾病的治疗潜力。但多糖的物理性质、化学结构和高级结构在抗肿瘤活性方面存在较大差异,如溶解度、一级结构(平均分子量、单糖残基、糖苷键的位置和单糖残基的序列)和溶液构象(三重螺旋、单螺旋和随机螺旋)等,本研究尚未测定从茯苓渣中提取多糖的分子量及溶液构象,需要在体内外进一步研究PCOS结构与免疫调节活性的结构-功能关系。
