鳜鱼副产物源水解物的制备工艺优化及其体外消化分析
2022-10-27吴占春周迎芹谢宁宁方旭波陈小娥
吴占春,李 苓,周迎芹,谢宁宁, ,方旭波,陈小娥
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.安徽省农业科学院农产品加工研究所,安徽合肥 230031;3.安徽省食品微生物发酵与功能应用工程实验室,安徽合肥 230041;4.浙江国际海运职业技术学院,浙江舟山 316021)
鳜鱼()是我国的名优淡水鱼之一,臭鳜鱼则是利用新鲜鳜鱼为原料,经过低温发酵而成。目前,鳜鱼加工成臭鳜鱼的前处理环节,需要进行“三去”,产生了大量的鱼腮、鱼鳞及鱼内脏等废弃物,仅安徽黄山地区每年就产生2万吨副产物。鱼类加工副产物(湿基)中含有占比较高的蛋白质(15%~30%),而从中制备出蛋白水解物仍然是近年来的研究热点。这是由于鱼类蛋白水解物中含有大量多肽,它们具有抗氧化、提高免疫力等生物活性潜力,研究价值较高。因此,如何合理利用臭鳜鱼加工副产物是完善臭鳜鱼绿色加工技术的重要研究内容之一。
酶解法是制备鱼蛋白水解物的重要技术手段之一,该技术具有反应过程定向可控、条件温和等优点,属于绿色加工范畴。Kumar等在使用黄鱼副产物制备水解物时,反应时间较短,且多肽得率高;Kim等制备鲑鱼副产物水解物时,发现酶解法具有营养成分保留率高、能耗低、安全可靠等优势。这些副产物中的蛋白质在使用酶解法制备成水解物后,也具有了更高的工业应用潜力。由于底物和制备目标的不同,通常需要选择合适的商业酶来定向制备蛋白水解物,如胃蛋白酶、碱性蛋白酶、中性蛋白酶、胰蛋白酶和风味蛋白酶等。其中,地衣芽孢杆菌产碱性蛋白酶(Alcalase)已经广泛应用于水产源蛋白水解物的制备。
蛋白水解物需要经过胃肠的消化才能在机体内发挥生物活性肽的功能和营养作用。模拟胃肠消化法,较多运用于评价人体对蛋白水解物等的消化效果,这种方法具有操作简单、快捷、重现性好等优点。针对功能性食品,通常采用胃蛋白酶消化率作为主要指标,这在一定程度上忽视了肠道内消化酶等的作用,因此,本试验采用的模拟胃肠两段连续消化有一定的必要性。
目前,针对鳜鱼副产物水解产物的研究主要涉及其保水性,但对其酶解工艺、功能性和消化性分析的研究尚未见报道。因此,本研究以臭鳜鱼加工工业中的副产物为开发对象,采用单因素法和响应面法确定最佳水解工艺,并研究水解物模拟胃肠消化后的可溶性肽含量及抗氧化活性变化,以期为开发高端宠物食品提供技术支撑。
1 材料与方法
1.1 材料与仪器
鳜鱼副产物(鱼鳞、鱼鳃和内脏混合物) 安徽省食品微生物发酵与功能应用工程实验室;Alcalase 2.4 L 碱性蛋白酶(200000 U/g)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt, ABTS)索莱宝科技有限公司;胃蛋白酶(3000 U/mg)、胰蛋白酶(250 U/mg)、福林酚、牛血清白蛋白 麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical, DPPH) TCI化成工业发展有限公司;氢氧化钠、盐酸、硫酸铜、硫酸钾、硫酸、甲醛、磷酸二氢钾、钨酸钠、钼酸钠、硫酸锂、液体溴 分析纯,国药集团化学试剂有限公司。
SYKAM S-433D氨基酸自动分析仪 德国Sykam科学仪器有限公司;K-350半自动凯氏定氮仪 瑞士Buchi实验室设备贸易有限公司;GC2014气相色谱仪 美国Agilent科技有限公司;Y50-plus均质乳化机 上海约迪机械设备有限公司;FE20台式pH计 瑞士Mettler Toledo集团;UV-5600紫外可见分光光度计 上海元析有限公司;H1750R台式高速低温离心机 长沙湘仪离心机仪器有限公司;FD-1CE冷冻干燥机 北京德天佑科技发展有限公司。
1.2 实验方法
1.2.1 鳜鱼副产物基本组成测定
1.2.1.1 基本营养成分测定 水分、粗蛋白、粗脂肪、灰分等含量的测定方法分别参照GB 5009.3-2016《食品安全国家标准 食品中水分的测定》直接干燥法、GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法、GB 5009.6-2016《食品安全国家标准 食品中脂肪的测定》索氏提取法、GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》高温灼烧法。
1.2.1.2 氨基酸组成测定 参照GB 5009.124-2016《食品安全国家标准 食品中氨基酸的测定》酸水解法进行氨基酸组成测定。
1.2.2 水解物制备流程 参照林煌华等的方法并稍作修改。鳜鱼副产物加水均质(3000 r/min,2 min),调节pH、温度,加入碱性蛋白酶酶解,灭酶(90 ℃,10 min)后离心(8000 r/min,15 min)取上清液,上清液过滤脱脂,旋蒸浓缩(60 ℃,30 min),冷冻干燥(-50 ℃,1 Pa,48 h)得到蛋白水解物。
1.2.3 单因素实验 固定料液比1:4、酶解pH9、酶解温度50 ℃、加酶量2.0%、酶解时间4 h,考察不同料液比(1:1、1:2、1:3、1:4、1:5 g/mL)、不同酶解pH(7、8、9、10、11)、不同酶解温度(45、50、55、60、65 ℃)、不同加酶量(1.0%、1.5%、2.0%、2.5%、3.0%)、不同酶解时间(1、2、3、4、5 h)对鳜鱼副产物源水解物水解度的影响。
1.2.4 响应面优化试验 根据Design Expert原理设计,以水解度作为响应值,以pH、温度和加酶量为变量,设计三因素三水平的响应面分析试验,优化试验结果。各因素的水平编码表见表1。
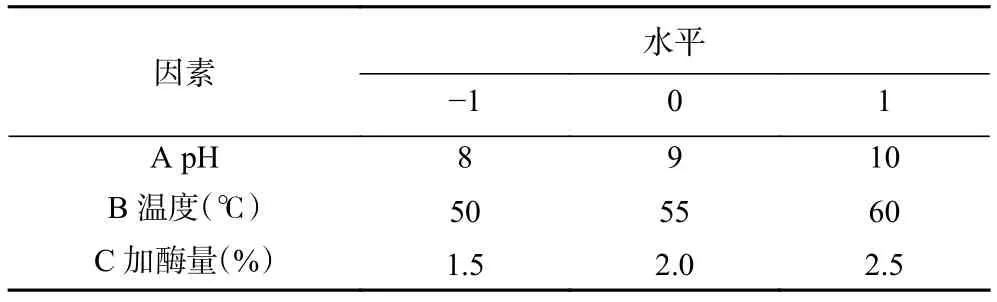
表1 响应面试验设计因素与水平Table 1 Factors and levels of response surface experiment
1.2.5 水解度的测定 氨基酸态氮的测定方法参照GB 5009.235-2016《食品安全国家标准 食品中氨基酸态氮的测定》比色法,总氮含量的测定方法参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法。水解度的计算公式如下:
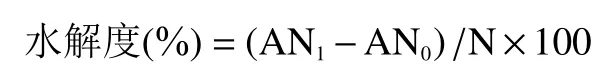
式中:AN:水解后的样品中的氨基酸态氮质量(μg);AN:水解前的样品中的氨基酸态氮质量(μg);N:样品中的总氮质量(μg)。
1.2.6 胃肠消化模型 参照He等的方法并稍作修改:胃消化阶段:将水解物按4%的质量浓度溶解于 HCl(0.01 mol/L)中,37 ℃ 水浴预热 5 min。按2.5%的质量浓度加入胃蛋白酶,混匀,37 ℃水浴2 h,模拟胃消化;肠消化阶段:用 NaHCO(0.9 mol/L)将经胃消化后的消化液调pH至5.3,后用NaOH溶液(1 mol/L)将pH调至7.5。按4%的质量浓度加入胰蛋白酶,混匀,37 ℃水浴4 h,模拟肠消化。
模拟胃肠消化过程中每隔1 h取10 mL模拟消化液,于沸腾水浴中灭酶10 min,冷冻干燥后置于-20 ℃备用。使用时将冻干粉用去离子水配制为1 mg/mL,测定可溶性肽含量和抗氧化活性。
1.2.7 可溶性肽含量测定 参照Lowry等方法测定可溶性肽含量。试剂甲:称取10 g碳酸钠、2 g氢氧化钠和0.25 g酒石酸钾钠,定容至500 mL;称取0.05 g硫酸铜,定容至10 mL。将两种溶液混合,现用现配;试剂乙:称取100 g钨酸钠和25 g钼酸钠放入2 L磨口回流瓶中,加入700 mL蒸馏水,再加50 mL磷酸(85%),100 mL浓盐酸,充分混合,接上回流管,小火回流10 h。回流结束时,加入150 g硫酸锂,50 mL蒸馏水及2~3滴液体溴,开口继续沸腾15 min。冷却后溶液呈黄色(如仍呈绿色,须再重复滴加液体溴的步骤)。加水稀释至1 L,过滤,滤液置于棕色试剂瓶中保存,使用时加水稀释一倍。
将1 mL模拟消化液(1 mg/mL)加入5 mL试剂甲,旋涡振荡摇匀,室温放置10 min后加入0.5 mL试剂乙,立即旋涡振荡摇匀,30 ℃水浴15 min后在500 nm下测定吸光值,以蒸馏水为空白对照。用牛血清白蛋白做标准曲线(y=0.0011x+0.062,=0.9996;式中:x:样品中可溶性肽质量 (μg),y:吸光值),将样品吸光值带入曲线计算出可溶性肽含量。计算公式如下:

式中:m:可溶性肽质量(μg);M:样品浓度(mg/mL);V:样品体积(mL)。
1.2.8 抗氧化活性测定
1.2.8.1 DPPH自由基清除率测定 参照李娜等的方法稍作修改。将2 mL模拟消化液(1 mg/mL)加入 2 mL DPPH(60 μmol/L)溶液中,旋涡振荡摇匀,室温放置30 min后在518 nm下测定吸光值,以乙醇为空白对照。计算公式如下:

式中:A:DPPH溶液加入无水乙醇的吸光值;A:DPPH溶液加入样品溶液的吸光值;A:无水乙醇加入样品溶液的吸光值。
1.2.8.2 ABTS自由基清除率测定 参照李娜等的方法稍作修改。将10 μL模拟消化液(1 mg/mL)和50 μL磷酸盐缓冲液(0.01 mol/L)加入96孔板,再加入 100 μL ABTS 溶液(0.5 μmol/L),迅速将 96孔板放入酶标仪,避光6 min后在405 nm下测定吸光值,以磷酸盐缓冲液为空白对照。计算公式如下:
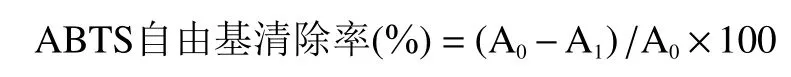
式中:A:空白吸光值;A:样品吸光值。
1.3 数据处理
采用Design Expert 12软件进行响应面分析。采用SPSS 16软件进行数据处理和分析,试验结果以均值±标准误差(Mean±SD)表示,使用Duncan多重比较法进行差异性比较,显著性水平为<0.05。
2 结果与分析
2.1 鳜鱼副产物基本组成分析
2.1.1 基本营养成分分析 对鳜鱼副产物进行基本营养成分分析,结果如表2所示。鳜鱼副产物中粗蛋白含量为11.02%,是鳜鱼鱼肉中粗蛋白含量的61.3%,是一种有潜力的制备生物活性肽的来源。

表2 鳜鱼及副产物基本营养成分(%)Table 2 Basic nutrients of mandarin fish and its by-products (%)
2.1.2 氨基酸组成分析 对鳜鱼副产物进行氨基酸组成分析,结果如表3所示。鳜鱼副产物中检测出17种氨基酸,包括7种必需氨基酸,10种非必需氨基酸。其中,含量较高的氨基酸为甘氨酸(14.1 mg/g)、谷氨酸(10.63 mg/g)、脯氨酸(8.04 mg/g)、丙氨酸(8.03 mg/g)、天冬氨酸(7.10 mg/g)、亮氨酸(6.01 mg/g),精氨酸(5.23 mg/g)。色氨酸未检出,这可能是由于酸水解法破坏了其结构所导致的。鳜鱼副产物中检测出的必需氨基酸含量为26.9±2.44 mg/g,疏水性氨基酸含量为35.7±2.11 mg/g,总氨基酸含量为89.1±5.50 mg/g。

表3 鳜鱼副产物氨基酸组成分析(mg/g)Table 3 Amino acid composition analysis of mandarin fish by-products (mg/g)
2.2 鳜鱼副产物酶解工艺优化
2.2.1 单因素实验 以水解度为指标,料液比、pH、温度、加酶量、酶解时间作为单因素参数,实验结果如图1所示。
随着料液比的增加,水解度呈现先显著上升后趋于平稳的趋势(<0.05),由9.86%不断上升,在1:4 g/mL时达到最大值18.04%,之后基本不变(图1A)。经研究表明,当料液比较小时,底物堆积影响水解的进行;当料液比超过最佳比例时,底物浓度超过最大水解度所需的量,水解度不再增加。根据这一研究结论,本实验得出的最佳料液比为1:4 g/mL,不进行响应面优化。
随着pH的增加,水解度呈现先显著上升后显著下降的趋势(<0.05),由16.18%不断上升,在9时达到最大值18.04%,之后降低至13.39%(图1B)。吕乐等研究发现pH会影响酶的活性中心构象,从而影响酶和底物的特异性结合。pH过高或过低均会降低酶活,进而影响水解度,因此选择pH8、9、10进行响应面优化。
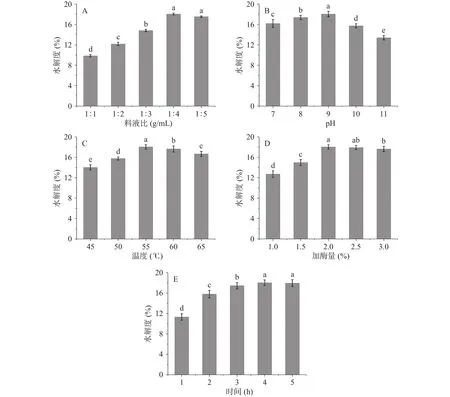
图1 不同酶解参数的单因素实验结果Fig.1 Single factor experimental results of different enzymatic hydrolysis parameters
随着温度的增加,水解度呈先显著上升后显著下降的趋势(<0.05),由14.01%不断上升,在55 ℃时达到最大值18.04%,之后降低至16.66%(图1C)。可能是因为酶活随温度的升高而增强,但当酶解温度超过最适温度时,酶可能会失活或变性。温度过高或过低会降低酶活,影响水解度,因此选择50、55、60 ℃进行响应面优化。
随着加酶量的增加,水解度呈现先显著上升后下降的趋势(<0.05),由12.71%不断上升,在2.0%时达到最大值18.04%,之后降低至17.63%(图1D)。原因可能是提高加酶量可以提高酶与底物的接触效率,从而使水解度增大;但加酶量超过最适数值时,酶与底物处于饱和状态,使水解度略微降低。选择加酶量1.5%、2.0%、2.5%进行响应面优化。
随着酶解时间的增加,水解度呈现先显著上升后平稳的趋势(<0.05),由11.3%不断上升,在4 h时达到最大值18.04%,之后基本不变(图1E)。原因是酶解初期,蛋白质不断分解为小分子肽和游离氨基酸,水解度不断上升;当底物完全消耗后,水解度不再增加。因此,最佳酶解时间为4 h,不进行响应面优化。
2.2.2 响应面试验结果 在单因素实验的基础上,根据 Box-Behnken 试验设计原理,选择 A pH(8、9、10)、B 温度(50、55、60 ℃)、C 加酶量(1.5%、2%、2.5%)进行三因素三水平响应面试验,共进行17组试验,试验设计见表4。

表4 响应面试验设计Table 4 Experimental design for response surface
根据试验结果建立回归模型并进行方差分析,结果如表5所示。可以看出,所选模型<0.01,影响极显著,说明与实际情况拟合很好;失拟项>0.05,影响不显著,说明未知因素对试验结果干扰小,模型选择适当。三种因素对响应值的影响顺序为C(加酶量)>B(温度)>A(pH);因素间交互作用影响的显著性为BC>AB>AC。

表5 模型的回归方程分析Table 5 Regression equation analysis of model
此模型可拟合出响应值对应的响应面分析图,其三维图形是响应值对试验因素构成的三维空间曲面图。当试验因素交互作用时,三维曲面图可直观看出响应值的变化趋势,如图2所示。可以看出,pH、温度和加酶量对水解度的影响均极显著。

图2 酶解参数相互作用的响应面三维图Fig.2 Three dimensional response surface diagram of the interaction of enzymolysis parameters
随着pH和温度的升高、pH和加酶量的升高、温度和加酶量的升高,水解度均呈现先上升后下降的趋势,这与单因素实验的结果一致。因素间交互作用均不显著,影响顺序为BC(温度和加酶量)>AB(pH和温度)>AC(pH 和加酶量)。
利用Design Expert12软件进行回归分析,得到的预测模型为Y=18.084-0.2525A+0.93875B+1.33125C+0.045AB-0.025AC+0.0725BC-1.30325A-1.30575B-1.50575C。经Design-Expert 12软件分析可得最佳工艺参数为酶解pH9.11、酶解温度57.12 ℃、加酶量2.02%。考虑到实际操作问题,选取参数为酶解pH9.1、酶解温度57.0 ℃、加酶量2.02%,对应的响应面模型预测水解度为18.47%。为验证响应面优化试验的可行性,重复3次酶解试验得到鳜鱼副产物水解物的水解度为18.38%,与回归方程预测值相差小于1%,说明水解物的最佳制备工艺参数是可靠的。
2.3 鳜鱼副产物水解物的胃肠消化性分析
2.3.1 可溶性肽含量变化 水解物在模拟胃肠消化过程中,可溶性肽含量随时间的变化趋势如图3所示。在模拟胃消化后,可溶性肽含量呈显著下降趋势,由 75.91 mg/g 降低至 62.42 mg/g(<0.05);在模拟肠消化后,可溶性肽含量显著降低,由62.42 mg/g降低至 30.61 mg/g(<0.05)。

图3 胃肠消化过程中可溶性肽含量的变化Fig.3 Changes of soluble peptide content during gastrointestinal digestion
可溶性肽含量在模拟胃消化后下降了17.76%,在模拟肠消化后下降了50.97%,这与刘文钊在研究菲律宾蛤仔水解物在模拟胃肠消化后的结果相近(16.0%、51.3%)。可溶性肽含量在胃消化阶段降低较少的原因可能是易被胃蛋白酶分解的苯丙氨酸、色氨酸、酪氨酸等氨基酸在水解物中的含量较少。可溶性肽含量在肠消化阶段降低较多的原因可能是胰蛋白酶在淡水鱼副产物的酶解产物中的酶切位点多于胃蛋白酶。还可能是因为易被胰蛋白酶分解的亮氨酸、精氨酸等氨基酸在水解物中的含量较高导致的。
2.3.2 抗氧化活性变化 水解物在模拟胃肠消化过程中,抗氧化活性随时间的变化趋势如图4所示。在模拟胃消化后,DPPH和ABTS自由基清除能力均呈上升趋势,其中DPPH自由基清除能力显著上升,由 55.32% 上升至 81.31%(<0.05);ABTS 自由基清除能力也显著上升,由47.29%上升至58.59%(<0.05)。在模拟肠消化后,DPPH和ABTS自由基清除能力均呈现下降趋势,其中DPPH自由基清除能力下降显著,由81.31%降低至51.36%(<0.05);ABTS自由基清除能力则稍有下降,由58.59%下降至48.67%。
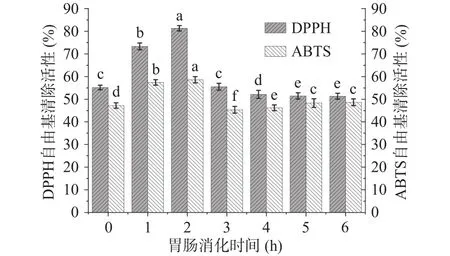
图4 胃肠消化过程中抗氧化活性的变化Fig.4 Changes of antioxidant activity during gastrointestinal digestion
在模拟胃消化后,抗氧化活性值得到显著提升(<0.05),原因可能是水解物在胃消化过程中产生了抗氧化活性肽。Gu等在研究鸡蛋寡肽的抗氧化活性时,发现鸡蛋酶解产物在胃消化后抗氧化肽的含量增加;徐广新等在研究酸奶的抗氧化活性时,发现酸奶的抗氧化活性在胃消化后有显著提升;王雨辰等在研究豌豆低聚肽的抗氧化功能时,发现豌豆低聚肽在胃消化后产生了具有高抗氧化活性的肽。在模拟胃消化后,DPPH自由基清除能力的提升显著高于ABTS的提升,这与曹振海等的试验结果一致。这可能是因为水解物中含量较高的脯氨酸、丙氨酸、亮氨酸残基等疏水基团与脂溶性的DPPH自由基结合效果更好。
相较于胃消化产物来说,肠消化产物的抗氧化活性值显著降低(<0.05),这可能是胰蛋白酶的定向水解作用,破坏了肽的结构,使其部分失去抗氧化能力。在Gu等的研究中,鸡蛋寡肽抗氧化活性在体外模拟肠消化后表现了降低的趋势;邵志芳等在研究乳清蛋白源抗氧化活性肽时,发现模拟肠液对肽活性的影响主要是胰蛋白酶会导致抗氧化活性肽的结构发生变化,从而使肽的抗氧化活性降低;刘文颖等在研究模拟胃肠消化对大豆低聚肽的结构和抗氧化活性的影响时,发现用胰蛋白酶处理大豆低聚肽后,肽结构也发生了明显变化,使得抗氧化活性降低。
目前,国内在水产品副产物水解物的模拟胃肠消化方面进行了大量研究,刘文颖等制备的三文鱼皮水解物在模拟胃肠消化后,DPPH和ABTS自由基清除能力分别为41.25%和39.17%;曹振海等制备的鲀鱼皮水解物在模拟胃肠消化后,两种自由基清除能力分别为48.31%和47.55%;梁杰等制备的鲍鱼内脏水解物在模拟胃肠消化后,两种自由基清除能力分别为49.35%和45.37%。在本实验中,鳜鱼副产物水解物在模拟消化后的DPPH和ABTS自由基清除能力分别达到51.36%和48.67%,说明鳜鱼副产物水解物在模拟胃肠消化后,仍具有较高的抗氧化活性。
3 结论
本研究通过利用鳜鱼副产物制备蛋白水解物,初步评价其体外胃肠消化后的抗氧化活性,并分析其消化性,为功能性宠物食品的开发提供技术依据。鳜鱼副产物制备水解物的工艺为料液比1:4 g/mL、pH9.1、酶解温度57.0 ℃、加酶量2.02%、酶解时间4 h。水解物在模拟胃肠消化后,可溶性肽由75.91 mg/g降低至30.61 mg/g,降低了59.67%。在抗氧化活性方面,水解物在模拟胃肠消化过程中,DPPH自由基清除能力最高达81.31%,ABTS自由基清除能力最高可达58.59%。研究结果为合理利用臭鳜鱼加工副产物,完善臭鳜鱼绿色加工技术提供了技术依据。
