雅安藏茶水提醇沉后各组分的物质含量、抗氧化和α-葡萄糖苷酶抑制活性对比分析
2022-10-27罗棵濒向卓亚邓俊琳朱永清施刘刚
夏 陈,罗棵濒,向卓亚,邓俊琳,陈 建, ,朱永清,施刘刚
(1.四川省农业科学院农产品加工研究所,四川成都 610066;2.雅安金花藏茶茶业有限公司,四川雅安 625100)
藏茶作为中国六大茶系中黑茶的典型代表,具有独特的“醇和”而不“苦涩”的滋味。对于生长在青藏高原的藏民而言,藏茶自从流入藏区以来便成为藏民不可缺少的必需饮品。藏茶富含多酚、黄酮、多糖、游离氨基酸等多种功能物质,同时基于黑茶独特的渥堆工艺,粗茶中多酚、茶黄素、茶红素等物质发生转化、降解、生成和积累等反应,与多糖、蛋白质等物质形成茶褐素等大分子物质,成为黑茶的一个重要特征,其含量的多少也决定了藏茶的口感和色泽。基于这些功能物质,研究发现藏茶水提物具有降血糖、降血脂、抗氧化等多种生物学功能。唐皓迪等研究发现高脂模型小鼠口服和灌胃藏茶水提物一段时间后,血清中甘油三酯、总胆固醇、低密度脂蛋白和血糖等重要血脂血糖指标显著下降。郭金龙等研究发现藏茶水提物对超氧阴离子的清除能力强于绿茶及众多阳性对照物(V、V、BHA和BHT)。
目前对于藏茶中水提物的研究多集中于功效活性,而藏茶水提物成分较为复杂,如多酚、黄酮、多糖、茶色素等,无法判断发挥生物活性作用的具体物质。研究发现水提物醇沉时醇浓度达到80%以上后,几乎可除去全部蛋白质、多糖、淀粉、无机盐类等,使得水提物中能溶于乙醇功效部分成为上清液,而多糖等有机大分子不溶于乙醇将被沉淀出来,使得水提物大致被分为两部分。基于雅安藏茶其水提物成分较为复杂,到目前为止,尚未全面系统地对藏茶水提物醇沉后各部分进行研究。故本研究旨在研究藏茶水提物经醇沉后各组分(水提物、上清液与醇沉物)的化学成分,并通过两种不同抗氧化体系(DPPH·和ABTS·清除能力)比较其体外抗氧化活性,同时比较-葡萄糖苷酶的抑制效果,为全面开发藏茶提取物提供理论依据。
1 材料与方法
1.1 材料与仪器
金花藏茶 由雅安市金花藏茶茶业有限公司提供,藏茶批号 20100619,形状砖状;DPPH、ABTS、-葡萄糖苷酶(≥10 U/mg)、对硝基苯--D-吡喃半乳糖苷(pNPG) 北京索莱宝科技有限公司;没食子酸(GA)、没食子儿茶素(GC)、表没食子儿茶素(EGC)、儿茶素(C)、咖啡碱(CA)、表儿茶素(EC)、儿茶素没食子酸酯(CG)、没食子酸儿茶素(GCG)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素没食子酸酯(EGCG)(纯度≥98%) 色谱纯,北京索莱宝科技有限公司;-生育酚聚乙二醇琥珀酸酯(水溶性VE)、福林酚、三氯化铝、碳酸钠、没食子酸 分析纯,成都市科龙化工试剂厂。
ELX-800酶标仪 美国伯腾仪器有限公司;KQ-250DB数控超声波清洗仪 昆山市超声仪器有限公司;Gentrifuge5180R冷冻干燥机 德国Eppendorf公司;1290高效液相色谱仪(配备自动进样器、二元泵、柱温箱、DAD检测器) 美国 Agilent公司;UPT-11-2T优普系列超纯水仪 四川优普超纯科技有限公司;Hei-vAP旋转蒸发仪 海道尔夫仪器设备有限公司。
1.2 实验方法
1.2.1 藏茶提取物的制备方法 将金花藏茶按照1:10(g/mL)的料液比,用75 ℃热水提取三次,分别提取为2、1和0.5 h,然后在50 ℃旋转浓缩至原体积的1/5,浓缩液在4 ℃的温度下按1:4的比例加入80%无水乙醇醇沉24 h,收集沉淀后溶于蒸馏水,将50 ℃旋转蒸发得到的浓缩液冷冻干燥后得藏茶水提醇沉物;收集的上清液经浓缩后冷冻干燥得到上清液样品;藏茶水提后得到的浓缩液直接冷冻干燥为藏茶水提物。以下所有实验均使用此样品。称取100 mg水提醇沉物与水提物分别溶于水进行分析测定;100 mg上清液溶于80%无水乙醇进行分析测定。
1.2.2 组分含量的测定 脂肪参照GB 5009.6-2016食品中脂肪的测定;总氨基酸参照国标GB 5009.124-2016食品中氨基酸的测定;水分参照国标GB 5009.3-2016食品中水分的测定。
1.2.3 总糖测定 总糖用苯酚-硫酸比色法测定,精密称取样品10 mg,置于100 mL容量瓶中,加水适量,超声处理使其完全溶解,用水定容至刻度,摇匀,精密吸取1.0 mL样品液,向试管中加1.0 mL苯酚试剂混匀后立即加5.0 mL浓硫酸,静置10 min。摇匀,30 ℃放置30 min后于490 nm测定吸光度。以葡萄糖溶液质量浓度(μg/mL)为横坐标(x),吸光值为纵坐标(y),绘制苯酚-硫酸法标准曲线y=0.0032x+0.1001,=0.9993,线性范围 11.72~750 μg/mL。
1.2.4 总多酚 总多酚按照福林酚法测定,20 μL上述样品液中加入20 μL福林酚试剂后静置5 min,加入160 μL 5% NaCO溶液,室温下避光反应60 min后,在765 nm下测定混合液吸光值。以没食子酸溶液质量浓度(μg/mL)为横坐标(x),吸光值为纵坐标(y),绘制标准曲线。没食子酸线性回归方程为y=0.0078x+0.0562,=0.9993,线性范围 0~175 μg/mL。
1.2.5 总黄酮测定 总黄酮用AlCl比色法测定,向 20 μL 上述样品液中加入 10 μL 25%(m/v)NaNO反应6 min 后,加入10 μL 10% AlCl·6HO 反应5 min,加入 30 μL 1 mol/L NaOH 和 100 μL 蒸馏水,510 nm波长处测定吸光值。以芦丁溶液浓度(μg/mL)为横坐标(x),吸光值为纵坐标(y),绘制标准曲线。芦丁线性回归方程为y=0.0034x+0.0466,=0.9996,线性范围 0~300 μg/mL。
1.2.6 茶色素测定 茶色素用Roberts萃取比色法测定,用30 mL乙酸乙酯将30 mL上述样品液中进行萃取并振荡5 min,得到4 mL乙酸乙酯层,用13 mL 95%乙醇定容至25 mL,得到溶液A(EA)。向25 mL乙酸乙酯层中加入25 mL 2.5% NaHCO后振荡30 s,静置分层后,将4 mL乙酸乙酯层用95%乙醇定容至25 mL,得到溶液C(EC)。向2 mL水层中加入2 mL饱和草酸溶液和6 mL超纯水,用95%乙醇(15 mL)定容至25 mL,得到溶液D(ED)。25 mL样品液用 25 mL 2.5% NaHCO振荡3 min,2 mL水相加入2 mL饱和草酸溶液和6 mL超纯水,用15 mL 95%乙醇定容,得到溶液B(EB)。以上溶液(EA、EB、EC、ED)在380 nm下测量吸光度,并以95%乙醇作为空白对照。

式中:EA、EB、EC、ED为在380 nm下测量吸光度值;TFs,茶黄素,g/100 g;TBs,茶褐素,g/100 g;TRs,茶红素,g/100 g;样品干物质率为100-含水率。
1.2.7 还原糖测定 还原糖按照3,5-二硝基水杨酸法测定。量取上述样品溶液2 mL,置具塞刻度大试管中,加入2 mL DNS试剂,摇匀,90 ℃水浴显色6 min,取出,流水冷却至室温,加水至25 mL,摇匀,在540 nm波长处检测吸光度。以葡萄糖质量浓度(mg/mL)为横坐标,吸光度为纵坐标绘制标准曲线y=0.1015x+0.0034(=0.9995)。
1.2.8 多糖测定 多糖按照董杨等修改测定,取1 mL上述样品试液于具塞试管中,再加入4 mL蒽酮-硫酸试液,立即摇匀并置于冰水浴中,然后于沸水浴中加热7 min,迅速冷至室温,静置10 min后,620 nm处测定吸光度,以蒸馏水做空白,根据葡萄糖标准曲线计算样品中多糖含量。
1.2.9 多酚类化合物组成的测定 藏茶提取物中多酚类化合物的测定采用高效液相色谱法,参照朱柏雨等的方法稍作修改。将藏茶提取物经0.22 μm微孔滤膜过滤后进样分析。色谱柱Eclipse Plus C柱(2.1 mm×50 mm, 1.8 μm);DAD 检测器,检测波长:280 nm;柱温:30 ℃;流量:0.3 mL/min;进样量:1 μL;流动相:1% 的甲酸水溶液(A)+乙腈(B)。梯度洗脱:0~2 min,B 5%~10%;2~10 min,B 10%~20%;10~15 min,B 20%~40%;15~17 min,B:40%~70%;17~20 min,B:70%~95%。
上述10个标准品20 mg,分别用甲醇溶解并定容至5 mL作为标准品母液。以二倍稀释法制备不同浓度的标准品溶液。以质量浓度(μg/mL)为横坐标(x),峰面积为纵坐标(y),绘制标准曲线,得线性方程如表1所示。样品中多酚类化合物的含量计算公式如下:多酚单体含量(μg/g)=待测液中多酚单体浓度×稀释倍数×样品定容体积/样品质量。
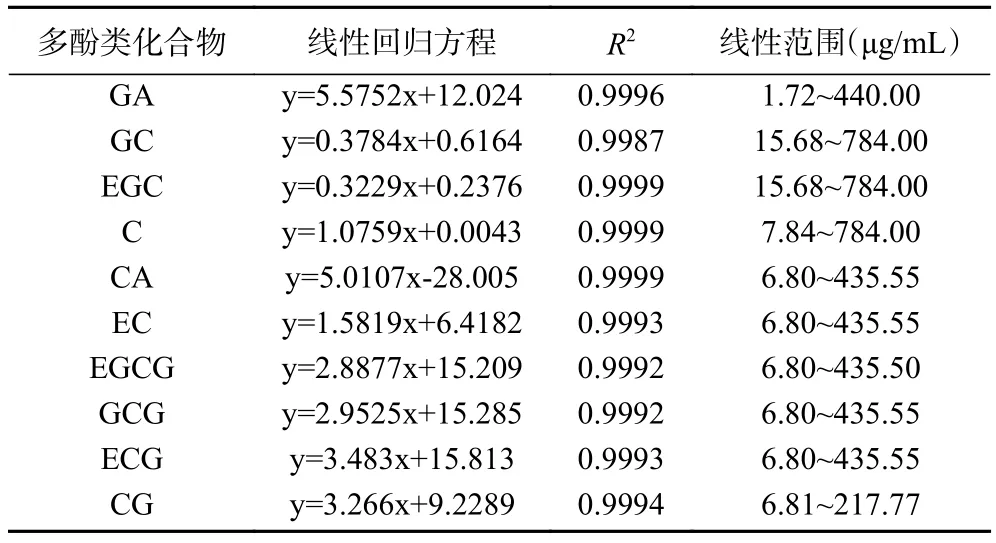
表1 对照回归方程及线性范围Table 1 The compare regression equation and linear range
1.2.10 抗氧化活性测定
1.2.10.1 DPPH·清除能力 参照Liu等方法并作适当的修改,将醇沉物、上清物和水提物用80%甲醇配制成不同浓度的溶液进行测定。取不同浓度 ( 9.76、 19.53、 78.12、 156.25、 312.50、 625.00、1250.00 μg/mL)的藏茶提取物溶液和维生素E(阳性对照)和0.2 mmol/L DPPH乙醇溶液以1:1比例混合,室温静置一段时间后在517 nm波长下比色,清除率计算公式:
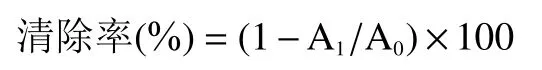
式中,A:空白对照组OD值;A:样品组或阳性对照组(维生素E)的OD值。
1.2.10.2 ABTS·清除能力 参照Lü等方法并作适当的修改,取不同浓度(9.76、19.53、78.12、156.25、312.50、625.00 μg/mL)藏茶提取物和维生素E溶液(阳性对照)和ABTS工作液(在734 nm波长处吸光度值为0.70±0.02的ABTS母液与过硫酸钾溶液混合液)混合反应6 min后于734 nm波长下测量OD值。清除率计算公式:
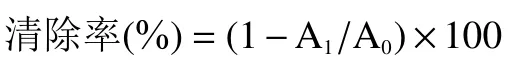
式中,A:空白对照组OD值;A:样品组或阳性对照组(维生素E)的OD值。
1.2.11-葡萄糖苷酶抑制性测定 将醇沉物、上清物和水提物用80%甲醇配成不同浓度的溶液进行测定。参照Chen等方法并作适当的修改,取不同浓度(9.76、19.53、39.06、78.12 和 156.25 μg/mL)的藏茶提取物和阿卡波糖(阳性对照)和-葡萄糖苷酶(0.1 U/mL,0.1 mol/L pH6.9的 PBS缓冲液配制)按照 1:1的比例混合,10 min后加入 100 μL pNPG(0.1 mol/L,0.1 mol/L pH6.9的 PBS缓冲液配制),37 ℃ 水浴锅放置 10 min 后,加入 100 μL NaCO,在405 nm的波长下测定OD值。计算公式:

式中,A:空白对照组OD值;A:样品组或阳性对照组(阿卡波糖)的吸光值。
1.3 数据处理
采用SPSS17.0软件进行数据分析,通过单因素方差分析(ANOVA)和Duncan多重比较方法进行显著性分析,<0.05表示差异具有显著性,结果用平均值±标准差表示(n=3)。
2 结果与分析
2.1 基本成分分析
藏茶提取物基本成分见表2。藏茶水提醇沉物中多糖含量显著(<0.05)高于上清液,这是由于水提物中多糖等水溶性物质大分子不溶于乙醇,当乙醇浓度达到80%时可以沉淀下大部分的多糖,因此经醇沉后多糖主要存在于醇沉物中。由表2可知,共检测到16种氨基酸,包括1种条件半必需氨基酸(酪氨酸)、7种必需氨基酸和8种非必需氨基酸。醇沉物中氨基酸总量为5.89 g/100 g,显著高于上清液。16种氨基酸中含量最高的为谷氨酸,其次为天冬氨酸和甘氨酸,为茶叶提供独特风味,这与杨天友等所研究的黑茶中氨基酸结果相一致。除谷氨酸和精氨酸外,醇沉物中其余氨基酸含量也均显著(<0.05)高于上清液。

表2 藏茶提取物中基本组分(g/100 g)Table 2 Chemical composition analysis of Tibetan tea extract (g/100 g)
2.2 多酚类化合物和茶色素分析
藏茶提取物多酚类化合物和茶色素含量见表3,其中藏茶上清液中总多酚、总黄酮含量以及主要的多酚类化合物含量(GA、GC、EGC、C、CA、EC、EGCG、GCG、ECG和 CG)均显著(<0.05)高于醇沉物,这是由于多酚类化合物易溶于水并且溶于乙醇,因此经醇沉后多酚类化合物主要存在于上清液中。此外,藏茶中CA含量最高(98.74 mg/g),其次为 GC(27.90 mg/g)和 GA(24.15 mg/g),而 CA 具有刺激中枢神经的功能,但经醇沉后醇沉物中含量显著降低(18.73 mg/g),可以减弱藏茶中的苦味和刺激性。
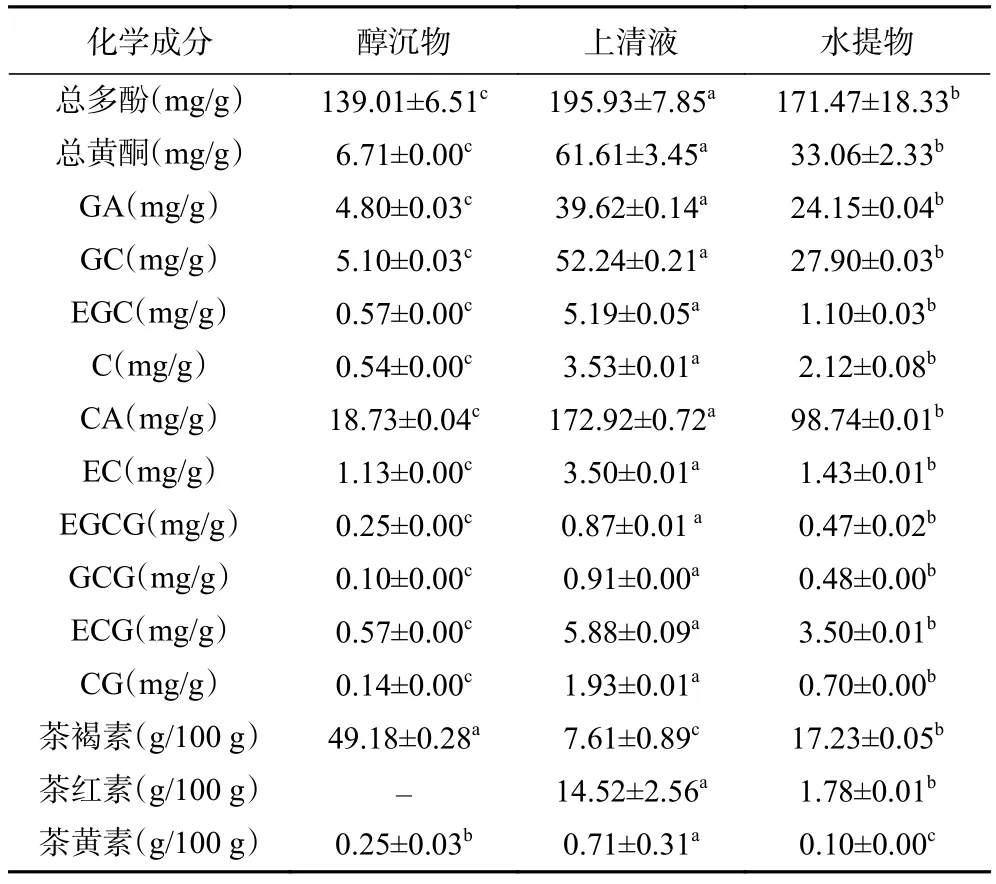
表3 藏茶提取物中多酚类物质和茶色素Table 3 Polyphenols and tea pigments in Tibetan tea extract
茶色素是黑茶在微生物发酵过程中多酚类化合物发生氧化、聚合以及偶联等生化反应,和蛋白质、多糖以共价键结合形成的水溶性聚合大分子物质,其结构复杂,主要分为茶褐素类、茶黄素类和茶红素类,茶色素对汤色、滋味以及功能性质有重要的影响。由表3可知,藏茶水提物中茶色素主要以茶褐素为主,含量为17.23 g/100 g,经醇沉后茶褐素主要存在于醇沉物中,上清液中有少量的茶褐素;茶红素只存在于上清液中;茶黄素主要存在于上清液中,少量存在于醇沉物中。研究发现茶褐素是与蛋白质、多糖、多酚、氨基酸等共价键结合形成的水溶性聚合大分子物质,溶于水而不溶于乙醇,因此经醇沉后沉淀中茶褐素最高。而茶红素和茶黄素是黑茶发酵过程中茶多酚氧化聚合形成的,因此溶于80%乙醇。
2.3 抗氧化活性
自由基作为人体生命活动时产生的中间代谢产物,大量自由基会破坏人体正常的细胞(如胰岛细胞等),从而引起糖尿病等疾病,而植物化合物的摄入可以有效地清除多余的自由基,从而影响糖尿病及其并发症的发生。因此,通过测定藏茶水提物、醇沉上清液与醇沉物对DPPH·和ABTS·清除率来评价抗氧化活性。如图1所示,在0~1250 μg/mL浓度范围内,藏茶水提物、上清液、醇沉物和维生素E对DPPH·和ABTS·均具有清除能力,并随着浓度的增加,清除率逐渐上升,其清除能力的强弱依次为维生素E>上清液>水提物>醇沉物。这是由于上清液中黄酮和多酚类化合物远高于醇沉物和水提物,而大量研究发现DPPH·和ABTS·清除能力与黄酮和多酚类化合物含量呈显著正相关。此外,当浓度为1250 μg/mL时,上清液对DPPH·的最高清除率达到88.04%,当浓度为 625 μg/mL,上清液对 ABTS·的最高清除率达到94.19%,抑制率均低于阳性对照维生素E,但强于报道的其他种类的黑茶提取物,周向军等研究发现0.2936 g/L乌龙茶茶褐素对DPPH·的最高抑制率接近80%。杨新河等研究发现1.00 mg/mL青砖茶、康砖茶、茯砖茶、六堡茶和普洱茶中茶多糖对ABTS·清除率分别为91.26%、92.93%、92.64%、92.34%和92.81%。
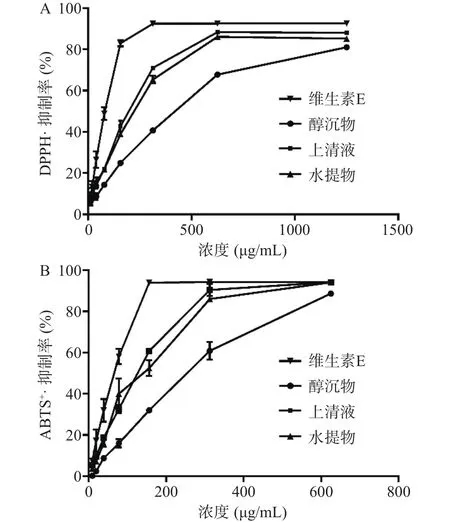
图1 DPPH·清除能力(A)和 ABTS+·清除能力(B)Fig.1 DPPH· scavenging capacity (A) and ABTS+· scavenging capacity (B)
2.4 α-葡萄糖苷酶酶抑制活性
-葡萄糖苷酶可将寡糖降解为单糖继而被肠上皮细胞所吸收,导致体内血糖水平升高,因此抑制-葡萄糖苷酶可降低餐后血糖水平。该研究结果表明藏茶提取物对-葡萄糖苷酶有明显的抑制作用,抑制强弱依次为醇沉物>水提物>上清液。这可能是由于醇沉物中含有较高含量的多糖和茶褐素,研究发现多糖和茶褐素可以抑制糖代谢酶的活性,从而起到降血糖功效。如图2所示,在9.76~19.53 μg/mL浓度范围内,对-葡萄糖苷酶的抑制作用随着浓度的增加而迅速增加,当浓度从19.53 μg/mL增加到78.13 μg/mL时,抑制活性缓慢增加。在一定浓度内,对-葡萄糖苷酶的抑制作用随着浓度的增加而增加,当浓度达到156.25 μg/mL,醇沉物抑制率达到最大值为81.02%。与过去的研究结果相一致,贺国文等研究发现茯砖茶不同分子质量提取物均对-葡萄糖苷酶有较强的抑制作用。黄群等研究报道黑茶可以通过抑制-葡萄糖苷酶,升高糖代谢关键酶的mRNA基因表达改善糖尿病的高血糖。
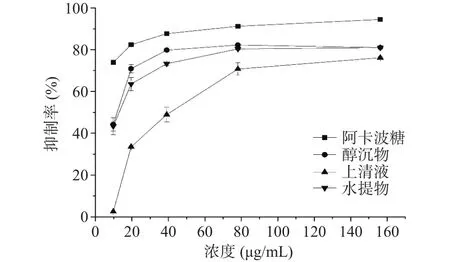
图2 α-葡萄糖苷酶抑制活性Fig.2 Inhibitory activity of α-glucosidase
3 结论
本文通过对藏茶水提醇沉物和上清液中基本组分、总多酚、总黄酮、茶色素、多酚类化合物以及抗氧化活性和-葡萄糖苷酶消化酶抑制作用分析比较,发现水提醇沉物中多糖、茶褐素含量较上清液高且CA比水提物明显减少,表现出较高的-葡萄糖苷酶抑制活性和较低的咖啡碱;而上清液中多为黄酮和多酚类化合物且高含量的CA,使其表现出更高的DPPH·和ABTS·清除能力以及较高的咖啡碱。藏茶水提醇沉物和上清夜的物质分析有利于其高值化、资源化利用。藏茶水提醇沉物有望开发为一种天然保健食品应用在保健品等领域。
