基于荧光光谱和二维相关分析技术探究硝磺草酮对玉米的生理效应
2022-10-25陈盼盼
高 倩, 陈盼盼, 王 毅
(安徽农业大学 资源与环境学院,合肥 230036)
玉米是我国的重要粮食作物之一,种植区域分布十分广泛。杂草危害是造成玉米减产的重要因素之一,而且随着玉米种植范围的不断扩大,杂草的种类也逐年增多[1]。玉米田杂草可使玉米减产20%~30%,严重时甚至减产40%以上[2]。化学除草剂是防治玉米田杂草的主要措施,但近年来由于草甘膦的过度使用导致了抗药性杂草的产生,因此开发新型除草剂的需求日益迫切。对羟基苯基丙酮酸双加氧酶 (HPPD) 抑制剂类除草剂具有高效、低毒、对作物安全性高、不易产生抗药性及对环境友好等特点,被认为是替代草甘膦的转基因作物靶标除草剂。目前,HPPD 抑制剂的开发和应用仍是研究的热点[3-4]。
硝磺草酮 (mesotrione,结构式见图式1) 作为HPPD 抑制剂类除草剂的代表性品种,具有用量低、土壤残留量少、对环境和后茬作物安全等优点,主要用于玉米田除草[5]。然而,随着硝磺草酮的大量使用以及玉米新品种的出现,其对玉米的药害也时有发生。硝磺草酮对植物的药害表现在光合作用受到抑制、叶片褪绿、株高和鲜重降低等现象。例如,李向楠等[6]通过测定耐性和敏感型玉米在硝磺草酮处理下的超氧阴离子产生速率、过氧化氢含量和叶绿素荧光参数,发现敏感型玉米叶片中积累的活性氧更多,光合作用受到严重抑制,最终植株干枯死亡。张宏军等[7]研究了4 个烟嘧磺隆敏感型玉米品种对硝磺草酮的响应情况,发现当硝磺草酮施药剂量高于有效成分210 g/hm2时,玉米光合效率显著降低,且4 种玉米的株高和鲜重均明显降低。除此之外,硝磺草酮的使用也会对玉米根系分泌物产生影响。根系分泌物在植物抵御各类逆境胁迫中发挥了重要作用,其分泌的生物大分子和小分子有机化合物具有较强的络合或螯合能力。因此,当农药与根系分泌物发生相互作用时,可以通过根系分泌物荧光强度的变化,间接地反映出农药对植株产生药害的程度,但目前尚未见关于硝磺草酮对玉米根系分泌物影响的研究报道。
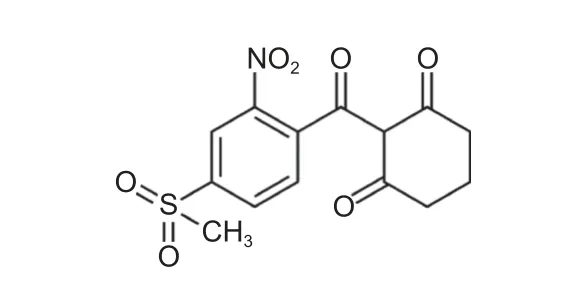
图式1 硝磺草酮结构式Scheme 1 The structural formula of mesotrione
鉴于此,本研究采用紫外-可见吸收光谱 (UVvis)、荧光光谱和二维相关分析 (2D-COS) 技术,探究了玉米植株在硝磺草酮胁迫下的生理响应,拟通过分析玉米根、茎、叶鲜重和叶绿素、类胡萝卜素含量的变化,以及玉米根系分泌物荧光物质成分的改变等,揭示不同浓度硝磺草酮对玉米生长过程的影响,以期为指导硝磺草酮的合理使用提供依据,并为HPPD 抑制剂类除草剂对作物的安全性评价提供参考。
1 材料与方法
1.1 药剂及主要仪器
97%硝磺草酮 (mesotrione) 原药,由广西南宁绿丰化工有限公司提供;二甲基亚砜 (DMSO), 购自上海阿拉丁生化科技有限公司。以加入73.83%硝酸钙的霍格兰 (Hoagland) 营养液用于玉米植株的培养。所用纯水和超纯水均通过Milli-Q 超纯水仪制取。
UV1900i 紫外分光光度计,日本岛津公司;Cary Eclipse 荧光分光光度计,美国安捷伦公司。
1.2 植物培养
挑选籽粒饱满、均匀一致的玉米种子 (金玉698),用0.5% NaClO 溶液消毒30 min;洗净后置于湿润的滤纸上,于25 ℃、相对湿度80%条件下萌发3 d;将幼苗用海绵包裹并移栽至霍格兰营养液中,放置于光照培养箱 (25 ℃,相对湿度80%) 中培养21 d,即玉米长至3 叶1 心期。
1.3 硝磺草酮暴露试验
准确称取0.01 g (精确至0.000 1 g)硝磺草酮原药,用DMSO 溶解并定容至10 mL,配制成1 000 mg/L 的母液;用加有73.83% 硝酸钙的霍格兰营养液将母液梯度稀释。根据其目前在中国登记的使用剂量,本研究中硝磺草酮溶液的试验质量浓度分别设为:0、0.5、1、5 和10 mg/L。
选取长势一致的玉米幼苗,分别移栽至装有1 L 不同质量浓度硝磺草酮溶液的6 孔黑色培养盒中。每盒移入6 株,再将培养盒放入25 ℃、相对湿度80%、12 h 光照/12 h 黑暗、375 μmol photon/(m2· s) 的光照培养箱中继续培养。分别于处理后2 h 和1、3、7、10、14 d 取叶片样品并提取根系分泌物,每个处理设3 个重复。
1.4 叶片叶绿素和类胡萝卜素含量测定
叶绿素含量测定:参考Lichtenthaler 等[8]的方法。选取叶心处叶片,将叶片中脉两侧对称位置的鲜叶剪下;准确称取0.01 g (精确至 0.0001 g)鲜叶,剪成大小一致的片状,用3~5 mL 80%丙酮溶液于黑暗条件下浸泡提取,直至叶片完全变为白色。以80%丙酮溶液作为溶剂对照,采用紫外分光光度计分别测定提取液在646 和663 nm 处的吸光度 (A646和A663) 。根据公式1~3 分别计算新鲜叶片中叶绿素a、叶绿素b 的含量以及总叶绿素含量。

式中,Ca为叶绿素a 的含量,mg/g (FW);Cb为叶绿素b 的含量,mg/g (FW);Ca+b为总叶绿素含量 (叶绿素a 和叶绿素b 含量的总和),mg/g(FW);V0为提取液体积,mL;m0为样品鲜重(fresh weight,FW),g。
类胡萝卜素含量测定:参考Lichtenthaler[8]的方法。同样采用紫外分光光度计测定470 nm(A470) 处玉米叶片的吸光度,然后根据所得叶绿素含量Ca和Cb以及公式 (4) 计算得到类胡萝卜素含量 (Cc,mg/g (FW))。
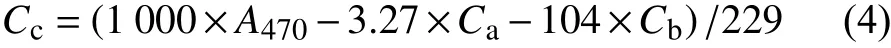
1.5 玉米根系分泌物提取及根茎叶鲜重测定
将洗净的玉米植株根系放入装有100 mL 超纯水的锥形瓶中,浸泡提取10 h[9]。根系分泌物提取过程中,植物于25 ℃、相对湿度80%、375 μmol photon/(m2· s) 条件下继续生长10 h。将收集的玉米根系分泌物提取液过0.45 μm 滤膜,于4 ℃保存,待用。将提取完分泌物的根系剪下,与茎叶分开,用滤纸快速吸干根系水分,分别称重并记录在不同质量浓度硝磺草酮胁迫下玉米植株地上部分茎叶和根系的鲜重。
1.6 荧光光谱扫描
采用荧光分光光度计扫描得到同步荧光光谱。在298 K 下,扫描波长范围设置为220~500 nm;激发波长和发射波长的狭缝宽度均设为10 nm,发射波长和激发波长的差值设定为60 nm恒定值,即Δλ=Em-Ex= 60 nm;扫描速率为1 200 nm/min。三维荧光光谱同样通过荧光分光光度计扫描获得。激发波长为200~550 nm,发射波长为250~650 nm,扫描速率为9 600 nm/min,激发和发射波长的狭缝宽度均为5 nm。所测结果均扣除试验空白 (即扣除相同条件下超纯水的背景值)。
1.7 二维相关分析
二维相关分析 (2D-COS) 作为一种先进的光谱分析手段,能够将光谱信号扩展至二维,从而提高分辨率。2D-COS 可以把多个重叠峰的复杂图谱进行简化,通过各信号峰之间的变化关系,研究分子内和分子间的相互作用[10]。此外,通过同步光谱和异步光谱的协同分析,可以很好地揭示复杂体系中荧光基团、官能团等分子基团的变化序列。为了研究硝磺草酮与玉米根系分泌物荧光基团结合的顺序,本研究采用以硝磺草酮质量浓度为外部扰动的内部因素评价矩阵 (internal factor evaluation matrix,IFE) 校正同步荧光光谱进行2D-COS 分析,并采用2Dshige 软件,对同步荧光光谱数据进行再处理,得到同步和异步的荧光光谱二维等高线图,用以揭示硝磺草酮胁迫后玉米根系分泌物荧光基团的变化规律。
同步图表示给定2 个波长 (λ1和λ2) 下光谱强度的同步变化。在对角线上出现的相关峰称作自峰,在对角线两侧的峰为交叉峰;其中自峰均为正值,而交叉峰可能为正值也可能为负值。在同步光谱中,若光谱强度Y(λ1,λ2)>0,则λ1和λ2的变化趋势相同;若Y(λ1,λ2)<0,则λ1和λ2的变化趋势相反。将同步光谱和异步光谱结合,如果对应的同步光谱强度Y(λ1,λ2) 和异步光谱强度X(λ1,λ2)正负相同,则波长λ1的变化比波长λ2的变化快;相反,如果正负不同,则表明λ2的变化比λ1快[11]。
2 结果与分析
2.1 叶片叶绿素含量变化
硝磺草酮通过植物根系进入植株体内后,会影响植株的正常生理活动。例如,史国栋研究发现,随着硝磺草酮叶面喷施浓度增加,谷子叶片中叶绿素含量整体呈现下降趋势,且药剂浓度越高其影响越难以得到缓解[12]。本研究发现,随着胁迫时间延长,高浓度硝磺草酮胁迫组的玉米叶心逐渐褪绿变白;当硝磺草酮质量浓度为5 和10 mg/L时,肉眼可以观察到这两个浓度下的玉米叶心分别在第7 天和第5 天开始出现白化症状。因此,为了探究不同浓度硝磺草酮胁迫不同时间下对玉米植株产生的影响,进一步测定了玉米叶片中叶绿素的含量变化。图1 为不同处理时间下玉米叶片的叶绿素相对含量,结合图2 可以看到,随着胁迫时间延长,对照组玉米的叶绿素a、叶绿素b 和叶绿素a 和b 总含量均呈先降低再升高然后再降低的趋势。表1 是通过单因素方差分析所得的不同胁迫时间下玉米叶片中叶绿素含量差异分析结果,从中可看出:在硝磺草酮单一浓度下,随着胁迫时间延长,10 和14 d 叶片中的叶绿素a、叶绿素b 含量及叶绿素a 和b 的总含量与2 h 及1、3、7 d 均具有显著差异 (P<0.05);另外,在相同时间内,随着硝磺草酮胁迫浓度增高,叶绿素总含量降低趋势逐渐加快,其中硝磺草酮为10 mg/L时降低最为明显。研究结果表明,当硝磺草酮胁迫浓度高于5 mg/L 时,10 d 后对玉米植株叶绿素的合成产生了明显的抑制作用,从而影响玉米的正常生长。
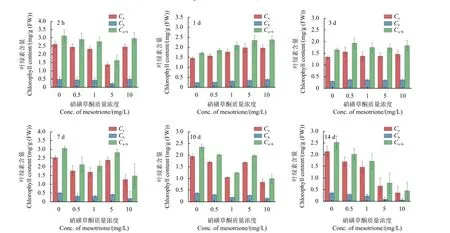
图1 不同浓度硝磺草酮胁迫不同时间下玉米叶片叶绿素含量(n=3)Fig. 1 The chlorophyll content in leaves of maize under different concentrations of nitrosulfuron stress at different times (n=3)

表1 硝磺草酮胁迫不同时间下玉米叶片叶绿素含量差异分析Table 1 Differential analysis results of chlorophyll content in maize leaves at different times under the stress of mesotrione
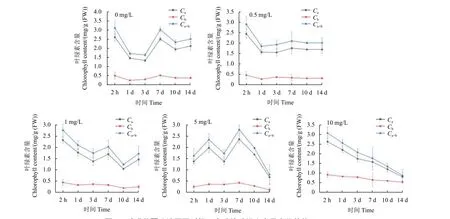
图2 硝磺草酮胁迫不同时间玉米叶片叶绿素含量变化趋势 (n=3)Fig. 2 Variation trend of chlorophyll content in maize leaves under the stress of mesotrione at different times (n=3)
2.2 叶片类胡萝卜素含量变化
HPPD 是植物中酪氨酸分解代谢和质体醌(PQ) 生物合成途径的关键酶,HPPD 将酪氨酸转化为PQ 和α-生育酚[13]。当HPPD 被抑制时,生育酚和PQ 水平下降,使得类胡萝卜素被耗尽,进而导致叶片漂白甚至植物死亡[14]。因此,对硝磺草酮敏感的植物可能会出现类胡萝卜素和叶绿素含量降低,叶片白化、植株变矮及鲜重降低等现象。不同浓度硝磺草酮胁迫不同时间下玉米叶片中类胡萝卜素的含量变化见图3。从中可以看出,不同浓度硝磺草酮胁迫2 h 及1、3、7 d 后,玉米叶片中类胡萝卜素含量变化不大 (t检验分析得P>0.05);而胁迫10 和14 d 后,高浓度硝磺草酮(5 和10 mg/L) 处理组类胡萝卜素含量均低于对照组和低浓度组,且差异显著 (P<0.05)。结合叶绿素含量变化,可以得出,高浓度硝磺草酮胁迫能够抑制玉米的光合作用,且随着胁迫时间的延长药害加重,受害叶片因色素含量降低而出现白化症状。

图3 不同浓度硝磺草酮胁迫不同时间下玉米叶片中类胡萝卜素含量 (n=3)Fig. 3 The carotenoid content in maize leaves under different concentrations of mesotrione stress at different times (n=3)
2.3 根、茎、叶鲜重变化
2.4 同步荧光光谱分析
不同浓度硝磺草胁迫不同时间下玉米根系分泌物的同步荧光光谱见图5。该光谱中共含有3 个荧光峰:峰I (Ex= 225~235 nm)、峰II (Ex= 280~325 nm) 和峰III (Ex= 390~400 nm)。根据文献中对同步荧光光谱中荧光峰的划分[15-17],峰I 和峰II 为类蛋白荧光峰,峰III 属于类腐殖质荧光峰。从图5 中可以看出:随着硝磺草酮胁迫浓度升高,玉米根系分泌物的同步荧光光谱发生了显著变化,整体上呈现随浓度升高荧光强度降低的趋势,表明不同浓度硝磺草酮胁迫导致玉米根系分泌物中荧光物质组分发生了变化。另外,在相同浓度硝磺草酮胁迫下,14 d 后峰I 的荧光强度相对增强,峰II 的荧光强度相对减弱。研究结果表明,硝磺草酮浓度和胁迫时间均会影响玉米根系
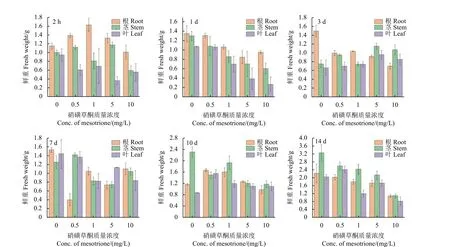
图4 不同质量浓度硝磺草酮胁迫不同时间下玉米根、茎、叶的鲜重变化 (n=3)Fig. 4 Changes of fresh weight of maize roots, stems and leaves under different concentrations of mesotrione stress at different times (n=3)
分泌物中荧光组分的变化。
2.5 三维荧光光谱分析
通过三维荧光光谱可以更直观地看出荧光峰值强度的变化。图6 和表3 分别为不同浓度硝磺草酮胁迫不同时间下玉米根系分泌物的三维荧光光谱和谱图中峰A (Ex:225~235 nm/Em:310~348 nm) 和峰B (Ex:280~325 nm/Em:316~358 nm)的荧光强度值。根据文献中对溶解性有机质三维荧光峰归属的划分[18-19],本研究中的峰A 和峰B均属于类蛋白峰。结合图5 的同步荧光光谱,由于其类腐殖质峰的荧光强度太低,所以在三维荧光谱图中未体现出来,说明在硝磺草酮胁迫下,玉米根系分泌物中的主要荧光物质为类蛋白物质,类腐殖质含量相对较少。根据玉米根系分泌物的荧光峰值强度,与对照组相比,在同一时间下,不同浓度硝磺草酮胁迫后根系分泌物的荧光强度均减弱。其中,当硝磺草酮浓度为10 mg/L时,3 d 和7 d 时峰A 消失,14 d 时峰B 也近乎消失,表明经10 mg/L 硝磺草酮胁迫后,玉米根系分泌物中的荧光物质组分发生了显著变化。胁迫时间为2 h 及1、3 d 时,峰A 随着硝磺草酮质量浓度的升高荧光强度逐渐减弱,峰B 在硝磺草酮质量浓度为5 mg/L 和10 mg/L 时荧光强度反而增强;胁迫7、10 和14 d 时,峰A 和峰B 的荧光强度均随着硝磺草酮质量浓度的升高呈先减弱后增强的趋势,原因可能是在较高浓度农药胁迫下,植物根系更倾向于分泌出富含类蛋白荧光基团的物质,以此来应对根系周围环境中农药的胁迫,这与相关文献结果[20]一致。因此,7、10 和14 d荧光强度的增强,可能是由于玉米根系分泌出了更多的类蛋白以应对高浓度硝磺草酮胁迫的缘故。

表3 不同质量浓度磺草酮胁迫不同时间下玉米根系分泌物三维荧光强度Table 3 Fluorescence intensity of fluorescence peaks in the three-dimensional fluorescence spectrum of maize root exudates under the stress of different concentrations of mesotrione at different times
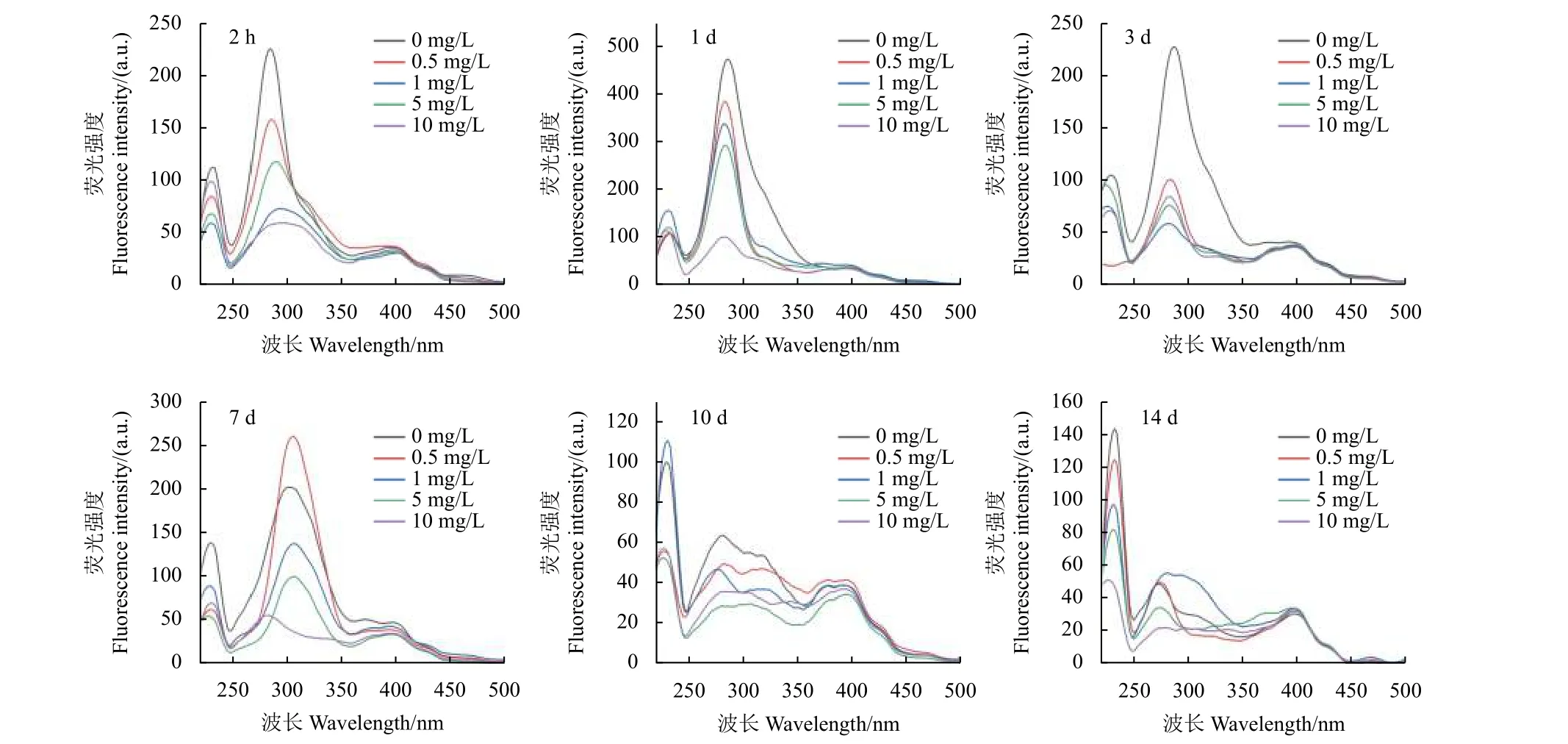
图5 不同质量浓度硝磺草酮胁迫不同时间下玉米根系分泌物的同步荧光光谱Fig. 5 Synchronous fluorescence spectra of maize root extractions under the stress of different concentrations mesotrione at different times
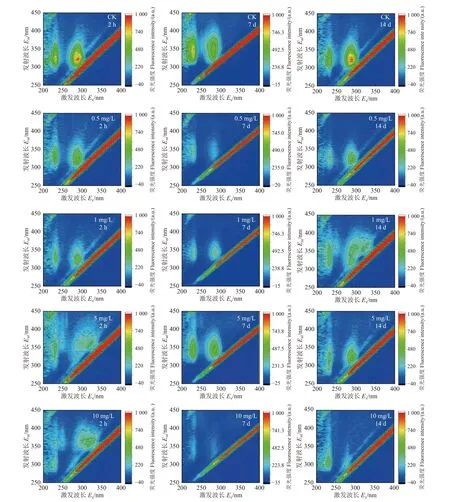
图6 不同质量浓度硝磺草酮胁迫不同时间下玉米根系分泌物的三维荧光光谱Fig. 6 3D fluorescence spectra of maize root extractions under the stress of different concentrations of mesotrione at different times

表2 硝磺草酮胁迫不同时间下玉米根、茎、叶鲜重差异显著性分析Table 2 Significance analysis of fresh weight difference of root, stem and leaf of maize under mesotrione stress at different times
2.6 二维相关分析
与同步荧光分析相比,二维相关分析 (2D-COS)技术提供了更详细的荧光峰变化信息。2D-COS 同步光谱图 (图7) 的对角线上存在两个显著的自峰(Ex=232 nm 和Ex=284 nm),分别对应于图5 中同步荧光光谱的峰I 和峰II。其中,在2 h 和1、3、7 d 时,Ex= 284 nm 处自峰的荧光强度高于Ex=232 nm 处自峰的荧光强度,说明随着硝磺草酮胁迫浓度的增加,上述4 个时间点的不同荧光基团荧光强度变化的绝对值依次为284 nm 处类蛋白荧光基团>232 nm 处类蛋白荧光基团。在图7 的同步光谱中,所有峰值均大于0,并且交叉峰X(284,232) 也大于0,说明在本研究浓度范围内,随着硝磺草酮浓度的增加,玉米根系分泌物荧光强度的整体变化趋势相同。而10 d 和14 d 的根系分泌物荧光强度变化趋势与2 h 及1、3、7 d 相反。
结合异步光谱图,2D-COS 技术可以揭示同步荧光光谱中不同波长处荧光基团的荧光强度随硝磺草酮浓度变化而变化的相互关系。从图7 中可知,1 d 和10 d 时根系分泌物的2D-COS 异步光谱谱图右下区域为正交叉峰,其中10 d 处有两个正交叉峰X(284, 234) 和X(346, 234);2 h 和3、7、14 d 的2D-COS 异步光谱谱图右下区域呈现负交叉峰区域,其中,2 h 和7、14 d 处有两个负交叉峰X(282~304, 232~234) 和X(306~360, 234~284)。两个正交叉峰区域的存在说明图7 的同步荧光光谱中类蛋白荧光峰 (Ex= 225~235 nm) 和(Ex= 280~325 nm) 均发生了荧光峰重叠。该结果同时还证实了2D-COS 是解决同步荧光光谱中峰重叠问题的有效工具。
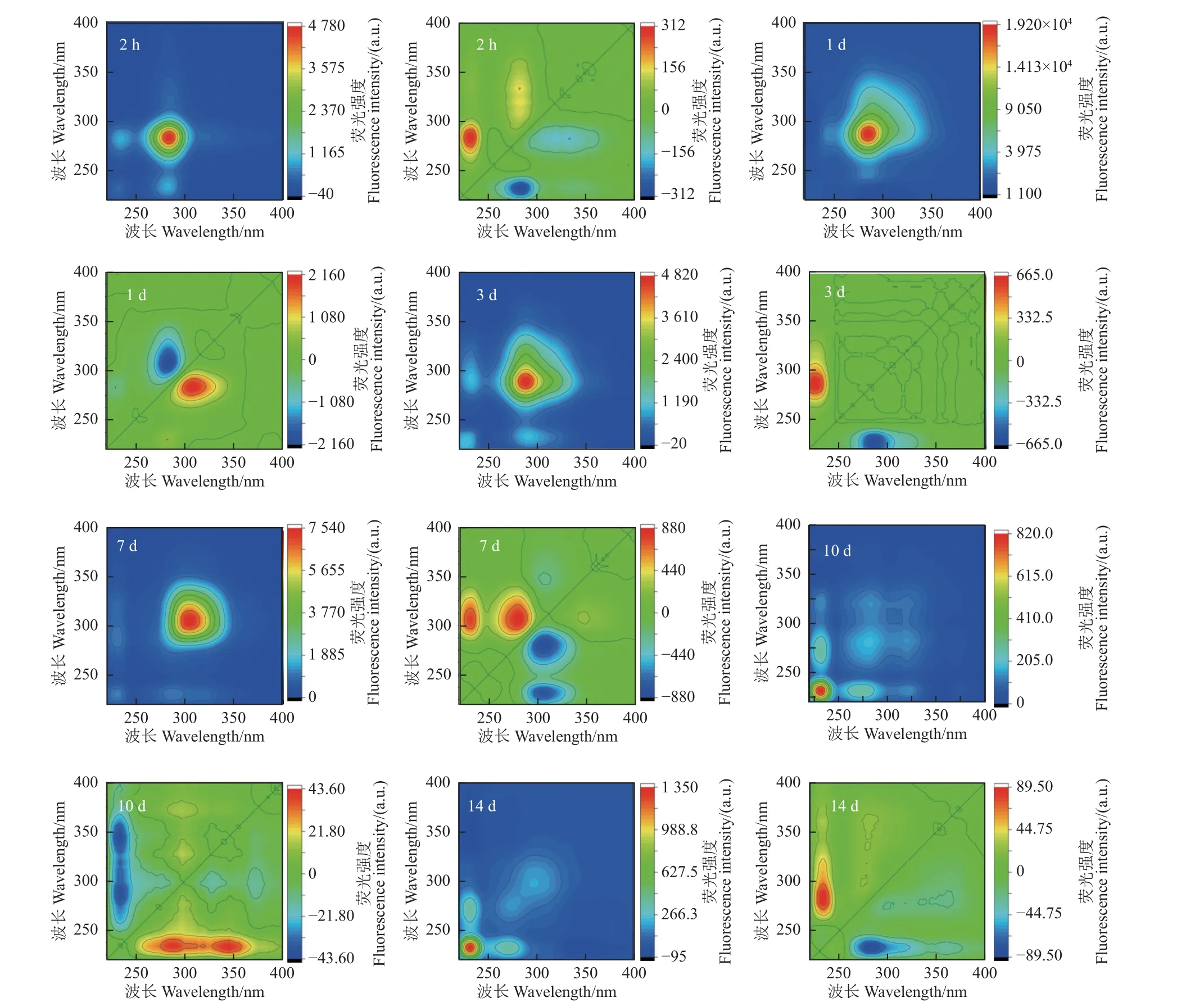
图7 硝磺草酮胁迫不同时间下玉米根系分泌物的同步和异步2D-COS 荧光光谱Fig. 7 Synchronous and asynchronous 2D-COS fluorescence spectra of maize root exudates under the stress of mesotrione at different times
根据2D-COS 解谱规则,所有的负交叉峰X(282~304, 232~234) 和X(306~360, 234~284) 表明,随着硝磺草酮质量浓度增加,2 h 和3、7、14 d 时玉米根系分泌物中232 nm 处的类蛋白先于284 nm 处类蛋白与硝磺草酮的结合;峰区域X(284, 234) 和X(346, 234) >0,说明1 d 和10 d 时玉米根系分泌物中284 nm 处的类蛋白先于232 nm处类蛋白与硝磺草酮结合。类蛋白物质随着硝磺草酮胁迫浓度增加的变化快慢可能与不同胁迫时间下不同类蛋白与硝磺草酮之间的结合能力强弱有关。
3 结论与讨论
本研究探讨了硝磺草酮胁迫下玉米的生理效应,分别采用紫外可见吸收光谱、同步荧光光谱、三维荧光光谱和2D-COS 技术,研究了硝磺草酮对玉米叶片光合系统、根茎叶鲜重和根系分泌物的影响。结果发现,除草剂在使用过程中可能会对作物的生长发育产生抑制作用,对生理指标产生不利影响。高鸣等[21]的研究表明,硝磺草酮叶面喷施后,对谷子株高和鲜重会造成影响;马兵兵[22]也发现,当土壤中莠去津 (atrazine) 浓度超过50 mg/kg 时,植株和根的生长会受到抑制;武婷婷[23]研究发现,大豆苗后施用10%硝磺草酮悬浮剂后,植株上部复叶褪绿,药害严重时复叶干枯、植株萎蔫。本研究结果表明,随着胁迫时间延长,5 和10 mg/L 的硝磺草酮处理能够抑制玉米叶片叶绿素和类胡萝卜素的合成,导致玉米出现白化症状,影响其正常生长,进而导致根、茎、叶鲜重降低。
此外,也有大量文献报道了植物根分泌物反过来对重金属和有机物污染物的影响。Montiel-Rozas 等[24]发现,根系分泌物可以改变重金属的生物利用度。Guo 等[25]的研究表明,植物根系分泌物对土壤中多环芳烃类 (PAHs) 化合物的降解和细菌群落结构产生影响。本研究中的同步荧光光谱和三维荧光光谱表明,玉米根系分泌物中含有类蛋白和类腐殖质物质,其荧光光谱的变化揭示了硝磺草酮与玉米根系分泌物的相互作用。硝磺草酮胁迫导致玉米根系分泌物中荧光物质的组成发生了显著变化,且药剂浓度越高及胁迫时间越久,硝磺草酮对玉米根系分泌物的荧光猝灭作用越显著。2D-COS 技术进一步表明,284 nm 处的类蛋白荧光基团优先与硝磺草酮进行结合,揭示了根系分泌物与硝磺草酮在不同胁迫时间下的结合能力不同。研究表明,当硝磺草酮质量浓度高于5 mg/L、胁迫时间超过10 d,会对玉米的生理和生长产生较大影响。本研究结果可为硝磺草酮的安全合理使用提供参考,同时也证实了利用光谱技术和2D-COS 技术可以很好地揭示植物对污染物胁迫的响应,拓展了其在环境毒理学领域的应用。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

高倩,硕士,实验师。2008 年毕业于安徽农业大学农药学专业,获农学硕士学位。2008 年至今任职于安徽农业大学资源与环境学院实验中心,从事农药学教学、科研及实验室管理工作,研究方向为农药残留与农产品质量安全,是安徽农业大学农药残留检测中心核心成员。参与国家自然科学基金、省部级项目10 余项,以第一作者在国内外期刊发表论文10 余篇,获得国家发明专利1 项。

王毅,博士,教授,博士生导师,农药学系主任。2014 年毕业于中国农业大学农药学专业,获理学博士学位,现任职于安徽农业大学资源与环境学院。长期从事农药环境毒理、农产品质量安全、新农药创制等方面的研究工作。近年来,主持国家自然科学基金2 项、安徽省自然科学基金优青、农业农村部农药残留限量标准制定、安徽农业大学“神农学者”英才计划、企事业单位委托等项目。以第一作者或通讯作者在Journal of Hazardous Materials、Analytical Chemistry、Journal of Agricultural and Food Chemistry、Environmental Pollution、Science of the Total Environment等高质量期刊上发表近30 篇SCI,以第一发明人授权国家发明专利3 项;担任《农药学学报》青年编委、Journal of Hazardous Materials、Journal of Agricultural and Food Chemistry、Sensors and Actuators B: Chemical等期刊审稿人。
