微塑料对氯氟醚菌唑在水稻环境中的立体选择性降解行为的影响
2022-10-25金银银李晨琛朱云龙李宗杰刘艳霞柴婷婷
金银银, 李晨琛, 朱云龙, 李宗杰, 刘艳霞,符 康, 柴婷婷*,, 崔 峰*,
(1. 浙江农林大学 食品与健康学院,杭州 311300;2. 浙江农林大学 绿色农药 2011 协同创新中心,杭州 311300)
氯氟醚菌唑 (mefentrifluconazole,MFZ) 是一种新型三唑类杀菌剂,可通过抑制真菌细胞膜重要组成成分麦角甾醇的生物合成,进而抑制病原菌的细胞生长[1]。氯氟醚菌唑具有广谱、高效,兼具保护、治疗、铲除作用,适用于大田作物以及经济作物等大约60 种作物中真菌性病害的防治,尤其对水稻纹枯病及稻瘟病等具有显著防效[2]。氯氟醚菌唑具有一个手性碳中心 (图式1),已有研究表明,其对映异构体的生物活性以及对非靶标生物的毒性具有立体选择性差异[3]。Cui 等[4]研究结果表明,氯氟醚菌唑S体对斑马鱼的毒性高于R体;Li 等[5]发现,氯氟醚菌唑R体比S体可与靶蛋白形成更稳定的构象,从而使R体对真菌表现出更高的生物活性。然而,目前我国尚未制定氯氟醚菌唑在水稻中的最大残留限量,有关其在水稻环境中的立体选择性行为也尚未见相关报道。

图式1 氯氟醚菌唑对映异构体化学结构式Scheme 1 The structural formula of mefentrifluconazole enantiomers
微塑料 (micro-plastics,MPs) 是直径小于5 mm的塑料碎片或颗粒,广泛分布在水体、陆地和空气中,是造成环境污染的主要载体[6]。已有研究表明,微塑料可通过雨水或灌溉迁移到周围的河流和农业径流中[7],并在农作物生长环境中持续存在。微塑料会直接或间接改变水土中微生物菌群的分布和理化性质[8],并影响生物对于药物的代谢分解[9-10]。规模化水稻种植的农业环境中存在各种微塑料污染[11],以及由真菌病害等作物疾病防治产生的农药残留超标风险。本研究参考前期报道中的微塑料对水稻生长代谢产生显著影响的浓度(1.5 mg/kg)[12]以及土壤环境中微塑料检出范围(0.57~12.9 mg/kg)[13],进行水稻植株盆栽模拟试验,研究了微塑料对氯氟醚菌唑在水稻环境中的立体选择性行为及消解动态的影响,旨在为氯氟醚菌唑的立体选择性环境行为研究提供基础数据。
1 材料与方法
1.1 仪器与试剂
高效液相色谱-串联质谱 (液相为LC-20A,质谱为LCMS-8050,日本岛津公司);TG16.5 台式高速离心机 (上海卢湘仪离心机仪器有限公司);VORTEX GENIUS 3 涡旋混合器 (德国 IKA 公司);BSA223S-CW 分析天平 (德国Sartorius 公司); Milli-Q 超纯水系统 (美国Millipore 公司);57044-SPE 固相萃取装置 (美国Supelco 公司);SHB-III 循环水式多用真空泵 (郑州长城科工贸有限公司);DN-24W 恒温水浴氮气吹干仪 (上海比朗仪器制造有限公司);KQ5200E 型超声波清洗器(昆山市超声仪器有限公司)。
甲醇和乙腈 (色谱纯,德国 Merck 公司);氯化钠和无水硫酸钠 (分析纯,上海凌峰化学试剂有限公司);氨水 (优级纯,西陇科学股份有限公司);OasisHLB 固相萃取柱 (美国Waters 公司,200 mg/6 mL);98.42%氯氟醚菌唑外消旋体 (racmefentrifluconazole ) 原药 (毕得医药公司);500 nm聚苯乙烯 (PS) 微球 (麦可欣科技有限公司)。
1.2 盆栽模拟试验
供试水稻品种为“甬灿975”。将水稻种子浸种催芽后,统一播种于水稻基质土上育苗。直至分蘖初期,将甬灿秧苗移至处理组盆中。本研究采用PS 微球水溶液与土壤混匀,使土壤中PS 微球含量为1 mg/kg,并设置有PS 微球处理组60 盆与无PS 微球处理组60 盆。于水稻分蘖末期,使用0.1%吐温80 水溶液将氯氟醚菌唑原药配制成药液,按有效成分180 g/hm2喷雾施用于水稻叶面,设计4 个处理 (M 组:无微塑料但喷施氯氟醚菌唑;MP 组:有微塑料且喷施氯氟醚菌唑;P 组:有微塑料但不喷施药物;CK 组:无微塑料且不施药,为空白对照组),每个处理组3 个平行,每组平行10 盆稻苗,共计120 盆。分别于施药后0 (2 h)、1、3、5、7、14、21 和28 d,采用随机多点取样法采集水稻植株、根系、土壤和田水样品。
1.3 样品前处理
1.3.1 样品制备
田水样本:准确量取田水样500 mL 于棕色试剂瓶中4 ℃环境保存,并尽快完成处理;
植株样本:土壤上部分的水稻植株用剪刀剪下,土壤下部分取到根,洗净,擦干水分,植株样本加入液氮用磨粉机磨碎后于-20 ℃环境保存;
土壤样本:随机取盆中土壤50 g,除去土壤中的碎石、杂草和植物根茎等杂物,混匀后留样,-20 ℃环境保存。
1.3.2 样品提取与净化
田水样本 (每个样本设3 个平行处理):500 mL 水样通过0.45 μm 滤膜后存于上样瓶中。依次加入5 mL 甲醇和5 mL 纯水活化HLB 小柱,将过滤后的水样以3~5 mL/min通过HLB 柱,以5 mLV(甲醇) :V(水) = 30 : 70 进行淋洗,弃去流出液后抽干,用5 mL 甲醇 (含体积分数为1% 的氨水) 洗脱目标物。收集洗脱液,于40 ℃水浴下氮吹至近干,用甲醇定容至1 mL,过0.22 μm 有机滤膜于1.5 mL 样品瓶中,-80 ℃保存待分析。
植株样本、土壤样本 (每个样本设3 个平行处理):分别称取5 g 样品 (水稻植株、根系以及土壤) 于50 mL 离心管中,加入10 mL 超纯水,涡旋混匀。加入20 mL 乙腈超声提取20 min 后,再加入2 g 氯化钠涡旋20 s,于7 000 r/min 下离心3 min 后取上清液至50 mL 离心管中。重复提取1 次。合并2 次上清液,加入2 g 无水硫酸钠于离心管中,上清液于40 ℃水浴下旋转蒸发浓缩至近干。用甲醇定容至1 mL,过0.22 μm 有机滤膜于1.5 mL 进样小瓶中,-80 ℃下保存待分析。
1.4 仪器条件
1.4.1 色谱条件 Chiralpak IG 手性柱 (4.6 mm ×150 mm,5 μm,大赛璐);柱温35 ℃;进样量1 μL;流速0.5 mL/min;流动相为V(10 mmol/L 乙酸铵水溶液) :V(甲醇) = 5 : 95。
1.4.2 质谱条件 采用多反应监测 (MRM) 条件下电喷雾正离子 (ESI+) 模式;雾化气流量3 L/min;加热气流量10 L/min;离子化电压 +3 500 V;接口温度300 ℃;传输线温度250 ℃;加热块温度400 ℃;干燥气流量10 L/min。
氯氟醚菌唑的离子信息见表1。

表1 氯氟醚菌唑离子对信息Table 1 The ion-pair information of mefentrifluconazole
1.5 计算方法
1.5.1 对映体EF 值 通过测定氯氟醚菌唑各对映体的含量,按 (1) 式计算氯氟醚菌唑对映体的EF值 (enantiomerfraction,对映体分数),评价氯氟醚菌唑在水稻环境中的立体选择性[5]。EF 值范围为0~1,如EF=0.5 时,说明无立体选择性;反之EF≠0.5,且偏离0.5 越多代表立体选择性越强[14]。

式中:CS表示氯氟醚菌唑S体的残留量,μg/kg;CR表示氯氟醚菌唑R体的残留量,μg/kg。
1.5.2 一级动力学方程公式和半衰期 根据一级动力学方程公式 (2) 得到降解速率常数k,按 (3)式计算氯氟醚菌唑对映体半衰期t1/2。
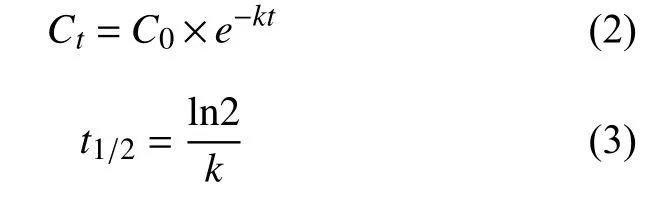
式中:Ct表示采样时间为t时分析物残留量,μg/kg;C0表示施药后分析物的初始残留量,μg/kg;k代表消解系数;t表示施药后时间,d。
1.6 方法验证
1.6.1 基质效应 基质效应 (matrix effects,Me)
是指样品中除分析物以外的所有成分对目标物测量的综合影响[15]。干扰成分影响目标物离子化效率,增强或抑制待测物响应,按 (4) 式计算参数Me,评价氯氟醚菌唑在不同水稻环境样品中的基质效应。当Me为正值时为基质增强效应,反之基质减弱效应。基质效应在 -20%~20%之间为弱基质效应;在 -50%~-20%或20%~50%之间为中等基质效应;超过 -50%或50%为强基质效应[16]。

式中:km代表基质匹配标准曲线的斜率;ks代表溶剂标准曲线的斜率。
1.6.2 标准曲线配制
溶剂标准曲线:将20 000 mg/L的氯氟醚菌唑标准样品依次用甲醇稀释成400 和8 mg/L 的标准储备液,并逐级稀释成质量浓度为0.2、0.1、0.05、0.01 、0.005 和0.001 mg/L 的标准溶液。
基质标准曲线:称取空白样品, 按 1.3.2 节方法进行前处理后获得空白基质液,分别配制质量浓度为0.2、0.1、0.05、0.01 、0.005 和0.001 mg/L的基质标准曲线。
1.6.3 添加回收试验 取空白水稻植株、根系和土壤样品进行4 个水平 (5 、10 、100 和2 000 μg/kg)的添加回收试验 (单一对映体为2.5 、5 、50 和1 000 μg/kg),田水样品进行4 个水平 (0.5、1、10和20 μg/L) 的添加回收试验 (单一对映体为0.25、0.5、5 和10 μg/L),每档浓度设置5 个平行。前处理方法同1.3.2 节,仪器条件同1.4 节进行测定分析。对添加水平为100 和2 000 μg/kg 的水稻植株、根系和土壤样品,以及添加水平为0.5、1、10 和20 μg/L 的田水样品,定容后用甲醇稀释至线性范围内再进行仪器测定。以同步稀释的基质匹配标准溶液进行定量分析,并计算氯氟醚菌唑对映体的添加回收率和相对标准偏差 (RSD)。
1.6.4 方法定量限 以满足农残分析回收率要求的最低添加水平为方法定量限 (LOQ)[16]。
1.7 数据分析
数据显著性分析采用SPSS 22 进行:采用单因素方差分析 (ANOVA) 和 Dunnett 检验分析对照组与处理组之间的显著性差异 (P<0.05,表示差异显著);配对样本T检验分析M 组与MP 组之间显著性差异 (P<0.05,表示差异显著)。采用Graph-Pad 8.0.2 对数据进行绘图。
2 结果与分析
2.1 氯氟醚菌唑残留分析方法
课题组前期已完成氯氟醚菌唑对映体的拆分及制备,并完成绝对构型解析[4]。基于前期工作,本研究采用HPLC-MS/MS 确定了氯氟醚菌唑R体和S体在Chiralpak IG 柱上分离度为1.79,达到完全分离,且氯氟醚菌唑R体优先出峰 (图1)。氯氟醚菌唑R体和S体在水稻植株、根系、土壤和田水中基质效应范围均在 -20%~20% 之间,为弱基质效应,因此可采用溶剂标准曲线进行定量分析。

图1 氯氟醚菌唑对映体典型色谱图Fig. 1 Typical chromatogram of mefentrifluconazole enantiomers
在0.000 5~0.1 mg/L 范围内,氯氟醚菌唑R体和S体的峰面积与对应的质量浓度间呈现良好的线性关系。氯氟醚菌唑R体线性方程:Y=21 208X+79 837 (R2=0.999 1),氯氟醚菌唑S体线性方程为Y= 21 104X+ 75 161(R2= 0.999 2)。
在有微塑料但不施药处理组 (P 组) 和空白对照组 (CK 组) 样本分别添加氯氟醚菌唑后,回收试验结果如表2 所示。P 组中,氯氟醚菌唑在水稻植株、根系、土壤和田水中平均回收率为75%~109%,RSD 为1.4%~13%;CK 组中平均回收率是76%~108%,RSD 为1.3%~12%。结果表明,P 组与CK 组氯氟醚菌唑对映体回收率无明显差异,且均符合《农作物中农药残留试验准则》[17]要求。氯氟醚菌唑对映体在水稻植株、根系和土壤中的 LOQ 为2.5 μg/kg,在田水中的LOQ 为0.25 μg/L。

表2 氯氟醚菌唑对映体在样品中的添加回收率 ( n=5)Table 2 Recoveries of MFZ enantiomers in samples (n=5)
2.2 氯氟醚菌唑对映体在土壤和水稻根系中的选择性降解行为
施药后28 d 内M 组和MP 组土壤中氯氟醚菌唑R体和S体浓度总体呈上升趋势 (图2-A 和图2-B),在药后21 d 达到残留量最高值,M 组氯氟醚菌唑R体和S体残留量分别为0.072 和0.073 mg/kg,MP 组分别为0.094 和0.096 mg/kg。EF 值随施药时间推移保持在0.50~0.52 范围内 (图2-C),土壤中氯氟醚菌唑对映体之间无立体选择性差异(P>0.05),且微塑料对氯氟醚菌唑对映体的立体选择性环境行为无显著影响 (P>0.05)。MP 组土壤中氯氟醚菌唑R体和S体的含量分别高于M 组38.3%和39.3% (图2-D),表明土壤中微塑料对农药存在吸附作用,影响氯氟醚菌唑在土壤中的降解和生物转化率。这与胡婷婷等[18]研究发现微塑料对环境中污染物的吸附作用结果一致。
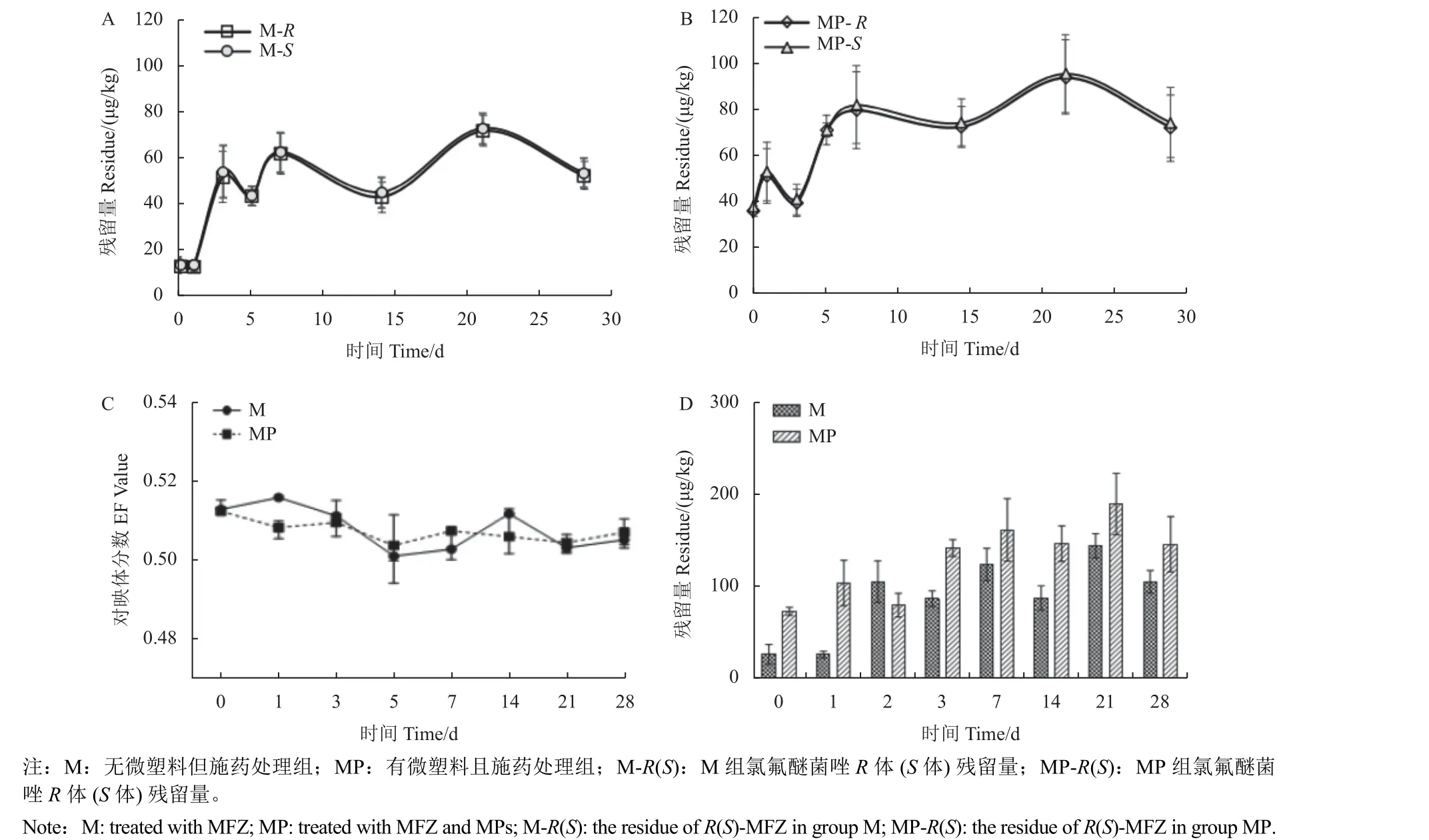
图2 氯氟醚菌唑对映体在土壤中残留量 (A、B 和D) 以及EF 值变化曲线 (C)Fig. 2 Residue (A, B and D) and EF value (C) of MFZ enantiomers in soil
由图3-A 和图3-B 可以看出:M 组和MP 组水稻根系中氯氟醚菌唑对映体分别在7 和14 d 时残留量达到最高值,随后其残留量变化趋于稳定。随施药时间推移,氯氟醚菌唑对映体在水稻植株中的EF 值变化趋势如 (图3-C) 所示:水稻植株中氯氟醚菌唑对映体之间无立体选择性差异(P>0.05),且微塑料对氯氟醚菌唑对映体的立体选择性环境行为无显著影响 (P>0.05)。本研究施药方式为叶面喷雾,氯氟醚菌唑从叶面和水体沉降到土壤表面和水稻根系并被吸附需要一定的过程[19],待达到吸附平衡后浓度随施药时间趋于稳定。MP 组氯氟醚菌唑对映体浓度变化趋于稳定的时间比M 组明显延长,其原因是微塑料在外部根表面和根冠上积累[20],阻塞细胞壁孔来限制根系对水分的吸收及与土壤环境的交互作用[21],并抑制根系生长、损害光合机制和抗氧化代谢[22]。

图3 氯氟醚菌唑对映体在水稻根系中残留量 (A、B 和D) 以及EF 值变化曲线 (C)Fig. 3 Residue (A, B and D) and EF value (C) of MFZ enantiomers in root
2.3 氯氟醚菌唑对映体在田水和水稻植株中的选择性降解行为
氯氟醚菌唑对映体在田水和水稻植株中的降解动态曲线如 (图4) 所示。M 组和MP 组中,田水样本中氯氟醚菌唑R体、S体降解率分别为94.73%、94.23%和79.26%、78.84%;植株样本中分别为97.04%、97.16%和92.25%、92.50%。结合施药后28 d 内EF 值变化趋势 (图4-C 和图4-F) 发现,M 组和MP 组氯氟醚菌唑在田水和水稻植株中均无立体选择性差异 (P>0.05),且微塑料对氯氟醚菌唑对映体的立体选择性环境行为无显著影响(P>0.05)。然而Li 等[5]发现氯氟醚菌唑S体在黄瓜中优先降解。生物体是一个复杂的手性环境,同一手性农药的对映体在不同的手性环境中通常会表现出不同的生理生化及环境行为[23]。Sun 等[24]发现茚虫威在安徽和北京两地甘蓝中存在不同的选择性降解行为,在北京地区甘蓝中茚虫威R体降解较快,而在安徽地区甘蓝中茚虫威S体优先降解;王鸣华等[25]发现在大米中甲霜灵R体优先降解,而在番茄和葡萄中甲霜灵S体优先降解。
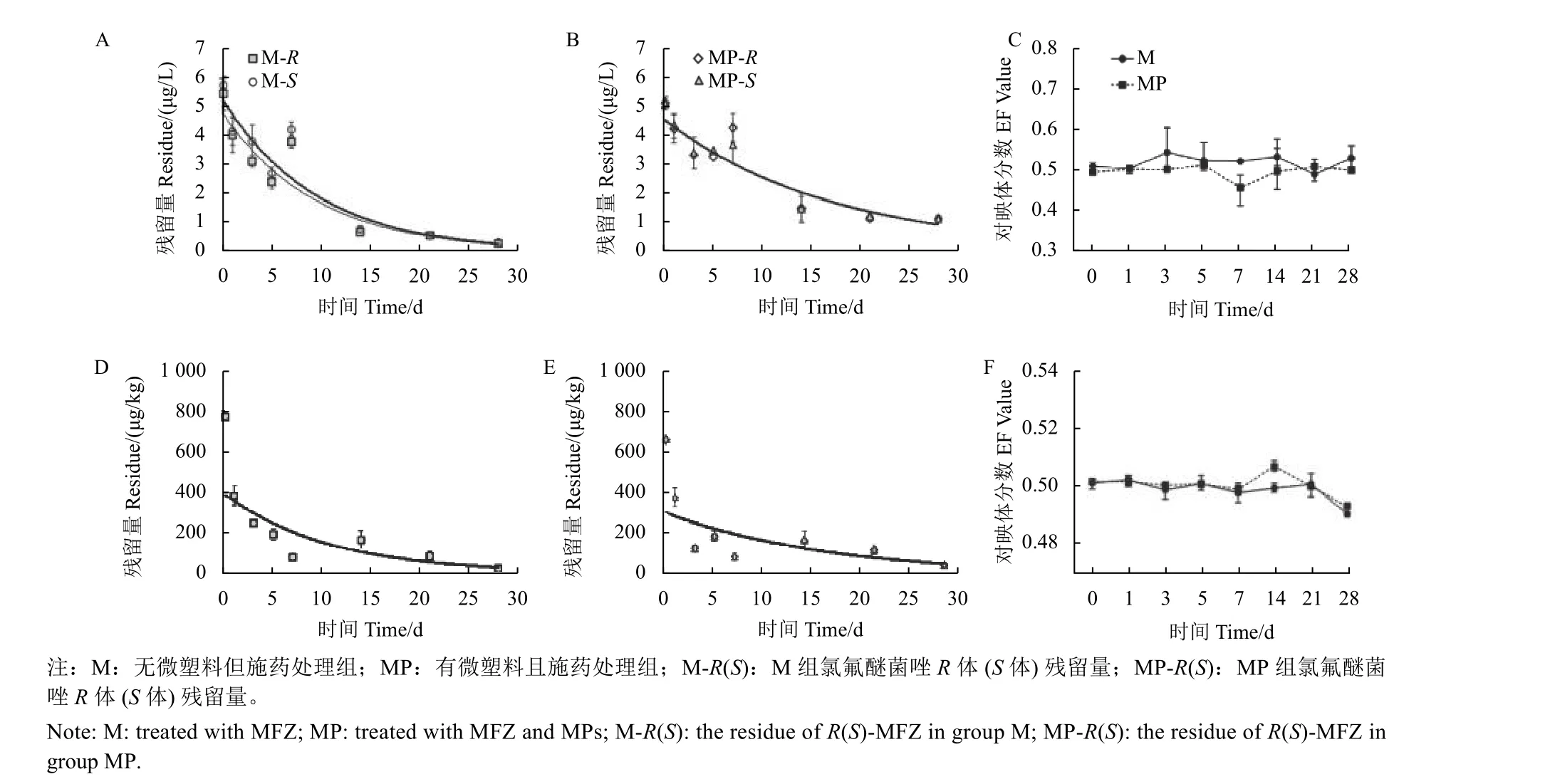
图4 氯氟醚菌唑对映体在田水中降解曲线 (A 和B) 及EF 值变化曲线 (C) 和水稻植株中降解曲线 (D 和E) 及EF 值变化曲线 (F)Fig. 4 Degradation curve (A and B) and EF value (C) of MFZ enantiomers in paddy water and degradation curve (D and E)and EF value (F) of MFZ enantiomers in plant
氯氟醚菌唑对映体在田水和水稻植株中的降解规律符合一级反应动力学方程,其降解方程及半衰期见表3。M 组和MP 组田水样本中,氯氟醚菌唑R体、S体半衰期分别为6.7、6.7 d 和11.6、11.7 d,水稻植株中分别为7.5、7.4 d 和11.7、11.6 d。MP 组中田水和水稻植株中氯氟醚菌唑R体、S体的半衰期比M 组明显延长,在田水中R体和S体分别延长73.1%和74.6%,在水稻植株中分别延长56.0%和56.8%。因微塑料对环境中残留药物具有吸附作用,且水稻根系具有向上输导性[26],导致水稻植株和田水中氯氟醚菌唑对映体半衰期的延长。
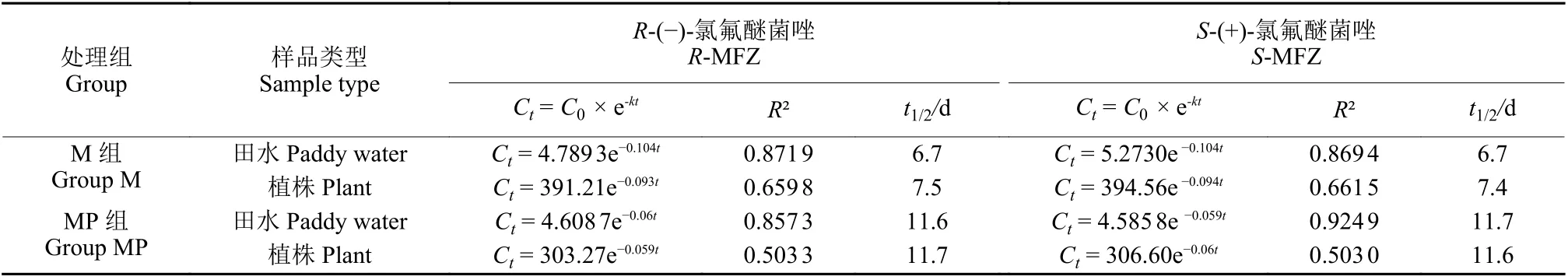
表3 氯氟醚菌唑对映体在田水和水稻植株中的降解方程及半衰期Table 3 Degradation equations and half-life of MFZ enantiomers in paddy water and plant
3 结论
本文基于HPLC-MS/MS 测定了盆栽模拟试验施药28 d 内氯氟醚菌唑对映体在水稻植株、根系、土壤和田水中的残留量,明确了氯氟醚菌唑对映体在水稻环境中的降解动态及其选择性行为,以及微塑料对氯氟醚菌唑立体选择性降解行为的影响。结果表明,氯氟醚菌唑对映异构体在田水、土壤、水稻植株和水稻根系中的立体选择性均无显著差异。微塑料处理组研究结果表明,微塑料对氯氟醚菌唑对映体在水稻环境中的立体选择性无明显影响,但显著延长了氯氟醚菌唑R体和S体在田水和水稻植株中的半衰期,增加手性农药氯氟醚菌唑残留超标风险。本研究结果为氯氟醚菌唑对映异构体的环境行为研究提供基础数据,同时也为微塑料对氯氟醚菌唑立体选择性及降解动态的影响提供参考。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

金银银,女,现为浙江农林大学食品与健康学院在读研究生。主要从事农药残留分析检测、新型污染物的环境行为等研究。

柴婷婷,女,2017 年毕业于中国农业大学农药学专业获得博士学位,现为浙江农林大学食品与健康学院副教授。研究领域涉及新型污染物的环境行为、新型污染物环境毒理学研究等。近年来主持或参加国家自然科学基金、国家重点研发计划、科技支撑计划等多项科研项目的究工作。

崔峰,男,2018 年毕业于中国农业大学农药学专业获得博士学位,现为浙江农林大学林业与生物技术学院讲师。主要从事农药及新型污染物环境毒理学、农药生物活性评价等相关研究。近年来参与国家自然科学基金、国家重点研发计划、浙江省重点研发计划等多项科研项目的研究工作。
