杀虫活性多肽研究进展
2022-10-25叶德兴周源琳张怡萌陈黛妮杨新玲
叶德兴, 周源琳, 张怡萌, 陈黛妮, 杨新玲
(中国农业大学 理学院 应用化学系 农药创新研究中心,北京 100193)
农药作为农业的重要生产资料,在控制病虫草害、保证农业生产和粮食安全等方面做出了卓越贡献。农药随着农业的发展和环境安全的要求提高而不断更新换代,以杀虫剂为例,先后经历了低效高毒的无机农药、高效高毒的有机农药、高效低毒的仿生有机农药和高效低风险的生态友好型农药时期 (图1)。近年来,一些农药如吡虫啉等新烟碱类杀虫剂由于对蜜蜂产生毒害,已被欧盟、美国等许多国家或地区禁用[1]。此外,鱼尼丁类杀虫剂如氯虫苯甲酰胺对小型甲壳类 (水蚤) 等水生生物和家蚕等陆生生物具有不同程度的毒性[2]。因此,开发生态友好型杀虫剂迫在眉睫。2020年,一种源自蓝山漏斗网蜘蛛Hadronyche versuta的多肽类杀虫剂Spear®荣获美国总统“绿色化学挑战奖 (小企业奖)”,该杀虫剂对刺吸式口器害虫(蚜虫、蓟马、飞虱等) 高效、对哺乳动物和蜜蜂安全且生态友好[3],杀虫活性肽因此成为农药研发者关注的焦点之一。本文将主要从来源和作用方式等角度,综述近年来杀虫活性多肽的研究进展,并对未来研究趋势进行展望。
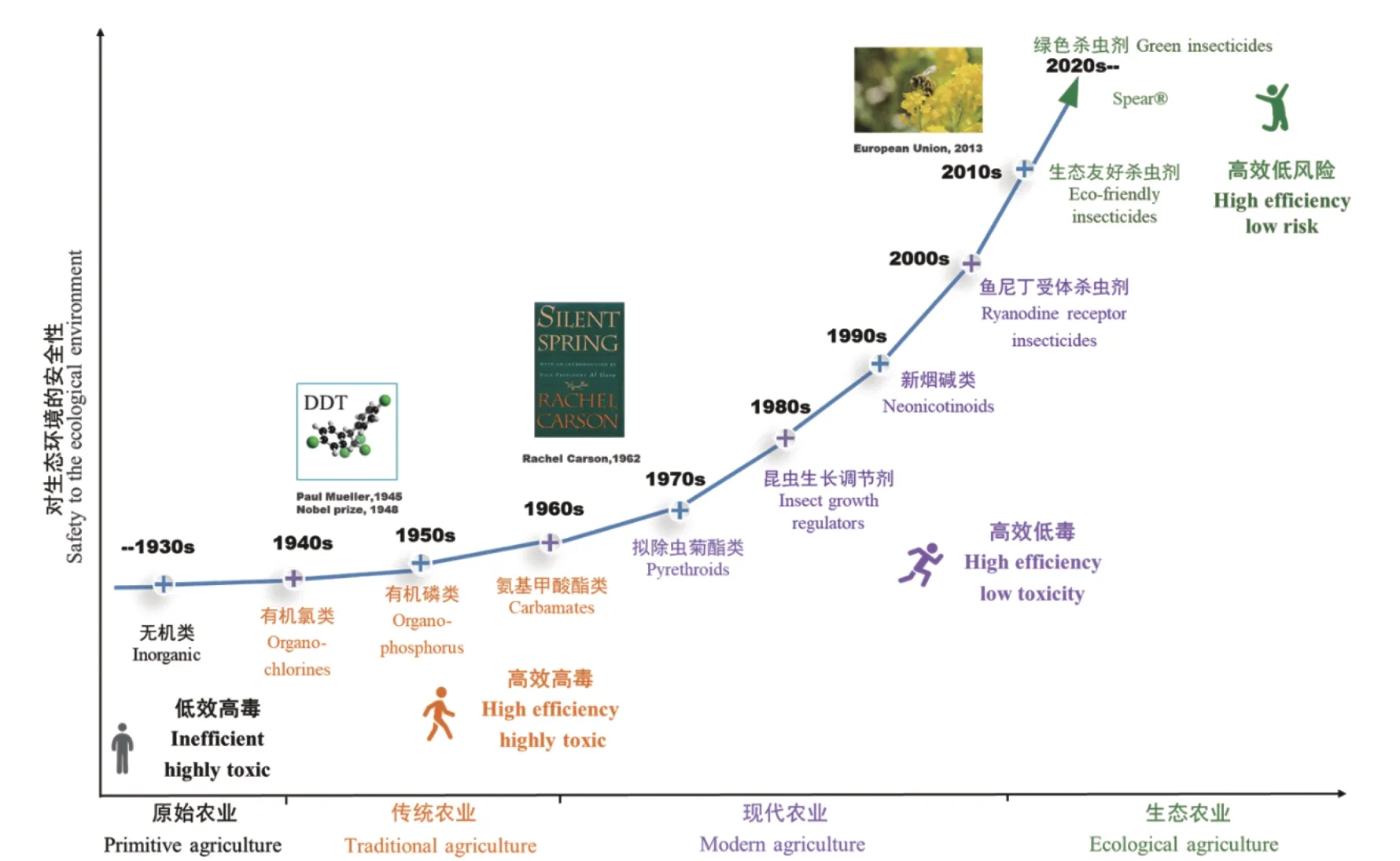
图1 不同时期农业背景下的杀虫剂发展历程Fig. 1 The development of insecticides in different periods of agriculture
1 杀虫活性多肽简介
多肽是由至少两种以上氨基酸按照一定的排列顺序通过肽键结合而成的化合物,也是蛋白质降解的中间产物,其分子量大小介于小分子和蛋白质之间。1902 年,英国伦敦大学的两位生理学家Bayliss 和Starling 在动物胃肠里发现了由27 个氨基酸残基组成的促胰液素,具有促进胃酸分泌、抑制胃泌素释放以及抑制肠道蠕动等功能,这是人类首次发现的多肽物质,他们因此获得诺贝尔生理学奖,至此,多肽物质正式出现在科学研究之中[4]。此后人们发现多肽作为生命体内重要的生理调节物质,具有多种生物学功能,如调节细胞的功能活动、作为神经递质传递信息、作为营养物质的运输工具输送营养等[5],且具有高活性、低毒性、环境安全等优点,在医药、化妆品、保健品及农业等领域得到广泛应用。尤其是近年来伴随着分子生物学和生物化学技术的飞速发展,有关多肽的研究进展迅速。例如,在医药领域,目前有超过80 余种多肽药物获得批准进入市场,在肿瘤、心血管疾病、糖尿病、免疫疾病等方面疗效显著,此外还有50 多种多肽药物处于临床开发期,400~600 种多肽药物正处于临床前的研究[6]。
鉴于多肽药物在医药领域的广泛应用,诸多学者开始探索多肽在农业应用的可能性。人们在探索过程中发现一些多肽物质 (如抗菌肽、昆虫神经肽、植物环肽等) 在农业领域可用于作物品质改良、动物饲料、食品保健、植物病虫害防治等。多肽与传统杀虫剂相比具有高活性、高选择性、且降解后对环境和非靶标生物安全等优点,因此具有开发为杀虫剂的巨大潜力。近年来发现了一些成功应用的例子,例如来源于植物环肽的商品化杀虫剂Sero-X®[7]、以及来自蜘蛛毒液的商品化多肽杀虫剂Spear®[3]的相继问世并斩获多项奖项,将多肽杀虫剂推向前所未有的浪潮。截止2022年,全球多肽杀虫剂产品登记数量已有4 种,其中美国登记产品3 种(http://npirspublic.ceris.purdue.edu/ppis/),澳大利亚登记产品1 种(https://australianmade.com.au/licensees/innovate-ag/sero-x)。
笔者通过SciFinder 数据库,以‘peptide’和‘insecticide’作为检索词进行统计分析 (图2),结果发现,自1992 年至2022 年的30 年时间内,以5 年为一个时间段进行统计,有关多肽类杀虫剂的相关研究呈现明显的上升趋势,尤其是近5 年就有1 493 篇相关报道。1993 年,Bland 等[8]就提出天然杀虫肽具有作为新型农药先导的潜力。2003 年,Gäde 等[9]对昆虫神经肽的生理学和在害虫控制中的潜在应用进行综述和展望。2022 年,Gressel[10]提出了设计多肽杀虫剂来作为“不可成药”靶标的活性分子的观点,使多肽杀虫剂有了更多的发展空间。由此可见,将多肽作为农药用于害虫防治,正成为越来越热门的研究方向之一。此外,从检索结果分析得知,至今已从自然界各种生物中成功分离得到许多具有杀虫活性的多肽,按来源可以分为动物源、植物源和微生物源杀虫活性肽。
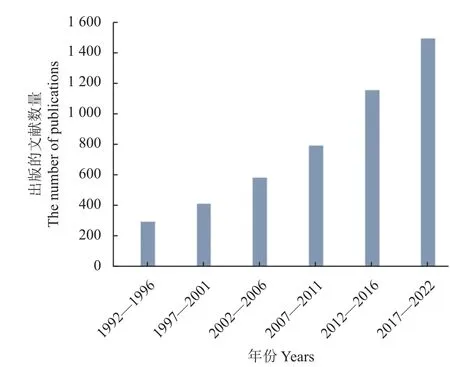
图2 多肽杀虫剂的研究趋势 (1992—2022 年,数据源自Scifinder 数据库)Fig. 2 Research progress in the field of peptide insecticide from 1992 to 2022
2 源于动物的杀虫活性多肽
经过数百万年的进化,自然界里的一些动物、特别是节肢动物 (如蜘蛛、蝎子、蚂蚁等) 和海洋动物 (如水母、海葵、锥形蜗牛等) 分泌产生了特异性和对靶标高效的毒液[11],用于捕食猎物、防御天敌以及种内交流与竞争。这些动物毒液是含有多肽和蛋白质等物质的复杂混合物,诸多学者研究并发现多种动物毒液具有杀虫活性,而毒液中的多肽是发挥杀虫作用的关键物质。这些肽通常具有与传统化学杀虫剂不同的作用模式,例如,在蚂蚁[12-14]、蜜蜂[15-16]等动物的毒液中所发现的杀虫活性多肽,可以选择性地靶向某些害虫物种,而不影响有益的昆虫或脊椎动物 (包括人类),从而最大限度地减少对环境的负面影响。此外,昆虫自身体内的内源神经肽及其类似物也会影响昆虫的正常生长发育等。本文对有关动物源杀虫活性多肽的不同来源及其作用的主要靶标害虫进行了整理,并对源于动物毒液的杀虫活性肽、以及昆虫神经肽及其类似物进行重点介绍。
2.1 源于节肢动物毒液的杀虫活性多肽
2012 年,Schwartz 等[17]综述了在节肢动物(如蜘蛛、蝎子、蚂蚁和蜈蚣等) 毒液中发现的杀虫活性多肽,它们对鳞翅目、双翅目、直翅目、鞘翅目等多种昆虫具有毒杀作用,但对哺乳动物低毒或无毒。其中,来自蜘蛛和蝎子毒液的杀虫活性肽一般高达9 kDa,分子质量较大,而且含有大量二硫键,可增加多肽在猎物体内的稳定性和对蛋白酶的抵抗力,使其降解速率降低。由于这些分子的稳定性,它们可以通过在昆虫的血淋巴中扩散而迅速到达其分子靶标并发挥杀虫作用[18]。从表1 也可以看出,源自节肢动物毒液里的杀虫肽大多是从蜘蛛和蝎子的毒液中提取得到的。
2.1.1 源于蜘蛛毒液的杀虫活性肽 据报道,每种蜘蛛毒液含有200 种左右的肽,在现存的10 万种蜘蛛物种里,其蜘蛛毒液保守估计可能含有多达2 000 万种生物活性肽,正因为其难以置信的化学多样性,使得蜘蛛毒液广泛用于药物与杀虫剂研发[19]。大多数蜘蛛毒液的主要成分为富含二硫键的小肽,它们通过靶向突触前离子通道或突触后受体杀死昆虫,目前报道的蜘蛛杀虫肽大部分(40.6%) 是从捕鸟蛛科 (Therafosidae) 家族的蜘蛛中分离出来的[20]。源自蜘蛛毒液的杀虫活性肽的主要优点是它们具有显著的杀虫效果以及对分子靶标的选择性。一些杀虫多肽还具有特殊的类别选择性,例如,沙漠灌木蜘蛛Diguetia canity毒液中的多肽β-diguetoxin-Dc1a[21]以及非洲狼蛛Augacephalus ezendami毒液中的多肽μ-theraphotoxin-Ae1a[22],它们对德国蜚蠊Blattella germanica具有强大的杀虫作用,但不会显著影响美洲大蠊Periplaneta americana。许多蜘蛛毒液具有胃毒活性[23-25],如71%的蜘蛛毒液对果蝇具有胃毒杀虫作用[24]。此外,从地窖蜘蛛Segesteria florentina的毒液中分离出的SF1a 可以通过与植物凝集素Galanthus nivalis融合而显著改善口服活性,该凝集素能将肽毒素附着在肠道上皮,并有效地将它们输送到血细胞、马氏管、脂肪体、卵巢和中枢神经系统[26]。特别令人兴奋的是,美国韦斯塔隆公司(Vestaron) 近年来以一种源自蓝山漏斗网蜘蛛Hadronyche versuta毒液的多肽ω/κ-HXTXHv1a 为基础,采用基因工程技术成功开发出生态友好的杀虫肽—GS-ω/κ-HXTX-Hv1a,并以此多肽为活性成分推出两个产品Spear®:1) Spear-T,专为温室使用而设计的产品,旨在控制困扰温室作物的四种主要害虫:蓟马、粉虱、蚜虫和螨虫。2) Spear-Lep,用于田间的水果、蔬菜和高价值作物的生物杀虫剂,主要防治鳞翅目害虫如毛毛虫、甘蓝银纹夜蛾、蠕虫。Spear®多肽杀虫剂对人类、其他哺乳动物、鸟类、鱼类和蜜蜂无毒无害,且采用微生物发酵而得,降解产物为氨基酸,因而具有出色的安全性,近来备受关注[3]。Spear®与现有杀虫剂作用机制不同,主要与烟碱乙酰胆碱受体(nAChR)变构调节剂位点II 结合,选择性地作用于目标害虫的离子通道[3],因此,被国际杀虫剂抗性行动委员会 (IRAC) 列入第32 组,与同靶标受体 (nAChR) 的第4 组和第5 组的杀虫剂,以及不同靶标受体的其他杀虫剂具有较低的交互抗性风险。
2.1.2 源于蝎子毒液的杀虫活性肽 蝎子毒液是神经毒性肽、粘多糖和其他成分的复杂混合物[27],主要成分是由23~80 个氨基酸组成的肽[28]。其中研究比较多的是针对钠离子或钾离子通道的特异性毒素肽,这些肽作用于具有高亲和力和特异性的离子通道,并且还可以区分昆虫和哺乳动物的离子通道[11],因而具有较好的选择性。例如特克曼似刺尾蝎Centruroide tecomanus的毒液含有选择性的杀虫活性肽Ct-IT1 和Ct-IT2,可导致蟋蟀在低剂量下瘫痪并最终死亡[28]。从黄肥尾蝎Androctonus australis毒液中分离得到的AaIT 是一种选择性杀虫肽,能作用于昆虫的钠离子通道,从而导致害虫的快速兴奋性麻痹甚至死亡[29]。由于其严格的毒性选择性和高生物活性,AaIT 被广泛应用于探索害虫生物防治的试验中。研究发现,AaIT 在杆状病毒或真菌中的重组表达可以增加其对害虫的毒性,将AaIT 应用到转基因作物,可使作物具有显著的抗虫能力[29]。因此,AaIT 作为一种有效的毒素,具有开发为商业杀虫剂的巨大潜力。2007 年,Gurevitz 等阐述了来自蝎子的β-毒素与昆虫的钠离子通道具有高亲和力的结合,并研究了二者的相互作用模式,这些信息对设计抗昆虫的选择性肽模拟物很有帮助[30]。
2.2 源于海洋动物的杀虫活性肽
由于独特的环境条件和广阔的空间,海洋栖息地比陆地环境孕育了更丰富的生物资源,因此针对海洋资源开发利用将有力地促进多肽杀虫剂的发展。目前关于海洋生物来源的杀虫活性肽研究主要集中在水母[31-33]、海葵[34-37]、锥形蜗牛 (芋螺)[38-42]等海洋动物中,但尚未有商品化的品种问世,在此仅对这3 类海洋生物来源的杀虫活性肽稍作简介。
2.2.1 源于水母的杀虫活性肽 水母是最为丰富的海洋生物之一,李鹏程课题组[31]发现野村水母Nemopilema nomurai的毒液NnFV 对红蜘蛛Tetranychus cinnabarinus表现出较好的杀虫活性,NnFV 通过影响红蜘蛛体壁导致其严重萎缩而死亡,田间试验发现NnFV 对柑桔全爪螨Panonychus citri具有较强的药效[32],而且NnFV 对蚕没有毒性,具有环境安全性。李鹏程团队[33]还发现来自水母Rhopilema esculentum触手的多肽毒液对杜鹃冠网蝽Stephanitis pyri和蚜虫 (如花生蚜Acyrthosiphon medicaginis、桃蚜Myzus persicae)具有杀虫活性,其对杜鹃冠网蝽S. pyri48 h 后的校正死亡率达到97.86%,LC50值为123.1 μg/mL,该发现为从海洋生物中开发生物杀虫剂奠定了良好的开端。
2.2.2 源于海葵的杀虫活性肽 海葵家族是一个研究和开发杀虫肽的宝库,Bosmans 等[34]报道了海葵毒液中对昆虫具有选择性的毒素肽,并发现其作用于昆虫钠离子通道,刘少华等[35]从舟山黄海葵粗毒液中纯化筛选出杀虫肽GF1,对脊尾白虾和黄粉虫具有高活性、但对哺乳动物小鼠低活性。来自沟迎风海葵Anemonia viridis的杀虫多肽Av3 对害虫钠离子通道表现出特异性[36],当Av3 和苏云金芽孢杆菌中的蛋白质Cry1Ac 融合表达形成融合蛋白Cry1Acv3,可显著提高Av3 的杀虫活性[37]。
2.2.3 源于锥形蜗牛的杀虫活性肽 锥形蜗牛是一大类掠食性腹足类动物,其毒液中含有无与伦比的药理活性和结构多样性的多肽化合物,但到目前为止所研究的毒液化合物尚不到总数的0.1%[38],这些肽毒素可以作用于钠、钾、钙离子通道以及烟碱乙酰胆碱受体 (nAChRs)[39]。Bruce等[40]把来自锥形蜗牛的毒素TxVIA 注射到鳞翅目(卷心菜蛾) 和双翅目 (家蝇) 幼虫体内时,显示出杀虫活性。高炳淼等[41]通过高通量筛选的方法开发潜在生物杀虫剂,首先构建了215 个芋螺毒素转录本的综合文库,然后基于具有杀虫活性的ImI 肽序列,采用同源对比法从库中筛选出6 种具有杀虫潜力的芋螺毒素,进一步通过生物测定发现其中两种毒素对黄粉虫具有很高的杀虫活性。海洋多肽CTx-btg01 具有良好的抑制昆虫细胞生长、高效的杀虫活性和较弱的哺乳动物毒性作用,可为研发新型高效安全的多肽类生物杀虫剂奠定基础[42]。
2.3 昆虫神经肽及其模拟物
2.3.1 昆虫神经肽 昆虫神经肽(insect neuropeptide,简称IN) 通常由5~80 个氨基酸组成,由昆虫大脑中枢神经系统分泌、合成,通过神经细胞或者体液在昆虫体内传递的小分子活性肽。早在1922年,波兰科学家Kopeć 就首次报道大脑中的神经肽物质控制着昆虫蜕皮和蜕变[43]。此后,美洲大蠊体内的直肠肽与蝗虫体内的脂肪动力激素(AKH) 这两种昆虫神经肽相继被报道。随着基因组学、现代生物化学、分子生物学、基因工程技术等的快速发展与应用,已有4 780 余种昆虫神经肽被发现[44]。昆虫神经肽根据其功能主要分为:促前胸腺素 (prothoracicotropic hormone, PPTH)[45]和抑前胸腺素 (prothoracicostatic hormone, PTSH)[46]、促咽侧体素 (allatotropins, ATs) 和抑咽侧体素(allatostatins, ASTs)[47]、羽化激素 (eclosion hormone, EH)[48]、滞育激素 (diapause hormone,DH)[49]、信息素生物合成激活肽 (pheromone biosynthesis activating neuropeptides, PBAN)[48-50]、利尿激素 (diuretic hormone, DH) 和抗利尿激素(antidiuretic hormone, ADH)[51]、直肠肽 (proctolin)[52]、昆虫激肽 (insect kinins, IKs) 或称为肌动肽(myokinins)[53]、速激肽 (tachykinins)[54]等。这些神经肽在昆虫体内扮演着十分重要的角色,其通过调控昆虫体内器官或腺体的活动,进而影响昆虫的生长发育、利尿、蜕皮、肌肉合成、信号传导等重要的生理生化过程。
昆虫神经肽具有很多优点:活性高,选择性强,对人畜无毒,降解后为氨基酸对环境无污染,绿色安全,因而引起研究者的青睐。目前,人们对4 类不同的昆虫神经肽进行了较为深入的研究,它们是信息素生物合成激活神经肽 (PBAN)、直肠肽、激肽 (IKs) 和抑咽侧体素 (ASTs),确定了它们的生物活性序列,并测试了这4 种神经肽对不同昆虫的杀虫效果[44]。来自谷实夜蛾、棉铃虫、甘蓝夜蛾等昆虫体内的PBAN 是一种具有多重功能的昆虫神经肽,主要调节雌蛾性信息素的产生,其通过和性信息素腺体细胞膜上的受体结合,经过一系列的信号传递途径,最终影响昆虫体内性信息素的合成和释放[44]。直肠肽是一种内源性五肽,最早于1975 年从美洲大蠊Periplanata Americana里发现,广泛分布在节肢动物中,具有调节昆虫后肠、生殖、骨骼以及心脏肌肉收缩的功能,其作为昆虫体内的兴奋性神经调节剂,可以增加动作电位的频率并调节肌肉收缩的幅度[44]。由蝗虫的运动神经元产生的直肠肽,能调节果蝇的爬行等行为[55]。昆虫激肽于1984 年从马德拉蟑螂Leucophaea maderae脑提取物中首次发现,迄今人们已分离并鉴定出40 多种不同的昆虫激肽,其功能主要有促进肌肉收缩和马氏管扭动、调节消化系统和协同利尿作用等,有些激肽还可以影响脂肪和蛋白质的合成、唾液腺的分泌等[56]。抑咽侧体素(ASTs)是一类由昆虫脑神经细胞分泌的昆虫神经肽,最早于1989 年从未交配的雌性太平洋折翅蠊Diploptera punctata的大脑提取物中发现,此外从果蝇、黏虫、蝗虫、蟋蟀、丽蝇和小龙虾等动物中都发现了ASTs,其功能主要通过作用于咽侧体进而抑制保幼激素(JH)合成与释放[57]。基于昆虫神经肽的这些重要生理功能和诸多优点,它们被认为是一类潜在的害虫控制剂的先导化合物,可以应用于有害生物的防治。
2.3.2 昆虫神经肽模拟物 天然昆虫神经肽容易被昆虫体内的酶降解、在有机和水溶液中的溶解度较差,存在生物利用性低、药代动力学性质差、生产成本昂贵等不足。因此,运用模拟肽学、生物技术等方法对天然昆虫神经肽进行结构修饰和改造,以期克服上述缺陷并保持优异的生物活性,从而发现具有实际应用价值的新型绿色杀虫剂就成为多肽杀虫剂研发的热点。国内外许多研究者从结构简化、生物稳定性、活性提高等角度出发,通过模拟肽学的方法对昆虫神经肽的结构进行了修饰和改造,得到许多神经肽模拟物并进行了构效关系研究,部分模拟物表现出良好的药效学和药代动力学性质,包括生物活性、代谢稳定性等。
鉴于PBAN 的稳定性差及穿透性差的问题,Nachman 等[58]用非肽代替PBAN 结构里的部分天然多肽,可以增加其稳定性及穿透性,从而提高生物活性。Harinton 等[59]用D 型苯丙氨酸取代L 型氨基酸并将主链环化,得到了高选择性且代谢稳定的环化PBAN 类似物,可抑制雌性点实夜蛾Heliothis peltigera性信息素的合成,Nachman等对PBAN 模拟物进行了更多介绍[60],本文就不再赘述。Noronha[61]曾报道2 位氨基酸被α-甲基化或N-甲基化的直肠肽模拟物可以用作激动剂和拮抗剂。Scherkenbeck 等[62]报道,将直肠肽的Tyr2和Leu3之间的一个NH 替换为O 后的模拟物可以使东亚飞蝗Locusta migratoria的肌肉收缩失去活性(1 mmol/L),直肠肽的环化模拟物(cycloproctolin)可作为有效拮抗剂阻止第二信使InsP3(胰岛素P3)和InsP4(胰岛素P4)产生直肠肽。Konopinska[63]曾介绍了直肠肽的80 种模拟物以及它们对美洲大蠊、东亚飞蝗等生物的活性。本课题组针对天然AST 易酶解的不足,利用模拟肽学和分子设计技术发现H17[64]、K15[65]、K24[65]、P5[66]、B1[67]、II12[68]和A6[69]等一系列具有高活性的AST 模拟肽化合物,并对国内外关于AST 模拟物的研究工作进行了详细总结[70]。
然而,有关昆虫激肽结构及其模拟物的相关综述报道较少,在此对昆虫激肽模拟物的研究进行较为详细的介绍。昆虫激肽 (Insect Kinins, IKs)的C 末端均含有特征性的进化保守五肽序列Phe-Xaa1-Xaa2- Trp-Gly-NH2(Xaa1=His, Asn, Phe, Ser或Tyr;Xaa2=Pro, Ser 或Ala)。Nachman 等[71]发现五肽序列Phe-Tyr-Ser-Trp-Gly-NH2与其天然母肽 leucokinin-VIII 具有水平相当的离体蜚蠊后肠肌亲和活性,而序列短于五肽的片段均失去亲和活性;Holman 等也发现五肽序列 Phe-Tyr-Pro-Trp-Gly-NH2在离体后肠肌亲和活性试验[72]和蟋蟀利尿试验[73]中均表现出与天然母肽相当的活性。以上研究表明,该核心五肽片段是昆虫激肽保持生物活性所必须的最短序列,也是其主要的功能区[53]。昆虫激肽家族成员均易被昆虫体内的组织结合肽酶 (例如血管紧张素转化酶(ACE)等) 所水解而失活[74],天然昆虫激肽中的两个酶解位点也已经被发现,其中主要的酶解位点位于活性核心五肽序列 Phe1-Tyr2-Pro3-Trp4-Gly5-NH2的Pro3和Trp4之间,次级酶解位点位于Phe1的N 末端[75-76]。Nachman 团队采用模拟肽学的方法,在酶解位点引入非天然氨基酸,得到的昆虫激肽模拟物抗酶降解能力显著提高,而且这些模拟物的活性与天然的昆虫激肽活性相当甚至更高。通过构象分析,Nachman[77]提出了昆虫激肽活性构象及与受体相互作用模型,并推测Phe1-Trp4形成的β转角是其活性构象。此外,研究发现C 末端酰胺化是昆虫激肽活性所必需的[78],而十分有趣的是,当C 末端由酰胺基变为醛基后的模拟物能引起棉铃虫幼虫死亡、以及家蝇的抗利尿作用[79]。董守良课题组[80-82]通过在酶解位点引入可光致异构化的硫代酰胺键Ψ[CS-N]、可诱导 cis/trans 异构变化的伪脯氨酸 (ΨPro),设计合成了多个系列的昆虫激肽模拟物,并研究了它们的构象与活性的关系。Zubrzak 等[75]将β氨基酸引入到昆虫激肽特定序列位点,所得到的昆虫激肽模拟物保持了一定的生物活性,且抗酶降解能力远高于天然肽。Smagghe等[83]发现昆虫激肽模拟物对豌豆蚜Acyrthosiphon pisum具有明显杀蚜活性。笔者以六肽类似物KAib-1 作为先导化合物,通过对昆虫激肽1、3、5 位进行结构修饰和优化,发现多个具有良好活体杀蚜活性的激肽模拟物如II-1[84]和IV-3[85],而且这些化合物表现出很好的稳定性。最近,笔者[86-87]利用模拟肽学手段针对昆虫激肽关键位点Phe2和Trp4进行结构优化,发现了杀蚜活性优异且对蜜蜂低毒的模拟肽化合物L25和M1,这为新型绿色蚜虫控制剂的创制提供了新的策略。
不同动物来源的杀虫活性多肽及其作用的主要靶标害虫详见表1。

表1 不同动物来源的杀虫活性多肽及其作用的主要靶标害虫Table 1 The insecticidal peptides from different animals and their main target pests

续表1Table 1 (Continued)
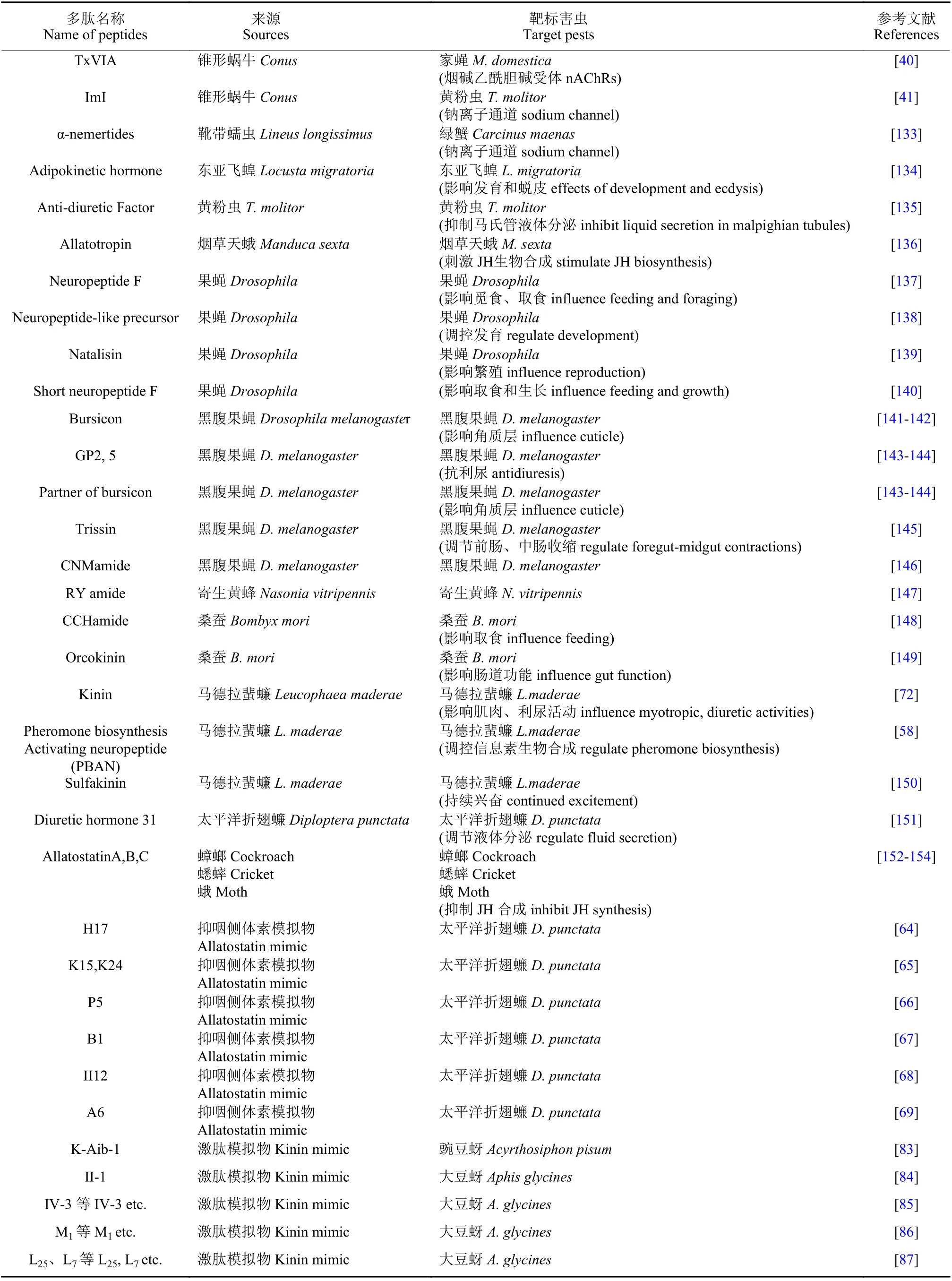
续表1Table 1 (Continued)
3 源于植物的杀虫活性多肽
在植物中分离出对害虫有毒、对非靶标生物安全的多肽,可为绿色作物保护提供新的策略。植物源杀虫活性多肽是植物自身合成的、对害虫有杀虫活性的一类小分子多肽。关于植物源杀虫活性多肽及其作用靶标已有诸多报道,它们大多来源于茜草科、豆科、堇菜科、茄科和葫芦科等植物中,包括环肽、豌豆白蛋白、防御素及重组肽等,对棉铃虫、蚜虫、烟粉虱、谷象及线虫等具有良好的防效,其中植物环肽、豌豆白蛋白因具有突出的杀虫活性,得到人们的广泛关注,在此作为重点介绍。
3.1 植物环肽
环肽是一系列植物来源的肽家族,它们由26 至37 个氨基酸以及6 个保守的半胱氨酸残基组成,这些半胱氨酸残基由3 个分子间二硫键连接,形成称为环胱氨酸结 (cyclic cysteine knot,CCK) 的环状结构[155]。环肽独特的拓扑化学结构使其不易被酶降解,不受温度变化和化学物质的影响[156],引起很多科学研究工作者的广泛重视与探究。植物环肽广泛存在于葫芦科、豆科、茜草科、茄科、堇菜科等植物中[157],这些环肽具有广泛的生物活性,如抗菌、杀虫、杀线虫、杀软体动物等[158],可为植物提供自然保护使其免受各种病虫害的侵害,利用该特性可以将具有杀虫或杀线虫活性的环肽配制成相应的生物农药,用于农业病虫害的防治。
2017 年,澳大利亚的Innovate Ag 公司开发出一种无毒、蜜蜂友好的世界首个植物环肽类生物杀虫剂—Sero-X®[6],其是从蝴蝶豌豆Clitoria ternatea中提取出来的环肽混合物,对棉铃虫Helicoverpaarmigera、烟粉虱Bemesia tabaci和稻绿蝽Nezara viridula等多种害虫有着良好的防治效果,且对非靶标生物没有影响[159]。百花蛇舌草Oldenlandia affinis中的环肽kalata B1[160]与kalata B2[161]可以杀死鳞翅目害虫棉铃虫H. armigera,蝴蝶豌豆Clitoria ternatea中环肽cter M 也对棉铃虫具有杀虫活性[162]。环肽cycloviolacin O1、kalata B1、kalata B2、kalata B7 对一系列软体动物如福寿螺Pomacea canaliculata显示杀灭活性[163]。Colgrave等[164]发现环肽cycloviolacin O14 、kalata B1、kalata B6 具有杀线虫活性。Pinto 等[165]发现从茜草科植物Palicourea rigida分离的环肽 paragidinbr1 会影响甘蔗害虫小蔗螟Diatraea saccharalis幼虫的生长发育,对草地贪夜蛾Spodoptera frugiperda也有一定防效。最近研究发现四种环肽cycloviolacin O2、cycloviolacin O3、cycloviolacin O13 以及cycloviolacin O19 对桃蚜的取食行为具有阻碍作用[166]。
大多数杀虫环肽可引起害虫的肠道上皮细胞肿胀、损伤并最终破裂[167],kalata B1 就是通过破坏棉铃虫肠道上皮细胞从而发挥杀虫作用[168],研究发现环肽通过破坏桃蚜中肠和消化道细胞来抑制桃蚜的取食行为[166]。对二斑叶螨Tetranychus urticae喂食特定的环肽后,环肽会作用于螨消化道并影响螨的正常生长[169]。总之,生物活性环肽通过与靶膜结合并发生相互作用,最后将其破坏,从而杀死昆虫。作用机制研究发现,这些环肽化合物有特定的氨基酸残基形成的疏水性表面,对其生物活性起着至关重要的作用,例如具有高效杀虫活性的环肽kalata B1、kalata B2、cycloviolacin O2 和cycloviolacin O14 结构中都含有疏水表面[170]。
3.2 豌豆白蛋白
1986 年,豌豆白蛋白(pea albumin 1b,PA1b)首次从豌豆种子中分离与鉴定[171]。PA1b 是由37个氨基酸组成的肽,其中含有6 个半胱氨酸参与构成3 个分子内的二硫键,二硫键的形成使得PA1b 具有耐酶降解性和热稳定性[172]。PA1b 作为一种有效的杀虫活性肽,可以防治储粮害虫和蔬菜中的主要害虫,如PA1b 对储粮害虫米象Sitophilus oryzae、谷象Sitophilus granarius和玉米象Sitophylus zeamays具有杀虫活性[172],对某些种类的蚜虫如豌豆蚜A. pisum[173]也有一定活性。此外还发现其对媒介害虫蚊子如尖音库蚊Culex pipiens[174]和埃及伊蚊Aedes aegypti表现出杀虫活性 (表2)。电生理学和生化的相关研究表明,PA1b靶向一种名为液泡-ATP 酶 (V-ATP 酶) 的多聚体蛋白质复合物[175]。V-ATP 酶大小约为1 MDa,由ATP 水解结构域 (V1) 与质子跨膜结构域 (V0) 组成[176],主要存在于昆虫的马氏管、中肠和唾液腺等器官的上皮细胞质膜上,对昆虫的生长发育有着重要作用[177]。PA1b 是在植物体内发现的第一个V-ATP 酶肽抑制剂,通过与质子跨膜结构域(V0) 的亚基c 和e 结合[178]阻断昆虫中肠上的VATP 酶活性,导致昆虫死亡。一些疏水性残基(如Phe-10、Ile-23、Arg-21 和Leu-27) 对PA1b 发挥生物活性至关重要[179]。研究发现,PA1b 对蜜蜂等有益昆虫没有影响且对哺乳动物低毒[180]。由于PA1b 具有对昆虫的独特选择性,且可以从大豆和豌豆等常见植物中提取,是一种很有前途的杀虫活性多肽。
3.3 其他植物源杀虫肽
源于豌豆、萝卜和大麦等一些植物组织中的γ-硫堇蛋白防御素为富半胱氨酸家族,是由45~54 个氨基酸组成的碱性肽,具有多种生物活性,如抗菌、抗虫、抑制α-淀粉酶和蛋白酶的活性[181]。Chen 等[182]报道了从绿豆中获得的新颖防御素VrCRP 对绿豆象Callosobruchus chinensis有杀虫活性,尤其是含有0.2% VrCRP 的种子可以完全阻碍豆象发育。Choi 等[183]在水稻体内表达来自芜菁Brassica rapa的植物防御素BrD1,结果发现表达BrD1 的转基因水稻品系表现出明显的抗褐飞虱Nilaparvata lugens的能力,这些研究表明植物防御素在抗虫作物的开发中会有很好的前景。此外,有研究表明,由刀豆Canavalia ensiformis中的刀豆毒素衍生而来的重组多肽jaburetox-2Ec,对秘鲁皮蠹Dysdercus peruvianus和四纹豆象Callosobruchus maculatus具有良好的杀虫活性,此活性是因刀豆毒素被昆虫组织蛋白酶水解产生10 kDa 杀虫肽pepcanatox 所致[184]。Mulinari 等[185]通过异源体系 (大肠杆菌) 产生相当于pepcanatox的重组肽jaburetox-2Ec,生测活性研究表明,草地贪夜蛾3 龄幼虫摄食含有16.3μmol/L jaburetox-2Ec 的饲料2 d 后,虫体变小 (比对照小20%),若摄取47 μmol/L 的jaburetox-2Ec 后,则全部死亡。
有关不同植物来源的杀虫活性多肽及其作用的主要靶标害虫详见表2。
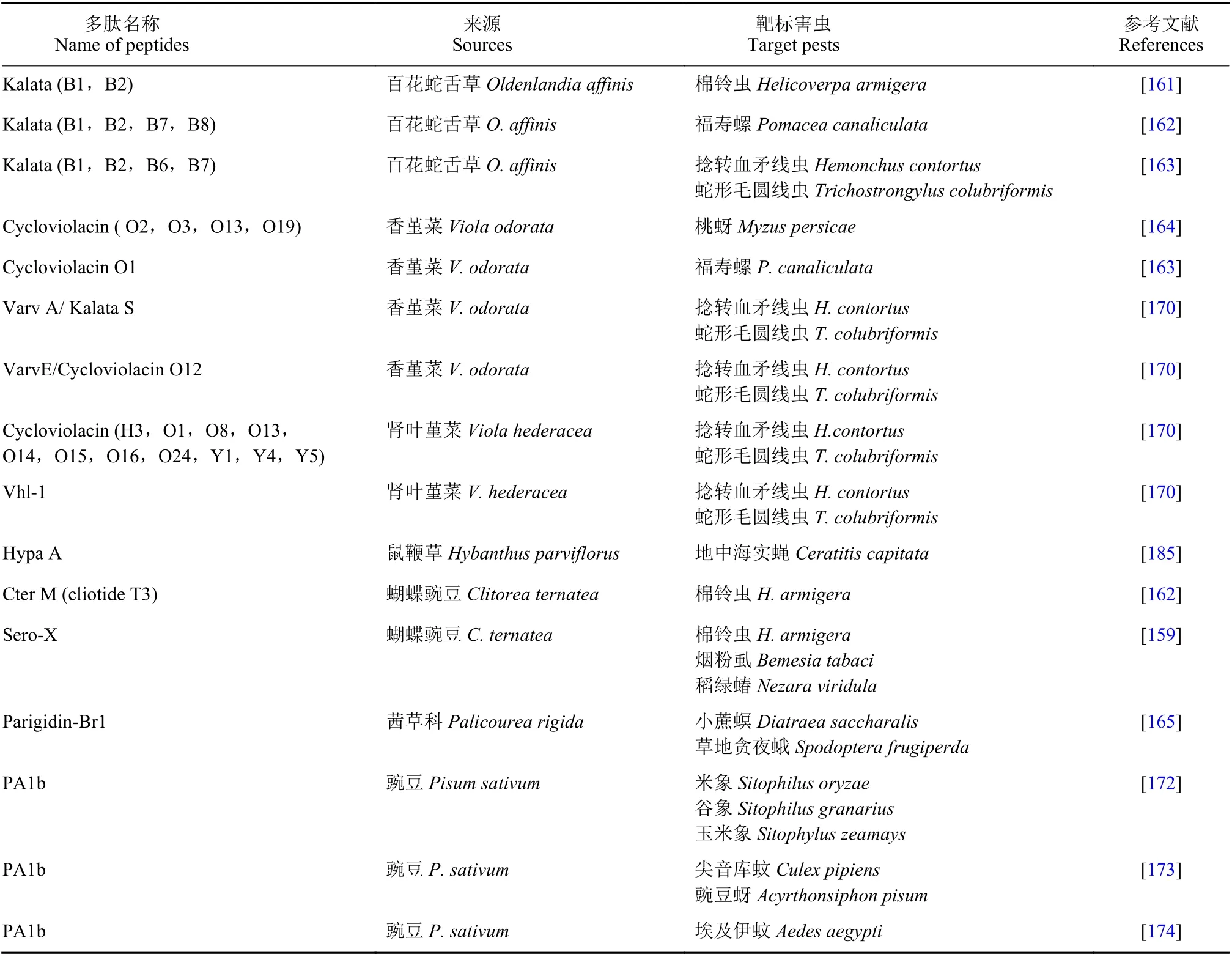
表2 不同植物来源的杀虫活性多肽及其作用的主要靶标害虫Table 2 The insecticidal peptides from different plants and their main target pests
续表2Table 2 (Continued)
4 源于微生物的杀虫活性多肽
微生物源多肽是一类重要的活性物质,主要来源于真菌和细菌,具有丰富的化学结构和生物活性。早在1939 年,杜博斯 (René Jules Dubos)在微生物中发现短杆菌肽具有良好的抗菌作用,此后许多学者在微生物中发现具有多种功能的多肽[186]。笔者以‘microbial peptides’为检索词在SciFinder 数据库进行检索发现,近30 年发表微生物多肽的相关文献量有18 248 篇。这些微生物多肽按照其功能可以分为8 类,分别为抗真菌、抗细菌、抗病毒、抗癌、抗藻、免疫抑制、抗疟疾以及杀虫活性等 (图3)。统计结果表明,微生物多肽的作用以抗细菌、免疫抑制、抗病毒以及抗真菌为主,占比达90%,而有关微生物杀虫肽的报道非常少,仅占3%。但随着粮食需求的增加以及全球提倡绿色农药的大背景下,有关微生物杀虫肽的研究会逐渐成为研究热点。
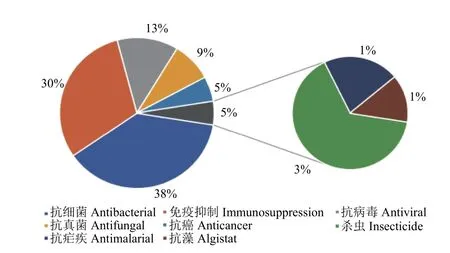
图3 不同功能微生物多肽的发文量占比(1992—2022 年,数据源自Scifinder 数据库)Fig. 3 Proportion of publications about microbial peptides with different functions from 1992 to 2022
已有文献报道,一些源自真菌的多肽具有良好的杀虫活性。例如,绿僵菌的代谢产物-绿僵菌素是由5 个氨基酸和1 个羧基酸残基形成的一类六元环缩肽化合物[187],目前已经被广泛用于防治鳞翅目、同翅目、双翅目、等翅目、直翅目和鞘翅目等多种昆虫。Mochizuki 等[188]从白僵菌中提取到的Beauveriolide I 可以杀死斜纹夜蛾Spodoptera litura和绿豆象Callosobruchus chinensis,杜丰玉[189]等发现来自白僵菌的另一种菌株Beauveria felinaEN-135 中的环肽iso-isariin D 具有杀虫活性。周立刚课题组[190]综述了635 种真菌环二肽(也称2,5-二酮哌嗪类),并根据其生物合成起源和结构特征把这些环二肽分为6 类:色氨酸-脯氨酸、色氨酸-色氨酸、色氨酸-Xaa (Xaa 表示为未指定的氨基酸)、脯氨酸-Xaa、非色氨酸-非脯氨酸和硫代类似物,并分别介绍了其结构和生物活性,其中部分化合物对谷实夜蛾Helicoverpa zea有较好活性。此外报道了缩羧酸环肽 (cyclic depsipeptides,CDPs)如环状三肽、环状四肽、环状五肽等的相关研究进展,并介绍了其杀虫 (如斜纹夜蛾Spodoptera litura、绿豆象Callosobruchus chinensis等) 活性的相关探索[191]。
一些源于细菌的多肽也具有良好的杀虫活性,例如, Mohamed 等[192]发现长枝木霉菌株Trichoderma longibrachiatumRIFAI 的2 种线性肽longibrachin A-I 和longibrachinA-II-b 可以杀死红头丽蝇Calliphora vomitoria。来自链霉菌属Streptomyces laindensisH008 的多肽 SLP1 具有杀死菜缢管蚜Lipaphis erysimi的活性[193]。Moreira等[194]发现芽孢杆菌中提取到的表面活性素家族的2 种环肽pumilacidin 和pumilacidin C 对埃及伊蚊Aedes aegypti有良好的活性。最近,Vestaron 公司以苏云金芽孢杆菌库斯塔克亚种 (Bt kurstaki strain) EVB-113-19 株系为活性成分开发上市的Bt 生物杀虫剂Leprotec®,在美国50 个州均获得了登记。该产品为液态剂型,可有效防治多种大田或温室作物的鳞翅目害虫,其与Spear®-Lep 联合使用效果更理想。
5 天然杀虫肽的应用开发
天然杀虫肽在实际应用中存在一些局陷性:1) 天然杀虫肽的稳定性差,易被昆虫体内的一些酶降解,也会受到外界环境条件(如温度、光照、湿度)的影响。2) 一些天然杀虫肽的生物活性较弱,或具有一定的毒性。3) 部分杀虫肽生产成本较高,影响市场竞争力。因此,将天然杀虫活性肽开发为杀虫剂需要综合考虑其田间稳定性、生物利用度、施用方法、安全性、生产成本等多方面因素,如基于其合成成本及稳定性差等问题,可以从生产合成 (化学合成、生物合成) 及性能优化(模拟肽技术的结构优化、剂型优化、递送系统优化) 等方面进行改良,基于天然杀虫肽的安全性,需要评估其对人类和其他脊椎动物、以及其它非靶标生物 (如传粉媒介昆虫和目标害虫的天敌) 的安全性等。
5.1 生产合成
天然杀虫活性肽的生产合成以化学合成以及生物合成途径为主。
5.1.1 化学合成 多肽化学合成主要通过氨基酸缩合反应来实现,其可以分为固相合成和液相合成,目前多以固相合成来制备杀虫活性肽。1963年,Merrifield 首次提出了固相合成多肽方法,并因此获得1984 年的诺贝尔化学奖[195]。研究最多的环肽kalata B1,目前已使用SPSS 方法有效合成[196]。此外,具有杀虫活性的昆虫神经肽类似物等均使用SPSS 的方法进行合成。值得注意的是,使用SPPS 方法合成的肽不宜超过50 个氨基酸残基,若肽链过长会导致低产率和低纯度[197]。
5.1.2 生物合成 多肽的生物合成方法主要包括发酵法和基因工程法。Narayani 等[196]介绍了利用微生物系统 (如大肠杆菌系统、酵母菌系统) 以及基于植物系统 (植物本身、植物细胞与组织培养物) 合成环肽的生物技术。Rivera-de-Torre 等[18]报道了动物毒素的异源表达、合成及纯化的多种方法。已经商品化的Spear®杀虫剂是经乳酸克鲁维酵母发酵生产,其成本可以与市场现有杀虫剂相媲美[3]。因此使用合成生物学或微生物发酵的方法代替传统的多肽固相合成方法来制备多肽杀虫剂,是值得深入研究的方向。生物合成方法原料虽然具备来源广泛和成本低等优点,但也存在一些技术不成熟,存在不易分离、产率低等问题[197],目前仍处于发展阶段。
5.2 性能优化
目前主要通过模拟肽技术或基因工程技术的结构优化、剂型加工技术、递送系统优化等措施来改善天然杀虫活性多肽的稳定性和提高其生物利用度等。
5.2.1 天然杀虫活性多肽的结构优化 对杀虫活性多肽进行化学修饰或改性可以提高其生物活性和药效稳定性,如天然昆虫神经肽易受温度、pH 等因素的影响。因此,国内外诸多团队 (如Nachman 团队、杨新玲团队、董守良团队等) 通过对天然昆虫神经肽进行化学结构的修饰改造,从而得到稳定性与活性都显著提高的模拟肽化合物[77-87]。此外,通过基因工程技术对天然多肽进行修饰也可以获得更高活性和稳定性的多肽,如美国韦斯塔隆公司(Vestaron Corporation)采用基因工程技术将甘氨酸-丝氨酸二肽的核苷酸密码子添加至天然蜘蛛毒肽ω/κ-HXTX-Hv1a 的基因序列,最终发现了兼具化学杀虫剂的有效性和生物制品的低风险性的多肽杀虫剂GS-ω/κ-HXTX-Hv1a (商品名Spear®),有望为农业和公共卫生领域害虫防控提供一种持续有效的绿色新工具[198]。
5.2.2 剂型优化 将天然活性肽设计成不同剂型,可以提高药剂的使用效果和使用价值,并达到提高稳定性、延缓抗性、降低毒性、减少环境污染、降低成本等效果。通过改进剂型 (如增添具有分散、润湿和稳定等作用的功能性助剂) 的方法促进多肽透过害虫表皮进入体内与靶标位点结合,增强药效稳定性 (如抗光解、耐雨水冲刷等性能)[198]。
5.2.3 递送系统优化 药物递送系统 (Drug Delivery System,DDS) 可以将适量的药物递送到正确的位置,从而增加药物的利用效率,提高疗效,减少毒副作用,降低成本。Nakasu 等[199]将杀虫活性肽融合到植物凝集素或病毒外套蛋白中,杀虫肽的利用率和杀虫活性得到提高。Herzig 等[200]使用转基因昆虫病原体 (例如杆状病毒,苏云金芽孢杆菌或绿僵菌) 来输送杀虫毒素,其在感染昆虫的同时可以表达杀虫毒素,从而显示出协同杀虫作用。因此,今后可以利用生物融合、昆虫病原体等方法改善天然杀虫活性肽的活性。此外,可以开发与其它作用机制的生物农药或化学农药的复配,通过不同作用机制的活性成分协同发挥增效作用、扩大杀虫谱和延缓害虫抗药性。
5.3 安全性评价
杀虫剂的开发、生产及使用的整个过程中都需要进行安全性评价,包括其使用情况、理化性质、环境行为特征以及对非靶标生物的毒性,其中对非靶标生物的毒性是安全性评价的重要指标,杀虫多肽也不例外。动物毒液是由多肽、蛋白质等多种物质组合而成的混合物,这些毒液具有一定的毒性,但并不一定意味着它们会对人类产生影响[18]。杀虫活性多肽是从毒液分离出的一种或几种化合物,安全评价研究发现这些杀虫肽对蜂、鸟、鱼、蚕等非靶标生物是安全的[20-21,33,159,180]。另一方面,天然杀虫肽由氨基酸缩合而成且其半衰期较短,能够在环境中快速降解为氨基酸而不会达到对非靶标生物产生风险,例如,源于蜘蛛毒液的商品化Spear®杀虫剂的急性毒性试验结果表明,其在最高施用剂量下对哺乳动物、环境生物 (蜜蜂、家蚕) 及水生生物无显著影响,高剂量(896.7 g/hm2) 未观察到对植物出苗和营养活力的毒害作用[188]。此外,Grover 等[158]发现具有杀虫活性的植物环肽 (如cycloviolacin O1、kalata B1、kalata B2、kalata B7 等) 具有低溶血毒性和低细胞毒性。
6 总结及展望
随着世界人口的日益增长,耕地面积的急剧减少,全球气候的恶化,提高单位面积农作物产量是保障粮食安全的重要策略。农药的使用可以大幅度减少因病、虫、草害所造成的损失,保障了农作物安全,在农业生产中做出了巨大贡献。但由于人们对传统农药的不合理使用以及其自身固有的一些缺陷,导致环境污染、害虫抗药性的产生以及影响非靶标生物等一系列问题,阻碍了农业的可持续发展。多种来源于动物、植物或微生物的多肽物质具有开发为生物杀虫剂的潜力,其具有高效低毒、在环境中降解为氨基酸、对非靶标生物安全等优点,是极具应用前景的绿色防控手段。针对杀虫活性肽合成成本和稳定性问题,深化天然杀虫活性肽的生产合成、提高天然杀虫多肽的生物活性、创制新农药等方面的创新性研究显得尤为重要。
寻求农药减量、发展高效低毒环保的生物农药已是全球趋势。杀虫活性多肽作为一种高效低毒、无残留、且对人畜安全的一类生物农药,有益于保护生态平衡、保证农业的可持续发展。随着分子生物学、生物化学、合成生物学以及基因工程等技术的飞速发展,将会极大地推进天然活性肽的产业化发展。相信在未来的可持续农业生产中,杀虫活性多肽一定会成为防治害虫的重要手段之一,在植物保护中发挥重要作用。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

叶德兴,男,硕士研究生。2021年6 月在山东农业大学制药工程(农药方向) 专业获工学学士学位。2021 年9 月至今在中国农业大学理学院农药学专业攻读硕士学位,主要从事多肽类农药的创制及其作用机制的研究。

杨新玲,教授,博士生导师,绿色农药分子设计与发现团队负责人。1995 年于北京农业大学农药学专业获得理学博士学位。1995年至今在中国农业大学从事教学科研工作,研究领域为新农药分子设计与合成、化学生物学,主要研究方向包括靶标导向的新型昆虫生长调节剂的创制、以昆虫源或植物源活性物质为模型的新型害虫行为控制剂研究等,先后主持或参加国家自然科学基金、国家科技支撑计划、973 计划、农业部公益行业项目、国家重点研发计划等课题10 余项。曾获IUPAC 农药化学‘农药科学特殊贡献奖’,现任北京农药学会副理事长兼秘书长,中国农药工业协会知识产权专业委员会副主任委员,中国化工学会农药专业委员会委员,中国化学会农业化学专业委员会委员,中国生化制药工业协会多肽分会专家委员会委员等。担任Pest Management Science等期刊编委,现任《农药学学报》常务编委。
