假禾谷镰孢引起的小麦茎基腐病发生危害与防控研究进展
2022-10-25李怡文李桂香黄中乔苗建强刘西莉
李怡文, 李桂香, 黄中乔, 苗建强*,, 刘西莉*,,
(1. 西北农林科技大学 植物保护学院,陕西 杨凌 712100;2. 中国农业大学 植物保护学院,北京 100193)
茎基腐病又被称作小麦冠腐病 (wheat crown rot)、旱地脚腐病 (dryland foot rot)、镰刀菌脚腐病(Fusarium foot rot)、旱地根腐病 (dryland root rot)和镰刀菌根腐病 (Fusarium root rot),是生产中具有毁灭性的土传病害之一[1]。该病害近年来在我国河南、河北、山东、陕西、安徽、江苏等多省均有发生。随着种植制度和耕作方式变更,该病害呈逐年快速加重的趋势,尤其是在小麦-玉米轮作、秸秆还田较多的黄淮麦区发生普遍,已成为我国小麦生产中的主要病害之一,对粮食安全生产构成重大威胁。病害的发生不仅导致小麦产量的下降,而且还会产生严重的毒素污染问题,使小麦品质下降,对人畜健康具有潜在威胁。2022 年中国科协已将“小麦茎基腐病近年为什么会在我国小麦主产区暴发成灾,如何进行科学有效地防控?”列入我国十大产业技术问题之一[2]。
目前,国内外有关学者从不同方向和领域对该病害进行了相关研究,以期寻找有效的管理策略。本文拟对小麦茎基腐病的发生和危害现状、病原菌生物学特点、致病机制和产毒特征、控制茎基腐病发生的相关措施及多种防病减毒方法进行系统概述,以期为科学防治小麦茎基腐病以及保障粮食和饲料安全提供参考。
1 小麦茎基腐病的危害、病原及发生原因
1.1 小麦茎基腐病发生及危害现状
小麦茎基腐病发生范围广,在世界上多个国家和地区都有分布,包括澳大利亚昆士兰和新南威尔士州北部[3-4]、美国俄勒冈州和华盛顿州[5]、新西兰[6]、智利[7]、阿根廷[8]、伊拉克[9]、土耳其[10]、阿尔及利亚[11]、阿塞拜疆[12]等。小麦茎基腐病的主要症状见图1,表现为小麦茎基部呈褐色 (图1 A),可上升至3~5 节,形成典型的“酱油杆” (图1 AB);在发病节间产生白色或粉色霉层 (图1 BC),茎秆内腔布满菌丝;根部变褐 (图1 D),节间呈褐色坏死,易折断;小麦灌浆期严重发病株产生失水状枯死和白穗 (图1 EF),造成籽粒干瘪,甚至无籽[13-14]。

图1 小麦茎基腐病症状Fig. 1 Fusarium crown rot (FCR) symptoms caused by Fusarium pseudograminearum on wheat
2009 年有相关学者报道,澳大利亚北部地区由假禾谷镰孢引起的茎基腐病导致谷物减产超10%[15]。2011 年,我国首次在河南省小麦-玉米轮作田中发现由假禾谷镰孢引起的小麦茎基腐病[16]。近年来,小麦茎基腐病在我国黄淮麦区和华东麦区广泛蔓延,导致小麦产量和品质下降的同时经济损失也逐年加重。据统计,河南省2013—2016 年由小麦茎基腐病引起的小麦产量损失已达38.0%~61.3%[14]。2017—2021 年因茎基腐病造成的河南省小麦年均减产3.6 万吨,最高年份减产4.4 万吨[17]。2015 年,通过对河北省中南部小麦产区病害调查发现,接近50%的茎基腐病发生地块的枯白穗率达1%~10%,病害发生严重地块出现了成片枯白穗现象[18]。2020 年,山东省小麦茎基腐病的发生面积已达80 万公顷[19]。小麦茎基腐病发生症状隐蔽性强,田间多见与小麦根腐病/全蚀病一起发生,侵染时期较长,发病高峰通常在灌浆期。该土传病害防治难度大且危害损失严重。目前我国河南、河北、山东和陕西4 省已陆续将小麦茎基腐病列入二类农作物病虫害目录进行预警和防控。
1.2 小麦茎基腐病病原镰孢菌种群结构
引起小麦茎基腐病的主要病原菌是假禾谷镰孢Fusarium pseudograminearum,有性态为Gibberella coronicola[20],其次为禾谷镰孢F. graminearum、黄色镰孢F. culmorum和亚洲镰孢F. asiaticum[21-22]。这些镰孢菌可侵染小麦和大麦的茎、茎基部和根部,引起坏死和干腐[23]。Gebremariam等[10]从茎基腐病样中分离到假禾谷镰孢F. pseudograminearum和多种镰孢菌,包括黄色镰孢F. culmorum、禾谷镰孢F. graminearum、木贼镰孢F. equiseti、锐顶镰孢F. acuminatum、燕麦镰孢F. avenaceum、尖孢镰孢F. oxysporum、层出镰孢F. proliferatum、腐皮镰孢F. solani、三线镰孢F. tricinctum、F. brachygibbosum、F. hostae、F. redolens、F. torulosum、F. flocciferum、F. incarnatum和F. reticulatum等。但这些镰孢菌通常被认为是次级定殖的腐生菌,而不是主要病原菌[24]。值得注意的是,小麦茎基腐病主要由多种镰孢菌侵染所致,而普通根腐病 (common root rot) 则由单一的病原真菌麦根腐平脐蠕孢Bipolaris sorokiniana(有性态Cochliobolus sativus) 引起[25]。
不同地区引起小麦茎基腐病的优势病原菌可能不同。据报道,澳大利亚东南部小麦茎基腐病优势病原菌是假禾谷镰孢[26];对土耳其小麦主产区2013 年的茎基腐病病样进行病原菌分离鉴定,发现优势病原菌是黄色镰孢,其次为假禾谷镰孢和禾谷镰孢[10];Moya-Elizondo 等[7]对智利南部小麦茎基腐病原菌分离鉴定,发现燕麦镰孢、禾谷镰孢和黄色镰孢分离比例较高;Zhang 等[27]分离鉴定了来自我国5 个省份 (江苏、安徽、河南、河北和山东) 的小麦茎基腐病病原菌,发现优势病原菌为亚洲镰孢和禾谷镰孢,而假禾谷镰孢仅占很小比例;但Zhou 等[28]报道,2013—2016 年间黄淮麦区冬小麦茎基腐病优势病原菌为是假禾谷镰孢,其次为禾谷镰孢,层出镰孢、木贼镰孢和F. sinensis;Deng 等[29]对2014—2016 年山东、江苏两省小麦茎基腐病原菌进行了分离鉴定,发现山东省小麦茎基腐病优势病原菌为假禾谷镰孢,而江苏省则主要为假禾谷镰孢和亚洲镰孢。朱运启等[30]研究表明,引起陕西省小麦茎基腐病的优势病原菌为假禾谷镰孢,其次为禾谷镰孢、三线镰孢和层出镰孢。范学锋[22]对我国不同麦区引起小麦茎基腐病的病原菌进行了系统的分离鉴定,发现西南麦区优势病原菌为禾谷镰孢,其次是亚洲镰孢;长江中下游麦区 (湖北、安徽和江苏) 优势病原菌为亚洲镰孢,其次是禾谷镰孢和假禾谷镰孢;北方冬麦区 (河南、河北、山东、山西和陕西) 优势病原菌是假禾谷镰孢;河套春麦区 (内蒙古巴彦淖尔和宁夏地区) 优势病原菌为假禾谷镰孢和黄色镰孢。综合分析发现,近年来假禾谷镰孢已逐年上升为我国北方小麦主产区茎基腐病的优势病原菌。
此外,研究发现镰孢菌的种群分布很大程度上受到气候条件的影响,比如:假禾谷镰孢在低降水量地区分布频率更高[31],且喜温暖的环境[32];黄色镰孢喜冷凉,亚洲镰孢和禾谷镰孢更喜温暖湿润的环境[32]。尽管假禾谷镰孢和禾谷镰孢均能侵染小麦茎基部引起茎基腐病,但假禾谷镰孢的致病力更强[24,31]。
1.3 假禾谷镰孢侵染循环及遗传多样性
1.3.1 假禾谷镰孢的侵染循环 假禾谷镰孢以菌丝和孢子 (分生孢子、厚垣孢子和子囊孢子) 形式在植物病残体上越冬。通常认为菌丝和孢子都可作为初侵染来源,田间厚垣孢子较少见,当环境条件适宜时,通常在小麦灌浆期可见黑色颗粒的子囊壳[13,33]。
病原菌通常首先侵染小麦胚芽鞘,进入根茎节间和叶鞘,随后进入茎表皮组织,通过气孔穿透组织,移动到下皮层和维管束组织,引发茎部形成典型的褐变坏死症状[34]。假禾谷镰孢侵染小麦茎基部后,也可以进一步通过髓薄壁组织移动到穗部[35]。早衰的茎杆中病原菌菌丝会不断增加,侵染木质部后转移至韧皮部,影响植物体内水分和营养运输,这也是“白穗”症状形成的主要原因[36]。已有报道表明,假禾谷镰孢不仅可以引起小麦茎基腐病,还可以引起小麦赤霉病 (Fusarium head blight, FHB),在澳大利亚和我国河北省部分地区,均已从赤霉病小麦病穗分离获得了该病原菌[3,37-38],但目前发现引起小麦赤霉病的镰孢菌群体中假禾谷镰孢所占比例较小。此外,假禾谷镰孢还可以侵染玉米引起玉米苗腐病[39],也可侵染大麦、燕麦和苜蓿属等作物[40]。
1.3.2 假禾谷镰孢的系统发育和遗传多样性 假禾谷镰孢是单一的系统发育种,与禾谷镰孢具有共同的祖先[41]。Burgess 等[42]将根据形态学和培养条件无法区分的禾谷镰孢复合种Fusarium graminearumSchwabe 命名为Group 1 和Group 2 两个类群,其中Group 1 的有性生殖为异宗配合,而Group 2 为同宗配合。随后,Group 1 被命名为假禾谷镰孢,其有性态为G. coronicola,交配型为MAT-1 和MAT-2 两种类型,属半活体营养型病原菌。其在形态上与禾谷镰孢没有明显差异,菌落颜色为红色、暗红色至红白色或灰褐色、棕黄色至白色,其边缘完整或呈波状。两者的分生孢子大小存在较小差异,假禾谷镰孢分生孢子中间位置最宽,而禾谷镰孢分生孢子最宽处是从顶端起的第1/3 至2/5 处[43]。据国外早期相关报道,对不同地区关于交配型调查结果表明,假禾谷镰孢群体中有性繁殖并不频繁。澳大利亚部分地区假禾谷镰孢两种交配型比例失衡,甚至交配型 MAT-1 和MAT-2 接近1 : 9,但也发现一些地区交配型比例接近1 : 1[44-45]。在一些小麦茎基腐病发生严重地块,田间很容易发现假禾谷镰孢产生的子囊壳,并且形成大量成熟的子囊孢子[33]。
相关研究发现,不同地区假禾谷镰孢群体间可能存在较高水平的遗传多样性。贺小伦等[46]对我国河南和河北省冬小麦区6 个地理群体小麦茎基腐病的优势病原菌假禾谷镰孢遗传多样性进行分析,发现河南北部地区假禾谷镰孢种群和河南东部地区种群遗传距离最近,河南南部地区假禾谷镰孢种群和河南东部地区种群的遗传距离最远,并且不同地理群体的假禾谷镰孢菌株间存在较大的基因流动。Khudhair 等[44]对澳大利亚小麦种植带16 个地区的假禾谷镰孢遗传多样性进行了分析,发现澳大利亚东部地区和西部地区的群体相互独立,新南威尔士州、南澳和西澳的假禾谷镰孢种群遗传多样性也普遍不同。其他一些地区间的假禾谷镰孢种群也存在不同遗传多样性[47-48]。此外,不同群体间可能存在随机交配和基因流动[46,48]。多项研究表明,假禾谷镰孢群体内遗传多样性水平高于群体间的遗传多样性水平[45-46,48]。不同地区假禾谷镰孢种群间的遗传差异也会影响未来不同地区的小麦茎基腐病防控管理策略的制定。
1.4 小麦茎基腐病发病条件及成因
相关学者分析,我国黄淮麦区茎基腐病大面积发生和流行的原因可能与栽培模式、品种抗性、土壤条件、降雨量和秸秆还田导致的土壤中病原菌量的积累等多种因素有关。小麦茎基腐病在干旱和半干旱地区发生较重,与土壤水分条件也密切相关[49]。温暖潮湿的条件有利于病原菌的侵染,播种时潮湿、成熟前干旱的条件会加重该病害的发生[18]。小麦茎基腐病发生严重度与降水量和湿度也密切相关,苗期水分充足和生长后期水分不足的情况下发病更严重[50]。田间病害调查发现,土壤干旱的地块容易发生小麦茎基腐病,而且同一田块中,干旱区域较不干旱的区域茎基腐病的发生更为严重[14]。进一步研究证明,干旱胁迫会影响假禾谷镰孢菌丝量的积累和侵染模式。病原菌初侵染阶段在水分充足条件下病害发生更严重,但在茎基腐病发生中后期,干旱胁迫会增加大麦体内病原菌的繁殖、气孔中菌丝的扩展和再侵染,导致病害症状更为严重[51]。
目前还不太清楚干旱胁迫为何会增强茎基腐发病严重度,推测假禾谷镰孢侵染诱导的寄主相关基因与抗旱性之间可能存在一定关联[52]。多年以来,我国北方地区以玉米-小麦连年轮作种植模式为主。秸秆还田虽然有利于提高秸秆资源利用率,改善了土壤有机质等指标,但同时也为病原菌存活和繁殖提供了适宜条件,导致田间病原菌数量不断增加。有研究表明,玉米秸秆还田处理的小麦茎基腐病的病情指数明显高于未还田地块,而连续的玉米秸秆还田地块,小麦茎基腐病表现为逐年加重[53]。总之,土壤中病原菌的大量积累,加之主栽品种抗病性差、土壤盐碱化严重和小麦生长后期干旱少雨等条件,会加速小麦茎基腐病的严重发生。
2 假禾谷镰孢的致病机制
虽然假禾谷镰孢与禾谷镰孢亲缘关系较近,但致病机制仍存在差异。假禾谷镰孢除了产生毒素外,还能产生多种其他具有生物活性的次生代谢产物,包括细胞分裂素类化合物fusatin、多聚乙烯类(PKs)和小非核糖体多肽(NRPs)等,这些物质有利于增强病原菌致病力或病害症状的发展[54]。近年来,相关学者围绕假禾谷镰孢的致病机制也取得了一些进展。例如:非核糖体多肽基因FpNPS9缺失突变体可降低假禾谷镰孢致病力和脱氧雪腐镰刀菌烯醇 (DON) 含量[55]。C2H2锌指转录因子参与假禾谷镰孢的生长、产孢和致病性[56-57]。FpCzf7的缺失导致假禾谷镰孢的菌丝生长、分生孢子产生、致病性和DON 毒素产生均明显降低[56];而FpCzf14主要在分生孢子产生中起到关键作用[57]。编码A 组转录因子APSES 同源蛋白的FpAPSES1和FpAPSES4对假禾谷镰孢的菌丝生长、分生孢子产生和致病力均具有重要作用,并且二者都可在假禾谷镰孢侵染阶段高表达,调控假禾谷镰孢DON 毒素的合成[58]。螺旋-环-螺旋结构转录因子FpbHLHs与假禾谷镰孢致病力密切相关,FpbHLH9敲除突变体显著降低假禾谷镰孢对小麦感病品种的致病力[59]。编码亮氨酸拉链蛋白bZIP 转录因子Fpkapc定位于假禾谷镰孢细胞核,参与调节碳代谢、细胞周期、离子结合和运输、氧化胁迫,以及DON 合成等相关基因的表达,对假禾谷镰孢生长发育和致病性至关重要。F p k a p c的缺失突变体与野生型假禾谷镰孢DON 含量基本一致,但会诱导多个TRI相关基因表达[60]。FpAda1也能调控假禾谷镰孢菌丝生长、分生孢子产生、致病性和细胞周期[61]。编码热激蛋白的基因Hsp70s与假禾谷镰孢致病性相关,其中敲除定位于内质网的FpLhs1,可降低假禾谷镰孢菌丝生长、孢子产生和致病力[62]。FpHsp104在假禾谷镰孢耐热性、致病力和生长发育方面具有重要影响,其敲除突变体对高温更敏感,且致病力减弱,而DON 含量并不受影响[63]。苯并噁唑酮(benzoxazolinone) 是禾本科植物防御性化合物,与抗病性密切相关。已有研究表明,假禾谷镰孢的侵染会诱导小麦体内2-苯并噁唑酮 (BOA) 和6-甲氧基-2-苯唑啉酮 (MBOA) 含量显著增加,并且无论在活体还是离体条件下,BOA 和MBOA 对假禾谷镰孢均具有良好的抑制作用[64]。但假禾谷镰孢也进化出相应机制降解寄主防御物质,其通过苯并噁唑啉酮分解代谢中的关键酶来抵御寄主分泌的防御性化学物质。比如:编码γ-内酰胺酶(γ-lactamase) 的FDB1对BOA 的降解是至关重要的[65];编码N-丙二酰转移酶 (N-malonyltransferase)的FDB2对降解MBOA 和BOA 是必须的[66]。对假禾谷镰孢致病机制的深入研究有利于为病害防控及镰孢菌的遗传分化提供理论依据。
3 假禾谷镰孢引起的小麦毒素污染及解毒途径
3.1 假禾谷镰孢产毒类型及小麦体内毒素分布
国内外研究表明,假禾谷镰孢在侵染小麦的过程中会产生一系列次生代谢物,尤其是单端孢酶烯族类 (trichothecene) 真菌毒素[54]。假禾谷镰孢产生的毒素类型包括 DON、3-乙酰化脱氧雪腐镰刀菌烯醇 (3ADON)、15-乙酰化脱氧雪腐镰刀菌烯醇 (15ADON) 和雪腐镰刀菌烯醇 (NIV)[6,44-45]。Fan 等[67]和徐飞等[68]在发生茎基腐病的小麦茎秆中检测到DON 毒素及其衍生物3ADON 和15ADON、玉米赤霉烯酮 (ZEN)、隐蔽型真菌毒素脱氧雪腐镰刀菌烯醇葡萄糖苷 (D3G) 及NIV。DON 化学性质稳定,能通过食物链传递,对人和动物有毒,中毒症状主要为恶心、呕吐、腹泻和腹痛等,并可致癌、致畸[69]。DON 对于假禾谷镰孢从植物茎基部向上扩展的过程是必须的,也是假禾谷镰孢引起茎基腐病的重要致病因子[70]。已有报道表明,假禾谷镰孢在小麦茎基部的致病力高于穗部,且在茎部产生的DON 含量更多,而禾谷镰孢在穗部产生的DON 含量远高于假禾谷镰孢[71]。在小麦植株中,高浓度DON 会诱导活性氧 (ROS) 的产生,伴有褪绿和坏死症状,根系生长也会受抑制[64]。
不同地区假禾谷镰孢产生毒素的类型存在差异。Deng 等[29]对2014—2016 年获得的假禾谷镰孢毒素化学型进行鉴定,发现采集于江苏省的假禾谷镰孢主要产生3ADON 化学型毒素,而山东省则以15ADON 毒素化学型为主。在澳大利亚东部、西部和南部地区检测到的假禾谷镰孢产毒类型均为3ADON[44],仅检测到极少量菌株产生的毒素类型为15ADON[45]。有研究表明,新西兰的假禾谷镰孢产毒素类型为DON 和NIV[6]。
假禾谷镰孢引起小麦茎基腐病会导致小麦茎秆中毒素的积累,毒素主要分布在第3 茎节以内,部分小麦第4~5 茎节也能检测到较高水平的毒素,仅有微量的毒素被转移到麦粒中[67]。我国每年有大量小麦秸秆用于饲料生产,发病严重的小麦秸秆用于饲料生产存在一定的毒素污染风险,受食物链的传递对人类和动物健康也具有潜在危害。
3.2 调控DON 毒素生物合成的生化途径
已有研究报道了DON 合成的具体过程,受多个编码单端孢霉烯族毒素合成酶的基因调控,从法尼焦磷酸 (FPP) 经过多个步骤最终合成DON[72-74]。据报道,DON 也是假禾谷镰孢产生的次生代谢产物,而糖酵解途径是多种次生代谢产物合成途径的上游途径,为DON 毒素的生物合成提供原料[75-76]。法尼焦磷酸 (FPP) 是DON 生物合成途径的前体,通过异戊二烯生物合成途径由乙酰-CoA 合成。糖酵解途径生成的丙酮酸通过丙酮酸脱氢酶转化为乙酰-CoA。丙酮酸和乙酰-CoA是DON 合成的主要前提物质[77]。其中葡萄糖是糖酵解途径的初始底物,为丙酮酸的合成提供原料[78],而丙酮酸对镰孢菌DON 毒素的生物合成起正调控作用。己糖激酶是糖酵解途径的关键酶,调控丙酮酸的合成,是DON 毒素生物合成的限速酶[77]。糖酵解途径生成的丙酮酸,继而经历柠檬酸循环和氧化磷酸化形成二氧化碳和水。丙酮酸转变为乙酰-CoA 是进入三羧酸循环TCA 循环的准备阶段。总的来说,DON 毒素的合成会受到上游糖酵解途径、异戊二烯途径、TCA 循环及DON 毒素生物合成等途径的影响 (图2)。
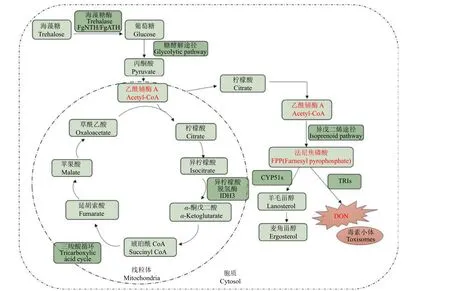
图2 DON 生物合成相关途径Fig. 2 Diagram of biochemical pathway involved in DON biosynthesis
D O N 关键生物合成酶定位于毒素小体(toxisomes) 上,毒素小体是由内质网网状结构衍生而来的,在毒素诱导条件下,TRI1 可以被传递到毒素小体。毒素小体的形成对于病原菌自身DON的合成至关重要。
3.3 植物病害防控中DON 的解毒方式及机制
培育抗病品种是防治小麦茎基腐病的有效手段之一,也是防止谷物毒素污染的根本措施。DON的真菌衍生物主要是3ADON 和15ADON,而植物衍生物主要是DON-3-β-D-葡萄糖苷(D3G),由葡萄糖偶联在DON 的C3 上[79]。植物尿苷二磷酸(UDP) 依赖的糖基转移酶 (UGTs) 糖基化DON 为低毒的D3G,是寄主小麦主要的解毒策略之一[70,80-81],如He 等[82]在苏麦3 号中克隆并鉴定了一个赤霉病诱导高表达的新基因TaUGT6,其编码蛋白可以糖基化DON 为D3G,进而通过降低DON 含量和毒性来提高赤霉病抗性。与此同时,小麦对假禾谷镰孢的抵御能力不同,植株体内的DON 积累量也不同。有研究发现,检测接种假禾谷镰孢的小麦植株内代谢物,发现小麦体内DON 被诱导,且抗性较高小麦体内菌丝量和DON 含量低于感病品种[64]。
由于目前仍缺乏抗病品种,使用化学杀菌剂仍是防控镰孢菌病害的有效方法。不同作用机制杀菌剂对DON 合成影响不同,并且长期大量使用单一杀菌剂导致病原菌抗药性的发生,也会改变镰孢菌产生的DON 含量。有研究表明,一定剂量的化学杀菌剂可以诱导DON 合成,如苯并咪唑类杀菌剂多菌灵,三唑类杀菌剂氟环唑、丙环唑、戊唑醇、苯醚甲环唑、氟菌唑、三唑酮、烯唑醇、丙硫菌唑和QoI 类杀菌剂嘧菌酯、唑菌胺酯、丁香菌酯、啶氧菌酯、氟嘧菌酯、烯肟菌胺等[83-87]。自20 世纪70 年代苯并咪唑类杀菌剂多菌灵用于控制小麦赤霉病,近年已发现田间抗药性菌群增加,并且抗性菌株会增加被侵染谷物中DON毒素含量[88]。多菌灵的使用也能刺激赤霉病病原菌DON 的合成,加重田间谷物毒素污染[89]。然而,氨基丙烯酸类杀菌剂氰烯菌酯能显著抑制禾谷镰孢DON 合成[90],琥珀酸脱氢酶抑制剂 (SDHIs)氟吡菌酰胺、氟酰胺、啶酰菌胺、苯并烯氟菌唑、氟唑菌酰胺可以显著抑制亚洲镰孢DON 的合成[91](表1)。
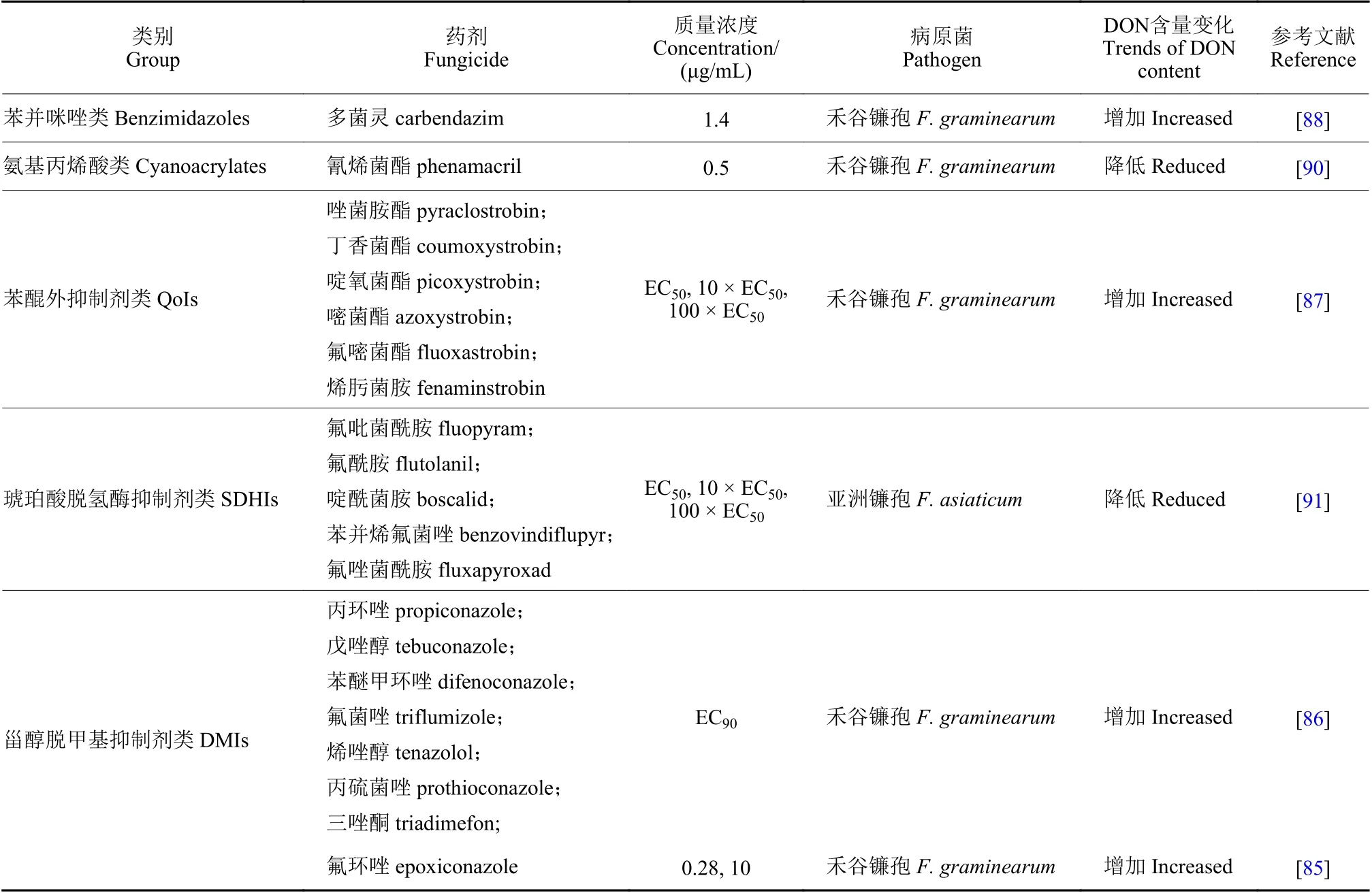
表1 杀菌剂对镰孢菌毒素合成的影响Table 1 Effect of fungicide on DON biosynthesis of Fusarium spp.
不同杀菌剂调控DON 合成的机制不同。多菌灵调控赤霉病菌DON 毒素生物合成的分子机制研究表明,多菌灵与参与TCA 循环的异柠檬酸脱氢酶 (IDH3) 能够竞争性结合β-微管蛋白,降低IDH活性;β-微管蛋白发生抗药性的单个氨基酸突变也会降低与IDH3 亲和性,导致乙酰辅酶A 积累,从而上调DON 毒素生物合成[89]。TRI5基因是编码单端孢霉烯族毒素合成途径中的第一个关键酶基因[92],对DON 毒素的生物合成具有重要的调节作用。已有研究表明,井冈霉素通过抑制禾谷镰孢海藻糖酶活性,降低中性海藻糖酶 (FgNTH)与丙酮酸激酶 (FgPK) 的互作,抑制糖酵解代谢水平和乙酰CoA 合成,并且能抑制DON合成中关键调控基因TRI5的表达,以此抑制禾谷镰孢DON 的生物合成[75,93]。由于低浓度三唑类杀菌剂能够激活病菌体内高渗透甘油 (HOG) 激酶信号途径,该途径上被激活的Hog1 激酶进入细胞核,进而磷酸化转录因子FgSR,调控FPP 上游相关基因的表达,进而增加了DON 合成,因此,低浓度的戊唑醇会刺激DON 的合成[86]。但是,最新研究表明,井岗霉素和戊唑醇可以协同防治赤霉病菌,主要归功于FgNTH 可以与CYP51B 互作,FgNTH受井岗霉素的抑制,CYP51A和CYP51B的表达量降低,进而增加了禾谷镰孢对戊唑醇的敏感性[93]。井岗霉素与叶菌唑协同使用可提高赤霉病防效并显著降低田间小麦穗部DON 的产生,但具体机制仍需进一步探究[75,93]。QoIs 杀菌剂能有效防治赤霉病,但是亚致死剂量药剂处理会增强小麦赤霉病菌DON 毒素合成能力,主要是由于QoIs 能够上调能量代谢中的乙酰辅酶A 生物合成,提供更多的次生代谢物生物合成前体,促进了赤霉病菌DON 毒素的生物合成,进而提高了毒素污染水平[87]。QoIs 杀菌剂不仅能够阻止呼吸链的电子传递,干扰能量合成,而且还能导致线粒体结构发生碎片化,破坏线粒体动态平衡,使线粒体与内质网耦合结构发生改变,从而促进了赤霉病菌产毒小体 (内质网重塑结构) 的形成[87]。SDHIs 杀菌剂可以通过抑制糖酵解途径和TCA 循环中关键酶或乙酰CoA 含量等降低亚洲镰孢DON 含量[91]。同时SDHIs 可以破坏亚洲镰孢产毒小体的形成,氰烯菌酯也可以抑制禾谷镰孢产毒小体的形成,但多菌灵会促进禾谷镰孢产毒小体的形成[90-91]。
4 小麦茎基腐病的综合防治措施
4.1 农业防治
假禾谷镰孢能以菌丝体形式在谷物和杂草的残茬上存活长达3 年之久[94]。针对该病害通常采用的农事管理措施包括轮作、间作、清除田间杂草和作物残茬等[44]。有研究已经表明,小麦连作加重茎基腐病的发生,而几种豆科作物与小麦轮作可以降低小麦茎基腐病的发生[19]。实际生产中小麦-西瓜轮作也在一定程度上可降低小麦茎基腐病的发生。此外,通过提高播种量并适期晚播、去除病残体、免留茬、旋耕改为深翻等方式也可降低田间病原菌菌量,从而减轻小麦茎基腐病的发生。同时,做好水肥管理,茎基腐病发生重的地方冬前和返青期各灌溉一次,避免苗期大水漫灌,并注意在成熟期适当浇水。
4.2 化学防治
对于假禾谷镰孢引起的小麦茎基腐病,生产上缺乏抗病品种,目前主要依靠化学药剂防治。但由于该病害是近年在在我国部分地区新暴发的病害,目前我国尚未有登记用于小麦茎基腐的防治药剂。已有多位学者采用种子处理的方式就小麦茎基腐病的防治进行了探索。部分温室试验表明,多菌灵对小麦茎基腐病防治效果良好,有效成分剂量3.90 mg/g 种子拌种处理防效可达76.66%[95]。甲氧基丙烯酸酯类杀菌剂醚菌酯有效成分为0.42 μL/2 g 种子拌种对小麦茎基腐病防治效果可达 50.33%[96]。康国强等[97]开展的小麦茎基腐病田间防效试验结果表明,25% 氰烯菌酯悬浮剂75 mL拌种 15 kg、3%苯醚甲环唑悬浮种衣剂 40 mL 拌种15 kg、10%咯菌腈悬浮种衣剂70 mL 拌种15 kg、6%戊唑醇悬浮种衣剂15 mL 拌种15 kg,对小麦茎基腐病防治效果优良,防效在76%~92%之间,并且保产效果明显。先正达公司研发的新型SDHIs杀菌剂三氟吡啶胺对小麦茎基腐病的防治效果优良。每 100 kg 种子用酷拉斯制剂 200 mL 和三氟吡啶胺 300 mL 复配处理防治小麦茎基腐病效果可达62%~82%[98]。对于以小麦秸秆作为动物饲料的地区,在使用杀菌剂防治时,应优先选择那些对病害防治效果好、且具有降低毒素产生的药剂,如氰烯菌酯、SDHIs 等;而对于小麦秸秆还田的地区,药剂选择的范围更宽。
4.3 生物防治
近年来,经大量研究筛选获得了多种具有生防潜力的微生物,既能较好抑制假禾谷镰孢生长又能有效降低小麦茎基腐病的发生严重度,对实现该病害绿色防控具有重要的意义。用于防治小麦茎基腐病的生防真菌主要包括芽孢杆菌Bacillusspp.和木霉菌Trichodermaspp.。如深绿木霉HB20111 和哈茨木霉TW21990 共培养发酵液对小麦苗期茎基腐病的防治效果优良[99];哈茨木霉拌种剂处理也能降低小麦根际镰孢菌属的相对丰度,并提高了小麦出苗率和产量[100]。枯草芽胞杆菌YB-05 菌株与申嗪霉素复配,对假禾谷镰孢引起的小麦茎基腐病具有较好的防治效果[101];贝莱斯芽孢杆菌B. velezensisYB-185 可显著抑制假禾谷镰孢菌丝生长和分生孢子萌发,YB-185 种子处理对小麦茎基腐病的室内和田间防效可达66.1%和57.6%[102];解淀粉芽胞杆菌B. amyloliquefaciens菌液拌种处理对小麦茎基腐病的田间防效可高达52.35%,并具有明显的增产作用[103]。此外,从山茱萸分离获得的内生真菌Talaromyces trachyspermus对假禾谷镰孢和禾谷镰孢均具有优异的拮抗作用,也是防治小麦茎基腐病的潜在生防菌资源[104]。丛枝菌根真菌 (AMF)Rhizophagus intraradices可以通过竞争假禾谷镰孢生态位点、增强抗氧化酶的活性以及降低脂质过氧化等多种方式,降低假禾谷镰孢种群密度,以减缓小麦茎基腐病的发生并增强寄主抗病性[105]。从小麦根部分离获得的内生放线菌吸水链霉菌Streptomyces hygroscopicusNH71 和MH243,基本上可以完全抑制假禾谷镰孢菌丝生长,且在室内条件下证明NH71 和MH243种子包衣后可降低茎基腐病的发生和减少产量损失[106]。未来生防资源的筛选和有效利用将对小麦茎基腐病的防治具有重要的意义。
5 小结与展望
近年小麦茎基腐病发生日趋严重,已成为我国小麦生产上的重大问题。抗茎基腐病小麦品种缺失,目前生产中主推的小麦品种大部分对茎基腐病表现为中感或高感,茎基腐病抗性改良极为迫切。镰孢菌作为半活体营养型病原菌,其腐生能力强,定殖后在土壤或植物病残体上存活时间长,因此,田间菌源基数的控制尤为重要。可采用深翻耕并结合生防菌剂处理的方式控制田间病原菌菌源,结合抗性改良,以及种子药剂处理的方式进行茎基腐病的长期有效防治。另外,小麦生长后期尤为重要的是注意水分管理,适度浇水,避免因干旱加重茎基腐病的发生。同时,小麦茎基腐病发生后植物病残体上的分生孢子在适宜条件下也可成为赤霉病发生的侵染源。因此,在小麦茎基腐病防治过程中需要协同综合防治小麦根腐病、赤霉病、纹枯病等其他麦类病害。
此外,避免谷物毒素污染问题尤为重要。在实际生产中注意选择合适的药剂复配以达到防病害降毒素的目的;同时,迫切需要开发防效好、抑菌谱广且不利于DON 合成的新型杀菌剂,用于小麦茎基腐病的持续防控。另外,筛选获得具解毒能力的微生物,将DON 转化为低毒或无毒产物也具有很好的发展潜力。据报道,许多真菌如曲霉属真菌Aspergillus tabens、哈茨木霉Trichoderma harzianum,细菌如芽孢杆菌属Bacillus.spp.、假单孢菌属Pseudomonasspp. 和乳杆菌属Lactobacillus.spp. 等都可以通过释放胞外酶降解DON毒素[107]。
由于假禾谷镰孢在田间存在不同交配型,因此需定期监测小麦产区田间假禾谷镰孢群体的遗传多样性,规避因有性重组而产生具有独特的致病力或产毒特征新菌株出现的潜在风险。2022 年中国科协将小麦茎基腐的暴发成因和科学防控列入我国十大产业技术问题之一,这对推动我国小麦茎基腐病的相关基础理论和防控技术的系统研究具有重要的意义,对实现该病害绿色防控具有重要的作用。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

李怡文,女,2020 年毕业于云南农业大学植物保护学院,获硕士学位。2020 年9 月至今,于西北农林科技大学植物保护学院攻读博士学位,研究方向为植物病原菌与杀菌剂互作的分子基础和病害防控技术。


苗建强,男,副研究员,硕士生导师。2018 年毕业于中国农业大学植物病理系,获博士学位,其间2016.11—2018.01 在美国俄勒冈州立大学植物病理学专业进行博士联合培养。西北农林科技大学植物保护学院副研究员,主要研究方向为植物病原菌抗药性分子机制及潜在卵菌抑制剂分子靶标发掘。荣获2019 年陕西省科技进步一等奖 (第6 完成人),2021 年“中化扬农农业化学新秀奖”。现任中国化学会农业化学专业委员会青委会副主任、陕西省植物病理学会监事、《农药学学报》青年编委。
刘西莉,女,二级教授,博士生导师。1991 年毕业于北京农业大学应用化学系并留校工作,先后获得中国农业大学植物病理系硕士、博士学位;2005—2006 年在丹麦哥本哈根大学植物科学系作学术访问学者;2007—2017 年为中国农业大学植物病理系教授;2017 年至今,任西北农林科技大学国家人才发展计划特聘教授。重点围绕“植物病原菌与杀菌剂互作的理论与病害控制技术”进行科学研究,主要研究方向:1) 卵菌重要基因功能研究及药物潜在分子靶标发掘;2) 植物病原菌与杀菌剂互作的分子基础;3) 植物病原菌抗药性风险评估及抗性治理;4) 主要农作物风险性种传、土传病害诊断和防控技术。曾先后荣获国家“科学技术进步二等奖” 3 项,发表科技论文 200 余篇,授权发明专利 37 项,牵头制定了系列“杀菌剂抗性风险评估”行业标准。荣获国家“万人计划”领军人才、农业部“农业科研杰出人才以及创新团队”及科技部 “中青年科技创新领军人才等称号。现任《农药学学报》副主编。
